Aunque la terapia génica está todavía en sus albores, la curación de las enfermedades genéticas por medio de técnicas de ADN recombinante ha despertado un gran interés. Así, a partir de 1998 se han aprobado más de 200 protocolos para ensayos experimentales, en los que están inscritos más de 2.000 pacientes.
Terapia de células somáticas
Este tipo de terapia consiste en alterar genes para tratar un trastorno específico. Las células se pueden extraer y manipular fuera del cuerpo (terapia ex vivo), o bien tratarlas mientras están dentro de él (terapia in vivo).
Algunos tipos de células son más susceptibles a la terapia génica. Las más adecuadas han de tener una larga duración en el organismo. En algunos sistemas se prefieren las células en proliferación, ya que el vector portador del gen puede integrarse en el ADN de la célula durante la replicación.
Las células de la médula ósea son las más adecuadas para la terapia somática, pero son difíciles de manipular y de aislar. Por ello se han investigado otros tipos de células diana, como son los fibroblastos de la piel, las células del endotelio vascular, los hepatocitos y los linfocitos. El inconveniente de estos tipos de células es que su ciclo vital es relativamente corto. Por consiguiente, la terapia que las utiliza requiere tratamientos repetidos de células modificadas genéticamente.
Terapia de sustitución génica
Este tipo de terapia implica reemplazar el producto de un gen ausente mediante la inserción de un gen normal. Esta inserción suministrará el producto ausente. De esta manera, muchos trastornos producidos por una deficiencia enzimática se pueden corregir, por lo que una estrategia de terapia génica medianamente eficaz puede proporcionar importantes beneficios para la salud.
Existen numerosas técnicas para introducir genes en las células como son la fusión celular, coprecipitación con fosfato cálcico, microinyección, electroporación, fusión de liposomas e introducción directa del ADN. De todas ellas, los virus son los vectores que han recibido la máxima atención, ya que han desarrollado métodos inteligentes para introducir sus genes en las células.
Vectores retrovirales
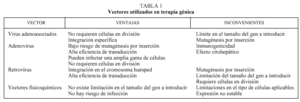
Los retrovirus son capaces de insertar copias de sus genomas en las células del huésped después de realizar la transcripción inversa de su ARN vírico a ADN. Se integran en el ADN del huésped con un alto grado de eficacia. Para ello, deben ser modificados para evitar su replicación en el huésped, lo cual se realiza utilizando técnicas de ADN recombinante para producir la deleción de la mayor parte del genoma retroviral, reemplazándolo por una copia normal de un gen humano, de sus elementos reguladores y de una señal de poliadenilación. De esta manera los retrovirus pueden aceptar inserciones de hasta 8b, y se propagan en células colaboradoras, que compensan su falta de replicación. Esto permite producir copias múltiples. Las partículas que contienen retrovirus pueden incubarse luego con las células somáticas del paciente.
El retrovirus modificado inserta el gen humano normal en el ADN de la célula del huésped y este gen codificará un producto en las células del paciente. Este sistema se ha utilizado para tratar algunas enfermedades como por ejemplo la deficiencia de adenosina desaminasa. Pero los retrovirus presentan también una serie de desventajas:
1. Por una parte pueden situarse cerca de un protooncogén y activarlo, causando la formación de un tumor, pero hasta el momento no se ha observado ningún caso.
2. La mayoría de los retrovirus penetran en la célula tras la lisis de su membrana durante la división celular, por lo que sólo pueden infectar células en división y serían ineficaces en células que no se encuentran en este estado.
Vectores adenovíricos
El adenovirus puede aceptar una inserción de 30 kb. Debido a su capacidad para invadir células, se está utilizando en ensayos en los que se usa el gen regulador de la conductancia transmembrana de la fibrosis quística (CFRT) normal, mediante aerosol en células epiteliales. Este tratamiento permite alterar la actividad del canal para el ion cloruro en pacientes con fibrosis quística.
El adenovirus no se integra en el genoma de la células del huésped con lo que no activará el protooncogén, pero esta falta de integración es también una desventaja ya que los adenovirus son eliminados del núcleo. Como consecuencia se produce una expresión genética pasajera y la necesidad de reintroducir el vector.
Se ha observado en ensayos clínicos que los adenovirus suelen inducir respuestas inflamatorias en los pacientes. Este fenómeno se ve acentuado con la introducción repetida de los mismos.
Otros vectores víricos
Los virus adenoasociados, un tipo de parvovirus, tienen la ventaja de presentar una ausencia de asociación conocida y ligada a enfermedades humanas, así como una integración estable en el ADN. Sin embargo estos vectores pueden aceptar una inserción de ADN de tan sólo 5 kb.
Aunque en general la terapia viral supone un reto importante, existe una serie de obstáculos: expresión genética pasajera y de bajo nivel; dificultades para alcanzar el tejido diana, y necesidad de regular con precisión la actividad génica. Esto no es un problema en algunas enfermedades. Sin embargo, es fundamental en enfermedades como la talasemia. Es difícil alcanzar la precisión utilizando la terapia génica viral.
En la actualidad, están en estudio tipos específicos de retrovirus capaces de infectar células que no se dividen.
Vectores no víricos
Uno de los más estudiados son los liposomas, un cuerpo graso que acepta grandes cantidades de ADN. Éstos se fusionan con las células, permitiendo que el inserto de ADN penetre en las mismas. Como carecen de péptidos, no desencadenan reacciones inmunitarias. Su principal desventaja es que no son eficaces en la transferencia de virus.
También es posible insertar directamente ADN en las células sin necesidad de utilizar ningún vector. Asimismo, se está utilizando ADN desnudo como vacuna, que codificará una proteína frente a la que el organismo producirá una respuesta inmunitaria (tabla 1).
Terapia con bloqueadores de genes
Este método se utiliza para corregir las mutaciones negativas dominantes como por ejemplo la enfermedad de Huntington y el síndrome de Marfan.
Aunque no están tan bien desarrollados como los métodos de terapia de sustitución génica, los métodos de bloqueo génico están en desarrollo y son prometedores.
Terapia antisentido
Consiste en crear mediante ingeniería genética un oligonucleótido con una secuencia de ADN complementaria a la secuencia de ARNm producida por una mutación. Este oligonucleótido se une al ARNm anormal, evitando su traducción en una proteína nociva.
Terapia con ribozima
Las ribozimas son moléculas de ARN, capaces de escindir el ARNm. Éstas pueden ser manipuladas para que escindan secuencias de ARNm específicas que contienen una mutación no deseada, destruyéndola antes de su traducción a proteínas.
Terapia génica para enfermedades no hereditarias
Alrededor de dos tercios de los protocolos de terapia génica se refieren a cánceres no hereditarios. Por ejemplo, el gen supresor p53, que se ha perdido en aproximadamente la mitad de los cánceres, es insertado en tumores pulmonares para detener la progresión tumoral. Algunos tumores escapan a la detección del sistema inmunitario, eliminando las moléculas del HLA de clase I. Liposomas con ADN que codifican moléculas de HLA se pueden introducir en el interior de las células de melanoma maligno, produciéndose la expresión de la molécula de HLA en la superficie de las células y la consiguiente destrucción por parte de las células T citotóxicas. Ello ha llevado en algunos casos a la desaparición del melanoma.
Diversos enfoques de terapia génica se están orientando al virus de la inmunodeficiencia humana. La mayoría de éstos van dirigidos a detener la replicación del virus.
Terapia de línea germinal
Consiste en una alteración de todas las células del cuerpo, incluidas las que originan los gametos. Por tanto, afecta tanto al paciente como a todos sus descendientes.
Este tipo de terapia presenta problemas. En primer lugar los embriones inyectados suelen morir, y algunos desarrollan tumores y malformaciones. En segundo lugar, lo habitual es que la mitad de los embriones sean normales. Por último, existen cuestiones éticas asociadas con la alteración de los genes del ser humano. De ahí que la terapia de línea germinal humana no pueda llegar a ser útil o deseable.
Aplicación de la terapia génica en humanos
Están siendo objeto de investigación enfermedades como las talasemias caracterizadas por una deficiente síntesis de las cadenas de hemoglobina. Existen estudios para corregir la betatalasemia que se basan en transferir ex vivo el gen de la betaglobina humana a células medulares precursoras de eritrocitos, de forma que las células maduras serán capaces de sintetizar la hemoglobina normal.
También se están realizando estudios de inserción de los factores VIII y IX de la coagulación, cuya ausencia es responsable de las hemofilias a y b. La inserción de estos genes se ha conseguido en el ámbito experimental en los hepatocitos y en los fibroblastos.
La hipercolesterolemia familiar, una de las enfermedades hereditarias más comunes, es debida a mutaciones en el receptor de la lipoproteína de baja densidad (LDL R). El empleo ex vivo de vectores retrovirales que contienen el gen humano para el LDLR en cultivos de hepatocitos permite obtener líneas celulares capaces de degradar las LDL.
La fibrosis quística es una de las afecciones hereditarias en la que se tiene más esperanzas. El gen responsable de la misma se denomina CFTR. Se ha demostrado que las células provenientes de pacientes que no presentan el gen y a las cuales se les ha transferido son comparables en sus respuestas a las traqueales normales. Por tanto, parece ser que la terapia génica para la fibrosis quística, usando vectores retrovirales sobre el epitelio pulmonar mediante aerosoles, es posible.
Existen también otras investigaciones de terapia génica para enfermedades como el enfisema hereditario, la distrofia muscular de Duchenne y la enfermedad de Gaucher.
Dentro del campo de la terapia génica, se puede considerar el cáncer como el área más importante y de más expansión. Su tratamiento se debe a una mejora de la capacidad global y a la rapidez del diagnóstico molecular. Las estrategias terapéuticas génicas se pueden clasificar en: inserción de genes oncosupresores (como el p53); bloqueo de la sobreexpresión de oncogenes (como el K-Ras); inserción de genes suicidas; inserción de genes inmunoestimulantes; vacunas e inserción de marcadores inmunológicos en las células tumorales para obtener una reacción inmunológica.
Por otra parte, la terapia génica del sida se basa en: inmunización; inhibición mediada por interferón; interferencia con proteínas virales; destrucción de las células infectadas; modificación del receptor viral CD4, y bloqueo de los ARNm virales (tabla 2).
Conclusiones
Los vectores virales ofrecen una transferencia eficaz de genes a las células somáticas, pero presentan inconvenientes como la escasa expresión del producto génico, el tamaño reducido de la inserción genómica, la generación de respuestas inmunitarias y, en algunos vectores, la baja capacidad para invadir células que no se dividen, así como el alto potencial de oncogénesis.
La utilización de terapia génica no viral, que incluye liposomas, cromosomas humanos artificiales y ADN desnudo, presenta algunas ventajas con respecto a los vectores virales, pero carece en cambio de la eficacia para la transferencia genética que presentan estos últimos.
Los métodos bloqueadores de genes, que incluyen el uso de moléculas antisentido y de ribozimas que escinden el ARN, se pueden utilizar para contrarrestar los efectos de las mutaciones.
Aunque la terapia génica es un área de investigación bastante activa, necesita aún de mucha experimentación. Tampoco está muy claro que la terapia génica llegue a proporcionar alguna vez un tratamiento o una curación segura a un costo razonable.
A pesar de todo esto, está demostrando grandes perspectivas para tratar enfermedades no hereditarias. El potencial de investigación es considerable, y el progreso actual demuestra que puede ser un tratamiento eficaz para algunas enfermedades.
El conocimiento del genoma humano realizado recientemente facilitará la aplicación de la terapia génica en un futuro. La sociedad tiene una gran esperanza en esta terapia, pero los científicos no deben prometer más de lo que verdaderamente se puede alcanzar. Para conseguir el éxito, las distintas ramas de la biología deben trabajar juntas. Así por un lado los genetistas deben investigar los genes implicados en las distintas enfermedades, los biólogos moleculares deben desarrollar vectores más seguros y eficaces, los inmunólogos deben estudiar la prevención de las respuestas inmunitarias, y finalmente los clínicos deben aplicar correctamente todo lo anterior, siempre con la ayuda del profesional del medicamento, el farmacéutico, que de esta forma está llamado a crear nuevos fármacos, basados en la biología molecular, que necesitarán de unos vehículos adecuados y de formas galénicas diferentes a los actuales y que, como decía Ehrlich, actúan como auténticas «balas» que llegan específicamente a los receptores requeridos.
Bibliografía recomendada
Chakravarti A. To a future of genetic medicine. Nature 2001; 409:822-3.
De Giovanni C, Nanni P, Forni G. The prospects for cancer gene therapy. Int J Immunopharmacol 2000;22:1025-32.
Hu WS, Pathak VK. Desing of retroviral vectors and helper cells for gene therapy. Pharmacol Rev 2000;52:493-511.
Kay MA, Glorioso JC, Naldini L. Viral vectors for gene therapy: the art of turning infectious agents into vehicles of therapeutics. Nat Med 2001;7:33-40.