En el paciente con diabetes mellitus tipo 2 (DM2) un buen control glucémico y del resto de los factores de riesgo puede reducir la presencia de complicaciones crónicas y disminuir la morbimortalidad cardiovascular. El tratamiento del paciente diabético debe contemplar un abordaje global, con especial hincapié no sólo en el control de la hiperglucemia sino también de las cifras de presión arterial, lípidos y el abandono del tabaquismo. La DM2 es una enfermedad en la que intervienen distintos mecanismos fisiopatológicos que pueden variar su importancia, según el momento evolutivo de la enfermedad. En la actualidad existen distintos grupos de fármacos (orales e insulinas) cuyo mecanismo de acción se basa en las diferentes alteraciones fisiopatogénicas responsables de la enfermedad.
Estudios prospectivos de largo seguimiento han demostrado que en muchas ocasiones, para alcanzar los objetivos de control metabólico deseados, será necesario asociar varios fármacos. Obviamente el tratamiento combinado no está indicado en todos los pacientes, y sólo debe plantearse en caso de no alcanzar los objetivos terapéuticos en monoterapia. Cuando esto sucede, estas asociaciones deben basarse en las características individuales del paciente, los objetivos de control y los mecanismos patogénicos presuntamente implicados. Numerosos estudios han demostrado la eficacia de distintas pautas de tratamiento combinado.
La diabetes mellitus tipo 2 (DM2) es una de las enfermedades con mayor impacto social y sanitario, dada su elevada prevalencia, sus complicaciones crónicas y la alta mortalidad que conlleva1. Los pacientes con DM2 tienen un incremento de 3-4 veces en la morbimortalidad cardiovascular constituyendo la principal causa de muerte. Las repercusiones de las complicaciones microvasculares (retinopatía, nefropatía y neuropatía) y del pie diabético afectan notablemente a la calidad de vida de estos pacientes y comportan un elevado coste para el sistema sanitario. El control de la DM ha demostrado ser capaz de reducir la incidencia de las complicaciones microvasculares en los diabéticos tipo 12 y tipo 23-6. En cuanto a la prevención de las complicaciones macrovasculares es aún debatible la influencia del control estricto de la glucemia sobre la morbilidad y mortalidad cardiovascular pese a los recientes estudios del UKPDS, por lo que el tratamiento de la hiperglucemia se contempla como parte del abordaje integral del conjunto de factores de riesgo que presentan estos pacientes como, por ejemplo, la hipertensión arterial, el tabaquismo o la dislipemia. Así, el estudio UKPDS también ha demostrado los beneficios del estricto control de la presión arterial tanto sobre la morbilidad por complicaciones micro y macrovasculares como sobre la mortalidad en la DM27.
Objetivos del tratamiento de la diabetes mellitus 2
Los objetivos del tratamiento de los pacientes afectados de DM2 van más allá de la simple normalización de la glucemia e incluyen:
1. Desaparición de los síntomas derivados de la hiperglucemia.
2. Evitar las descompensaciones agudas de la enfermedad.
3. Evitar o retrasar la aparición o progresión de las complicaciones crónicas:
Microangiopáticas: retinopatía diabética, nefropatía diabética y neuropatía diabética.
Macroangiopáticas: cardiopatía isquémica, enfermedad cerebrovascular y arteriopatía periférica.
4. Disminuir la tasa de mortalidad.
5. Mantener una buena calidad de vida.
Los objetivos terapéuticos deben ser más estrictos en los pacientes más jovenes, ya que tienen más posibilidades de desarrollar cualquiera de las complicaciones diabéticas. En pacientes ancianos (mayores de 75 años) o con una esperanza de vida muy limitada no es necesario, o incluso puede ser peligroso, un control glucémico estricto, por lo que debe evitarse el sobretratamiento. En el modelo teórico propuesto por Vijan los beneficios del control glucémico acerca de las complicaciones microvasculares se limitan a los pacientes que inician la diabetes antes de los 50 años y a aquellos con control metabólico deficiente6. También se observa que el beneficio es mayor cuando se cambia de un control deficiente a moderado que cuando se cambia de un control moderado a un control de casi normoglucemia6. Estas observaciones evidencian la necesidad de priorizar las intervenciones en los pacientes más jóvenes y en los que tienen peor control metabólico8-12.
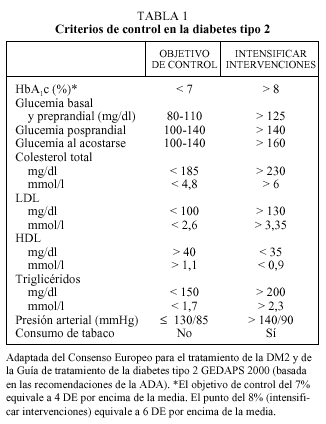
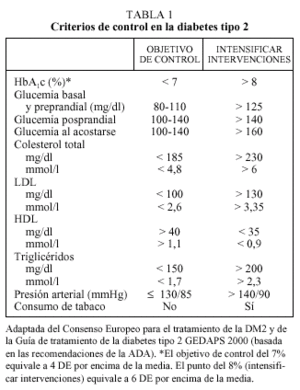
Criterios de control en la diabetes mellitus 2
La hemoglobina glucosilada (HbA1c) constituye el mejor parámetro de control glucémico, ya que se correlaciona con la aparición de complicaciones micro y macrovasculares a largo plazo y porque proporciona información sobre el grado de control en los 2-4 meses previos. En estudios epidemiológicos, se ha observado que a partir de valores superiores al 8% aumentan las complicaciones micro y macrovasculares1. En estudios de intervención como el DCCT2, el UKPDS4 y el de Kumamoto3 los beneficios en los grupos de terapia intensiva se obtuvieron con valores de HbA1c medios próximos al 7%. A la luz de dichos estudios tanto el Consenso Europeo para el tratamiento de la DM2 como las recomendaciones de la Asociación Americana de Diabetes (ADA) proponen unos criterios de HbA1c basados en el intervalo de normalidad utilizado en el estudio DCCT (4-6%, media = 5% y DE = 0,5). Sin embargo, mientras que el Consenso Europeo considera buen control una HbA1c < 6,5% y aceptable una HbA1c < 7,5%10, la ADA considera como objetivo terapéutico una HbA1c < 7% y propone intensificar las medidas terapéuticas cuando la HbA1c es superior al 8%8. En nuestro país, la Guía del GEDAPS recomienda utilizar la propuesta de la ADA
y propone como indicador de resultados intermedios el porcentaje de pacientes con HbA1c < 8% (media ± 6 DE)11 (tabla 1).
En el manejo terapéutico son también de gran utilidad las cifras de glucemia, tanto en sangre venosa en ayunas (determinación del laboratorio) como las efectuadas en sangre capilar en ayunas o en período posprandial, ya que permiten seleccionar tanto el fármaco más adecuado como valorar cambios en dosis o pautas.
Actualmente se da tanta importancia a la normalización de los parámetros glucémicos como a la del resto de factores de riesgo cardiovascular: presión arterial, lípidos, índice de masa corporal y el abandono del hábito tabáquico8-13. El hecho de ser diabético comporta un riesgo cardiovascular equiparable al de un paciente que ya presenta cardiopatía isquémica (CI)14, por lo que los objetivos terapéuticos tensionales y de lípidos propuestos actualmente para las personas con diabetes son mucho más estrictos que en la población general y son equivalentes a los propuestos para pacientes con enfermedad coronaria establecida. Pequeñas mejoras en el conjunto de ellos seguramente son más beneficiosas que un control muy estricto en uno de ellos junto a una actitud poco intervencionista en el resto.
Bases para el tratamiento de la diabetes mellitus 2
Tras la ingesta alimentaria, los valores de glucemia se mantienen en los límites normales por tres mecanismos que se realizan de forma coordinada: el estímulo de la secreción de insulina, la supresión de la producción hepática de glucosa por la insulina (y en menor grado por la hiperglucemia) y la estimulación de la captación de glucosa por los tejidos periféricos (fundamentalmente el muscular).
En los pacientes con DM2 e hiperglucemia en ayunas, la producción hepática de glucosa es excesiva pese a las altas concentraciones de insulina circulantes. Por tanto, existe una resistencia hepática a la acción de la insulina. A mayor producción hepática de glucosa, mayor hiperglucemia basal. Esta alteración queda reflejada en la práctica clínica en pacientes afectados de DM2 a los que se realiza un perfil glucémico. Con cierta frecuencia, los valores máximos de glucemia se obtienen en ayunas. En general, se considera que la hiperglucemia basal es el mayor determinante de la glucemia media durante todo el día y de la HbA1c; y los fármacos que actúan disminuyendo la producción hepática de glucosa son especialmente efectivos mejorando el control glucémico. No obstante, algunos estudios recalcan la importancia de la hiperglucemia posprandial sobre la HbA1c.
La resistencia a la acción de la insulina se manifiesta, así mismo, en el tejido muscular. Tras la ingesta, la captación muscular de glucosa inducida por la secreción de insulina está disminuida. La hiperglucemia posprandial está producida tanto por una disminución de la captación muscular como por un aumento de la producción hepática de glucosa. Por tanto, los fármacos que mejoran la sensibilidad muscular a la insulina serán efectivos disminuyendo la hiperglucemia posprandial. La importancia que desempeña la hiperglucemia pos-prandial en el control metabólico global es un tema de debate. Se ha cuantificado en un 22% de la hiperglucemia global de 24 h.
El deterioro de la secreción de insulina también desempeña un papel en la alteración de la homeostasis de la glucosa en la DM2, aunque éste es un tema controvertido. Es evidente que, en términos de concentraciones eficaces, en la DM2 existe un déficit de la secreción de insulina. Este defecto puede ser cualitativo o cuantitativo, relativo o, más raramente, absoluto (en fases avanzadas de la enfermedad). Cuando existe hiperglucemia basal moderada (glucemia inferior a 140 mg/dl, 7,8 mmol/l), la insulinemia tras la ingesta está elevada en términos absolutos, aunque sea insuficiente para conseguir el efecto deseado. Cuando existe hiperglucemia basal más intensa (glucemia superior a 180- 200 mg/dl, 10-11,1 mmol/l), existe ya un déficit de secreción insulínica. Por tanto, en esta situación clínica serán efectivos los fármacos que aumentan la secreción de insulina.
A partir de todo lo anterior, en la fisiopatología de la DM2 intervienen varias alteraciones que contribuyen en mayor o menor grado, en función de las características del paciente y estadio de la enfermedad, a la disfunción metabólica que provoca la hiperglucemia. La DM2 es una enfermedad evolutiva, de forma que la alteración fisiopatológica dominante variará desde diferentes grados de resistencia insulínica al déficit absoluto de esta hormona. Los distintos tratamientos farmacológicos inciden más o menos específicamente en algunas de estas alteraciones. Aunque no son absolutamente independientes unas de otras, pueden desglosarse en las siguientes causas:
1. Resistencia a la insulina: defectos en la sensibilidad del tejido muscular y del hígado a la insulina.
2. Defectos de secreción de insulina: falta del pico de secreción temprana y déficit de secreción global de insulina.
Los principales efectos son la hiperglucemia en ayunas (por aumento de producción hepática de glucosa) y la hiperglucemia tras las comidas (por defecto de secreción posprandial de insulina).
Si los diferentes fármacos disponibles para el tratamiento de la DM2 inciden en la corrección de alteraciones distintas, parece lógico y plausible pensar que la combinación de ellos puede ser eficaz. Así, si un paciente padece un déficit de insulina a la vez que una resistencia, combinar insulina con un fármaco que mejore la sensibilidad a la insulina parece beneficioso desde el punto de vista teórico. En otra situación, si coexiste hiperglucemia intensa en ayunas y moderada durante el día, una dosis de insulina nocturna que actúe en las primeras horas del día sobre la hiperglucemia basal, junto con un hipoglucemiante oral que mejore la hiperglucemia moderada del resto, parecería una combinación razonable. En definitiva, si en la DM2 intervienen varias alteraciones, actuar farmacológica e independientemente sobre cada una de ellas tiene una buena base teórica.
Abordaje terapéutico de la diabetes mellitus 2
A diferencia de lo que ocurre en la DM tipo 1, que se basa universalmente en la combinación del tratamiento con insulina, dieta y ejercicio físico, el tratamiento de la DM2 es muy variable en función de las características del paciente y de la evolución de la enfermedad. Los fármacos indicados en un paciente afectado de DM2 variarán desde la abstención de los mismos (tratamiento únicamente dietético) a la utilización de los
diferentes tipos de fármacos orales o bien la administración de insulina, todos ellos solos o en diferentes combinaciones. Por tanto, es fundamental reconsiderar periódicamente la efectividad del tratamiento. Los cambios vendrán motivados por diversos aspectos de la evolución de la enfermedad como son el estado ponderal (obesidad o normopeso), grado de resistencia a la insulina, grado de déficit de secreción de insulina, predominio de la hiperglucemia en ayunas o en estadio posprandial, así como de la existencia de las distintas complicaciones crónicas.
El esquema terapéutico propuesto por las diferentes guías terapéuticas9-13 es básicamente el siguiente:
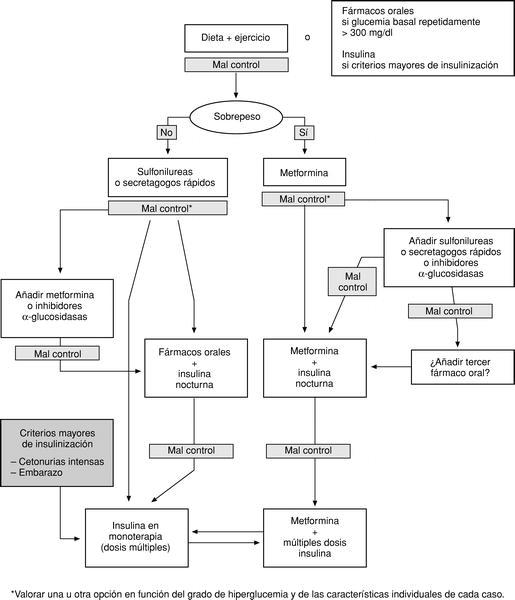
1. El tratamiento inicial ante un paciente al que se diagnostica la enfermedad y que no presenta criterios de insulinización inmediata consiste en una dieta adecuada a su estado ponderal (hipocalórica en caso de sobrepeso y normocalórica en caso de normopeso) y una pauta de ejercicio físico adecuada.
2. Cuando a pesar de estas medidas no se consigue un control adecuado se debe prescribir un fármaco hipoglucemiante oral. Si el paciente presenta sobrepeso u obesidad es de elección la metformina, ya que tiene claras ventajas sobre el resto de fármacos orales al mejorar la sensibilidad a la insulina y no comportar aumento de peso. Si el control no es adecuado, puede asociarse una sulfonilurea, un secretagogo de acción rápida o un inhibidor de las alfaglucosidasas. En el paciente con normopeso, si el tratamiento dietético fracasa se recomienda instaurar un fármaco que estimule la secreción de insulina (secretagogos). En este caso son de elección las sulfonilureas por su mayor experiencia de uso, pero también cabe considerar los secretagogos de acción rápida. Si el control no es adecuado, puede asociarse a la sulfonilurea otro fármaco como los inhibidores de la alfaglucosidasa o la metformina.
3. Por último, si fracasa el tratamiento con fármacos hipoglucemiantes, solos o combinados, debe pasarse al tratamiento con insulina sola o asociada a fármacos orales.
En la figura 1 se presenta el algoritmo de tratamiento.
Fig. 1. Algoritmo de tratamiento de la diabetes tipo 2.
Tratamiento con fármacos orales en monoterapia
El tratamiento inicial en la DM2 consiste en establecer un plan de alimentación y actividad física adecuadas que permita controlar las cifras de glucemia. Estas medidas son insuficientes en la mayoría de pacientes por lo que, tras aproximadamente 3 meses sin conseguir un control metabólico aceptable y en ausencia de criterios de insulinización, se debe instaurar tratamiento con un fármaco oral8-13,15,16. De acuerdo con el Consenso Europeo se considera control metabólico aceptable, en general, HbA1c < 6,5% o glucemia basal < 110 mg/dl. En personas sin factores de riesgo o con cortas expectativas de vida, HbA1c < 7,5% o glucemia basal < 125 mg/dl. Los cambios en el tratamiento deben ser tempranos para prevenir las complicaciones o retrasar su progresión si ya están presentes13.
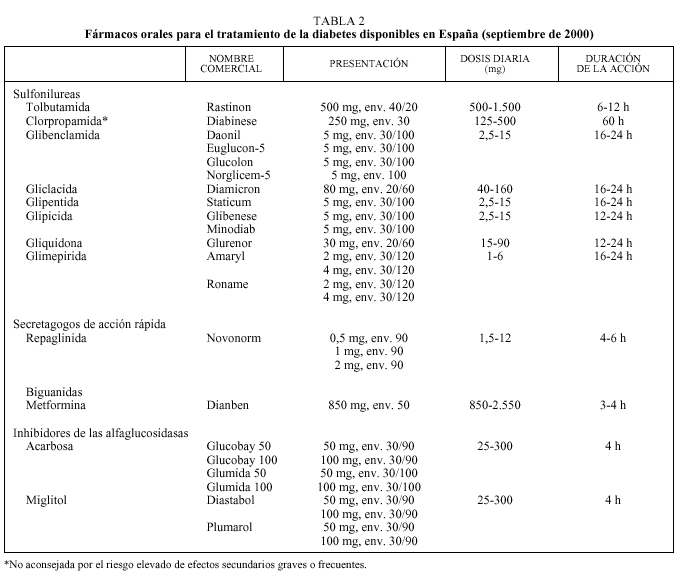
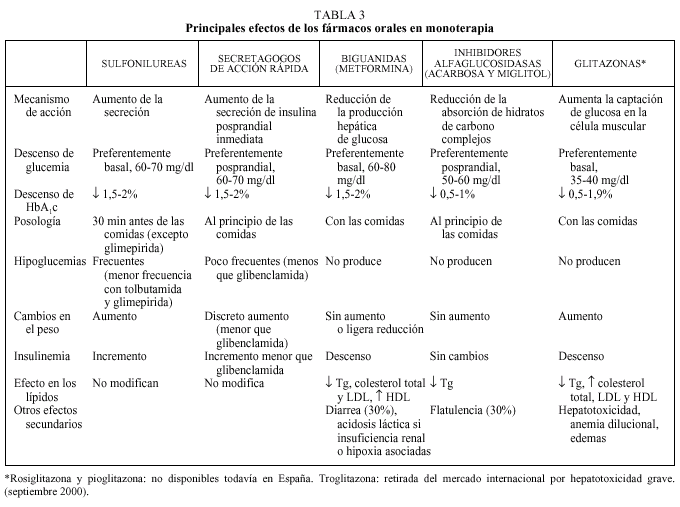
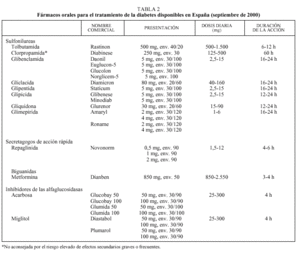
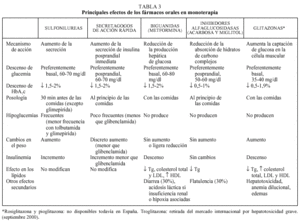
Debe considerarse siempre la necesidad de insulinización cuando el paciente presenta sintomatología hiperglucémica importante junto a una glucemia basal mayor de 300 mg/dl12,13. Con cierta frecuencia, tras un tiempo prudencial y una vez conseguido un control aceptable, se puede suspender la insulina y reemplazarla por un fármaco oral10,11, ya que al mejorar el control se reduce la glucotoxicidad de la hiperglucemia y mejora la sensibilidad a la insulina. Se considera necesaria una insulinización transitoria cuando aparecen enfermedades intercurrentes graves (infecciones), cirugía mayor, en la fase aguda de un IAM y durante el embarazo y la lactancia9-13. En la tabla 2 se relacionan los fármacos orales disponibles en nuestro país. En primer lugar revisaremos las características principales de cada uno de los grupos de fármacos orales disponibles y sus indicaciones en monoterapia (tabla 3).
Sulfonilureas
Su principal mecanismo de acción es la estimulación de la liberación de insulina por las células beta pancreáticas, motivo por el que requieren la existencia de cierta reserva insulínica. Se han descrito otros beneficios a nivel extrapancreático como la reducción de la producción hepática de glucosa o la mejora de la resistencia insulínica en tejidos periféricos, aunque no está bien establecida su relevancia clínica15.
Son fármacos muy eficaces (reducción de la HbA1c de 1,5 a 2 puntos) y han demostrado en el estudio UKPDS reducciones de las complicaciones crónicas similares a las obtenidas con la insulina4. Este mismo estudio ha descartado la relación entre mortalidad por infarto de miocardio y tratamiento con sulfonilureas, sugerida en la década de los años cincuenta por el estudio UGDP. En un período de 10 años se consiguió una reducción de 0,7 puntos en la HbA1c en los pacientes tratados con glibenclamida frente al tratamiento convencional (7,2 frente a 7,9) con sólo un incremento de peso de 1,7 kg respecto al otro grupo y con un 0,6% de hipoglucemias graves.
La sulfonilurea más utilizada en nuestro medio es la glibenclamida. Salvo el caso de la tolbutamida, que tiene una acción más débil, todas las sulfonilureas son prácticamente equipotentes. Sin embargo, sus diferentes características farmacológicas permiten individualizar su indicación: tolbutamida y glimepirida se han recomendado para los ancianos por el menor riesgo de hipoglucemias graves; tolbutamida en casos de insuficiencia hepática por su escasa eliminación biliar y gliquidona cuando existe insuficiencia renal moderada por su eliminación biliar11.
Los alimentos interfieren su absorción (excepto en el caso de glimepirida), por lo que el fármaco se administrará al menos 30 min antes de iniciar la ingesta. Las dosis se aumentarán cada una o dos semanas hasta conseguir corregir las glucemias basales.
El principal efecto secundario de las sulfonilureas es la hipoglucemia grave, que puede ser prolongada y recidivante y que es más frecuente con las de vida media prolongada, como la glibenclamida. El riesgo de hipoglucemia grave con glibenclamida (1,66 por 100 personas-año) es el mismo que con clorpropamida y casi el doble que con glipicida o gliclacida15. La glimepirida oscila entre el 0,9 y 1,7 por 100 personas-año, y la menor incidencia se ha observado con tolbutamida (0,35 por 100 personas-año). En este punto cabe recordar que los pacientes tratados con insulina tienen una mayor incidencia de hipoglucemias (2,76 por 100 personas- año)15. Los factores predisponentes más frecuentes son la edad superior a 60 años, la disminución de la ingesta, la insuficiencia renal y, en menor grado, el consumo de alcohol y fármacos que interfieren en su metabolismo y eliminación15. La frecuencia de hipoglucemias (graves y no graves) en pacientes tratados con sulfonilureas en el estudio UKPDS fue la mitad que en los tratados con insulina (17% frente al 37%, respectivamente)16. Clorpropamida, una sulfonilurea de primera generación, puede producir mayores interacciones farmacológicas, inhibición de ADH y flushing por efecto antabús, por lo que no se recomienda actualmente su uso11.
En los últimos años ha habido un intenso debate sobre el posible aumento del riesgo de infarto en pacientes tratados con sulfonilureas, especialmente con glibenclamida15. Las sulfonilureas actuarían sobre los canales KATP de la célula pancreática pero también, aunque en menor medida, sobre los canales KATP cardiovasculares (especialmente del miocardio), lo que podría aumentar el riesgo de isquemia aguda y fibrilación ventricular al interferir la activación de dichos canales in vitro e in vivo15. Sin embargo, el estudio UKPDS no ha demostrado que el tratamiento con clorpropamida o glibenclamida tenga una repercusión negativa en la morbimortalidad cardiovascular4 y, por tanto, queda en el terreno de la especulación el posible beneficio de utilizar fármacos más selectivos de los canales KATP pancreáticos15.
En cuanto a la dosificación de las sulfonilureas, diferentes estudios han demostrado que la mayor parte de ellas llegan al máximo de su efecto hipoglucemiante con dosis menores a las usadas habitualmente. Así, por ejemplo, con 10 mg de glibenclamida, 15 mg de glipicida o 4 mg de glimepirida se controlan más del 75% de los pacientes15. En contra de lo que cabría esperar, cuando se superan estas dosis, se observa una menor secreción de insulina y un empeoramiento del control glucémico en bastantes pacientes. Esto se debe a una desensibilización de la liberación de insulina inducida por las sulfonilureas y se relaciona muy probablemente con una reducción del cierre del canal KATP secundario a la regulación a la baja del receptor de sulfonilureas o a un efecto inhibidor directo sobre el propio canal KATP15.
Las contraindicaciones de las sulfonilureas son la alergia a las sulfamidas; la DM tipo 1 y la DM secundaria a alteración pancreática; la insuficiencia hepática grave y la insuficiencia renal por la menor eliminación del fármaco y consiguiente aumento del riesgo de hipoglucemia. Finalmente, también están contraindicadas en el embarazo y la lactancia por el riesgo de hipoglucemia en el recién nacido.
La glimepirida es la sulfonilurea de introducción más reciente, y su efectividad es similar a la de otras sulfonilureas de segunda generación (reducción de la HbA1c entre 1,2 y 1,9 puntos). Presenta algunas ventajas sobre el resto como una menor incidencia de hipoglucemias (especialmente en la fase de ajuste de dosis), su absorción es independiente de las ingestas y se puede administrar en dosis única17-20, lo que es un factor importante a considerar en pacientes polimedicados. La dosis de inicio es de 1 mg, pudiéndose aumentar semanalmente hasta 6 mg, aunque la dosis de 4 mg es la más habitual. Se metaboliza en el hígado y se elimina en un 60% por la orina. Ha sido utilizada en pacientes con insuficiencia renal crónica sin que se haya observado acumulación del fármaco ni incremento de las hipoglucemias, hecho que se atribuye a un mayor aclaramiento del fármaco al aumentar el volumen de distribución por una menor ligadura a proteínas plasmáticas15. Finalmente, se ha observado que induce menos hiperinsulinemia y menos episodios de hipoglucemia que glibenclamida, por lo que podría ser la sulfonilurea más indicada en ancianos (como lo es la tolbutamida) y en obesos18.
Biguanidas
La metformina es la única biguanida recomendada actualmente, ya que la fenformina y la buformina tienen un riesgo elevado de acidosis láctica9-13,15,21. El riesgo de acidosis láctica ha sido el principal freno a la utilización de metformina a pesar de estar disponible en el mercado desde 1957 y tener numerosas ventajas con respecto a las sulfonilureas.
El mecanismo de acción principal de la metformina es la reducción de la producción hepática de glucosa mediante la disminución de la neoglucogénesis hepática, aunque también aumenta la captación de glucosa en la célula muscular21.
Su efectividad es similar a la de las sulfonilureas (reducciones de HbA1c entre 1,5 y 2 %), pero sin producir aumento de peso ni hipoglucemias y se asocia a una reducción de las cifras de presión arterial, triglicéridos y LDL21-23. En algunos estudios también se ha observado una reducción de peso24. Además, es el único fármaco que ha demostrado una reducción de las complicaciones macrovasculares en el grupo de pacientes con sobrepeso en el estudio UKPDS4. Por todo ello, se recomienda como fármaco de primera elección en pacientes con sobrepeso9-13.
Se debe empezar con un comprimido al día (850 mg) en la comida principal, para mitigar los frecuentes efectos adversos gastrointestinales. Las dosis deberían incrementarse cada 1 o 2 semanas hasta un máximo de 2 o 3 comprimidos según la respuesta clínica11. Un 85% de los pacientes consiguen la máxima reducción de HbA1c (2%) con dosis de 2.000 mg, sin obtener reducciones adicionales cuando se llega a los 2.500 mg23. No se metaboliza en el hígado y su eliminación es renal.
El efecto secundario más frecuente es la diarrea (30%), que es dependiente de la dosis, autolimitada y transitoria, y que suele remitir al reducir la dosis del fármaco. Un 5% no toleran ni la dosis mínima24. El efecto secundario más grave, aunque muy poco frecuente, es la acidosis láctica, con una incidencia de 0,01-0,067 casos por 1.000 pacientes-año y una mortalidad del 50%. La mayoría de casos se han dado en individuos con insuficiencia renal o respiratoria, en los que estaba claramente contraindicada21,25. Recientemente se ha cuestionado el papel de la metformina en la acidosis láctica, llegándose a sugerir que podría tratarse de una asociación no causal en pacientes con una enfermedad grave y una alteración previa del metabolismo del lactato25. El riesgo de morir por una acidosis láctica por metformina no es superior al de morir por una hipoglucemia grave producida por una sulfonilurea21. El déficit de absorción de la vitamina B12, observado en un 30% de pacientes, raramente provoca anemia perniciosa.
Son contraindicaciones la insuficiencia renal por el riesgo de acumulación, la insuficiencia respiratoria o cardíaca crónicas, la cirrosis con insuficiencia hepática, el embarazo y la lactancia, el consumo crónico de alcohol y los déficit de vitamina B12 y ácido fólico. Puede prescribirse en pacientes ancianos, aunque a partir de los 80 años siempre debe garantizarse que el aclaramiento de creatinina sea superior12,13,21 a 60 ml/min/ 1,73 m2, ya que los valores de creatinina sérica no son una medida fiable de la función renal en las personas de edad avanzada.
Debe suspenderse el tratamiento y proceder a la insulinización transitoria en caso de cirugía mayor, infarto agudo de miocardio, infecciones graves y cualquier otra situación que predisponga a insuficiencia renal aguda o acidosis. En caso de exploraciones radiológicas con contrastes yodados debe suspenderse hasta 24-48 h después de su realización por el riesgo de insuficiencia renal aguda.
Inhibidores de las alfaglucosidasas
Este grupo está constituido por miglitol y acarbosa. Inhiben de forma competitiva y reversible las alfaglucosidasas de la microvellosidades intestinales retrasando la absorción de los hidratos de carbono complejos y disminuyendo el pico glucémico posprandial12,13. En monoterapia no producen incremento de peso ni hipoglucemia. Sin embargo, cuando se utilizan asociados a una sulfonilurea o insulina es necesario recordar que en caso de hipoglucemia debe utilizarse glucosa pura, ya que la sacarosa (azúcar común) es un disacárido. Algunos estudios han demostrado un modesto descenso de los triglicéridos sin cambios en el colesterol LDL ni HDL26.
El efecto de los inhibidores de las alfaglucosidasas sobre la HbA1c es inferior al observado con sulfonilureas y metformina (0,5-1 punto)12,13,27-31. Su efectividad es menor en pacientes con dietas pobres en hidratos de carbono13. En el estudio UKPDS se utilizó frente a placebo en 1.946 pacientes, independientemente del tratamiento que estuvieran recibiendo: dieta, sulfonilureas, metformina, insulina sola o combinada con sulfonilurea o metformina. Globalmente, en los pacientes que todavía tomaban el tratamiento al cabo de los 3 años, se observó una reducción de la HbA1c del 0,5%30.
Se recomienda su uso como primer fármaco en pacientes con valores elevados de HbA1c y glucemias basales aceptables en los que predominan las hiperglucemias posprandiales, así como en los casos en que existen contraindicaciones o riesgo de efectos adversos graves con sulfonilureas o metformina13. La dosis inicial aconsejada es de 25 mg (medio comprimido) al iniciar las comidas y sin masticar. La dosis debe ser aumentada semanalmente para minimizar los efectos secundarios, hasta llegar a los 300 mg/día, que es la dosis habitual. Con dosis superiores de acarbosa (200 o 300 mg tres veces al día) se produce un descenso algo mayor de la HbA1c (1,1 puntos) pero empeorando los efectos secundarios. Su acción máxima se observa a los 3 meses27.
El efecto secundario más importante de la acarbosa y el miglitol es la flatulencia, que se observa con una frecuencia similar (30%) y que puede verse acentuada por dietas ricas en hidratos de carbono complejos, legumbres y hortalizas. Los efectos gastrointestinales debidos a la acarbosa, flatulencia en el 30% y diarrea en el 16%, son frecuentes y comportaron una importante tasa de abandonos en el estudio UKPDS (58 frente al 39% con placebo) que debe ser tenida en cuenta30. Se han descrito algunos casos de elevación de transaminasas con dosis elevadas de acarbosa y que desaparece al suspender el fármaco, por lo que podría ser aconsejable su determinación a los 3 meses de iniciar el tratamiento.
Las contraindicaciones de los inhibidores de las alfaglucosidasas son las enfermedades intestinales crónicas, el embarazo y la lactancia, la cirrosis hepática y la insuficiencia renal con valores de creatinina plasmática superiores a 2 mg/dl, ya que puede aumentar las concentraciones plasmáticas de acarbosa y no se dispone de estudios sobre las posibles consecuencias de este fenómeno13.
Nuevos secretagogos de acción rápida (repaglinida y nateglinida)
La repaglinida, comercializada recientemente, es un secretagogo que actúa a nivel pancreático facilitando la liberación posprandial de insulina mediante la activación de un receptor diferente del de las sulfonilureas y con un menor incremento de la insulinemia basal15. Se trata de un derivado del acido benzoico (familia de las meglitinidas) que se absorbe rápidamente, con una vida media corta y que se elimina por vía biliar, por lo que tiene menos riesgo de hipoglucemia y podría ser ventajosa para controlar las hiperglucemias posprandiales y en pacientes con insuficiencia renal o riesgo de hipoglucemia. La reducción de HbA1c es semejante a la descrita para sulfonilureas y metformina (1,5-2 puntos) pero con unos valores de glucemia 2 h postingesta significativamente inferiores32.
En un estudio comparativo a 12 meses con repaglinida y glibenclamida no se observaron grandes diferencias en cuanto a eficacia (reducción de HbA1c de 1,3), ni frecuencia de hipoglucemias (19 y 15%, respectivamente). Sólo se observó una ligera ganancia de peso que fue menor en los pacientes tratados con repaglinida (2,45 y 3,64 kg, respectivamente). Los valores de insulinemia basal y péptido C también fueron inferiores en el grupo tratado con repaglinida33.
Las indicaciones de repaglinida son prácticamente las mismas que las de las sulfonilureas con especial hincapié en el control de las hiperglucemias posprandiales10,11,13,15 y con la ventaja de su seguridad en ancianos y en casos de insuficiencia renal. Dado que se trata de un fármaco de reciente introducción, el nivel de evidencia científica que soporta su utilización como fármaco de primera elección es menor que el de las sulfonilureas.
Otra familia dentro de los secretagogos de acción rápida son los derivados de la D-fenilalanina (nateglinida), actualmente en fase de investigación.
Glitazonas
Este grupo, también conocido como tiazolidinedionas o agonistas ppar-gamma, está formado por pioglitazona, rosiglitazona y troglitazona. Las dos primeras están comercializadas en EE.UU., mientras que la troglitazona ha sido retirada por el elevado riesgo de toxicidad hepática grave. Actualmente no están disponibles en nuestro país.
Su principal mecanismo de acción es en el músculo y tejido graso, aumentando la captación y uso de la glucosa en los tejidos, básicamente en músculo y tejido graso. También disminuyen, aunque en menor medida, la neoglucogénesis y la síntesis de ácidos grasos a nivel hepático. Todo ello hace que, además de mejorar los valores de glucosa en plasma, aumente la sensibilidad a la insulina sin hacerlo su secreción15. Por este motivo, no producen hipoglucemias. Se metabolizan en hígado y se excretan por heces. Sus indicaciones son básicamente situaciones de predominio de resistencia a la insulina, especialmente cuando existe intolerancia o contraindicación para el uso de metformina.
La mayor parte de la información sobre la efectividad de este grupo se debe a troglitazona, el fármaco con más experiencia clínica. Su efectividad es inferior a la de las sulfonilureas y la metformina (entre 0,5 y 1 punto de descenso de la HbA1c)34,35, por lo que para muchos autores sería preferible usarlos como fármacos coadyuvantes para pacientes con obesidad y resistencia a la insulina en los que fracasa la monoterapia10,13. No obstante, se ha registrado un discreto aumento de peso de trascendencia clínica incierta.
La troglitazona se asocia con daño hepatocelular en un 2% de pacientes, en la mayoría de casos leve, excepto en un pequeño número de pacientes que desarrollaron una necrosis hepática grave36, lo cual ha provocado recientemente su retirada definitiva del mercado en EE.UU. Estos efectos parecen ser debidos a una reacción idiosincrática de algunos pacientes sin relación con la edad, sexo, dosis ni asociaciones con otros fármacos. Los aumentos de transaminasas se dieron entre el tercero y séptimo mes, y en algunos pacientes en los que se continuó la terapia las cifras, posteriormente, se normalizaron. Por todo ello se recomienda un control periódico y estricto de la función hepática36, recomendación que parece razonable mantener para el resto de los fármacos del grupo.
Además de estas alteraciones se han comunicado otros efectos adversos: náuseas, vómitos, diarrea, dolor abdominal, edema que desaparece al retirar el fármaco, aumento del volumen plasmático con disminución de las cifras de hemoglobina y cardiomegalia sin hipertrofia del ventrículo izquierdo. La troglitazona y la rosiglitazona provocan un aumento del colesterol total sin variar el índice LDL/HDL, mientras que la pioglitazona se asocia a una discreta mejoría del perfil lipídico35.
Tratamiento combinado con fármacos orales
Cuando se inicia el tratamiento farmacológico en monoterapia hasta un 30% de pacientes responden de manera insuficiente. Este fenómeno, conocido como «fracaso primario» y atribuido inicialmente sólo a las sulfonilureas, se ha descrito también con el resto de
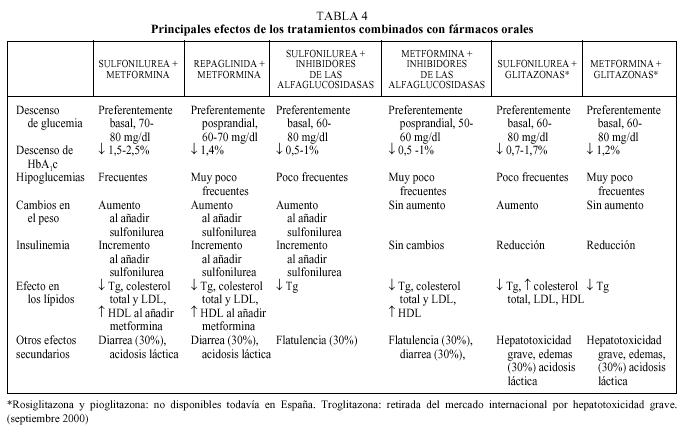
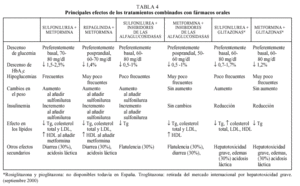
fármacos orales y tiene relación con el grado de hiperglucemia13. En general, es necesario esperar aproximadamente 3 meses para observar el beneficio del tratamiento y si persiste esta respuesta insuficiente se puede sustituir por un fármaco de otro grupo con un perfil de acción más adecuado a las características del paciente, aunque probablemente se observe el mismo fenómeno. En la mayoría de casos, sin embargo, se puede conseguir un control aceptable que puede durar varios años, tras los cuales se observa un progresivo empeoramiento del control metabólico independientemente del fármaco utilizado4. Este fenómeno, conocido como «fracaso secundario» es debido a la pérdida progresiva de la secreción de insulina, forma parte de la evolución natural de la DM2 y está determinado genéticamente. Se estima que hasta un 10% de pacientes-año dejan de responder a la monoterapia. En el estudio UKPDS, al cabo de 9 años del tratamiento en monoterapia (sulfonilureas, metformina e insulina), menos del 25% de los pacientes presentaban valores de HbA1c < 7%37. Para mejorar el control glucémico en esta situación, actualmente todas las guías de tratamiento proponen añadir un segundo fármaco oral9-13. En algunos casos podría considerarse la posibilidad de utilizar insulina sola o asociada a un fármaco oral, pero la menor aceptación de la terapia insulínica por parte de los pacientes probablemente condiciona esta posibilidad (fig. 1). La justificación de la terapia combinada se basa no sólo en el fracaso de la monoterapia a largo plazo sino en el hecho, avalado por diferentes estudios, de que es factible aprovechar el efecto sinérgico de los diferentes mecanismos de acción de los fármacos9-13. La terapia combinada permite, además, utilizar menores dosis de los fármacos, lo que puede reducir la frecuencia o gravedad de los efectos adversos (generalmente dependientes de la dosis), y con una efectividad superior. En la tabla 4 se presentan resumidas las ventajas e inconvenientes de las diferentes pautas de tratamiento combinado.
Sulfonilurea-metformina
Constituye la asociación con más experiencia de uso y la que es potencialmente más beneficiosa ya que incide en los dos principales mecanismos fisiopatológicos de la DM2: la deficiencia de insulina (sulfonilureas) y la resistencia a la insulina (metformina). La adición de metformina a pacientes tratados con sulfonilurea disminuye la glucemia basal en un 25-30% y la HbA1c en un 1,7-2,3% sin aumentar significativamente el número de hipoglucemias24,38-40. También se ha observado una disminución entre el 10 y el 15% del colesterol total, colesterol LDL y triglicéridos y un aumento de colesterol HDL. Aunque la mayor parte de estudios se han realizado con glibenclamida, cabe pensar que el resto de sulfonilureas sean igualmente eficaces.
En el estudio realizado por DeFronzo24, 422 pacientes con control deficiente con glibenclamida fueron asignados a placebo o metformina. En el grupo de placebo la HbA1c aumentó en 0,2 puntos mientras que en el de metformina se redujo en 1,7 puntos al cabo de 29 semanas. El estudio de Hermann38 estableció que la mejora en la HbA1c es independiente del fármaco con que se inicie el tratamiento. Así, 144 pacientes tratados sólo con dieta y control deficiente fueron distribuidos aleatoriamente a empezar por glibenclamida o metformina o la asociación de ambos. Los dos grupos de monoterapia necesitaron el otro fármaco para conseguir mejorar el control. Al cabo de 6 meses los descensos de la HbA1c fueron de 2,3 para los que empezaron por metformina, 2,0% para los que empezaron por glibenclamida y 2,2 para los que empezaron con ambas a la vez. Todos los pacientes consiguieron valores deHbA1c < 7%38.
En el estudio UKPDS se probó esta asociación mediante la asignación aleatoria a tratamiento durante 3 años con metformina en un subgrupo de pacientes con mal control a pesar de dosis plenas de sulfonilureas (clorporpramida o glibenclamida) observándose un exceso de mortalidad del 96% frente al grupo que recibió placebo, lo que ha cuestionado la utilización de esta combinación. En un estudio observacional también se constató este fenómeno, aunque no se puede descartar que un peor control glucémico fuera la causa del exceso de la mortalidad y a su vez el motivo de la adición de metformina41. Sin embargo, los autores del UKPDS atribuyen este hecho al azar, ya que ambos grupos presentaron una mortalidad menor que la esperada en relación con el conjunto de la cohorte del estudio, además del pequeño número de pacientes y el corto tiempo de seguimiento. De hecho, el número de episodios cardiovasculares fue el mismo5. Actualmente se acepta que esta asociación es segura y de elección cuando fracasa cualquiera de los dos fármacos en monoterapia9-13.
La demostrada efectividad de esta asociación ha llevado a algunos autores a sustituir el tratamiento con insulina por la combinación de glibenclamida y metformina40. Así, en 55 pacientes obesos, con menos de 10 años de tratamiento insulínico y péptido C positivo, se logró suspender la insulina en 42 de ellos (76 %) con una reducción de 1,3 puntos en la HbA1c y un descenso del peso de 2,3 kg. Los restantes debieron volver a usar insulina por empeoramiento del control glucémico o intolerancia gastrointestinal al fármaco. Los pacientes con más probabilidades de responder fueron los que presentaban un tiempo de insulinización menor (media de 5 años) y menores requerimientos de insulina (media: 0,77 U/kg) y de índice de masa corporal (media: 30)40.
Fundamento fisiopatológico
Efecto sinérgico al producirse una estimulación de la secreción de insulina por parte de las sulfonilureas y una reducción de la producción hepática de glucosa (neoglucogénesis) por metformina. La metformina también mejora la sensibilidad a la insulina (captación de glucosa) a nivel periférico en la célula muscular.
Efectividad sobre la HbA1c
Reducción adicional de 1,5 a 2 puntos independientemente del fármaco de partida.
Efectividad sobre el estado ponderal
La adición de metformina a un paciente tratado con sulfonilurea no supone un incremento de peso e incluso puede producirse una discreta reducción. Cuando es la sulfonilurea la que se añade a la metformina cabe la posibilidad de que se produzca un ligero aumento de peso.
Efectividad sobre el perfil lipídico
Las sulfonilureas tienen un efecto neutro, mientras que la metformina reduce las concentraciones de triglicéridos, colesterol total y LDL e induce un leve aumento de HDL.
Hipoglucemias
Cabe esperar un incremento del riesgo cuando se añade sulfonilureas a pacientes tratados con metformina. Al añadir metformina a una sulfonilurea también puede aumentar la frecuencia de hipoglucemias por la mejora de las cifras glucémicas basales.
Efectos secundarios
Se debe respetar escrupulosamente la contraindicación de la insuficiencia renal por el riesgo de hipoglucemias y de acidosis láctica. Pueden aparecer diarreas al añadir metformina.
Perfil de paciente idóneo
Paciente afectado de DM2 con o sin sobrepeso en tratamiento con sulfonilurea o metformina en monoterapia y con control metabólico deficiente mantenido. La adición de sulfonilureas o metformina es la combinación con mayor experiencia y efectividad y, por tanto, de primera elección siempre y cuando no existan contraindicaciones.
Sulfonilurea-inhibidor de las alfaglucosidasas
La adición de un inhibidor de las alfaglucosidasas (acarbosa o miglitol) a una sulfonilurea disminuye la glucemia posprandial en 25-30 mg aproximadamente y la HbA1c de 0,5-1% sin que se observen cambios en los valores de insulina ni aumento de las hipoglucemias26,42-45. El miglitol, introducido en el mercado en 1999, presenta el mismo perfil terapéutico y de efectos secundarios que la acarbosa, por lo que no parece aportar ningún beneficio adicional importante13. Por otra parte, la acarbosa fue utilizada en el estudio UKPDS (añadida a la sulfonilurea que ya tomaba el paciente) durante 3 años observándose una reducción significativa de 0,51 puntos de la HbA1c en los pacientes que al finalizar el período seguían tomando el tratamiento30. En el estudio de Chiasson también se obtuvo una reducción de 0,5 puntos en la HbA1c al añadir acarbosa a pacientes tratados con sulfonilureas42. La asociación de sulfonilureas y miglitol proporciona resultados similares44. Debe tenerse en cuenta el riesgo de hipoglucemia, que debe ser tratada con glucosa pura (ya que la sacarosa, azúcar común, es un disacárido), así como los frecuentes efectos secundarios gastrointestinales.
Fundamento fisiopatológico
Efecto sinérgico al producirse una estimulación de la secreción de insulina por parte de las sulfonilureas y una reducción de las glucemias posprandiales por el retraso en la absorción de hidratos de carbono.
Efectividad sobre la HbA1c
Reducción adicional de 1,5 a 2 puntos cuando se añade la sulfonilurea y entre 0,5 y 1 puntos cuando se añade un inhibidor de las alfaglucosidasas.
Efectividad sobre el estado ponderal
Cuando se añade una sulfonilurea a pacientes tratados con inhibidores, cabe la posibilidad de que se produzca un ligero aumento de peso durante los primeros meses. La acarbosa y el miglitol no producen cambios en el peso.
Efectividad sobre el perfil lipídico
Tanto las sulfonilureas como los inhibidores tienen un efecto neutro, aunque se podrían reducir las concentraciones de triglicéridos de manera indirecta al mejorar el control glucémico.
Hipoglucemias
Cabe esperar un incremento del riesgo cuando se añade sulfonilureas a pacientes tratados con inhibidores de las alfaglucosidasas.
Efectos secundarios
Se debe respetar escrupulosamente la contraindicación de la insuficiencia renal por el riesgo de hipoglucemia grave. Debe tenerse en cuenta la posibilidad de aparición de efectos secundarios gastrointestinales, que son frecuentes con acarbosa y miglitol.
Perfil de paciente idóneo
Paciente afectado de DM2 con o sin sobrepeso, en tratamiento con una sulfonilurea con grado de control metabólico inadecuado, básicamente por mantener glucemias posprandiales elevadas. También cuando existe contraindicación o intolerancia a la metformina.
Metformina-inhibidores de las alfaglucosidasas
Hay muy pocos estudios sobre la eficacia de la asociación metformina-acarbosa, y sus resultados son inferiores a los de la asociación de sulfonilureas con metformina. Se debe tener en cuenta el riesgo de que se potencien sus efectos secundarios y la interferencia en la biodisponibilidad de la metformina. En el estudio de Chiasson se obtuvo una reducción de 0,8 puntos en la HbA1c y de 62 mg en la glucemia posprandial al añadir acarbosa a los pacientes tratados con metformina42. En el estudio de Rosenstock los efectos adversos no aumentaron y no sobrepasaron el 30%, siendo la reducción de la HbA1c del 0,65%. No se observaron cambios en las concentraciones de insulina, perfil lipídico ni en el peso45. En cuanto al riesgo de interacciones, aunque se han descrito, no parecen tener relevancia clínica.
Esta asociación fue también utilizada en el estudio UKPDS y se observó a los 3 años una reducción no significativa de 0,70 puntos de la HbA1c en los pacientes que al finalizar el período seguían tomando el tratamiento30. Debe tenerse en cuenta el riesgo de posible sumación de los frecuentes efectos secundarios gastrointestinales.
Fundamento fisiopatológico
Efecto sinérgico al producirse una reducción de las glucemias basales al disminuir la producción hepática de glucosa (neoglucogénesis) por la metformina y una reducción de las posprandiales por efecto del inhibidor, sin aumento de la insulinemia.
Efectividad sobre la HbA1c
Reducción adicional de 1,5 a 2 puntos cuando se añade la metformina y entre 0,5 y 1 puntos cuando se añade un inhibidor.
Efectividad sobre el estado ponderal
Ninguno de los dos tienen efectos negativos sobre el control ponderal. La adición de metformina a un paciente tratado con acarbosa podría producir una discreta reducción.
Efectividad sobre el perfil lipídico
Los inhibidores tienen un efecto neutro, mientras que la combinación con metformina reduce los valores de triglicéridos, colesterol total y LDL y produce un leve aumento de HDL.
Hipoglucemias
Ninguno de los dos fármacos produce hipoglucemia por sí mismo.
Efectos secundarios
Se debe respetar escrupulosamente la contraindicación de la insuficiencia renal por el riesgo de acidosis láctica. Debe tenerse en cuenta la posibilidad de agravamiento de los efectos secundarios gastrointestinales, que son frecuentes con ambos fármacos.
Perfil de paciente idóneo
Paciente afectado de DM2 con sobrepeso u obesidad, en tratamiento con metformina con control metabólico inadecuado, básicamente por mantener glucemias pos-prandiales elevadas.
Repaglinida-metformina
Se trata de una asociación equiparable a la de las sulfonilureas con metformina, aunque dada la reciente introducción de repaglinida se dispone de menor experiencia. La menor frecuencia de hipoglucemias graves observada con repaglinida en comparación con glibenclamida haría preferible esta asociación en pacientes con riesgo de hipoglucemia (ancianos, por ejemplo) o en pacientes en los que predominan las hiperglucemias posprandiales.
En un estudio en el que pacientes tratados con metformina fueron aleatorizados a seguir con metformina, sustituir ésta por repaglinida o terapia combinada con ambos fármacos, se observó una reducción de la HbA1c (1,4 puntos) con el tratamiento combinado sin que se apreciaran cambios en los dos grupos que siguieron en monoterapia46. La adición de repaglinida a los pacientes tratados con metformina comportó un incremento de peso de 2,4 kg y un 33% de ellos presentaron alguna hipoglucemia (sólo en 2 pacientes la glucemia capilar fue menor de 50 mg/dl)46.
Fundamento fisiopatológico
Efecto sinérgico al producirse una estimulación de la secreción de insulina posprandial por parte de repaglinida y una reducción de la producción hepática de glucosa (neoglucogénesis) por metformina. Esta última también mejora la sensibilidad a la insulina (captación de glucosa) a nivel periférico en la célula muscular. Esta asociación podría controlar mejor las hiperglucemias posprandiales que la asociación de metformina con una sulfonilurea, aunque no se dispone de estudios comparativos.
Efectividad sobre la HbA1c
Reducción adicional de 1,4 en pacientes tratados previamente con metformina en monoterapia.
Efectividad sobre el estado ponderal
La adición de repaglinida a los pacientes tratados con metformina comporta un incremento de peso semejante al observado con sulfonilureas.
Efectividad sobre el perfil lipídico
Repaglinida tiene un efecto neutro, mientras que metformina se asocia a una reducción de los valores de triglicéridos, colesterol total y LDL y un leve aumento de HDL.
Hipoglucemias
La adición de repaglinida a los pacientes tratados con metformina comporta la aparición de hipoglucemias leves de manera similar a lo que ocurre con las sulfonilureas.
Efectos secundarios
A pesar de que la repaglinida no está contraindicada en caso de insuficiencia renal, sí lo está la metformina. Debe tenerse en cuenta la posibilidad de aparición de efectos secundarios gastrointestinales debidos a metformina.
Perfil de paciente idóneo
Paciente con o sin sobrepeso en tratamiento con repaglinida o metformina en monoterapia y con control metabólico deficiente mantenido. La repaglinida es terapéuticamente equivalente a una sulfonilurea y es una alternativa en el paciente en el que predominan las hiperglucemias posprandiales o existe riesgo de hipoglucemias graves.
Terapia combinada con tres fármacos orales: secretagogo, metformina (o glitazonas) y un inhibidor de las alfaglucosidasas
El Consenso Europeo plantea la posibilidad de utilizar tres fármacos cuando el control es insuficiente con dos fármacos orales10. Aunque no parece descabellado utilizar la asociación de un secretagogo, metformina y un inhibidor de las alfaglucosidas (o una glitazona en los países en que están comercializadas), parece más recomendable asociar insulina nocturna a los fármacos orales que ya toma el paciente11,13. La triple terapia podría ser una alternativa a la insulinización cuando existen dificultades (pacientes ancianos con escaso soporte familiar, por ejemplo) o el paciente no acepta la insulinización de ninguna manera. No existen estudios prospectivos que evalúen la efectividad de esta posibilidad terapéutica, aunque cabe esperar una reducción adicional de 0,5 a 1 puntos en la HbA1c13. En un pequeño estudio sin grupo control la adición de acarbosa a 11 pacientes tratados con metformina y sulfonilureas comportó una reducción adicional de 1,4 puntos en la HbA1c47. En todo caso, la combinación de distintos fármacos orales nunca puede ser una alternativa válida a la terapéutica con insulina en pacientes que precisan dicho tratamiento.
Fundamento fisiopatológico
Efecto sinérgico al producirse una estimulación de la secreción de insulina por parte de las sulfonilureas, una reducción de la producción hepática de glucosa (metformina) y de mejora de la sensibilidad a la insulina a nivel periférico por glitazona y un retraso en la absorción de hidratos de carbono con el inhibidor de las alfaglucosidasas.
Efectividad sobre la HbA1c
Reducción adicional de 0,5 a 1,0 puntos al añadir el inhibidor o la glitazona.
Efectividad sobre el estado ponderal
La adición del inhibidor no supone cambios en el peso.
Efectividad sobre el perfil lipídico
Cabe esperar una reducción de los valores de triglicéridos.
Hipoglucemias
Al mejorar los valores glucémicos basales pueden ser más frecuentes. La hipoglucemia debe ser tratada con glucosa pura ya que la sacarosa (azúcar común) es un disacárido.
Efectos secundarios
Puede empeorar o aparecer flatulencia o diarrea.
Perfil de paciente idóneo
Paciente con o sin sobrepeso en tratamiento con sulfonilureas y metformina y con control metabólico deficiente mantenido que no acepta la insulinización.
Asociaciones con fármacos actualmente no disponibles en nuestro país
Sulfonilurea-glitazona
En dos estudios recientes, la adición de 600 mg de troglitazona a pacientes tratados con una sulfonilurea disminuyó la glucemia en 25-60 mg aproximadamente y la HbA1c en 0,7 y 1,7 puntos, respectivamente48,49. Esta combinación se asocia a una reducción significativa de las concentraciones de insulina. Estos resultados son similares a los observados con la asociación de troglitazona con metformina50 y notablemente superiores a los descritos con troglitazona en monoterapia35. Debe tenerse en cuenta el incremento de peso y de colesterol LDL que se ha observado en los estudios mencionados, ya que es un efecto secundario consustancial a la utilización de ambos fármacos. Aunque se dispone de menos información con rosiglitazona y pioglitazona, cabe esperar unos beneficios similares, motivo por el que parece razonable usarlas como fármacos de segunda línea y básicamente como terapia combinada.
Metformina-glitazona
Se trata de una asociación potencialmente útil, aunque con escasa experiencia en la bibliografía. En un pequeño estudio reciente con 29 pacientes, el tratamiento con troglitazona o metformina en monoterapia durante 3 meses no produjo reducciones significativas de la HbA1c, mientras que el tratamiento combinado durante 3 meses más produjo una reducción significativa de 1,2 puntos de la HbA1c50. La glucemia basal se redujo en 41 mg al final del tratamiento combinado.
Tratamiento combinado con insulina más fármacos orales (tabla 5)
Tratamiento combinado con insulina más sulfonilureas
Hasta la década de los noventa se habían realizado numerosos estudios para evaluar la eficacia de la combinación de insulina con sulfonilureas, pero con pocos pacientes y de corta duración. En los últimos 10 años, tanto el conocimiento más exacto de la fisiopatología de la DM2 como la realización de ensayos clínicos metodológicamente muy estrictos han permitido valorar de forma adecuada los beneficios de esta asociación farmacológica51-66.
En un extenso metaanálisis realizado en 1991 sobre los datos de 22 trabajos publicados en los 12 años previos51, los autores concluyen que la adición de una sulfonilurea a pacientes tratados con insulina mejora ligeramente el control metabólico, utilizando menor dosis de insulina al compararla con la utilización de insulina en monoterapia. Otro metaanálisis más reciente, publicado en 199652, estudia únicamente los ensayos clínicos realizados con una metodología rigurosa (aleatorizados, controlado con placebo, población homogénea) seleccionando 16 publicaciones, y concluye que la adición de sulfonilureas a pacientes tratados con insulina puede ser apropiada, dado que disminuye significativamente la glucemia basal y la HbA1c con una dosis menor de insulina, sin cambios significativos en el peso corporal. Los autores apuntan que aumenta el cociente coste/efectividad del tratamiento. Más recientemente, en el estudio de Feinglos64 se demuestran los beneficios de añadir una sulfonilurea (glipicida) a pacientes con mal control, a pesar del tratamiento con insulina.
Probablemente la experiencia más interesante es la publicada por Yki-Jarvinen53 en 1992 al evaluar en un excelente ensayo clínico no únicamente insulina en una o más dos dosis con o sin sulfonilurea, sino diferentes formas de combinar dichos fármacos. El estudio comparó, en 153 pacientes con DM2 con mal control previo con hipoglucemiantes orales, 5 grupos: sulfonilurea más insulina matutina, sulfonilurea más insulina a las 21 h, insulina en mezcla rápida y NPH antes del desayuno y la cena, insulina NPH a las 21 h y rápida antes de las comidas y, por último, el mantenimiento del tratamiento sólo con sulfonilureas. Se realizó un seguimiento de 3 meses. La HbA1c descendió de forma similar en todos los grupos, de forma significativa respecto al grupo control. Los resultados demostraron que el grupo que recibía sulfonilurea más insulina a las 21 h consiguió un control metabólico similar al de 2 o 3 inyecciones de insulina, pero induciendo un menor aumento de peso y fue superior a la pauta con insulina en dosis única por la mañana. Además, los valores de insulinemia fueron menores en este grupo. Sin embargo, debe tenerse en cuenta que en este estudio, un 64% de los pacientes sin obesidad y un 86% de los obesos también recibían tratamiento con metformina, que no fue suspendida. Dado que el incremento ponderal es el inconveniente fundamental de la insulinización en la DM2, esta combinación (sulfonilurea más insulina monodosis nocturna a las 21 h) consigue atenuar este problema. Sin embargo, el seguimiento a los 12 meses de estos pacientes mostró un empeoramiento de la HbA1c sólo en los pacientes obesos que requirieron mayores cantidades de insulina con el consiguiente incremento de peso54.
Con la comercialización de glimepirida se han realizado estudios específicos de combinación de este fármaco con insulina, que han motivado su aprobación como terapia combinada por la FDA y la Agencia Española del Medicamento. En 1998, Riddle et al estudiaron, en 208 pacientes afectados de DM2 con fracaso secundario a hipoglucemiantes orales, la eficacia de insulina en monoterapia frente a la asociación de glimepirida con una mezcla de insulina (30% rápida) antes de cenar durante 24 semanas. Los pacientes tratados con la asociación obtuvieron un control glucémico similar, evaluado mediante glucemia basal y HbA1c, pero alcanzado más rápidamente, con menor dosis de insulina (49 frente a 78 unidades/día) y menos abandonos55.
Desafortunadamente, el estudio clínico sin duda más importante realizado en el ámbito de la DM2, el UKDPS, no ha evaluado la eficacia de esta asociación4. Como conclusión, en los pacientes que en tratamiento únicamente con sulfonilurea tienen mal control metabólico, la combinación de ésta con insulina no consigue un control metabólico mejor que la insulina sola, pero sí atenúa la ganancia de peso, fundamentalmente si se administra en dosis única por la noche. En la práctica, una combinación útil puede ser administrar insulina de acción intermedia al acostarse (o bien en la cena) junto con sulfonilureas de vida media corta antes de las tres comidas.
Fundamento fisiopatológico
Las sulfonilureas tienen efecto estimulador de la secreción endógena, y en menor grado un aumento de la sensibilidad a la insulina, por lo que la utilización simultánea de sulfonilureas e insulina puede conseguir un efecto sinérgico, con menor dosis de la hormona exógena. Por su parte, la insulina nocturna controla la glucemia basal al reducir la producción hepática de glucosa nocturna.
Efectividad sobre la HbA1c
Se consigue un descenso de HbA1c mayor en comparación al tratamiento con sulfonilureas aisladas, y similar al que se observa con insulina en monoterapia.
Efectividad sobre el estado ponderal
La combinación de sulfonilureas e insulina se acompaña de un menor aumento de peso que el tratamiento con insulina sola.
Efectividad sobre el perfil lipídico
Sin diferencias significativas. Estudios aislados han demostrado descenso de triglicéridos.
Hipoglucemias
En algunos estudios, menor frecuencia en tratamiento combinado.
Efectos secundarios
La tolerancia de la combinación es buena, sin efectos segundarios propios de la asociación.
Perfil de paciente idóneo
Paciente afectado de DM2 con normopeso o sobrepeso moderado, en tratamiento con sulfonilureas con grado de control metabólico inadecuado, básicamente por mantener glucemia en ayunas elevada. Opcionalmente, también se ha demostrado beneficiosa en pacientes ya insulinizados con mal control metabólico, aunque en este caso sea preferible la indicación de metformina9-13.
Tratamiento combinado con insulina más metformina
Dado que la metformina mejora la sensibilidad a la insulina, su combinación con esta hormona administrada exógenamente, en una enfermedad en que coexisten alteraciones tanto en la secreción como en la sensibilidad a la insulina, parece idónea. En efecto, los estudios actuales realizados en este sentido así lo demuestran67-72. En un reciente ensayo sobre 96 pacientes con DM2 con mal control con sulfonilureas, Yki-Jarvinen68 compara la eficacia durante un año de insulina nocturna combinada con metformina, con glibenclamida, con metformina más glibenclamida, con placebo, o con una pauta de dos dosis de insulina. El estudio concluye que en pacientes con DM2 mal controlados con sulfonilureas, la combinación de insulina nocturna (bed time) junto con metformina evita el aumento de peso que se observa con otras combinaciones, e incluso es mejor con respecto al control glucémico o aparición de hipoglucemias que las otras pautas. En otro ensayo, los mismos autores demuestran que este efecto beneficioso de la asociación de insulina con metformina se consigue por una disminución tanto en la dosis de insulina exógena como en el aporte energético dietético exó-
geno69.
Otra situación diferente para plantear los beneficios de esta combinación es la de pacientes con DM2 ya insulinizados pero con un control metabólico deficiente. En un ensayo publicado recientemente por el grupo de Raskin70 en Dallas (Texas) en 43 pacientes, la asociación de insulina y metformina, comparada con insulina y placebo durante 24 semanas, consiguió un mejor valor de HbA1c (reducción de 2,5 puntos frente a 1,6 puntos), menor dosis de insulina (reducción de 4,5 unidades frente a incremento de 22,8 unidades) y también menor aumento de peso (0,5 kg frente a 3,2 kg).
En nuestro entorno, en un estudio recientemente publicado por Relimpio et al71, los autores también demuestran que añadir metformina al tratamiento previo con insulina consigue una mejoría en los valores de HbA1c (7,7 frente a 9,6 %), colesterol total (5,2 frente a 6,0 mmol/l) y colesterol LDL (3,3 frente a 3,9 mmol/l), con peso estable (en relación con el aumento de peso en el grupo tratado sólo con aumento de dosis de insulina).
A partir de todo lo anterior, se debe contemplar esta asociación como alternativa a la insulinización convencional y, de hecho, la guía de consenso europeo para el tratamiento de la DM2 así lo hace10.
Fundamento fisiopatológico
La metformina actúa aumentando la sensibilidad a la insulina, por lo que la utilización simultánea de metformina e insulina puede conseguir un efecto sinérgico, al mejorar la respuesta del organismo con menor dosis de la hormona exógena. Además, tiene un efecto importante sobre el control del peso.
Efectividad sobre la HbA1c
Se consigue un descenso de HbA1c mayor en comparación con el tratamiento con metformina aislada, y similar al que se observa con insulina aislada.
Efectividad sobre el estado ponderal
La combinación de metformina e insulina se acompaña de una estabilidad en la evolución del peso, a diferencia del aumento que ocurre con el tratamiento con insulina en monoterapia.
Efectividad sobre el perfil lipídico
Disminución de colesterol total y LDL.
Hipoglucemias
Menor frecuencia en tratamiento combinado respecto a insulina sola.
Efectos secundarios
Se mantienen los efectos secundarios de la metformina, fundamentalmente los gastrointestinales.
Perfil de paciente idóneo
Paciente afectado de DM2 con sobrepeso u obesidad, en tratamiento con sulfonilurea, metformina, o insulina aislada con grado de control metabólico inadecuado. En el caso de tratamiento previo con sulfonilureas o metformina básicamente para mejorar la glucemia en ayunas. En el caso de insulina, para poder disminuir la dosis de insulina y evitar el incremento ponderal.
Tratamiento combinado con insulina e inhibidores de las alfaglucosidasas
La acarbosa, inhibidor de las alfaglucosidasas intestinales, disminuye la absorción de hidratos de carbono, por lo que atenúa la hiperglucemia posprandial. La asociación de este fármaco con insulina se ha postulado como un mecanismo para disminuir los requerimientos de insulina y controlar perfiles glucémicos en pacientes en los que predominen elevaciones importantes de la glucemia en el período posprandial42,73-77. Un estudio realizado en 145 pacientes con DM2 con mal control metabólico en tratamiento con insulina demuestra que la asociación de acarbosa (en comparación con placebo) consigue disminuir la glucemia posprandial y la media de HbA1c en una magnitud del 0,69% como grupo, aumentando los efectos secundarios gastrointestinales característicos del fármaco74. El uso de miglitol proporciona resultados similares76. Es evidente que cualquier disminución de HbA1c es beneficiosa, pero este beneficio es escaso y se debe ponderar en relación con los efectos secundarios y el coste económico.
Fundamento fisiopatológico
La acarbosa y el miglitol tienen un efecto inhibidor de las alfaglucosidasas, disminuyendo la absorción intestinal de los hidratos de carbono, por lo que reducen la hiperglucemia posprandial. La utilización simultánea de acarbosa o miglitol e insulina puede conseguir un efecto sinérgico, con menores requerimientos posprandiales de la hormona exógena.
Efectividad sobre la HbA1c
Se consigue un descenso de HbA1c de aproximadamente el 0,5-0,7% en comparación con el tratamiento con insulina aislada.
Efectividad sobre el estado ponderal
La combinación de acarbosa con insulina no modifica la evolución del peso corporal con respecto a la insulina aislada.
Efectividad sobre el perfil lipídico
Sin diferencias en los valores en ayunas. Disminuye la trigliceridemia posprandial.
Hipoglucemias
Sin diferencias significativas.
Efectos secundarios
Los efectos segundarios propios de los inhibidores de las alfaglucosidasas, básicamente en forma de flatulencia, dolor abdominal y diarrea.
Perfil de paciente idóneo
Paciente afectado de DM2, en tratamiento con insulina con grado de control metabólico inadecuado, básicamente por mantener glucemias posprandiales elevadas.
Tratamiento combinado con insulina y glitazonas
El mecanismo de acción de las glitazonas incide sobre la sensibilidad periférica a la insulina, por lo que su combinación con insulina se perfila como muy útil en situaciones de resistencia a esta hormona, como ocurre en la DM2. Los estudios iniciales ya realizados en este sentido así lo corroboran78,79. En un estudio sobre 350 pacientes con DM2 en mal control con insulina, la adición de troglitazona durante 26 semanas consigue disminuir la HbA1c un 1,4%, y la dosis de insulina un 29%. Las situaciones susceptibles de esta combinación son similares a las que se podrían beneficiar con la metformina pero, a diferencia de la combinación con metformina, se acompaña de aumento de peso. Los efectos secundarios más importantes se centran en las alteraciones hepáticas ya comentadas.
Fundamento fisiopatológico
Las glitazonas actúan aumentando la sensibilidad a la insulina, por lo que la utilización simultánea con insulina puede conseguir un efecto sinérgico, al mejorar la respuesta del organismo con menor dosis de la hormona exógena.
Efectividad sobre la HbA1c
Se consigue un descenso de HbA1c mayor en comparación con el tratamiento con insulina aislada, del 0,8-1,4%.
Efectividad sobre el estado ponderal
La combinación de glitazona con insulina se acompaña de un aumento de peso mayor a placebo.
Efectividad sobre el perfil lipídico
Aumenta ligeramente el colesterol total, LDL y HDL.
Hipoglucemias
Menor frecuencia en tratamiento combinado respecto a insulina aislada.
Efectos secundarios
Alteraciones de la función hepática, que pueden ser graves en el caso de la troglitazona, mientras que con rosiglitazona y pioglitazona sólo se han registrado elevaciones ocasionales de las transaminasas.
Perfil de paciente idóneo
Paciente afectado de DM2 con sobrepeso u obesidad, en tratamiento con monoterapia con insulina con grado de control metabólico insuficiente. Pacientes en los que, habiéndose creído útil y/o eficaz la asociación de insulina y metformina, presenten contraindicación o intolerancia digestiva a esta última.
Los efectos de las diferentes combinaciones de fármacos orales en insulina se detallan en la tabla 5.
Recomendaciones de otras Sociedades Científicas
Respecto al tratamiento combinado de la DM2, las principales Sociedades Científicas (Consenso Europeo10, ADA12, Canadian Diabetes Association9) son claramente favorables. Concuerdan en los siguientes puntos:
1. Cuando con la dieta, las modificaciones del estilo de vida y la monoterapia con fármacos orales a dosis máximas no se alcanza los objetivos de control debe iniciarse el tratamiento combinado.
2. El tratamiento combinado puede realizarse mediante la asociación de dos (o incluso tres) fármacos orales o con la asociación de fármaco oral e insulina de acción intermedia (preferentemente administrada de forma nocturna). También es posible añadir un fármaco oral a un paciente previamente insulinizado que no alcance sus objetivos de control.
3. La mayoría de los pacientes, con el tiempo, precisarán asociaciones farmacológicas para alcanzar los objetivos de control.
Las particularidades de cada una de las recomendaciones se desarrollan en los siguientes apartados:
Recomendaciones del Consenso Europeo
1. Cuando con la dosis máxima tolerada de dos fármacos orales no se alcanzan los objetivos de control, debe añadirse un tercer fármaco.
2. En pacientes con buena reserva de secreción insulínica es muy útil la asociación de fármacos orales con insulina NPH en monodosis nocturna.
Recomendaciones de la American Diabetes Association
1. La elección del segundo fármaco oral debe basarse en las características individuales y en la magnitud de la hiperglucemia en el momento de iniciar el tratamiento combinado. La metformina resulta muy útil en obesos. La asociación que ha demostrado mayor descenso de la HbA1c es la de sulfonilurea con metformina.
2. La insulina puede asociarse a sulfonilureas, metformina, acarbosa o troglitazona.
3. Si el paciente toma una sulfonilurea se recomienda mantenerla (con dosis aproximadamente de la mitad o un cuarto de la dosis máxima) y añadir insulina NPH al acostarse.
Recomendaciones de la Canadian Diabetes Association
1. Cuando se inicia directamente un tratamiento con insulina, el uso concomitante de fármacos orales puede ser una opción aceptable (mejor control glucémico con menores requerimientos de insulina y menor incremento de peso).
2. Existen evidencias científicas a favor de las siguientes asociaciones:
Grado A (existe una buena evidencia): metformina + sulfonilureas, metformina + acarbosa, acarbosa + sulfonilureas, acarbosa + insulina, insulina + troglitazona.
Grado B (existe una aceptable evidencia): insulina + metformina.