La leishmaniasis es una histoparasitosis producida por protozoos del género Leishmania, de localización intracelular (macrófagos), caracterizada por lesiones viscerales, cutáneas y mucosas y transmitida por la picadura de insectos dípteros de la familia Pheblotomidae, géneros Phlebotomus y Lutzomyia. Existen reservorios domésticos y silvestres, por lo que se puede considerar como una verdadera zoonosis.
Esta parasitosis se distribuye por 88 países, tanto de zonas áridas como tropicales. Se calcula que cada 12 millones de personas sufren alguna de las formas de leishmaniasis y aparecen 1,5 millones de casos nuevos, de los cuales 500.000 son de tipo visceral (el 90% de la India y Sudán) y 1 millón de tipo cutáneo (el 90% en Afganistán, Argelia y Brasil, entre otros países). Por otra parte, 350 millones de personas habitan en zonas de riesgo.
En la actualidad esta parasitosis está aumentando en nuestro país, debido a la mayor incidencia de la infección en pacientes con sida y al aumento del número de viajeros a países tropicales, donde la leishmaniasis es endémica1.
En el presente trabajo se exponen las características de esta parasitosis, en sus formas visceral y cutaneomucosa, especialmente en lo que se refiere a aspectos epidemiológicos, clínicos y terapéuticos, tanto en adultos como en niños.
El parásito
El género Leishmania, orden Kinetoplastida, está constituido por diversas especies y subespecies de protozoos flagelados, cuyo ciclo biológico heteroxénico transcurre en el intestino de los insectos vectores y en los tejidos de un hospedador vertebrado.
La morfología de las diferentes especies del género Leishmania es muy similar, por ello la taxonomía se sustenta en el estudio de diferentes características. Una son las bioquímicas, basadas en el estudio de las isoenzimas (zimodemas); otras inmunobiológicas, basadas en el uso de anticuerpos monoclonales específicos (serodemas) para las subespecies y en la hibridación del ADN del quinetoplasto (esquizodemas), y otras están basadas en el comportamiento biológico de Leishmania, ya sea en animales de experimentación, en el vector, o en los medios de cultivo in vitro.
El parásito presenta dos estadios en su ciclo evolutivo: el amastigote y el promastigote (mastigo: látigo o flagelo). El primero de ellos es de forma ovoidea o esférica, de 2 a 5 µm de diámetro, núcleo redondo, quinetoplasto en forma de bastón y sin flagelo libre; es la forma intracelular del parásito. El segundo es de forma fusiforme de 14 a 20 µm de largo por 2 a 4 de ancho. Esta forma se encuentra en el tubo digestivo del vector y puede cultivarse in vitro2.
Epidemiología
El género Leishmania involucra a numerosas especies y subespecies, de las cuales 15 afectan al hombre, 10 de ellas en países del Nuevo Mundo (América) y 5 en países del Viejo Mundo (Europa, Asia, África y Oceanía).
Los humanos son hospedadores accidentales cuando por sus actividades se ponen en contacto en el ciclo primario de transmisión animal-vector (zoonosis). Existen excepciones como en la leishmaniasis visceral de la India, donde el ciclo primario de transmisión ocurre entre humano-vector-humano (antropozoonosis). Por lo general, pocas especies de flebotomos vectores y de hospedadores vertebrados mantienen los ciclos de transmisión. Usualmente, hay un hospedador reservorio primario y una especie de flebotomo vector por cada especie de Leishmania en cada foco2.
Los vectores son mosquitos hematófagos de los géneros Phlebotomus en el Viejo Mundo y Lutzomyia en el Nuevo Mundo, donde existen más de 350 especies de flebotomos, de los cuales 88 son vectores potenciales. Los flebotomos hembras requieren sangre para su reproducción, por ello pican a los seres humanos y animales (fig. 1).
Fig. 1. Hembra del mosquito Phlebotomus, vector de la leishmaniasis.
En el intestino del mosquito los amastigotes se transforman en promastigotes, los cuales se dividen profusamente por fisión binaria. Aquellas hembras infectadas transmiten la enfermedad cuando inoculan los promastigotes al picar a los hospedadores susceptibles. En los mamíferos, los promastigotes penetran en los monocitos o macrófagos a través de receptores específicos, en donde se transforman en amastigotes, que se multiplican sólo en el interior de estas células del sistema reticuloendotelial, comportándose como parásitos intracelulares obligados.
La forma clásica de la enfermedad dependerá de las características biológicas de especie o subespecie de Leishmania, pero la localización de las lesiones cutáneas dependerá, principalmente, de las características de comportamiento del vector y del hospedador.
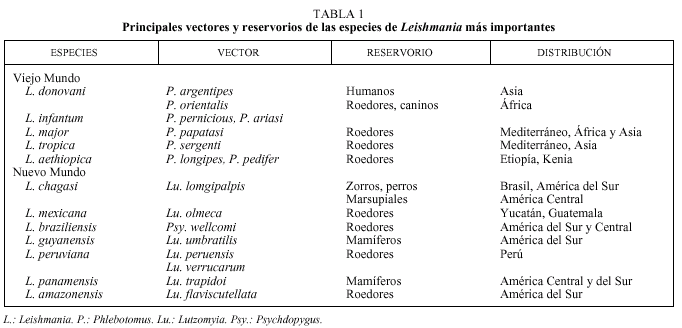
Los reservorios primarios usualmente son mamíferos silvestres, que generalmente no muestran signos evide ntes de infección y los amastigotes, presentes en la piel o las vísceras, son escasos. Los mamíferos domésticos, frecuentemente, son reservorios secundarios3 (tabla 1).
Respecto a la edad, la leishmaniasis predomina en niños entre los 6 meses y los 4 años, con un máximo entre dos y tres años y no existe predilección por uno u otro sexo. Las especies de Leishmania que infectan al hombre pueden manifestarse en dos formas clínicas diferentes: visceral y cutaneomucosa.
Leishmaniasis visceral
A esta forma también se la denomina kala-azar (en sánscrito significa «enfermedad negra») y sus agentes causales son L. donovani, que predomina en el subcontinente indio, China, África e Irak; L. infantum, predominante en la cuenca del Mediterráneo europeo y africano, y L. chagasi, causante de la leishmaniasis visceral en América.
Epidemiología
Más del 90% de los casos de leishmaniasis visceral, a nivel mundial, aparecen en la India, Bangladesh, Nepal y Sudán. En la cuenca mediterránea, especialmente en España, la leishmaniasis visceral se está incrementando debido al aumento del sida4. En América, se presenta desde el sur de Estados Unidos hasta el norte de Argentina, con una mayor incidencia en el noreste de Brasil, donde la mayor parte de los casos corresponde a niños menores de 10 años de edad.
Los factores de riesgo para esta enfermedad son la desnutrición, por ello los niños son los más afectados, y la presencia de perros infectados en las zonas rurales. Diversos animales salvajes como el zorro y la zarigüeya pueden mantener y propagar esta zoonosis. Lutzomyia lomgipalpis es el vector más importante y el agente etiológico es, en este caso, Leishmania chagasi.
Manifestaciones clínicas
En las áreas endémicas, entre el 30 y 100% de las personas infectadas no presenta síntomas. El período de incubación promedio es de 2 a 4 meses, con un rango entre 3 semanas y más de dos años.
La enfermedad clásica se caracteriza por la presencia de fiebre, esplenomegalia y anemia, pero existen formas incompletas que pueden carecer de alguna de estas manifestaciones. En las áreas endémicas, algunos individuos pueden desarrollar enfermedad oligosintomática, caracterizada por tos, diarrea, fiebre baja y ausencia de visceromegalias. En estos individuos no se desarrolla la forma clásica de leishmaniasis visceral y se recuperan espontáneamente5.
Inicialmente la enfermedad puede ser insidiosa, rara vez brusca, con predominio de la fiebre, que es diaria y de curso irregular. Posteriormente aparecen signos generales y viscerales como hemorragias nasales, gingivales o intestinales, así como esplenomegalia intensa, que puede descender, incluso, hasta el pubis y es de dureza variable. La hepatomegalia es más discreta y, a veces, cursa con ictericia. En ocasiones aparecen micropoliadenopatía y edema en las extremidades inferiores y no es excepcional que aparezcan molestias digestivas, como vómitos, dolores epigástricos y anorexia, lo que lleva al adelgazamiento y debilidad general6-8.
En los niños, en ausencia de tratamiento temprano, se produce retraso de crecimiento y en todos los pacientes, en la etapa final y severa de la enfermedad, al mal estado general y a la disminución de las defensas se añaden las infecciones intercurrentes, como tuberculosis, disentería, bronconeumonía y sarampión, que pueden agravar el proceso y llevar a la muerte. En niños también son frecuentes la septicemia y la osteomielitis y, dentro de las complicaciones neurológicas, la menin-
gitis.
Los signos cutáneos más frecuentes del kala-azar son los nódulos subcutáneos, ulceraciones de la piel y cambios de color. A la palidez por la anemia se agregan áreas de pigmentación o, a veces, de despigmentación, lesiones en las que se pueden encontrar parásitos. El pelo se hace quebradizo y la piel se seca y se hace escamosa, adoptando un aspecto gris ceniciento del que deriva el nombre de la enfermedad9.
Diagnóstico
En el diagnóstico diferencial se deben incluir enfermedades que produzcan esplenomegalia, tanto secundarias a procesos infecciosos como a enfermedades neoplásicas, hepatopatías, cardiopatías, inmunopatías e incluso metabolopatías (tabla 2).
El hemograma revela anemia normocítica, normocrómica, leucopenia, eosinopenia y trombocitopenia. La velocidad de sedimentación está acelerada y existe una marcada hipergammaglobulinemia, a expensas, sobre todo, de la IgG8.
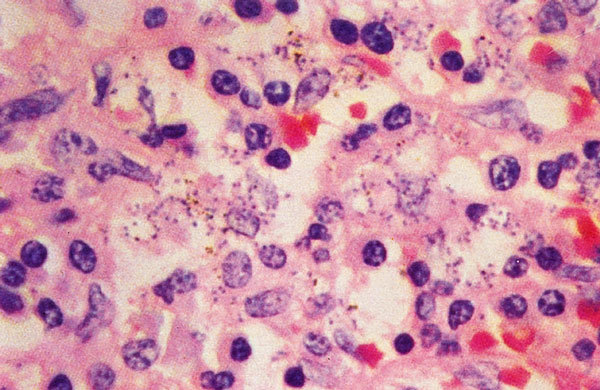
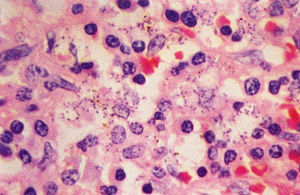
El diagnóstico parasitológico se llevará a cabo por diversos procedimientos. En primer lugar, mediante punción de médula, ganglios linfáticos, bazo e hígado. En esos medios, especialmente en la médula, se deben buscar los amastigotes de Leishmania en el interior de los histiocitos (coloración de Giemsa) o anticuerpos monoclonales. La punción esplénica es el método más sensible (más del 95%), pero sólo se debe realizar por un experto y cuando el paciente tenga un tiempo de protrombina normal y plaquetas superiores a 40.000/µm8 (fig. 2).
Fig. 2. Leishmaniasis visceral: corte de bazo que muestra numerosas células fagocitarias mononucleares que contienen formas amastigotas de L. donovani. Coloración hematoxilina-eosina.
Con el material obtenido de las punciones o biopsias es posible cultivar el parásito en medios apropiados como el agar sangre NNN (Novy-Nicolle-McNeal) o inocular en animales susceptibles, como el ratón, la rata y el hámster.
Para el diagnóstico inmunológico se emplean las pruebas serológicas, como la aglutinación directa e indirecta, que tienen una sensibilidad del 97-100% y especificidad del 70%, la inmunofluorescencia indirecta y la prueba ELISA, con una sensibilidad del 95-100% y especificidad del 99%9.
La prueba de la intradermorreacción tiene utilidad en el estadio subagudo y crónico. Los pacientes con la forma clásica, particularmente los graves, suelen tener esta prueba negativa por el estado de anergia que se encuentran.
Tratamiento
Los fármacos de elección son las sales de antimonio. En el Nuevo Mundo se emplea más la N-metilglucamina (Glucantime®), a dosis de 20 mg/kg de peso y día, en una o dos inyecciones al día, durante 20-30 días. En el Viejo Mundo es más empleado el estibogluconato de sodio (Pentostam®), a la misma dosis y pauta, sin exceder de los 850 mg al día.
Medicamentos de segunda elección son la anfotericina B y la pentamidina, empleadas cuando fallan los antimoniales o existe coinfección con el VIH. La primera se emplea a dosis de 0,5-1 mg/kg de peso y día, a días alternos, hasta alcanzar una dosis total de 15-20 mg/kg de peso, y la segunda a dosis de 2-4 mg/kg de peso, 1-3 veces por semana, durante 5-25 semanas, según la gravedad del proceso10-12.
No hay que olvidar los efectos secundarios de estos preparados, sobre todo en edades infantiles. Las sales de antimonio pueden producir mialgias, artralgias, fiebre, astenia, hepatotoxicidad y pancreatitis, entre otras; además, no están indicadas en mujeres gestantes. La toxicidad de la anfotericina B se manifiesta con fiebre, hipotensión, nefrotoxicidad y anemia, y en la pentamidina con hipotensión, hipoglucemia y vómitos. Todas estas complicaciones son de carácter reversible11,12.
El tratamiento se complementará con una alimentación hiperproteica e hipercalórica, con suplementos vitamínicos y hierro, así como con antibióticos en el caso de existir complicaciones infecciosas.
Pronóstico
La mortalidad de la leishmaniasis visceral en la forma clásica puede ser alta, de hasta el 90%, pero con tratamiento adecuado es menor del 5%. La mortalidad se incrementa cuando existe desnutrición intensa o depresión inmunitaria celular, producida por neoplasias, tratamiento corticoide o infección por el VIH. Cuando los pacientes se curan no suelen tener secuelas, aunque aproximadamente el 20% de los pacientes de la India
y el 5% en África desarrollan leishamaniasis dérmica poskala-azar.
Control
Las medidas de control son múltiples y deberían ser integradas. Incluyen acciones de diagnóstico y eliminación de los perros infectados, lucha contra los vectores mediante la aplicación de insecticidas de acción residual, y diagnóstico y tratamiento tempranos de las personas infectadas. Las acciones de control implican también actividades educativas y participación comunitaria13.
Leishmaniasis cutaneomucosa
Epidemiología
Esta variedad de leishmaniasis se presenta, al igual que el kala-azar, desde el sur de Estados Unidos hasta el norte de Argentina. Se encuentran libres de transmisión Canadá, Chile, Uruguay y la mayoría de las islas del Caribe. La leishmaniasis cutánea que se presenta en países del Viejo Mundo muestra algunas características diferentes de la del Nuevo Mundo. La distribución y la epidemiología de la enfermedad están en relación con las condiciones ecológicas y socioeconómicas y la transmisión guarda relación con la distribución altitudinal del vector, que oscila entre los 700 y 3.000 m sobre el nivel del mar.
A esta variante de la enfermedad se le ha denominado «úlcera de los chicleros» en México, «uta» y «espundia» en Perú y Bolivia, y también «pian bois» en las Guayanas. El ciclo de transmisión es complejo y por lo general existe especificidad ante los reservorios y los vectores de cada subespecie de Leishmania.
Los vectores del parásito son especies del género Lutzomyia. En el Nuevo Mundo, 44 especies son vectores potenciales, que tienen su hábitat, generalmente, en las zonas rurales, siendo sólo las hembras, hematófagas, las que transmiten la infección. Los mosquitos viven en lugares oscuros y húmedos como, por ejemplo, los huecos de los árboles, cuevas, resquicios entre las piedras, etc. Es importante conocer los hábitos de los vectores para la aplicación de medidas de control y prevención de este parasitismo.
La transmisión depende del contacto hombre-vector. El patrón de transmisión depende de dónde ocurre la picadura y puede ser intradomiciliario, cuando el vector se introduce en las casas de las personas; peridomiciliario, cuando el contacto hombre-vector ocurre alrededor del domicilio, y rural, en donde las personas se exponen a la picadura del vector al internarse en el bosque o realizar actividades agrícolas, en lugares donde se encuentran los reservorios y vectores del parásito.
En la transmision intra y peridomiciliaria ambos sexos son afectados por igual, sin embargo, en la transmisión rural son, sobre todo, los varones. Si la transmisión es intradomiciliaria, los niños menores de 4 años son los más afectados.
Los reservorios naturales del parásito lo constituyen los vertebrados silvestres, principalmente roedores; los animales domésticos tienen un papel menos importante y se comportan como reservorios secundarios. Los animales naturalmente infectados no suelen presentar lesiones evidentes en la piel, siendo necesario efectuar biopsias y cultivos para la demostración parasitológica.
Todas las especies de Leishmania de importancia médica producen lesiones cutáneas y algunas de ellas tienen la capacidad de producir lesiones mucosas. Las subespecies más importante es Leishmania (Viannia) braziliensis14.
Manifestaciones clínicas
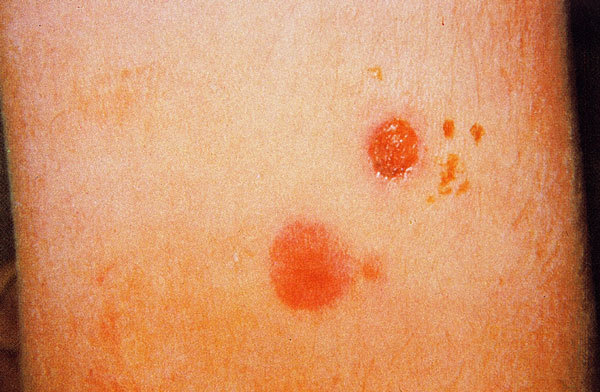
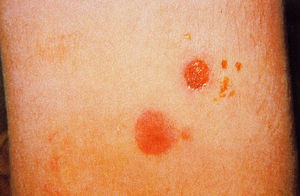
La lesión cutánea típica es la úlcera. Inicialmente, en el sitio de la picadura e inoculación del parásito, aparece un eritema pruriginoso que evoluciona a pápula y vesícula pustulosa de base indurada, que luego se abre como una pequeña úlcera, que se cubre de una costra (fig. 3). La lesión inicial puede ser única o múltiple y, en ocasiones, las lesiones pueden confluir; estas úlceras de mayor tamaño, generalmente, tienen bordes netos y edematosos con un color violáceo, son indoloras y, cuando se retira la costra que la cubre, se aprecia un fondo granulomatoso grueso, hiperémico y sangrante.
Fig. 3. Lesiones cutáneas en distintos estadios, producidas por Leishmania braziliensis.
Si esta lesión se infecta, se aprecia un exudado blancoamarillento de mal olor, con dolor local y linfangitis regional. Las zonas de piel más afectadas son las descubiertas, principalmente la cara y miembros superiores e inferiores; son muy raras en las palmas de las manos, plantas de los pies y cuero cabelludo. No todas las lesiones evolucionan hacia la ulceración; pueden observarse lesiones infiltrativas en placas, nódulos subcutáneos o formaciones vegetantes, denominadas «verrucomas».
Solamente el 10% de los afectados desarrolla lesiones mucosas. Aparecen cuando las lesiones cutáneas han cicatrizado, aunque a veces pueden ser concomitantes. Normalmente aparecen en los 5 primeros años posteriores a la aparición de la lesión cutánea primaria.
Las lesiones suelen iniciarse en el tabique nasal y posteriormente se extienden a las mucosas de la orofaringe, paladar y úvula, laringe e, incluso, pueden afectar a las cuerdas vocales y tráquea. Algunas de estas lesiones pueden evolucionar a ulceraciones y en casos avanzados se puede observar amputación del tabique nasal («nariz de tapir»), cornetes o parte del ala de la nariz. La afección de la epiglotis, cuerdas vocales y tráquea puede producir disfonía, disfagia y dificultad respiratoria10.
En casos de leishmaniasis difusa pueden aparecer infiltraciones de la piel y del tejido celular subcutáneo, dando lugar a ondulaciones que, en la cara, dan el aspecto de lepromas; en estas lesiones los parásitos son abundantes8.
Diagnóstico
El diagnóstico clínico se basará en las características de las lesiones y en el antecedente epidemiológico. Se hará el diagnóstico diferencial con lesiones piógenas, heridas contaminadas, ulceraciones varicosas, micosis cutáneas, entre otras, así como con neoplasias de la cavidad oral, linfomas, rinoescleroma y sífilis.
El diagnóstico parasitológico requiere la demostración de los amastigotes en el frotis de la lesión y en la biopsia, o de los promastigotes, a través de los medios de cultivo in vitro. El frotis puede obtenerse mediante un raspado con hoja de bisturí o espátula, o bien por aspiración con aguja hipodérmica, tomada en el borde de la lesión. Los parásitos se visualizan libres o en el interior de los histiocitos mediante coloración Giemsa.
Los cultivos se realizan en medio NNN suplementado con sangre desfibrinada de conejo (15%). La biopsia debe realizarse en el borde de la lesión y el material obtenido puede emplearse para estudio parasitológico, histopatológico e incluso para la determinación de la especie de Leishmania, mediante la hibridación de K-ADN y el uso de los anticuerpos monoclonales.
También se ha empleado la técnica de intradermorreacción de Montenegro, que consiste en la inoculación de un lisado de promastigotes y la aparición de una lesión de más de 5 mm, maculopapular, en el punto de inoculación, a partir de las 48 h. Esta prueba tiene una sensibilidad del 90%9.
Dentro de las pruebas serológicas, la inmunofluorescencia indirecta y ELISA son los métodos más usados para la detección de anticuerpos. A veces esta prueba produce reacción cruzada con la enfermedad de Chagas y con kala-azar.
Tratamiento y control
Los fármacos de elección son los antimoniales polivalentes, que pueden aplicarse por vías intravenosa, intramuscular e intralesional. Los más empleados son el antimoniato de N-metilglucamina (Glucantime®) y el estibogluconato sódico (Pentostam®). Se vigilará la posible aparición de complicaciones y se controlará, sobre todo, el estado cardíaco, renal y hepático de los pacientes, antes y durante la aplicación del tratamiento. Los fármacos de segunda línea son la anfotericina B y la pentamidina; ambas son más tóxicas que los antimoniales y su uso debe ser intrahospitalario. Las dosis y pautas de tratamiento han sido descritas anteriormente, aunque el Pentostam se recomienda a mitad de la dosis que para la forma visceral12.
El control de esta parasitosis es complejo y requiere un enfoque multidisciplinario, como se ha referido anteriormente. Deben realizarse un diagnóstico y un tratamiento tempranos, luchar contra los vectores y reservorios, gestión ambiental, educación y protección personal15.
La protección individual se basa en el uso de repelentes o impregnación de vestidos y ropa con permetrina, que establece una barrera entre el sujeto y el vector, impidiendo la picadura. El control del vector se realiza con el uso de insecticidas de acción residual, aunque su efecto es temporal y sólo es efetivo si la transmisión es intradomiciliaria. En nuestro país la leishmaniasis es una enfermedad de declaración obligatoria.