El origen de los marcapasos parte del invento realizado en 1958, en Estocolmo, por el Dr. Senning, cirujano cardíaco que realizó estimulación cardíaca sobre un paciente llamado Larsson mediante dos cables suturados al epicardio y un generador.
La estimulación endocárdica definitiva fue realizada por primera vez por el Dr. Parsonnet. En España, la primera intervención fue realizada en 1963 por Castellanos y Berkovitz, que colocaron un marcapasos a demanda en modo VAT.
Actualmente se ha avanzado mucho, y son muchos los modelos existentes y sus indicaciones.
El marcapasos podría definirse como un dispositivo electrónico cuya utilidad es hacer latir el corazón a base de descargas eléctricas que sustituyen al propio sistema de conducción cardíaca y garantizan un latido sincrónico y eficiente.
A grandes rasgos, consta de una pila, actualmente con un peso de menos de 250 g, que se coloca en el tejido subcutáneo y de la cual salen uno o dos cables que por la vena subclavia llegan al corazón (punta del ventrículo derecho y aurícula en algunos casos).
Recursos para la colocación de marcapasos
La estimulación cardíaca permanente es una técnica que compete al campo de la cardiología, y no está bien definido qué especialista debe efectuarla; de hecho, en España, dependiendo del centro, los marcapasos son colocados por cardiólogos, intensivistas y cirujanos cardíacos. El profesional encargado de su colocación, seguimiento y manejo debe tener amplios conocimientos de electrofisiología y de las técnicas de cateterización aplicadas para la estimulación cardíaca.
En las unidades de marcapasos trabaja un equipo médico a tiempo completo o parcial, según la demanda asistencial, además de dos o tres ATS/DUE (asistente técnico sanitario/diplomado universitario de enfermería) con conocimiento y entrenamiento suficientes para poder colaborar con el médico. Lo ideal es que dichas unidades tengan los protocolos necesarios para atender las demandas asistenciales urgentes durante las 24 h, los 365 días del año.
Durante el proceso de implantación, los recursos humanos mínimos necesarios son un facultativo médico especializado, un ATS/DUE debidamente adiestrado y una auxiliar de clínica. Todas las actividades de programación del marcapasos deben ser realizadas o supervisadas por un médico.
Para la implantación es necesario un quirófano o, en su defecto, una sala de hemodinámica en la que se garanticen las medidas de asepsia necesaria. Esta sala tendrá espacio suficiente para que, en caso necesario, se puedan hacer maniobras de reanimación cardiopulmonar (RCP) avanzadas, pericardiocentesis y colocación de drenajes torácicos. Anexo a la sala debe haber un almacén donde guardar los materiales. La sala dispondrá además de la infraestructura necesaria para administrar oxígeno, sistema de vacío para aspiraciones, gases anestésicos, aislamiento eléctrico y radiológico, así como dosímetros.
Esta sala dispondrá al menos de un sistema de fluoroscopia con intensificador de imagen y tubo rotatorio que proporcione, por lo menos, un campo visual de unos 18 cm, de ser posible con impresora de imagen y grabación de vídeo. Además de la proyección anteroposterior, debe ser capaz de realizar proyección lateral u oblicua mediante sistema de arco, factor muy importante cuando se quiere comprobar la ubicación de una sonda en aurícula o seno coronario.
Otros medios a disposición del equipo son el material quirúrgico adecuado, el material de acceso venoso, la monitorización electrocardiográfica, los sistemas de medida de umbrales y análisis de señales endocárdicas, polígrafo con capacidad de registro de señales endocavitarias, programador del marcapasos que se implante, desfibrilador/cardioversor, marcapasos externo, y demás.
Indicaciones de estimulación cardíaca
Tanto el Colegio Americano de Cardiólogos (ACC) como la Asociación Americana del Corazón (AHA) están tratando de unificar las normas de actuación en cuanto a la implantación de marcapasos. Las indicaciones de marcapasos se clasifican en tres grandes grupos de acuerdo con las siguientes consideraciones:
Grupo I. Situaciones en las que existe evidencia o acuerdo general en que la colocación de marcapasos es de utilidad y eficacia.
Grupo II. Situaciones en que la evidencia es controvertida y existe divergencia en cuanto a la utilidad y eficacia de un procedimiento o tratamiento. Este grupo se subclasifican en:
Grupo IIa. La evidencia es mayoritaria y se inclina a favor de la utilidad y eficacia.
Grupo IIb. La utilidad o eficacia se basa en un menor grado de evidencia.
Grupo III. Son situaciones en que el acuerdo general apoya la ineficacia del procedimiento, e incluso algunos opinan que puede ser perjudicial.
A su vez, en estos grupos se ha estudiado la necesidad de marcapasos como evidencias científicas del grupo A, B y C. Las recomendaciones de nivel A corresponden a un estudio realizado por expertos en los que revisaron metaanálisis y trabajos aleatorizados con elevado número de casos; las de nivel B estudian los resultados de ensayos clínicos y estudios bien diseñados pero no aleatorizados, y las de nivel C son las catalogadas como opiniones de expertos.
Bloqueo auriculoventricular adquirido del adulto
La colocación de marcapasos depende de la presencia o ausencia de síntomas o signos importantes y atribuibles a la bradicardia.
En el grupo I se incluyen los bloqueos auriculoventriculares de tercer grado, independientemente de su localización anatómica, si se asocian con uno de los siguientes signos o síntomas:
a) Bradicardia sintomática (recomendación de nivel C).
b) Arritmias y otras situaciones médicas que hagan necesaria la administración de tratamiento farmacológico que tengan como efecto secundario bradicardia sintomática (recomendaciones de nivel C).
c) Asistolias iguales o superiores a 3 s, o ritmo de escape menor de 40 lat/min en pacientes en vigilia y asintomáticos (recomendaciones de nivel B y C).
d) Tras tratamiento intervencionista con ablación del nódulo auriculoventricular e inducción de bloqueo auriculoventricular (recomendaciones de niveles B y C).
e) Bloqueo auriculoventricular postoperatorio que no se resuelve solo (evidencia de nivel C).
f) Enfermedades neuromusculares con bloqueo auriculoventricular tales como síndrome de Kearns-Sayre y distrofia muscular miotónica, entre otros (recomendaciones o evidencia científica de nivel B).
g) Bloqueo auriculoventricular de segundo grado, independientemente de su localización y asociado a bradicardia sintomática (recomendaciones de nivel B).
En el grupo II se incluyen:
a) Bloqueos auriculoventriculares de tercer grado sintomáticos, independientemente de su localización anatómica, con frecuencias de escape iguales o superiores a 40 lat/min (recomendaciones de nivel B y C).
b) Bloqueos auriculoventriculares de segundo grado tipo II asintomáticos (recomendación de nivel B).
c) Bloqueos auriculoventriculares de segundo grado tipo I sintomático, de localización intra o infrahisiana como hallazgo detectado durante un estudio electrofisiológico (recomendación o nivel de evidencia grado B).
En el grupo III se incluyen:
a) Bloqueos auriculoventriculares de primer grado asintomático.
b) Bloqueos auriculoventriculares de segundo grado tipo I a nivel suprahisiano asintomáticos.
c) Bloqueos auriculoventriculares secundarios a condiciones que se consideren transitorias y de improbable repetición (por ejemplo, intoxicación medicamentosa).
Bloqueos bifasciculares y trifasciculares crónicos (bloqueo de rama asociado a hemibloqueo y prolongación de PR)
Dentro de este grupo se engloban las lesiones fasciculares de conducción al menos dobles y por debajo del nódulo auriculoventricular. Se tiene evidencia científica de que los pacientes con este tipo de alteraciones presentan síntomas y tienen un elevado riesgo de padecer bloqueo auriculoventricular avanzado asociado a una elevada mortalidad por muerte súbita.
Se aconseja que en los pacientes sintomáticos con bloqueo bifascicular, pero en los que no se ha podido documentar bloqueo auriculoventricular completo, cuando se constate en estudio electrofisiológico un intervalo HV >= 100 ms se implante marcapasos.
Entre ellos se incluyen:
Grupo I con evidencia científica tipo B: a) bloqueos auriculoventriculares de segundo grado tipo II; b) bloqueos auriculoventriculares de tercer grado intermitentes.
Grupo II con evidencia o recomendación científica tipo B: síncopes no documentados como debidos a bloqueo auriculoventricular, si se han excluido otras causas, y sobre todo cuando en el estudio electrofisiológico se detecta HV prolongado (mayor o igual a 100 m).
Grupo III con evidencia o recomendación científica tipo B: bloqueo bi o trifascicular (bloqueo de rama asociado a hemibloqueo y prolongación del PR) asintomático que nunca ha inducido bloqueo auriculoventricular.
En el postinfarto
La necesidad de estimulación cardíaca permanente está relacionada con el tipo de infarto, la duración y la clínica del bloqueo. La mayoría de los trastornos de la conducción auriculoventricular asociados a infarto agudo de miocardio de localización inferior suelen resolverse solos.
Por otra parte, hay que tener en cuenta que los pacientes con infarto que presentan trastornos de la conducción auriculoventricular normalmente fallecen antes de plantearse la necesidad o no de marcapasos definitivos, ya que suelen ser infartos de gran dimensión.
La necesidad o no de implantación de marcapasos se reparte en los tres grupos del siguiente modo:
Grupo I con evidencia científica tipo B: a) bloqueo auriculoventricular de segundo grado tipo II persistente o de tercer grado intra o infrahisiano, independientemente de la localización del infarto; b) bloqueo auriculoventricular de segundo grado tipo II transitorio, asociado a bloqueo de rama, en presencia de infarto agudo de miocardio anterior.
Grupo II con evidencia científica tipo B: bloqueo auriculoventricular avanzado persistente (más de 3 semanas) de localización en el nódulo auriculoventricular
Grupo III con evidencia científica tipo B: a) bloqueo auriculoventricular transitorio en ausencia de trastornos de la conducción intraventricular; b) bloqueo auriculoventricular transitorio en presencia de hemibloqueo anterosuperior izquierdo aislado; c) hemibloqueo anterosuperior izquierdo adquirido en ausencia de bloqueo auriculoventricular, y d) bloqueo auriculoventricular de primer grado persistente en presencia de bloqueo de rama de antigüedad no determinada.
En la enfermedad del nódulo sinusal
Dentro del contexto de enfermedad del nódulo sinusal se engloba una amplia gama de arritmias, y en un mismo paciente pueden o no coexistir varias de ellas: bradiarritmias en forma de bradicardia sinusal, paros o pausas, taquibradiarritmias...
La distribución de la recomendación o no de marcapasos en los tres grupos es la siguiente:
Grupo I con recomendación científica C: a) disfunción sinusal con bradicardia documentada, incluyendo pausas sinusales que inducen síntomas, en aquellos casos en que esto es producido por medicaciones que son necesarias y no sustituibles, y b) incompetencia cronotrópica sinusal sintomática.
Grupo II con recomendación científica C: a) disfunción sinusal de aparición espontánea o secundaria a fármacos, con frecuencias cardíacas menores a 40 lat/min, aun cuando no se haya podido establecer una relación clara entre los síntomas y la bradicardia, y b) prevención de la fibrilación auricular recurrente con bradicardia dependiente.
Grupo III: a) disfunción sinusal en pacientes asintomáticos; b) disfunción sinusal en pacientes con síntomas sugerentes de bradicardia en los que no se ha demostrado que ésta corresponda a la disminución de la frecuencia, y c) disfunción sinusal con bradicardia sintomática debida a tratamiento farmacológico que puede ser retirado o modificado.
En la hipersensibilidad del seno carotídeo
La indicación de implantación de marcapasos se distribuye en los tres grupos del siguiente modo:
Grupo I con recomendación científica grado C: síncopes recurrentes ocasionados por estimulación del seno carotídeo, con pausas > 3 s y en ausencia de cualquier medicación que deprima el nodo sinusal o la conducción auriculoventricular.
Grupo IIa con recomendación grado C: síncopes recurrentes sin causa desencadenante evidente y con respuesta inhibitoria al masaje cardíaco.
Grupo IIb con recomendación grado B: paciente con síncope de repetición en el cual el test de basculación reproduce la bradicardia.
Grupo III: a) respuesta cardioinhibitoria a la estimulación del seno carotídeo en ausencia de síntomas; b) síncope recurrente, mareo o inestabilidad en ausencia de respuesta cardioinhibitoria, y c) síncope vasovagal en el que las medidas encaminadas a modificar la respuesta anómala resultan eficaces.
En la infancia y la adolescencia
La estimulación cardíaca puede estar indicada en los siguientes casos:
Grupo I con evidencia científica B o C: a) bloqueo auriculoventricular avanzado de segundo o tercer grado acompañado de bradicardia sintomática, insuficiencia cardíaca congestiva o bajo gasto cardíaco (recomendación C); b) disfunción del nódulo sinusal sintomática (recomendación B); c) bloqueo auriculoventricular postoperatorio avanzado de segundo o tercer grado en el que no se prevé que se resuelva o persiste más de una semana (recomendación con evidencia B); d) bloqueo auriculoventricular congénito de tercer grado con ritmo de escape con QRS ancho o asociado a disfunción ventricular (recomendación con evidencia B); e) bloqueo auriculoventricular congénito de tercer grado en el lactante con ritmo cardíaco < 55 lat/min o asociado a cardiopatía congénita con ritmo ventricular de 70 lat/min (evidencia C), y f) taquicardia ventricular secundaria a pausas con o sin síndrome de QT prolongado (evidencia científica grado B).
Grupo II con recomendaciones científicas C: a) síndromes de bradicardia-taquicardia que precisa tratamiento antiarrítmico a largo plazo a excepción de la digital; b) bloqueo auriculoventricular congénito de tercer grado, en un niño de más de 1 año de edad, con ritmo de escape inferior a 50 lat/min o con pausas inesperadas en el ritmo ventricular superiores al doble o triple del ciclo cardíaco de base; c) síndrome QT prolongado con bloqueo auriculoventricular de segundo o de tercer grado, y d) bradicardia sinusal asintomática en niño con cardiopatía congénita compleja con frecuencias cardíacas en reposo de unos 35 lat/min o con pausas > 3 s.
Grupo III: a) bloqueo auriculoventricular transitorio en el postoperatorio con recuperación de la conducción normal antes de la semana; b) bloqueo bifascicular postoperatorio asintomático con o sin bloqueo auriculoventricular de primer grado; c) bloqueo auriculoventricular de segundo grado tipo I asintomático, y c) bradicardia sinusal sin signos ni síntomas en la adolescencia, con intervalo RR máximo de 3 s y frecuencias cardíacas mínimas > 40 lat/min.
Existen diversas indicaciones especiales para la implantación de marcapasos que han ido surgiendo en los últimos años, según los avances de estos dispositivos iban en aumento. Así, puede estar indicada la implantación de marcapasos en la miocardiopatía hipertrófica, en la dilatada y en el contexto de un trasplante cardíaco.
En la miocardiopatía hipertrófica
Hace algunos años se comenzó a colocar marcapasos de doble cámara basándose en la idea de que mejoran el gradiente obstructivo. Los estudios aleatorizados que han intentado demostrar el beneficio de esta estimulación han resultado controvertidos, aunque parece evidente que disminuyen el gradiente y mejoran la capacidad funcional de la insuficiencia cardíaca. Las indicaciones de la implantación de marcapasos en la miocardiopatía hipertrófica son las siguientes:
Grupo I: a) bloqueo auriculoventricular asociado a miocardiopatía hipertrófica, y b) bloqueo sinusal sintomático.
Grupo II: pacientes con miocardiopatía hipertrófica refractarios al tratamiento médico con gradiente significativo en el tracto de salida del ventrículo izquierdo en reposo o provocado.
Grupo III: a) pacientes asintomáticos o controlados con tratamiento médico, y b) pacientes sintomáticos pero sin gradiente al tracto de salida del ventrículo izquierdo.
En la miocardiopatía dilatada
Los pacientes con insuficiencia cardíaca secundaria a miocardiopatía dilatada pueden mejorar mediante la estimulación con sistema de doble cámara, con un intervalo auriculoventricular corto. Se cree que así se mejora la actividad mecánica auriculoventricular y el tiempo de llenado ventricular reduce la regurgitación mitral y se aumenta el gasto cardíaco y la tensión arterial. La colocación de marcapasos en este contexto se distribuye en los siguientes grupos:
Grupo I: las mismas indicaciones que la clase I para la enfermedad del nódulo sinusal o bloqueo auriculoventricular asociado a miocardiopatía dilatada.
Grupo II: pacientes con miocardiopatía dilatada sintomática, refractarios al tratamiento médico e intervalo auriculoventricular prolongado, cuando un estudio hemodinámico haya demostrado el beneficio de la estimulación.
Grupo III: a) pacientes asintomáticos con miocardiopatía dilatada; b) pacientes con miocardiopatía dilatada controlados médicamente, y c) pacientes sintomáticos con miocardiopatía isquémica.
En el trasplante cardíaco
La implantación de marcapasos también puede estar indicada tras el trasplante cardíaco, dado que la incidencia de bradiarritmias oscila entre el 16 y el 25% según la bibliografía. En la mayor parte de los casos se trata de disfunciones sinusales, aunque en un porcentaje importante ceden en el plazo de 6 a 12 meses desde el trasplante. Es por ello que se debe evitar la precipitación en la colocación del marcapasos, sugiriéndose la administración de teofilina para mejorar la disfunción sinusal.
Los últimos avances tecnológicos ya han dotado a estos pacientes de la posibilidad de un marcapasos fisiológico DDDR dotado de biodetector de aceleración endocárdica, con el que se ha sugerido que el rechazo miocárdico se puede detectar más precozmente.
Las indicaciones de la implantación de marcapasos en el contexto del trasplante cardíaco se distribuyen del siguiente modo:
Grupo I: bradiarritmias sintomáticas o incompetencia cronotrópica que no se va a resolver.
Grupo II: bradiarritmias sintomáticas o incompetencia cronotrópica que, aunque transitoria, puede persistir meses o el paciente requiere intervención quirúrgica.
Grupo III: bradiarritmias asintomáticas en el paciente trasplantado.
Técnicas de implantación
Más del 95% de las implantaciones que se realizan en la actualidad se hacen por vía endovenosa, reservándose la vía epicárdica para aquellos casos en que la vía endocárdica no es posible. En los casos de estimulación epicárdica, las vías de elección son la subxifoidea o la subcostal.
La estimulación endocárdica tiene una serie de ventajas sobre la epicárdica; de este modo la morbimortalidad, la estabilidad de los umbrales y el hecho de no precisar anestesia general en estos casos la convierten en el modo de estimulación ideal.
Para la implantación se elige el lado opuesto a la mano dominante, lo que, en el caso de la estimulación unipolar, disminuye la interferencia de miopotenciales.
Las formas de acceso para la estimulación endocárdica son la disección venosa y la punción venosa percutánea.
La disección venosa consiste en la disección de la vena cefálica a nivel del surco deltopectoral o bien de las venas yugulares externa e interna. En un 12% de los casos no es posible introducir la sonda por el calibre inadecuado de la vena, y en un 7% existen variantes anatómicas de la normalidad que se manifiestan con ausencia de esta vena.
La punción venosa percutánea es la técnica más utilizada en la actualidad. No obstante, también presenta sus inconvenientes, como la compresión o cizallamiento de los cables en el cruce entre la clavícula y la primera costilla.
Una vez canalizada la vía, se procede a la colocación del cable-electrodo. Tras situarlo en el lugar adecuado se procederá a determinar los umbrales (voltaje, miliamperaje, amplitud de la onda P o R, resistencias, etc.). Durante el acto de implantación los umbrales deben ser medidos con un analizador de similares características a las del generador a implantar, considerándose como umbrales agudos aceptables, para una duración de impulso de 0,50 ms, los siguientes valores:
Captura: ventrículo, máx. 1 V; aurícula, máx. 1,5 V.
Detección: ventrículo, mín. 2,5 mV; aurícula, mín. 1 mV.
La resistencia determinada para un estímulo de 5 V de amplitud oscilará entre 400 y 700 . En la actualidad existen cables de alta impedancia con los que se obtienen impedancias medias próximas a 1.500 . Durante la implantación es aconsejable estimular durante algunos minutos con amplitudes superiores a 5 V para comprobar si se produce o no estimulación diafragmática a través del electrodo ventricular o del frénico a través del electrodo auricular. Para fijar el cable al fondo de la bolsa deben utilizarse siempre uno o dos puntos de material no reabsorbible.
En el caso en que sea necesaria la colocación de otro electrodo en la aurícula, éste debe ser colocado por nueva punción subclavia, ya que cuando se utiliza un solo introductor, aunque lo permitan los calibres de ambos cables, se suele experimentar mayor dificultad para la maniobrabilidad, con el consiguiente desplazamiento del cable no manipulado. Para la estimulación de doble cámara los cables se colocan siempre en el mismo orden (el auricular más interno), lo que permite la identificación ulterior y, en caso de cizallamiento, hace que no exista compromiso de la captura ventricular. Con respecto al cable auricular, puede optarse por la utilización de modelos preformados en J o rectos, según la experiencia en cada modelo que tenga el implantado.
La bolsa para alojar el generador se realiza en el plano de separación del tejido celular subcutáneo y la fascia del pectoral mayor, lo que se consigue con facilidad incluso con disección roma. El tamaño de la bolsa debe ser el adecuado para el generador, suficientemente amplia para que la piel no se encuentre sometida a tensión. Para evitar la migración del generador es aconsejable fijarlo al músculo y a su fascia.
Como medidas adicionales a la hora de colocar un marcapasos, en casos de alto riesgo pacientes inmunodeprimidos debe efectuarse profilaxis con una cefalosporina de primera generación o vancomicina; en el resto de los pacientes no es necesario.
En los pacientes anticoagulados con dicumarínicos se procede a su sustitución con heparina sódica, que será suspendida al menos 4 h antes del procedimiento. En la actualidad se tiende a suspender el dicumarínico durante unos días, en los cuales el paciente es tratado con heparinas de bajo peso molecular a dosis terapéuticas. Así pues, hay que poner un gran esmero en la hemostasia. Posteriormente se mantiene vendaje compresivo y se reinicia la heparina transcurridas de 12 a 24 h.
Selección del modo de estimulación
Para unificar criterios a nivel mundial, la denominación de los modelos de estimulación se desarrolló mediante un código de letras.
La primera posición del código designa la cámara estimulada.
La segunda posición del código designa la cámara cuya actividad se detecta.
La tercera posición del código designa el modo de respuesta frente a la actividad intrínseca.
La cuarta posición del código corresponde a la programabilidad.
La quinta posición del código indica si el generador tiene actividad antitaquicardia o no.
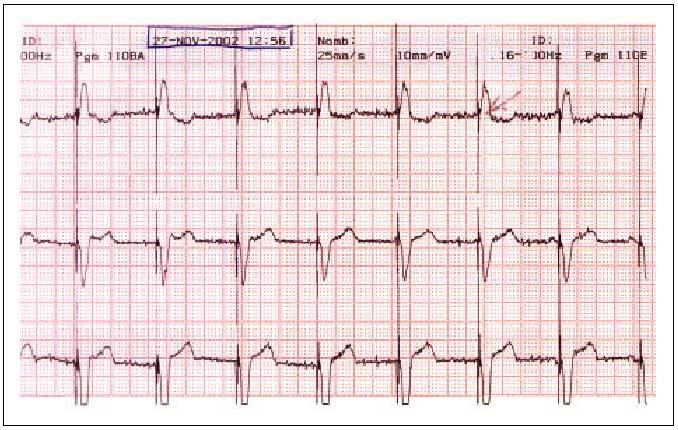
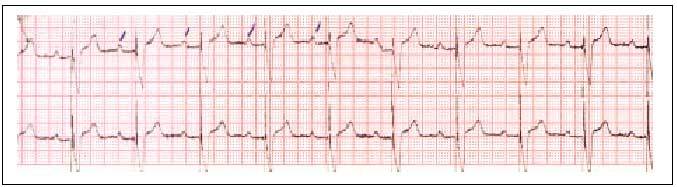
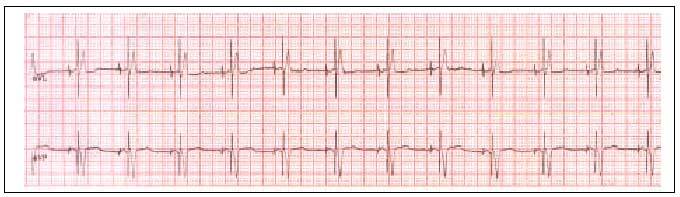
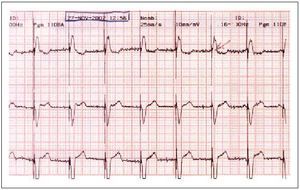
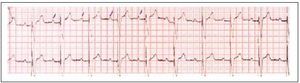
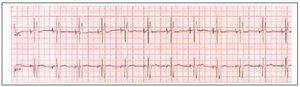
El código NASPE/BPEG, con sus distintas posibilidades, aparece en la tabla 1, y las figuras 1-3 reflejan los trazados electrocardiográficos de pacientes con marcapasos VVI (fig. 1), VDD (fig. 2) y DDD (fig. 3).
Fig. 1. Trazado electrocardiográfico de paciente portador de marcapasos modelo VVI. Se ve que la espiga sigue al complejo QRS.
Fig. 2. Trazado electrocardiográfico de paciente portador de marcapasos VVD. Se ve que la espiga aparece detrás de cada onda P.
Fig. 3. Trazado electrocardiográfico de paciente portador de marcapasos DDD. Se ve que hay dos espigas, una antes de la onda P y otra antes del QRS.
Complicaciones
Las complicaciones más frecuentes que se pueden detectar en el paciente al que se le implanta un marcapasos son las siguientes:
Hematoma de la bolsa
Se debe a una hemostasia incompleta o bien a grandes aumentos de la presión intratorácica y sangrado en el punto de penetración del cable. Su aparición es más frecuente en pacientes con problemas hematológicos y en pacientes anticoagulados. Lo normal es que el hematoma se reabsorba solo pero, si es de grandes dimensiones, en ocasiones se requiere la punción y aspiración del mismo con medidas de asepsia.
Infección del marcapasos
Es la segunda complicación más frecuente, con una incidencia que oscila entre el 3 y el 40%. La infección puede afectar a todo el sistema de estimulación, desde la piel al endocardio, produciendo infección de la piel y partes blandas, infección de la bolsa (lugar donde más frecuentemente se da el problema) e infección de la sonda con sepsis y endocarditis. Los gérmenes más frecuentemente implicados son Staphylococcus aureus, S. epidermidis, enterobacterias, Pseudomonas y hongos como Candida albicans.
El tratamiento conservador de la infección localizada de la bolsa no suele dar buenos resultados, y en la mayoría de los casos siempre es preciso extraer pila y cable y colocarlos en el otro lado. En aquellos pacientes en que la infección es más grave y cursa con fiebre, bacteriemia, afectación del estado general y sepsis, es obligatorio mantener tratamiento antibiótico parenteral prolongado, de acuerdo con los resultados del hemocultivo. Siempre es de obligada realización un ecocardiograma transtorácico y transesofágico para comprobar o descartar la existencia de verrugas o endocarditis.
Desplazamiento del catéter y/o perforación
Se manifiesta con disfunción del sistema, siendo obligatoria la recolocación del electrodo. Los desplazamientos suelen ocurrir sobre todo en los primeros días tras la implantación y su incidencia es variable, oscilando entre el 2 y el 10%. La perforación del pericardio, provocada por el manejo de la sonda electrodo con el fiador metálico insertado en toda su longitud, puede dar lugar a derrame pericárdico o taponamiento cardíaco. Se sospechará en pacientes con umbrales de captura elevados, pérdida de la captura, contracciones diafragmáticas y de los músculos intercostales sincrónicas con el impulso, entre otros signos.
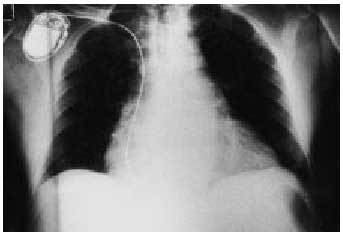
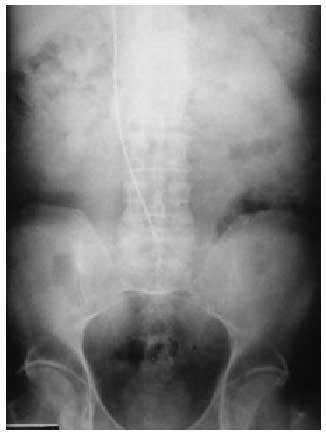
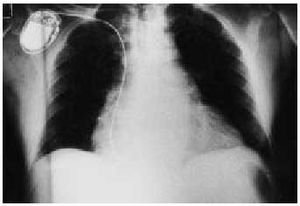
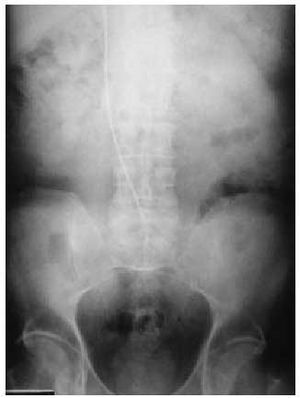
Otro tipo de complicación más infrecuente es que en el cambio del generador de un lado al otro y, sobre todo, si el extremo proximal del electrodo no está debidamente sujeto, se puede soltar y quedar unido a su extremo distal (es decir, a la punta del ápex del ventrículo izquierdo, flotando intravascularmente). En estos casos la extracción requiere cirugía cardiovascular (figs. 4 y 5).
Fig. 4. Radiografía de tórax en la que se ve que en la punta del ápex del ventrículo derecho hay dos sondas, una unida al generador y otra que dirige su otro extremo a la vena cava inferior.
Fig. 5. Radiografía en la que se ve el otro extremo del electrodo introducido en la vena cava inferior y flotando en ella.
Alteraciones del cable-electrodo
Suelen deberse a deterioros del mismo durante la implantación o como consecuencia de la degradación de sus componentes. Cuando sólo se afecta el aislante puede producirse pérdida de la captura por derivación de la corriente y alteraciones de la impedancia del electrodo. Cuando lo afectado es el conductor, su fractura produce pérdida de la captura. Si la fractura es incompleta, se observan alteraciones en el ciclado por inhibición inadecuada del generador.
Alteraciones de la detección
La infradetección es la falta de reconocimiento de la actividad eléctrica de la cámara donde se aloja el cable, y puede ser corregida por reprogramación de la sensibilidad o, en algunos casos, hay que proceder a la recolocación del mismo.
La sobredetección es el reconocimiento de señales eléctricas cardíacas inapropiadas (onda T) o extracardíacas (miopotenciales o interferencias electromagnéticas ambientales). En el primer caso, la solución se basa en la reprogramación del período refractario o de la sensibilidad. En la inhibición por miopotenciales se puede optar por reprogramar en modo VVT o por el cambio de la polaridad de uni a bipolar, si el cable y el generador así lo permiten.
Alteraciones de la captura
La pérdida de la captura puede obedecer a desplazamientos del cable o a establecimiento de fibrosis en la interfaz endocardio-electrodo (lo que se denomina bloqueo de salida).
Marcapasos VDD con electrodo único
En los pacientes con bloqueo auriculoventricular de segundo o tercer grado y que preservan la función sinusal no es necesaria la estimulación auricular, y en ellos es ideal la estimulación atriosincrónica. En la década de los ochenta comenzó a utilizarse la estimulación VDD con electrodo único, situado en el ápex del ventrículo derecho y que disponía de dos polos flotantes situados a una distancia variable de la punta, de tal forma que el sensor auricular quedaba ubicado cerca de la cara lateral alta de la aurícula derecha. El seguimiento de estos pacientes ha puesto en evidencia que, a los 5 años, más del 90% continúa en programación VDD con una sincronía auriculoventricular superior al 90%.
La estimulación VDD con electrodo único está contraindicada en la enfermedad del nódulo sinusal, en la fibrilación o flutter auricular y ante la existencia de cardiomegalia con dilatación de la aurícula derecha o en la imposibilidad de detectar potenciales endocavitarios auriculares adecuados durante la implantación.
Los automatismos
Los automatismos pretenden hacer más seguro el funcionamiento de los marcapasos y facilitar su seguimiento; entre ellos podemos destacar:
1. Autocaptura. Permite medir periódicamente el umbral de estimulación y ajustar la energía a la salida del generador a un valor siempre superior al obtenido. En caso de producirse un fallo de captura se origina una salida de alto voltaje que impide la asistolia. El objetivo de la autocaptura es asegurar siempre la captura del miocardio por el estímulo y producir el menor gasto energético posible, con lo cual aumenta la longevidad de la batería.
2. Autodetección. Es otra forma de automatismo, que tiene por objetivo ajustar la sensibilidad programada en cada cámara para evitar problemas de hiper o infradetección.
3. Cambios de polaridad del electrodo. El objetivo es analizar el funcionamiento de un cable bipolar y cambiar su polaridad, con estimulación a unipolar en caso de detectar deterioro del electrodo externo.
4. Cambio de modo ante arritmias (AMS). El objetivo es evitar que el paciente portador de un marcapasos AV secuencial y con taquicardias supraventriculares ocasionales experimente una estimulación rápida a una frecuencia máxima de sincronía AV durante el tiempo que dure la taquiarritmia auricular, con lo cual los síntomas desaparecen o se atenúan.
5. Otros. Control automático de los períodos refractarios auriculares y búsqueda del intervalo AV.
Seguimiento del paciente con marcapasos
Debe realizarse en una unidad funcional de marcapasos, dotada de los medios necesarios. El protocolo de seguimiento consiste, a grandes rasgos, en:
Valoración de la sintomatología del paciente.
Exploración de la zona de implantación del generador.
Visualización del ritmo cardíaco en el ECG de base.
Frecuencias magnéticas.
Inhibición del generador para conocer frecuencias intrínsecas cardíacas (sobre todo cuando la batería esté a punto de agotarse).
Determinación del umbral de estimulación en cada una de las cámaras.
Investigación de miopotenciales.
Investigación de conducción retrógrada.
Análisis de datos de telemetría.
Ajuste de salida y detección de la polaridad.
Criterios para el recambio de pila
Existen tres procedimientos para conocer los signos de agotamiento de la batería de un generador de impulsos:
a) Frecuencia espontánea. Los marcapasos suelen disminuir su frecuencia de estimulación alrededor de un 10% de la frecuencia nominal al inicio de su agotamiento, y entonces es el momento electivo de recambio (ERT). Pero no todos los fabricantes respetan esta norma. Posteriormente su frecuencia decae más e incluso se asocia a defectos de captación y conducción (agotamiento del generador [EOL]). El tiempo que transcurre entre el ERT y el EOL es como mínimo de 3 meses.
b) Frecuencia magnética. Al aplicar un imán sobre el generador, su frecuencia de estimulación varía entre 80 y 100 lat/min. Simultáneamente todos los marcapasos, excepto los modelos de programación específica, pierden la función de detección y estimulan de forma asincrónica.
c) Telemetría. La telemetría permite conocer dos parámetros fundamentales en el estado de la batería: el voltaje y la impedancia de la pila. El voltaje de la pila decae progresivamente desde su puesta en funcionamiento (de 2,7 V cuando se implanta a menos de 2,5 V en su agotamiento). La impedancia de la batería asciende progresivamente desde su inicio (0,1 k) hasta su agotamiento (> 4 k).
Posibles fuentes de interferencia con los marcapasos
Las posibles interferencias electromecánicas exógenas en el buen funcionamiento de los marcapasos pueden ser galvánicas, magnéticas o electromagnéticas. Estas interferencias afectan al funcionamiento del marcapasos según la intensidad del campo, la distancia a la fuente, la frecuencia y la forma de onda de la señal, la orientación física del marcapasos, el tipo de sistema implantado, el tipo de biodetector, la programación de la sensibilidad y el modo de demanda.
Electrocauterio o bisturí eléctrico. Los posibles efectos que producen son inhibición de uno o varios latidos, inhibición total del marcapasos o fallo permanente del mismo. Cuando se vaya a utilizar este instrumento, previamente (en el preoperatorio) hay que determinar si el paciente es dependiente del marcapasos o no. Si se utiliza cauterio monopolar hay que ubicar el electrodo de masa con suficiente pasta conductora en la extremidad inferior o lo más alejado posible del marcapasos. Procurar no utilizar electrobisturí a una distancia menor de 15 cm de la zona del marcapasos. Utilizar el electrobisturí de forma intermitente y con la menor energía posible.
Cardioversión eléctrica y desfibrilación. El uso de estos procedimientos puede provocar reprogramación a parámetros nominales, aumento de los umbrales de estimulación, fallo permanente de la función del marcapasos e infradetección temporal. En estos casos es preferible usar las palas en posición anteroposterior. Si no es posible, utilizar palas precordiales con posición perpendicular a la línea entre el marcapasos y la punta del electrodo ventricular. Utilizar las palas a una distancia mínima de 10 cm del generador y no ponerlas nunca sobre el marcapasos; utilizar la mínima energía posible; tener a disposición el programador adecuado; estudiar el marcapasos tras la técnica (estado de batería, umbrales, etc.).
Ablación eléctrica. Puede producir aumento transitorio de los umbrales de estimulación y de sensibilidad, con inhibición o infradetección y ciclos irregulares. Ante esta situación se analizará el generador antes y después de la ablación con programador adecuado. Durante la emisión de corriente de radiofrecuencia es preciso colocar el imán sobre el generador para tener un modo asíncrono fijo.
Radiación terapéutica. Puede desprogramar y provocar alteraciones de la detección y de la estimulación. Ante esta situación se evitará la irradiación terapéutica sobre el generador y, si no fuera posible, se cambiará el generador de lado. Durante cada sesión se protegerá de las radiaciones, y el generador se analizará después de cada sesión.
Resonancia magnética. Produce alteraciones por sus campos magnéticos y de radiofrecuencia. No debe someterse a esta técnica a ningún paciente con marcapasos.
Litotricia. Los marcapasos unicamerales pueden ser inhibidos temporalmente, y los bicamerales pueden ser inhibidos o producir arritmias. Ante esta técnica se programará el marcapasos en modo VOO, y el punto focal del litotroptor se colocará al menos a 15 cm del marcapasos.
Electroshock. No suele dañar los marcapasos. No obstante, se pueden crear miopotenciales capaces de inhibir el marcapasos con detección monopolar. Es necesario monitorizar el ECG y posteriormente revisar el generador.
Tratamientos dentales. Pueden interferir el funcionamiento del marcapasos con el uso del fresado y los ultrasonidos; aunque pueden producir inhibición transitoria, no dañan el marcapasos. Ante esta situación el fresado o los ultrasonidos se utilizarán de forma intermitente, no se apoyarán los instrumentos sobre el generador y los marcapasos que tengan modulación de la frecuencia se desprogramarán.
Electrodomésticos. Sólo interfieren si se colocan directamente sobre el marcapasos. Los microondas actuales no interfieren el funcionamiento del marcapasos. Para evitar problemas, los enchufes de los electrodomésticos deben tener toma de tierra y no se pondrán en funcionamiento encima del marcapasos.
Teléfonos. Los teléfonos conectados a la red e inalámbricos no producen interferencias. Los móviles (salvo algunas marcas comerciales) sí pueden producirlas, y ello depende de la proximidad a la emisora o a la antena repetidora, de la proximidad del teléfono móvil y de su antena generadora de impulsos. Para evitar problemas debe llevarse el móvil en el lado opuesto a la zona del marcapasos, el teléfono no se apoyará sobre el marcapasos y se mantendrá una distancia mínima al generador de 30 cm.
Bibliografía general
Aurichio A, Klein H, Tockman B, Dourht J. Transvenous biventricular pacing for heart failure. Can the obstacles be overcome? Am J Cardiol 1999:83:136-42.
Kappenberger L, Linde C, Daubert C, Stein C. Pacing in hypertrophic obstructive cardiomyopathy: a randomized crossover study. PIC Study Group. Eur Heart J 1997;18:1243-56.
Linde C, Gadler F, Edner M, Nordlander R, Rosenquist M, Ryden L. Results of atrioventricular synchronous pacing with optimized delay in patients with severe congestive heart failure. Am J Cardiol 1995;75:919-23.
Payne ME, Murray KD, Watson KW, Galbraith TA, Horwanitz EP, Starling RC, et al. Permanent pacing in heart transplant recipients: underlying causes and long-term results. J Heart Lung Transplant 1991;10:734-42.