Siguiendo como directrices los criterios expuestos por la SNOAPAD y recogido en el trabajo publicado por Kassai et al1 podemos encuadrar a Toxocara canis (Werner, 1782) Stiles 1905, parásito objeto de estudio en esta revisión en: Subreino (Metazoa), Phylum (Nemathelminthes), clase (Nematoda), subclase (Secernentea), orden (Ascaridida), superfamilia (Ascaridoidea), familia (Ascarididae), subfamilia (Toxocarinae) y, por último, género (Toxocara).
Además existen otras especies de Toxocara, como Toxocara cati (Schrank, 1788) Brumpt 1927, Toxocara vitulorum (Goeze, 1782) Travassos 1927 y Toxocara pteropodis Baylis 1936.
Morfología y ciclo biológico
Los vermes adultos tienen forma cilíndrica y son alargados y de color marfil. En su morfología externa cabe destacar que presentan estrías transversales irregulares, con alas cervicales prominentes más largas que anchas. Además presentan labios que circundan un orificio oral que se continúa con el esófago. Estos labios presentan un bulbo con dos lóbulos laterales separados por un canalículo2.
Los adultos presentan dimorfismo sexual, así los machos miden entre 4 y 10 cm de longitud por 2,5 mm de diámetro, mientras que las hembras son más grandes, con 5-18 cm de longitud por 2,5-3 mm de diámetro. El extremo caudal de los machos muestra un apéndice alargado digitiforme, sin alas caudales, con dos series de 20-30 papilas preanales pequeñas y cinco papilas postanales a cada lado de la cola, no existiendo gubernáculo. Los órganos genitales en la hembra se extienden a ambos lados de la región vulvar, que se sitúa en posición anterior. Tiene interés señalar en este momento que las hembras pueden llegar a poner 200.000 huevos/día3.
Los huevos miden de 85-90 µm por 75 µm, son subglobulares y presentan una cubierta gruesa con pequeñas depresiones, lo que les permite mantenerse viables en el medio externo durante largos períodos de tiempo, aun en condiciones ambientales poco favorables. En el momento de la puesta tienen color amarillo debido a los pigmentos biliares del tubo digestivo del hospedador, coloración que no se observa cuando se obtienen por histerectomía a partir de una hembra grávida.
Existen cuatro fases larvarias (LI a LIV), siendo la LII, que se encuentra dentro de los huevos embrionados, la fase infectante. Con respecto al tamaño de las diferentes fases larvarias, se considera que la LI puede llegar a medir hasta 0,5 µm, la LII hasta 500 µm, la LIII hasta 1,5 mm y la LIV hasta 20 mm. La cutícula, anillo nervioso y núcleos ganglionares, sistemas excretores y digestivo se originan durante LI, produciéndose pocas modificaciones en la fase LII. La diferenciación del aparato digestivo y del aparato genital (aparición de los labios y del esbozo genital) se origina durante la tercera fase larvaria. Finalmente, en la LIV se diferencian tanto los labios como el sexo, culminando en la fase adulta con la total maduración sexual, el crecimiento íntegro y la aparición de la expansión de alas cervicales.
Características generales del ciclo biológico de Toxocara canis
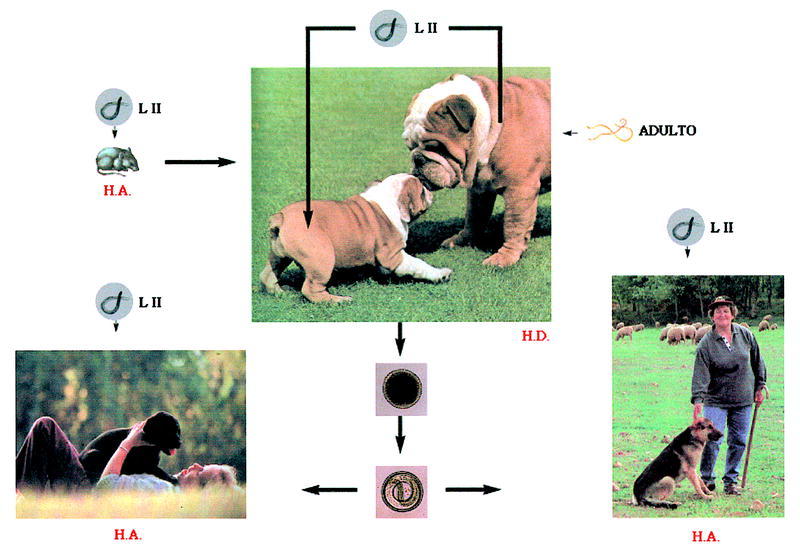
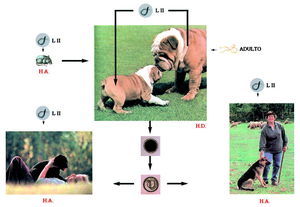
El ciclo biológico de Toxocara canis se representa en la figura 1. Los huevos sin embrionar son expulsados con las heces de los perros (hospedador definitivo) al medio ambiente, donde embrionan, alcanzando el estado de LII entre 9 y 15 días, dependiendo de las condiciones ambientales. Para un eficaz proceso de formación del embrión son requisitos indispensables la presencia de O2 como la elevada humedad relativa (85%-95%).
Fig. 1. Ciclo biológico de la Toxocara canis.
Para que el ciclo biológico pueda desarrollarse el hospedador definitivo debe ingerir los huevos embrionados que eclosionan en el intestino, liberando las larvas infectantes que atraviesan diferentes órganos hasta asentarse definitivamente en el intestino delgado. En este órgano van madurando, llegando al estado adulto, siendo la fecha límite el trigésimo día después de la ingestión de los huevos.
En los perros adultos algunas larvas LII quedan acantonadas en los tejidos, lo que justifica que en las perras gestantes estas larvas se movilicen y atraviesen la placenta, llegando al hígado fetal. Por esta razón los cachorros tres semanas después de su nacimiento pueden albergar ya vermes sexualmente maduros en el intestino delgado, capaces de liberar huevos al medio externo.
Otra vía de entrada de las larvas infectantes al hospedador definitivo es la ingestión de hospedadores paraténicos infectados, fundamentalmente roedores. En este caso el ciclo del parásito se completa mucho antes, ya que estas larvas no emigran por los tejidos del animal. La muda hasta adulto empieza más pronto y la eliminación de huevos tiene lugar después de un corto período de prepatencia.
Los huevos embrionados con LII infectantes del medio pueden, además, ser ingeridos por hospedadores paraténicos. Estos huevos pierden la cubierta y las larvas quedan libres para desplazarse por distintos órganos, pero no llegan a madurar. El hombre, que se encuentra entre este tipo de hospedadores, mantiene un contacto lúdico o profesional con los hospedadores definitivos. La ingestión, accidental, de estos huevos ocasiona en él el síndrome de larva visceral emigrante.
Estudios recientes sugieren que una hembra adulta de Toxocara canis puede poner al día entre 25.000 y 85.000 huevos. Teniendo en cuenta que un perro infectado puede tener entre 50-100 vermes adultos, el número de huevos que un perro puede eliminar al día es entre 1 y 2 millones. Esto implica que la posibilidad de que un hospedador definitivo o paraténico entre en contacto con el parásito es muy alta3.
Ciclo biológico de Toxocara canis en el hospedador definitivo
Una vez que los huevos embrionados son ingeridos, eclosionan en el intestino delgado y liberan la larva que penetra en la mucosa intestinal. La posterior migración depende de la edad, sexo e historia previa de la infección.
Así, en los cachorros de menos de tres meses, la mayoría de los huevos infectantes eclosionan en el duodeno entre las 2-4 horas después de la ingestión. La larva infectante (LII) atraviesa la pared del intestino, alcanzando los vasos y los ganglios linfáticos desde los que continúa, vía capilares venosos, al sistema portal hepático. Otras larvas van directamente a los capilares mesentéricos y desde éstos al hígado. A las 24 horas ya se observan larvas en el hígado que crecen ligeramente, alcanzando un tamaño de 410-490 µm de longitud. Del hígado pasan al corazón por la vena suprahepática y la vena cava, y desde éste por la arteria pulmonar llegan a los pulmones. La población pulmonar de larvas es máxima a los 3-5 días postinfección. Crecen en los pulmones y la mayor parte de ellas perforan la pared bronquial, alcanzan el espacio aéreo y desde él se desplazan hasta la tráquea y la faringe, donde son deglutidos.
La muda de LII a LIII parece que tiene lugar en los pulmones, tráquea o esófago. Hacia el décimo día llegan al estómago, donde permanecen varios días efectuando la muda a L-IV.
Las larvas de cuarto estadio aparecen en el duodeno a partir de los trece días postinfección, mudando al estado preadulto y madurando entre los días decimonoveno y vigésimo séptimo. Los huevos aparecen en las heces a las 4-5 semanas postinfección.
Un número reducido de larvas en estos cachorros no alcanzan la tráquea, sino que a través de la vena pulmonar van otra vez al corazón y por la circulación sistémica se distribuyen por todo el organismo, localizándose en diferentes tejidos. Sin embargo, en los perros de más de seis meses un número relativamente pequeño de larvas pasa de los pulmones a la tráquea, ya que la mayoría de ellas a través de la vena pulmonar llegan al corazón, distribuyéndose a continuación por los tejidos.
Por otro lado hay que destacar que se recuperan más larvas de los tejidos somáticos de las hembras que de los machos. Además, cuando los huevos infectantes se administran a hembras preñadas, algunas son resistentes a la infección, confinando las larvas en su intestino, mientras que en otras hembras las larvas migran a los tejidos somáticos sin evidencia de infección intestinal; estas larvas permanecen en el segundo estadio. Algunas migran, a través de la placenta, hasta el hígado fetal, donde mudan a LIII en el momento del nacimiento. La infección de la madre tiene que ser poco tiempo antes o inmediatamente después del apareamiento para que se establezca la infección prenatal; también la infección prenatal puede originarse de infecciones anteriores de la madre. Las larvas en los tejidos somáticos siguen sin evolucionar, aunque permanecen viables durante meses e incluso años. Los cachorros se infectan habitualmente antes del nacimiento a través de la placenta, tras la reactivación de infecciones somáticas latentes de la madre. El 98,5% de la infección de los cachorros es prenatal y el 1,5% sucede durante la lactancia.
Ciclo biológico de Toxocara canis en el ser humano
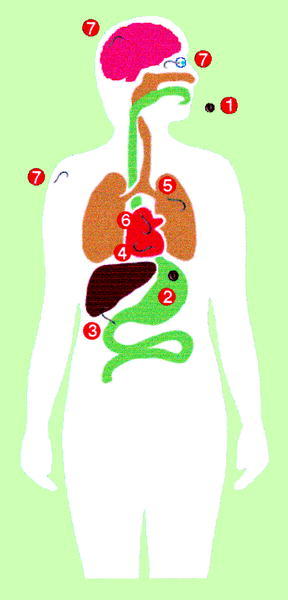
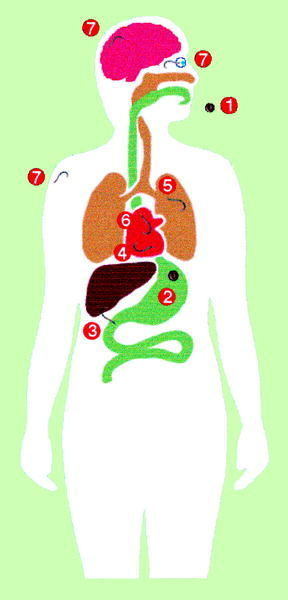
El contacto entre T. canis y el hombre (fig. 2) se inicia también por la ingestión de huevos que contienen la larva LII infectante. La eclosión se puede realizar tanto en el estómago como en el intestino delgado ya que los estímulos requeridos son muy diversos, lo que puede, en parte, explicar el amplio rango de hospedadores paraténicos. El lugar fundamental de penetración es el intestino delgado, particularmente el íleon, siendo los huevos que alcanzan el colon eliminados en su mayor parte. El lugar exacto de penetración es en las criptas de Liewerkühn, posiblemente por ser las zonas con menor movilidad durante la ingestión. En estas zonas se produce la degranulación de las células de Paneth en el momento de la penetración larvaria. Desde el intestino se diseminan al hígado principalmente por vía portal, aunque existen algunas evidencias de otras vías como la diseminación intraperitoneal hasta alcanzar la superficie hepática o el paso directo por vía linfática hasta el pulmón. Desde el pulmón se diseminan a través de la circulación sistémica por todas las partes del organismo. En modelos experimentales aproximadamente al séptimo día postinfección la mayor parte de las larvas se recuperan en el sistema nervioso central y en la mus culatura estriada, finalizando la fase visceral e iniciándose la fase miotrópica/neurotrópica. En el sistema nervioso central no se produce la encapsulación de larvas mientras que en el músculo sí que aparece este fenómeno. A medida que transcurre el tiempo disminuye el número de larvas recuperables, aunque algunas larvas pueden permanecer viables durante períodos prolongados de tiempo, siendo éstas las responsables de la toxocariosis ocular.
Fig. 2. Ciclo biológico de Toxocara canis en humanos.
Epidemiología
La toxocariosis canina aparece preferentemente en zonas cálidas y templadas del globo, lo que condiciona, lógicamente, el perfil epidemiológico de la toxocariosis humana. Teniendo en cuenta que los humanos se comportan como hospedadores paraténicos y no excretan huevos, los datos que permiten inferir la distribución de la toxocariosis humana únicamente son de tipo serológico.
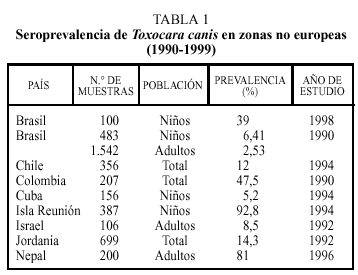
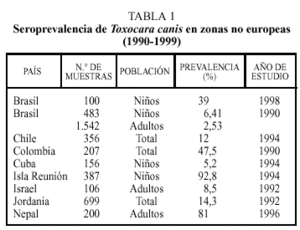
En estudios realizados en regiones no europeas la prevalencia de anticuerpos en humanos frente a Toxocara canis es variable (tabla 1)4, depende de diferentes factores como el país o zona de estudio, el tipo y número de población estudiada e incluso el año en que se realizó el trabajo. Así, por ejemplo, las cifras más elevadas en la población global o en adultos se han descrito en Colombia o Nepal. Como es lógico, debido a las características del ciclo biológico del parásito, se encuentra una mayor tasa de seropositividad en niños, alcanzando valores muy elevados en Isla Reunión y cifras notables en Brasil. También el grado de desarrollo socieoeconómico se relaciona de forma inversa con la presencia de población expuesta a este parásito.
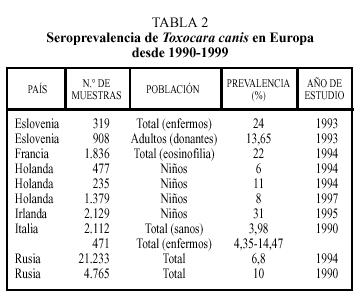
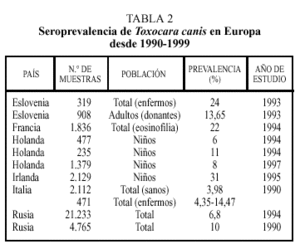
Los datos correspondientes a países europeos (excepto España) se expresan en la tabla 24. La tasa de seropositividad es variable entre los diferentes países, siendo, en general, más elevada en los países del Este, oscilando entre el 6,8% de Rusia y el 24% encontrado en Eslovenia. La frecuencia varía atendiendo a otros factores. Así, en individuos en los que existía alguna evidencia de enfermedad (por ejemplo, eosinofilia) aparecen tantos por ciento más elevados de positividad. También en este grupo de trabajos se constata la mayor tasa de seropositividad en el colectivo infantil.
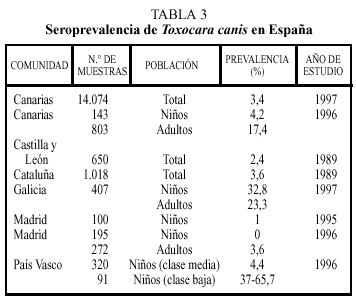
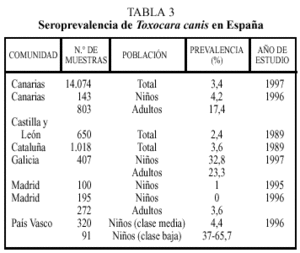
Los estudios seroepidemiológicos realizados en España incluyen las comunidades indicadas en la tabla 34. Nuevamente, en estos estudios se encuentran diferencias sustanciales entre regiones. Así, las altas tasas de seropositividad en Galicia o Canarias pueden reflejar una climatología benévola para la viabilidad de los huevos, mientras que la baja frecuencia encontrada en Madrid puede ser debida a un menor contacto con la fuente de infección dado el tipo de vida que se realiza en las grandes ciudades.
Con respecto a la distribución epidemiológica del contacto entre humanos y Toxocara canis, un factor de gran importancia es la contaminación de suelos con huevos y su viabilidad2. En este sentido, los resultados varían de unos estudios a otros, dependiendo de diversos factores, entre los que se encuentra la zona sometida a muestreo o el tipo de análisis. Así, en los estudios realizados en nuestro país son positivas un 8,7% de las muestras de suelo obtenidas en parques de Madrid, un 37% de las muestras de parques de la isla de Tenerife y un 7,3% de las muestras de suelo obtenidas en Salamanca (capital y pueblos de la provincia)5.
La actividad económica es otro factor determinante que explicaría las diferentes prevalencias en adultos entre Galicia y Cataluña. En este sentido, la importancia del estatus económico es un factor puesto de manifiesto en el trabajo realizado en el País Vasco.
Patogenia y fisiopatología
El conocimiento de la patogenia y fisiopatología de la toxocariosis deriva de tres tipos de estudios complementarios: a) modelos experimentales de enfermedad; b) estudios de biología molecular, así como técnicas de estudio de proteínas, y c) estudios incruentos realizados en pacientes con toxocariosis. En este apartado nos centraremos en los dos primeros estudios.
Los modelos experimentales empleados en toxocariosis son muy variados y han aportado diferentes datos acerca de la patogenia de la enfermedad. En este sentido, el modelo murino ha sido útil en la evaluación de las lesiones hepáticas, pulmonares y cardíacas de la enfermedad3, 6. En este modelo se ha observado la presencia de lesiones hepáticas características constituidas por granulomas con un componente eosinofílico que en algunos casos rodeaban a las larvas (fenómeno denominado liver trapping). En este fenómeno los estudios inmunológicos han permitido concluir que se trataba de un proceso específico y que en su génesis intervenían linfocitos T (principalmente linfocitos CD4), siendo poco importante la participación de los sistemas efectores humorales. Las lesiones pulmonares características también incluyen una respuesta eosinofílica, así como un aumento del número de macrófagos. Finalmente se ha puesto de manifiesto que ratones CBA/J infectados con T. canis desarrollaban una miocarditis eosinofílica seguida de una fibrosis del músculo cardíaco6, fenómeno descrito, aunque de forma excepcional, en la toxocariosis humana (ver más adelante). Otro modelo de interés es el desarrollado en gerbillos, ya que reproduce de forma más adecuada las formas oculares (principalmente las de tipo exudativo) de la enfermedad. También se ha descrito recientemente un modelo de toxocariosis en cerdos, que ha aportado nuevos datos a la patocronia de la enfermedad7. Así, se ha observado a los 7 días de la infección experimental la presencia de larvas en los ganglios linfáticos mesentéricos, hígado y pulmón. Aproximadamente desde el día decimocuarto y hasta el vigésimo octavo la mayoría de las larvas estaban en los pulmones. También se recogieron larvas del cerebro entre los 14 y 21 días, no aislándose ninguna de los ojos.
Las técnicas de biología molecular y de estudio proteico han permitido identificar varias moléculas importantes tanto en la superficie larvaria como en productos de secreción/excreción. Los cuatro tipos principales de moléculas identificadas corresponden a glucoproteínas, cisteín-proteasas, prohibitinas, proteínas involucradas en la inhibición de la proliferación celular y acuaporinas, proteínas de membrana que transportan selectivamente agua a través de las membranas celulares. De todas ellas, las mejor estudiadas son varias glucoproteínas que poseen un peso molecular de 32, 55, 70,120 y 400 kDa8, 9. Algunas de estas proteínas (32 y 120 kDa) son componentes de la superficie larvaria y además aparecen como antígenos de excreción/secreción, mientras que otras (55, 70 y 400 kDa) exclusivamente son productos de excreción/secreción. En los últimos años se ha incrementado el conocimiento de varios aspectos de estos antígenos en diferentes sentidos. Así, se ha comprobado su naturaleza glucoproteica, al identificar la presencia de residuos glucídicos de N-acetilgalactosamina y N-acetilglucosamina y al observar que reaccionan frente a anticuerpos monoclonales que reconocen este tipo de moléculas. Por otro lado se han clonado los cADN de algunas de estas proteínas: el antígeno de 32 kDa y una proteína de 26 kDa.
Aunque resulta obvio, es preciso señalar que la ingestión, eclosión y penetración intestinal de las larvas de T. canis en el hombre no se asocia a manifestaciones clínicas de interés, aunque en estudios experimentales (ver ciclo biológico) aparece degranulación de las células de Paneth en la base de las criptas de Lieberkühn.
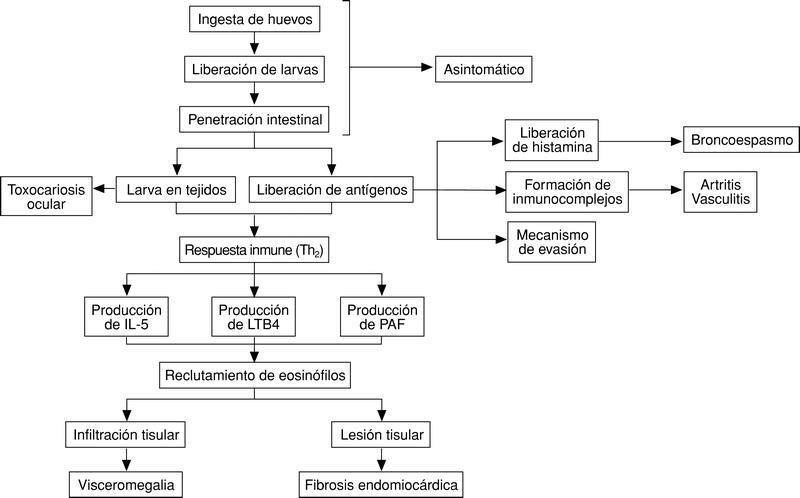
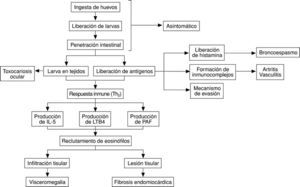
Los mecanismos patogénicos de la toxocariosis son de tres tipos, esquematizados en la figura 3: a) presencia de la larva en diferentes tejidos; b) liberación de antígenos al medio extracelular, y c) respuesta inmunológica al helminto.
Fig. 3. Mecanismos patogénicos de la toxocariosis.
Una vez las larvas superan la pared intestinal se producen tres fenómenos de forma prácticamente simultánea:
1) Las larvas se dirigen a los diferentes tejidos (hígado, pulmón, músculo, sistema nervioso, ojo) en donde pueden ejercer efectos patógenos o no. Debemos señalar en este momento que, aunque en algunos casos puede demostrarse tejido larvario en el interior de los granulomas, exceptuando en el ojo, este fenómeno es excepcional. Así pues, la presencia de larvas y la reacción inflamatoria a las mismas es el mecanismo fundamental de algunas formas de la toxocariosis ocular, siendo poco importante en otras manifestaciones clínicas.
2) Como parte de la estrategia de evasión parasitaria se produce la liberación de los antígenos mencionados previamente al medio extracelular. Estos antígenos liberados pueden ejercer efectos nocivos por sí mismos (por ejemplo, son capaces de inducir la liberación de histamina directamente de mastocitos10 o estimular la formación de anticuerpos y por tanto la formación de inmunocomplejos, desencadenando manifestaciones típicas de este mecanismo, artralgias, lesiones cutáneas, vasculitis, etc.). Además la liberación de estos antígenos desempeña un papel importante en la evasión parasitaria. Así, por ejemplo, se ha comprobado que la eliminación de estos antígenos lleva a la pérdida de la superficie parasitaria de moléculas defensivas del hospedador, por lo que de esta forma se evitan sus efectos deletéreos11. Por otro lado existen epítopos compartidos con las glucoproteínas A y B de los grupos sanguíneos.
3) Tanto los antígenos presentes en la superficie de vermes como los liberados al medio externo son capaces de inducir una respuesta inmunológica. Aunque algunos autores han sugerido que en esta respuesta intervienen tanto linfocitos Th1 (principalmente por la formación de granulomas) como Th2, es este último tipo de respuesta la que predomina en la toxocariosis. Un fenómeno esencial de esta respuesta es la presencia de eosinófilos (asociados o no a macrófagos) en los tejidos por los que han circulado o se han depositado las larvas. Los mecanismos de acumulación de eosinófilos en la toxocariosis están mediados principalmente por interleucina 5, aunque otras sustancias quimiotácticas como leucotrieno B4 o PAF también contribuyen a este proceso12. El papel esencial de la IL-5 en este fenómeno se ejemplifica en modelos de toxocariosis desarrollados en ratones genéticamente deficientes en IL-5, ya que éstos desarrollaban menor lesión pulmonar y una eosinofilia menor que cepas sin este defecto. La fuente de IL-5 en la toxocariosis son tanto los linfocitos CD4(+) como los linfocitos CD4() CD8(), siendo esencial en este proceso la interacción VCAM-1/VLA-4 5. Aunque es comúnmente aceptado que los eosinófilos desempeñan un papel central en la infección por Toxocara canis, ya ha sido indicado previamente la estrategia de estos parásitos para eliminar antígenos de membrana, lo que dificultaría la citotoxicidad de estas células11. Sin embargo, todos los autores están de acuerdo en que la infiltración por eosinófilos desempeña un papel clave en las lesiones infiltrativas de la toxocariosis (hepatomegalia, infiltrados pulmonares) e incluso en lesiones tóxicas (por ejemplo, cardíacas).
Manifestaciones clínicas
La infección por T. canis en humanos en muchas ocasiones cursa de forma asintomática, lo que se manifiesta por una serología positiva en ausencia de manifestaciones clínicas. En un segundo grupo de individuos aparece un cuadro poco definido, denominado por algunos autores «toxocariosis encubierta», en el que se incluyen diferentes manifestaciones clínicas asociadas a serología positiva. Finalmente existen dos síndromes bien definidos, mutuamente excluyentes, producidos por Toxocara canis, denominados síndrome de larva visceral emigrante y síndrome de larva emigrante ocular.
Síndrome de larva visceral emigrante
Se caracteriza en su expresión completa por la presencia de episodios febriles, tos, sibilancias, bronconeumonía, anemia, hepatomegalia, eosinofilia y una serología positiva. Aunque el agente etiológico más importante de este síndrome es Toxocara canis, otros helmintos como Toxocara cati, Baylisascaris procyonis y Gnathostoma spinigerum3 pueden producirlo. Habitualmente este síndrome aparece en niños pequeños (6 meses a 5 años de edad) que han tenido una historia de geofagia o estrecha relación con cachorros y que por tanto han sido expuestos a una cantidad notable de parásitos. Desde el punto de vista clínico, el hígado y el pulmón son los órganos afectados más frecuentemente, apareciendo hepatomegalia, que en ocasiones es muy notable y simula una masa tumoral, siendo poco frecuente la presencia de adenopatías o esplenomegalia. Las manifestaciones pulmonares características son la disnea y la tos seca en la anamnesis, apareciendo sibilancias en la exploración física. En los estudios analíticos convencionales aparece característicamente eosinofilia importante y ocasionalmente anemia. Radiológicamente es común encontrar infiltrados pulmonares difusos. Recientemente se ha publicado una serie en la que se indicaban los datos obtenidos en la ecografía abdominal de niños con toxocariosis, observándose que un 72% de los pacientes presentaban hepatomegalia (con lesiones focales hepáticas) y en un 50% se detectaba esplenomegalia, siendo muy frecuente la observación de adenopatías.
De forma menos frecuente se ha descrito la asociación con el síndrome de larva visceral emigrante de manifestaciones reumatológicas (artralgias, prurito generalizado, lesiones cutáneas migratorias, celulitis eosinofílica o síndrome de Wells13 y púrpura de Schonlein-Henoch14) y neurológicas (meningitis eosinofílica, encefalitis, masas cerebrales, aracnoiditis y mielopatías). Finalmente debe señalarse la descripción de un caso de fibrosis endomiocárdica que simulaba un tumor ventricular en cavidades cardíacas derechas.
Síndrome de larva emigrante ocular
Aparece característicamente en niños mayores (sobre todo varones), sin historia evidente de contacto con cachorros ni geofagia, asumiéndose que esta forma clínica se debe a la ingestión de una baja carga parasitaria. El cuadro clínico se limita al ojo, no presentando afectación hepática, pulmonar, reumatológica, neurológica ni cardíaca. Las manifestaciones más frecuentes son unilaterales y consisten en la pérdida de la agudeza visual, el dolor ocular, la presencia de una pupila blanca y el estrabismo de semanas de duración. No suele haber datos clínicos sugerentes de afectación sistémica ni de lesión de otros órganos o sistemas. En concreto es excepcional la presencia de eosinofilia, anemia o leucocitosis. Los tres patrones más característicos en el fondo de ojo son la presencia de un granuloma en el polo posterior de la retina (a menudo confundida con un retinoblastoma), los granulomas periféricos aislados y endoftalmitis crónica.
La persistente eosinofilia, leucocitosis y los elevados valores de isohemaglutininas que se dan en el síndrome de larva visceral emigrante no se producen en la toxocariosis ocular. Por último, el diagnóstico diferencial con el retinoblastoma es de crucial importancia15, teniendo en cuenta en casos de diagnóstico difícil la proporción de LDH y fosfoglucoisomerasa en humor acuoso y plasma.
Toxocariosis encubierta
Otra presentación clínica de la infección producida por T. canis es la denominada «toxocariosis encubierta» caracterizada por síntomas generalmente inespecíficos, formándose asociaciones con hepatomegalia, tos, alteraciones del sueño, dolor abdominal, cefaleas y trastornos de la conducta. La eosinofilia se presenta de forma variable, así la ausencia de eosinofilia no excluye la toxocariosis. Otras manifestaciones incluyen anorexia, adenitis cervical, dolores de extremidades, disnea y fiebre. Se han descrito casos de toxocariosis encubierta en los que las manifestaciones clínicas originan síndromes de enfermedades reumáticas, asociados a demencia, encefalitis, epilepsia, meningitis, etc. Para aclarar si existe una entidad como tal de toxocariosis neurológica se realizó un estudio de casos/control16, concluyendo que la migración de larvas de T. canis al sistema nervioso central no induce un síndrome neurológico característico, correlacionándose con la asociación de varios factores de riesgo que incluye la exposición frecuente a perros y la infección repetida con dosis bajas.
La asociación de la infección por T. canis con el asma es conocida desde hace años, demostrándose que un gran porcentaje de niños con asma (29%) tenían anticuerpos IgE específicos contra este parásito17.
Diagnóstico
Mientras que en el hospedador definitivo (cánidos) el diagnóstico de la infección producida por T. canis se realiza por métodos directos (coprología), no es posible utilizar estos métodos para el diagnóstico de la toxocariosis en hospedadores paraténicos, ya que no eliminan parásitos en sus heces y también es difícil encontrarlos migrando a través de los tejidos del hospedador. Por ello, y a pesar de que se han descrito métodos histopatológicos útiles, las técnicas que se utilizan para el diagnóstico de la toxocariosis humana son habitualmente técnicas serológicas basadas en la detección de anticuerpos o en la detección de antígenos circulantes. En este sentido, Savigny18 puso a punto una técnica para mantener larvas de segundo estadio in vitro con el fin de obtener antígenos excretores/secretores procedentes de su metabolismo larvario. Este antígeno es utilizado para el serodiagnóstico por ELISA en la detección de anticuerpos anti-IgG específicos con resultados de hasta un 95% de sensibilidad y 78% de especificidad. No obstante, existen algunos problemas con esta técnica. En primer lugar, la reactividad cruzada que presenta, tanto con otros nematodos cercanos como, por ejemplo, Ascaris y/o Anisakis, como con otras infecciones donde se produce migración larvaria. En segundo lugar, los antígenos excretores/secretores de las larvas presentan sustancias similares a los grupos sanguíneos A y B humanos. De tal manera que cuando existen sueros humanos con isohemaglutininas anti-A o anti-B es difícil la interpretación de los resultados. A la vista de estos problemas se desarrolló un ELISA para detectar anticuerpos anti-IgE específicos19 que aunque evitaba el problema de las interferencias con las hemaglutininas anteriormente comentado, no poseía la sensibilidad del test anterior y por tanto era insuficiente por sí solo para el serodiagnóstico de esta enfermedad. También se han utilizado ELISA de captura que detectan epítopos carbohidratados sobre los antígenos excretores/secretores de T. canis. Estos ensayos tampoco pueden emplearse por sí solos en el diagnóstico de la toxocariosis ya que presentan el 25% de falsos positivos con sueros diagnosticados de esquistosomosis y filariosis.
Se ha empleado la técnica de dot-ELISA con resultados similares a los obtenidos con ELISA.
También se ha utilizado la técnica de Western-Blot con gran sensibilidad, aunque con algunos problemas respecto a la reactividad cruzada. En algún trabajo se ha demostrado la existencia de al menos una banda entre T. canis y A. suum que desaparecía cuando los sueros eran absorbidos previamente con antígeno de A. suum.
Respecto al empleo de técnicas de biología molecular (reacción en cadena de la polimerasa [PCR]) para el diagnóstico de la toxocariosis en un estudio experimental con modelo murino se comprobó que esta técnica detectaba específicamente T. canis en biopsias hepáticas, no apareciendo bandas cuando los ratones estaban infectados con A. suum.
Un aspecto a tener en cuenta en el diagnóstico de la toxocariosis es el debido al que se realiza en las formas oculares de la infección. Es bien conocida la baja sensibilidad existente en la detección de anticuerpos sistémicos en la toxocariosis ocular. Algunos autores comentan como posible causa la baja carga parasitaria y/o el período de tiempo comprendido entre la infección y la realización del diagnóstico serológico. La alternativa para el diagnóstico de la toxocariosis ocular se ha planteado con la detección de anticuerpos locales, y para ello se han utilizado muestras procedentes de humor acuoso o humor vítreo, elevándose la sensibilidad en la detección de anticuerpos anti-Toxocara. El inconveniente que presenta esta técnica es la obtención de humor acuoso o vítreo, ya que su extracción, al realizarse mediante una técnica cruenta, puede originar graves lesiones oculares.
Tratamiento y prevención
Se han utilizado diferentes benzimidazoles y algún derivado piperacínico para el tratamiento de la toxocariosis humana. De todos ellos los más utilizados han sido el tiabendazol, que se emplea a una dosis de 25 mg/kg cada 12 horas durante 2 días, albendazol a una dosis de 400 mg cada 12 horas durante 3-5 días y dietilcarbamacina a dosis de 2 mg/kg cada 8 horas durante 7-10 días. Todos estos fármacos se administran por vía oral. De los dos benzimidazoles más empleados, en la actualidad se utiliza más el albendazol, ya que el tiabendazol es más tóxico, dando lugar a efectos secundarios en el 50% de los pacientes a los que se administra. Los efectos secundarios más comunes son: acufenos, alteraciones visuales y olfatorias, neutropenia, síndrome de Stevens-Johnson, olor de la orina a espárragos y cristaluria, edema angioneurítico y linfadenopatías. Por otro lado, los pacientes en estado grave o con otras enfermedades concomitantes deben recuperarse antes de administrar dietilcarbamacina. También debe emplearse con extremada precaución en niños. Magnaval20 realizó un estudio comparativo entre la dietilcarbamacina y la de un benzimidazol (mebendazol) para valorar cuál era más eficaz frente a la infección humana producida por T. canis. Los resultados de este estudio mostraron que existía una similitud entre los dos fármacos cuando se valora la clínica y el tanto por ciento de eosinófilos. Sin embargo, el mebendazol era más eficiente sobre la cinética de anticuerpos IgE anti-Toxocara y presentaba menores reacciones adversas que la dietilcarbamacina.
Respecto al tratamiento de la toxocariosis ocular, se recomienda fotocoagulación con láser en lesiones localizadas.
Algunas medidas son de gran utilidad para prevenir la toxocariosis: desparasitar periódicamente a los perros, especialmente a los cachorros; lavarse las manos con agua caliente y jabón después de haber jugado con el perro o de haber realizado juegos o trabajos en los que se haya tenido contacto con tierras contaminadas con huevos del parásito; educar especialmente a los niños para que cumplan estos cuidados higiénicos, imprescindibles para no tener contacto con T. canis; no permitir que los niños jueguen en áreas donde los perros defecan libremente; limpiar el área donde viven los perros al menos una vez por semana; enseñar a los niños que es muy peligroso comer cosas del suelo.
Agradecimientos
Queremos expresar el agradecimiento de los autores a Francisco Iriarte por el tiempo desinteresadamente empleado en el diseño del ciclo biológico de Toxocara canis y de su paso por los distintos hospedadores.
Financiación: Junta de Castilla y León 5A51/99.