El empleo de los antiinflamatorios no esteroides (AINE) se asocia a efectos secundarios en al menos el 25% de las personas que los utilizan1,2, destacando por su frecuencia los trastornos gastrointestinales, especialmente los que afectan al tramo gastroduodenal.
La frecuencia de estos efectos secundarios es diferente. Así, los síntomas dispépticos referidos a epigastrio están presentes en al menos el 25% de los sujetos que toman AINE, mientras que la frecuencia de complicaciones se calcula próxima al 1% en un período de 6 meses continuados de tratamiento con AINE3-5. La frecuencia de úlceras gástricas o duodenales se ha evaluado de manera objetiva en ensayos clínicos controlados con placebo y se ha calculado entre el 15 y 30% de los casos en 6 meses6-8. De cualquier manera, el significado clínico de estas úlceras endoscópicas es incierto, ya que una proporción elevada de las mismas puede ser asintomática y nunca se va a complicar9.
El manejo de la gastropatía por AINE sigue siendo uno de los problemas principales a los que nos enfrentamos en la práctica clínica diaria. En un reciente estudio realizado en nuestro país10 se calcularon y estratificaron los costes de los efectos secundarios debidos a la toma de AINE y el impacto que sobre ellas tienen las estrategias de tratamiento profiláctico. Los resultados que se obtuvieron fueron los siguientes:
En costes directos, los efectos secundarios gastrointestinales asociados a AINE se asocian a un gasto que supera los 54.000 millones de pesetas anuales en una estimación restrictiva, lo que supone que el precio real de los AINE sea un 86% superior al precio original.
El tratamiento gastroprotector fue incorrecto en aproximadamente un 80% de los casos, lo que supone un gasto adicional de 25.720 millones de pesetas, es decir el coste adicional de los efectos secundarios gastrointestinales por AINE se acerca a los 80.000 millones en estimaciones conservadoras.
Por todo ello es evidente que aunque el tratamiento profiláctico es importante, no lo es menos la utilización adecuada de los recursos terapéuticos de que se dispone.
Antes de abordar cuál es el tratamiento más efectivo y en qué pacientes debemos instaurarlo, la primera pregunta que nos debemos realizar es si el AINE es estrictamente necesario para el paciente, ya que si no es así, y conociéndose perfectamente que este grupo de fármacos tiene capacidad de lesionar la mucosa gastroduo denal, lo único que estamos haciendo con dicho tra tamiento es someter al paciente a una iatrogenia claramente innecesaria. De hecho, en un estudio realizado en Canadá11 se comprobó que casi la mitad de las prescripciones de AINE y que, por tanto, la mitad de las complicaciones originadas por estos fármacos, se podrían evitar simplemente con una buena prescripción de los mismos.
Profilaxis primaria
En el caso de que el paciente necesite el AINE por su enfermedad de base, la siguiente pregunta que nos surge es:
¿A quién debemos tratar: a todos los pacientes o sólo a determinados grupos?
Analizando los diversos estudios epidemiológicos disponibles, se observa que no todos los pacientes que consumen AINE desarrollarán lesiones en el tracto digestivo y aunque el consumo de AINE aumenta el riesgo de padecer una hemorragia digestiva por un factor de 4-512, únicamente uno de cada 1.000 consumidores de AINE presentarán una complicación gastrointestinal grave o una perforación13.
Por ello, y sobre la base de la evidencia disponible, se puede identificar a la población de riesgo en la gastropatía por AINE y que, por tanto, precisará tratamiento profiláctico. Los factores de riesgo se exponen en la tabla 1 y son:
1. Historia previa de úlcera o complicaciones. Se considera el factor de riesgo más importante para padecer gastropatía o sus complicaciones con un riesgo relativo de alrededor de 13 en los diferentes estudios. En el estudio MUCOSA14 se comprobó que la frecuencia de complicaciones en pacientes tomadores de AINE y con historia ulcerosa previa era del 7,84% y esta frecuencia se elevaba hasta el 8,9% si el paciente tenía historia previa de hemorragia digestiva. Asimismo, en un estudio de casos y controles que estudiaba el riesgo global de complicaciones (hemorragia digestiva y perforación) asociado al consumo de AINE15, se comprobó que la historia previa de enfermedad péptica era el factor de mayor predicción de hemorragia digestiva o perforación.
2. Edad. La edad es otro de los factores de riesgo reconocidos universalmente, y se produce un incremento proporcional del riesgo con la edad. En un metaanálisis realizado16 se determinó que los sujetos mayores de 60 años tenían un riesgo relativo de hemorragia digestiva de 2,38 frente al 0,44 de los pacientes menores de 60 años. En un estudio posterior de Henry et al17 se determinó que la odds ratio de padecer una hemorragia digestiva en pacientes consumidores de AINE es de 2 en los pacientes menores de 59 años, de 3 en los pacientes entre 60 y 79 años y de 4,2 en pacientes mayores de 80 años, es decir un riesgo con incremento proporcional con la edad.
3. Enfermedad concomitante grave. Aunque sea un factor de riesgo comúnmente aceptado, no existen abundantes evidencias que lo apoyen, aunque sí algunas. En el estudio MUCOSA14 y en un estudio de casos y controles realizado en nuestro país la presencia de una enfermedad cardiovascular ha sido definida como un factor de riesgo importante en los pacientes que consumen AINE como aspirina a bajas dosis13.
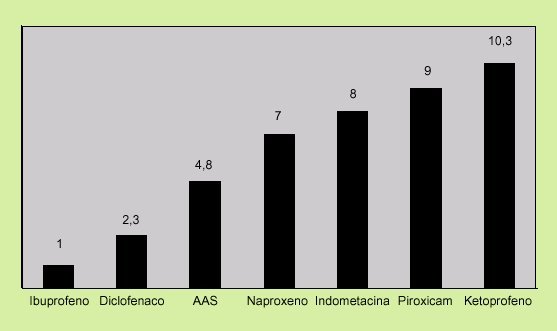
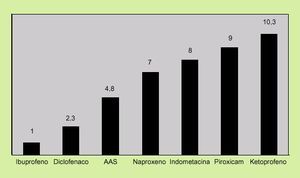
4. Dosis y tipo de AINE. En términos de riesgo, existe una clara dependencia para todos los AINE, aunque no existe una dosis segura, ya que el riesgo de sufrir complicaciones gastrointestinales, como una hemorragia digestiva, se asocia también a dosis bajas de ácido acetilsalicílico (AAS)18. Asimismo, no todos los AINE tienen el mismo riesgo de originar complicaciones. En la figura 1 se expone el riesgo relativo de complicaciones gastrointestinales según el tipo de AINE.
5. Consumo de tabaco y alcohol. Son factores de riesgo menos importantes y que deben considerarse en el contexto de cada paciente, siendo necesarios más estudios para precisar la auténtica magnitud de su importancia. En un estudio realizado por nuestro grupo, el consumo de tabaco y alcohol constituyen factores de riesgo de perforación gastrointestinal tanto de origen bajo como alto en pacientes que consumen AINE13.
Una vez definida la población de riesgo, las siguientes preguntas que se deben plantear son:
¿Qué fármaco debo utilizar para la profilaxis y a qué dosis?, ¿son todos igual de efectivos?
Anti-H2
Los estudios realizados hasta la fecha indican que la administración de ranitidina a dosis habituales es efectiva en la disminución de la incidencia de úlcera duodenal en pacientes que consumen AINE pero no en la disminución de la incidencia de úlcera gástrica19-22. Esta situación supone un grave problema en estos pacientes, ya que la mayoría de las lesiones que aparecen secundariamente a la administración de AINE lo hacen en la mucosa gástrica. Asimismo, se ha comprobado que el aumento de la dosis no conlleva una reducción de la incidencia de úlcera gástrica23. En un reciente metaanálisis se observó que la ranitidina no ofrecía protección consistente frente a la enfermedad ulcerosa asociada al consumo de AINE en pacientes con tratamientos de menos de 3 meses de duración24. Mención aparte merece la famotidina, ya que este fármaco, a dosis dobles de lo habitual, es decir, de 40 mg/día, consigue disminuir la incidencia acumulada de úlcera gástrica y úlcera duodenal de forma significativa22. Sin embargo, estos hallazgos se basan en los resultados obtenidos en un único estudio y con datos limitados y de menor magnitud que para la ranitidina.
Misoprostol
Este fármaco es un análogo de las prostaglandinas que ha demostrado en numerosos estudios su eficacia en la profilaxis primaria de úlcera gástrica y úlcera duodenal en pacientes consumidores de AINE, comparado frente a placebo y ranitidina. La dosis necesaria para obtener este efecto es de 800 µg/día, aunque hay estudios que sugieren que la dosis de 600 µg/día es igual de efectiva y mejor tolerada que la de 800, y más efectiva que la dosis de 400 µg/día25. El principal problema que presenta el misoprostol es que, a las dosis realmente efi caces, su administración se acompaña de frecuen tes efectos secundarios, especialmente diarrea, que obligan al cese del tratamiento. De hecho, en el estudio MUCOSA14 un 42% de los pacientes en tratamiento con misoprostol tuvo que abandonar el estudio por efectos secundarios, frente a un 36,4% de los pacientes que estaban en tratamiento con placebo. La reducción de la dosis a 600 µg/día se asocia con una menor tasa de efectos secundarios (12%).
Inhibidores de la bomba de protones
Existen numerosos estudios que han investigado la eficacia del omeprazol en la profilaxis primaria frente a ranitidina, misoprostol y placebo. En un reciente metaanálisis se observó que omeprazol fue superior al resto de los antisecretores24 en la profilaxis de úlcera gástrica y úlcera duodenal (dos veces mayor para úlcera duodenal) con una protección dos veces superior a la de los anti-H2 considerados éstos de forma global.
Acexamato de cinc
Su administración inhibe la secreción gástrica y además estimula diferentes factores de la defensa gástrica. Asimismo, se trata de un fármaco muy atractivo por su bajo coste. Sin embargo, únicamente existe un estudio de 28 días frente a placebo en el que demuestra ser eficaz en la profilaxis de la úlcera gastroduodenal por lo que son necesarios más estudios para precisar el potencial papel de este fármaco en la gastropatía por AINE26.
Sucralfato
Únicamente se dispone de dos estudios de 3 y 6 meses que analizan la eficacia de este fármaco frente a placebo y misoprostol, y en ellos no demuestra ser más eficaz que placebo y es claramente menos eficaz que misoprostol27, por lo que es un fármaco que no se debe considerar como una alternativa para la profilaxis de la gastropatía por AINE.
Dosmalfato
El dosmalfato es un fármaco de reciente aparición. Existen dos estudios comparativos frente a misoprostol; en el primero de ellos se estudió la eficacia de ambos fármacos en la prevención de desarrollo de lesiones pépticas y ambos demostraron ser igual de eficaces en la prevención de úlcera gástrica, sin embargo en este estudio no se incluyeron pacientes con historia ulcerosa previa además de que la dosis utilizada de misopros tol fue de 400 mg/día, lejos de la dosis eficaz de dicho fármaco28.
En el segundo estudio realizado se comprobó la eficacia de ambos fármacos en la profilaxis a largo plazo (12 semanas). En este estudio la dosis de misoprostol utilizada fue de 800 µg/día y ambos fármacos resultaron tener una eficacia similar en la prevención de las lesiones, aunque con una menor incidencia de efectos secundarios con dosmalfato que con misoprostol29. No existen datos comparativos frente a omeprazol ni frente a placebo.
Por tanto, basándose en la evidencia disponible en estos momentos, y teniendo en cuenta no sólo la eficacia de cada uno de los fármacos sino también la comodidad en la posología así como la tolerancia a los mismos, la pauta de elección más favorable en profilaxis de la enfermedad gastroduodenal por AINE es el omeprazol a dosis de 20 mg/día. Aunque existen menos datos al respecto, otros inhibidores de la bomba de protones parecen ser igualmente eficaces. De ellos, el que más datos aporta es el lansoprazol (15 y, sobre todo, 30 mg/día) que ha resultado ser tan eficaz como las dosis de 800 µg/día de misoprostol en la prevención de úlcera gástrica. Otras alternativas aprobadas en España en la profilaxis de la gastropatía por AINE son acexamato de cinc y dosmalfato además, por supuesto, del misoprostol, que fue el que primero obtuvo la indicación.
Tratamiento de la gastropatía y profilaxis secundaria
Hasta ahora hemos expuesto la actitud que se debe tomar ante un paciente que está tomando AINE pero, ¿qué debemos hacer para tratar a un paciente con una lesión causada por la ingestión de estos fármacos?
En el tratamiento de las lesiones asociadas a la administración de AINE, lo primero que debemos plantearnos, al igual que sucede con la profilaxis, es si el AINE es estrictamente necesario. En caso de que no fuera así y el antiinflamatorio puede ser eliminado, cualquiera de los fármacos disponibles (antisecretores, fármacos protectores de la mucosa gástrica, análogos de prostaglandinas) es eficaz en la curación de las lesiones en los tiempos estándar o incluso con mayor rapidez que si la lesión no hubiese sido ocasionada por el antiinflamatorio. En el caso contrario, es decir, que el paciente necesitara continuar en tratamiento con AINE, debemos tener en cuenta diferentes datos, obtenidos de varios estudios.
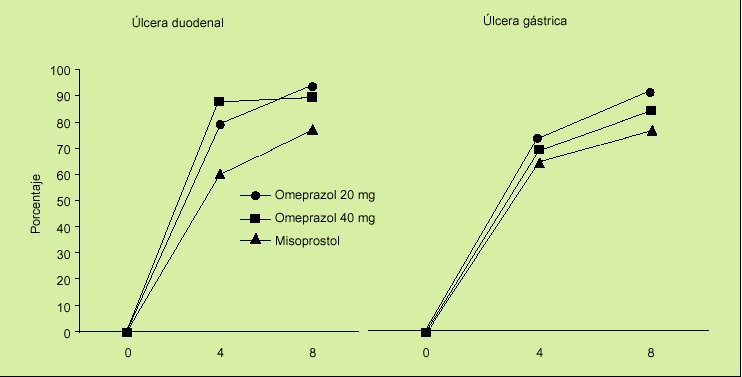
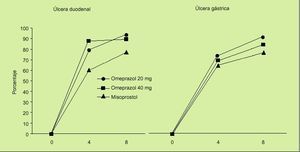
En el estudio OMNIUM8 se comparaba la eficacia de omeprazol frente a misoprostol en el tratamiento de la enfermedad ulcerosa gastroduodenal y también se evaluaba la eficacia del tratamiento de mantenimiento en pacientes en tratamiento con AINE. Los resultados obtenidos son los siguientes:
1. En el tratamiento de las lesiones originadas por la ingestión de AINE, consideradas globalmente, los porcentajes de curación fueron similares para omeprazol (20 mg/día) y misoprostol (200 µg/6 h) (el 75% frente al 71%). Sin embargo, analizando los resultados del estudio existen varios datos importantes que deben ser tomados en consideración:
En la curación de las erosiones, el tratamiento con misoprostol es más efectivo que el tratamiento con omeprazol (el 87 frente al 77%). La significación clínica es previsiblemente irrelevante.
En la úlcera duodenal, el porcentaje de cicatrización fue significativamente superior en el grupo de pacientes tratados con omeprazol que en el grupo de pacientes tratados con misoprostol (el 93% frente al 77%).
En la úlcera gástrica también la administración de omeprazol a la dosis de 20 mg/día consigue una mayor tasa de cicatrización cuando se compara con misoprostol (el 87 frente al 73%) (fig. 2).
Fig. 1. Riesgo relativo de complicaciones gastrointestinales según AINE. (Tomada de Henry et al. Br Med J 1996; 312: 1563-156.)
Fig. 2. Porcentaje de curación de lesiones ulcerosas asociadas a AINE a las 4 y 8 semanas de tratamiento. Estudio OMNIUM.
El incremento de la dosis de omeprazol a 40 mg/día no conlleva una mayor eficacia que la dosis de 20 mg/día.
2. En la fase de mantenimiento (profilaxis secundaria) se comparó la eficacia de misoprostol a dosis de 400 µg/día y omeprazol a dosis de 20 mg/día frente a placebo. En esta fase del estudio se pudo comprobar que ambos fármacos eran superiores al placebo y que a los
6 meses el omeprazol resultaba más efectivo que el misoprostol (el 61 frente al 48%).
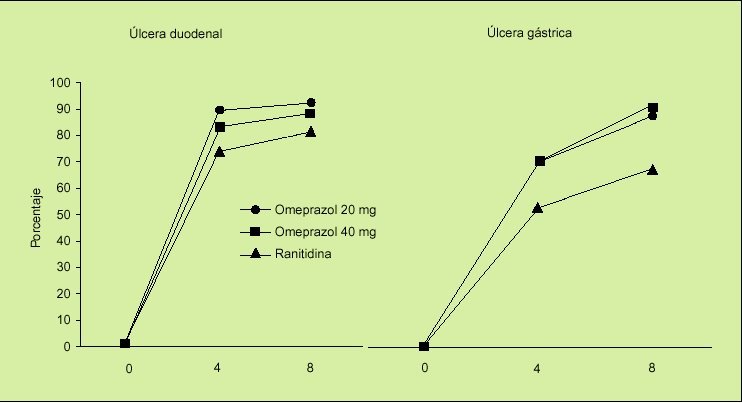
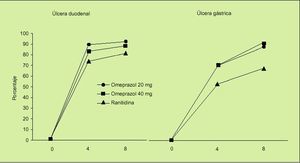
Un estudio similar al anterior es el estudio ASTRONAUT7, pero en este caso se comparaba la eficacia de omeprazol frente a ranitidina y al igual que en el estudio OMNIUM en dos fases: tratamiento y profilaxis secundaria. Los resultados obtenidos fueron los siguientes:
1. En la fase de curación, el omeprazol consigue mayores tasas de cicatrización de las lesiones ulcerosas:
En la úlcera duodenal el porcentaje de cicatrización con 20 mg/día de omeprazol fue significativamente mayor que el obtenido con ranitidina (el 92 frente al 81%).
En la úlcera gástrica también la administración de 20 mg/día consigue una mayor tasa de cicatrización que la ranitidina (el 84 frente al 64%) (fig. 3).
Fig. 3. Porcentaje de curación de lesiones ulcerosas asociadas a AINE a las 4 y 8 semanas. Estudio ASTRONAUT.
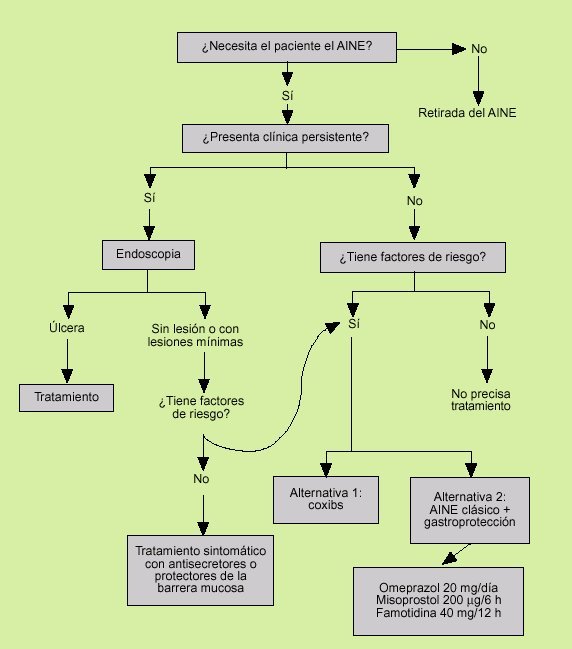
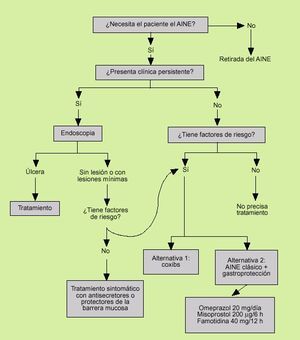
Fig. 4. Estrategía terapéutica en la dispepsia del paciente con ingesta de AINE.
En el tratamiento de mantenimiento también la administración de omeprazol resultó ser significativamente más eficaz que la administración de ranitidina (el 79 frente al 66%).
2. Al igual que sucede en el estudio OMNIUM, el incremento de la dosis de omeprazol a 40 mg/día no conlleva un aumento de la eficacia en la cicatrización de las lesiones ulcerosas gástricas o duodenales.
Profilaxis de las complicaciones
El estudio MUCOSA ha demostrado que, cuando se compara con placebo, el misoprostol es eficaz en reducir a casi la mitad la frecuencia de complicaciones en pacientes con artritis reumatoide que toman AINE5. En prevención secundaria, omeprazol fue más efectivo que la erradicación de Helicobacter pylori en la prevención de recidiva hemorrágica en pacientes con historia reciente de hemorragia por úlcera péptica (el 2 frente al 17%)30. Dosis de 200 µg/12 h de misoprostol fracasaron en prevenir recidiva hemorrágica en un estudio similar cuando se comparó con la frecuencia observada en tratamientos con naproxeno más misoprostol frente a nabumetona sola (el 2 frente al 20%)31.
En otro estudio32 de carácter observacional se ha observado una baja frecuencia de complicaciones en pacientes de riesgo con historia previa de hemorragia que toman AINE junto con omeprazol.
Tratamiento de los síntomas
Los pacientes que utilizan AINE tienen dispepsia con más frecuencia que lesiones o complicaciones. Asimismo, existe una mala correlación entre la presencia de los síntomas y la existencia de lesiones endoscópicas en los pacientes que consumen AINE. En un reciente estudio33, se ha podido comprobar que la sensibilidad de los síntomas para determinar la presencia de lesiones (úlceras o erosiones gastroduodenales) en sujetos en tratamiento con AINE es de tan sólo un 25%, con una especificidad del 95%, un valor predictivo positivo del 50% y un valor predictivo negativo del 75%.
En los pacientes que presentan síntomas existen dos estrategias.
Si los síntomas se originan al poco tiempo de iniciado el tratamiento con AINE, se debe replantear el tratamiento. Si se desea continuar éste, es posible hacer un cambio del mismo por otro de menor gastrolesividad (ibuprofeno, meloxicam o, mejor, coxibs), reducir dosis si es factible y/o asociar como primera medida un fármaco gastroprotector.
Si los síntomas persisten o se inician después de un tratamiento prolongado con AINE, es prudente realizar una gastroscopia para determinar la presencia o no de lesiones. En el caso de que no se encuentren lesiones o éstas sean poco relevantes, como petequias o erosiones, lo adecuado sería la utilización de antisecretores, aunque la documentación disponible al respecto es escasa. Los fármacos que de manera global han demostrado eficacia en reducir los efectos dispépticos en estos pacientes incluyen el omeprazol, la ranitidina, la famotidina y el misoprostol, aunque los mejores resultados se obtienen con los antisecretores y en especial con el omeprazol.
Debe tenerse en cuenta que existe un pequeño grupo de pacientes que no responderán al tratamiento con inhibidores de la bomba de protones y muchos de ellos abandonarán el tratamiento con AINE. Este dato es importante ya que el tratamiento con inhibidores de la bomba de protones consigue la cicatrización de la gran mayoría de las lesiones pépticas, por lo que en un princi pio no sería necesario que el paciente abandonase el tratamiento con AINE si éstos son realmente necesarios.
Una opción en estos pacientes sería la administración de fármacos con inhibición selectiva de la COX-2, si bien esta estrategia de tratamiento tampoco garantiza el éxito, ya que si bien la frecuencia de síntomas dispépticos es menor, no se consigue siempre eliminar la aparición de dispepsia.
Tratamiento de la infección por Helicobacter pylori en pacientes que consumen AINE
En el momento actual, las evidencias disponibles señalan que la erradicación de la infección por H. pylori no supone ninguna ventaja adicional en la estrategia de profilaxis de la gastropatía por AINE. Por tanto, la erradicación de la infección no está indicada en el paciente que toma o va a precisar AINE.
En lo que se refiere a la prevención de complicaciones existe un estudio30 en el que se ha comprobado que la administración de omeprazol a dosis de 20 mg/día es más efectiva que la erradicación de H. pylori en la prevención de complicaciones hemorrágicas (el 4 frente al 17,3%). De hecho, existen dos estudios en los que se ha demostrado que la eficacia del antisecretor en la profilaxis secundaria de la gastropatía por AINE es mayor en los pacientes H. pylori positivos que en los negativos7,8, con independencia del tratamiento administrado. Resultados que posteriormente han sido confirmados por el estudio HELP33, que ha objetivado que, en población de riesgo, las tasas de cicatrización de las lesiones son menores en los pacientes a los que se les ha erradicado la infección, y que el fracaso terapéutico en la prevención es cercano al 50% en ambos grupos (erradicados y no erradicados), es decir, independiente del estatus de la infección. Dos estudios de pequeño tamaño han señalado, sin embargo, que en pacientes sin historia previa ulcerosa y que inician el tratamiento con AINE la erradicación podría ser beneficiosa para reducir la frecuencia de úlceras30,34. Nuevos estudios, especialmente centrados en la nueva generación de AINE, inhibidores selectivos de la COX-2, deben determinar el alcance real de la erradicación como estrategia terapéutica.
Inhibidores específicos de la COX-2
El impacto sobre la salud pública de los AINE ha llevado a la búsqueda de nuevos agentes más seguros pero con igualdad de eficacia analgésica y antiinflamatoria. Dos nuevos fármacos han sido comercializados que son el rofecoxib y celecoxib. Estos agentes no inhiben la isoenzima COX-1 a dosis supraterapéutica. Aparentemente son tan efectivos como los AINE no selectivos en el tratamiento de la artrosis y la artritis reumatoide, y están asociados a una reducción en la incidencia de lesión aguda, de úlcera y de tolerancia gastrointestinal comparados con otros AINE no selectivos.
Tolerancia gastrointestinal
La frecuencia de interrupción del tratamiento y de síntomas dispépticos es menor con estos dos agentes que frente a AINE comparador, aunque mayor, en general, que frente a placebo. En recientes estudios con un número elevado de pacientes, las interrupciones de tratamiento por síntomas dispépticos con rofecoxib y AINE comparadores fue de 8,2 frente a 12,0 por 100 pacientes-año, respectivamente35. En otro estudio reciente, la tolerancia intestinal de celecoxib (definida como la presencia de uno o más de los siguientes síntomas: dispepsia, dolor abdominal y vómitos), comparada con naproxeno y con placebo, se observó que dicha tolerancia gastrointestinal es significativamente mejor en los pacientes tratados con celecoxib que en los pacientes tratados con naproxeno, observándose asimismo que el incremento de la dosis de celecoxib hasta 400 mg/día no conllevaba una peor tolerancia. Además, se comprobó que la tolerancia del tratamiento con celecoxib era similar a la observada en el grupo tratado con placebo36.
Lesiones agudas de la mucosa gastroduodenal
La proporción de lesiones agudas gastroduodenales observadas con dosis supraterapéuticas (250 mg/día) de rofecoxib fue similar a la observada con placebo tras 7 días de tratamiento. Por contra, el porcentaje de pacientes que desarrollaron lesiones con graduación mayor o igual a 2 en la escala de Lanza, que tomaban AAS (650 mg/6 h) o ibuprofeno (800 mg/8 h) fue del 94 y del 71%, respectivamente. Asimismo, los valores basales de tromboxano B2 se redujeron sólo en los pacientes que tomaron AAS y naproxeno37.
Lesiones ulcerosas gastroduodenales en tratamientos prolongados
En tratamientos prolongados los resultados fueron similares: en dos estudios gemelos publicado por Laine et al38 y Hawkey et al39 en más de 1.500 pacientes con artrosis que recibieron rofecoxib (25 o 50 mg al día) frente a placebo e ibuprofeno (800 mg/8 h) durante 12 o 24 semanas, se demostró que la frecuencia de úlceras endoscópicas mayores de 3 mm fue igual en los pacientes que tomaron rofecoxib que en los que recibieron pla cebo y claramente inferior que las observadas con ibuprofeno.
En cuanto al celecoxib, en el análisis de las lesiones endoscópicas tras 12 semanas de tratamiento, se comprobó que no existían diferencias estadísticamente significativas en la incidencia de úlceras gastroduodenales en los pacientes tratados con celecoxib (independientemente de la dosis utilizada) respecto a placebo y que dicha incidencia de úlcera gastroduodenal era significativamente mayor en el grupo de pacientes tratados con naproxeno que en el resto de los grupos40.
Complicaciones gastrointestinales
Los estudios señalan que estos fármacos se asocian a una menor frecuencia de complicaciones gastrointestinales. Se conocen datos con ambos fármacos. La combinación de los 8 estudios de artrosis en fase IIb/III (5.435 pacientes) con rofecoxib señalan una menor frecuencia de complicaciones con este fármaco que con los AINE comparadores41. La incidencia acumulada de perforación, úlcera sintomática, obstrucción o hemorragia (PUH) fue del 1,3 frente al 1,8% con los AINE comparadores, y las tasas por 100 pacientes/año fueron de 1,33 y 2,60, respectivamente. En el análisis con placebo que duró hasta 4 meses, la incidencia acumulada fue del 0,9, el 0,9 y el 1,6%, respectivamente. Más recientemente, nuevos datos han confirmado la mayor seguridad de este fármaco desde el punto de vista de las complicaciones gastrointestinales. En el estudio VIGOR42 se evaluó la frecuencia de episodios clínicamente relevantes en más de 8.000 pacientes que sufrían artritis reumatoide y que fueron tratados con naproxeno, 500 mg/12 h, o con rofecoxib, 50 mg/24 h. La frecuencia de úlcera sintomática, hemorragia o perforación tras 12 meses de seguimiento, expresada como tasa por 100 pacientes-año, fue del 2,1% con rofecoxib frente al 4,5% con naproxeno (p < 0,001). De esta manera se precisan sólo 41 tratamientos con rofecoxib para prevenir un episodio gastrointestinal clínicamente significativo (NNT). El análisis de complicaciones, eliminando úlceras sintomáticas, esto es, perforaciones, obstrucción y hemorragias, fue el 0,6 frente al 1,4%.
Existen otros dos estudios que analizan de manera conjunta en 14 estudios aleatorizados la incidencia de complicaciones gastrointestinales en los pacientes tratados con celecoxib. En el estudio de Goldstein et al43 se observó que la incidencia de complicaciones asociada al tratamiento con celecoxib (0,2%) era similar a la observada en el grupo placebo (0%) y unas 4-7 veces menor que la observada en pacientes en tratamiento con un AINE no selectivo (1,68%). En el estudio CLASS44 se confirmó la menor frecuencia de episodios clínicamente significativos con celecoxib frente a AINE comparadores (el 2,08 frente al 3,52%; p = 0,02). Sin embargo, las diferencias respecto a complicaciones, el objetivo primario del estudio, no fueron significativas (el 1,5 frente al 0,8%; p = 0,09). Este hecho fue posiblemente debido a la presencia de pacientes que tomaban aspirina a dosis bajas en ambos grupos de tratamiento. Este aspecto es particularmente interesante, ya que sugiere que la combinación de celecoxib (posiblemente también otros coxibs) con aspirina a dosis bajas debe tener una estrategia terapéutica diferente que se deberá definir en base a la incorporación de nuevos datos.