La función principal del aparato respiratorio es garantizar un correcto intercambio pulmonar de gases, es decir, conseguir unas cifras óptimas de oxigenación tisular y una correcta eliminación del dióxido de carbono (CO2) producido por el metabolismo tisular. La insuficiencia respiratoria es un síndrome clínico caracterizado por la falta de una correcta oxigenación arterial y/o una correcta eliminación del CO2.
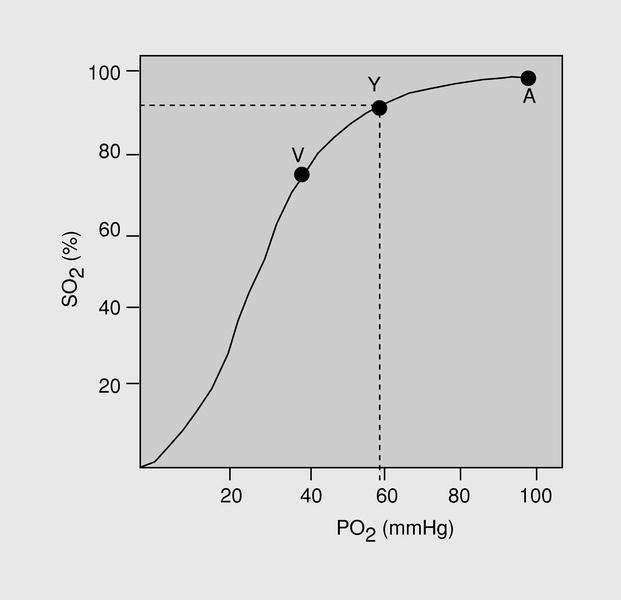
Los criterios diagnósticos de la insuficiencia respiratoria (IR) se basan en la curva de saturación de oxígeno de la hemoglobina (fig. 1). Valores de presión arterial de oxígeno (PaO2) inferiores a 60 mmHg respirando aire ambiente (fracción inspiratoria de oxígeno [FiO2], del 21%), en reposo y al nivel del mar son diagnósticos de IR.
Fig. 1. Curva de saturación de la oxihemoglobina.
Clasificación de la insuficiencia respiratoria aguda (IRA)
La IRA (fig. 2) se puede clasificar atendiendo a diferentes criterios. Según criterios fisiopatológicos o gaso métricos, dado que la IR se define por las anomalías de la PaO2 y la presión arterial de CO2 (PaCO2), se clasifica en dos grandes grupos según si la hipoxemia arterial se asocia o no a hipercapnia1:
Fig. 2. Clasificación esquemática de la insuficiencia respiratoria. SNC: sistema nervioso central; SAHS: síndrome de apnea-hipo-
pnea durante el sueño; EPOC: enfermedad pulmonar obstructiva crónica, y SDRA: síndrome de distrés respiratorio agudo.
Insuficiencia respiratoria hipercápnica
La IR hipercápnica puede ser de instauración crónica o aguda. En el primer caso se acompaña de una compensación metabólica que permite mantener el pH del medio interno dentro de los valores de la normalidad. En el segundo caso se acompaña de una disminución del pH del medio interno, la acidosis respiratoria, que es un criterio de gravedad.
Insuficiencia respiratoria no hipercápnica
En general se puede dividir, según las características clínicas y anatomopatológicas de la enfermedad causal, en: a) enfermedades agudas, localizadas (neumonía grave, tromboembolismo pulmonar) o difusas (síndrome de distrés respiratorio agudo [SDRA]), y b) enfermedades crónicas, con IR de presentación aguda o agudización de una IR crónica, como es el caso de la EPOC sin retención de CO2, la agudización del asma bronquial, enfermedades pulmonares intersticiales difusas y una variedad de enfermedades vasculares pulmonares crónicas.
Tratamiento clínico de la insuficiencia respiratoria aguda
El tratamiento clínico del paciente con IRA se basa, además del abordaje clínico de la enfermedad de base, en las medidas de soporte de la IRA, que son todas las medidas encaminadas a conseguir unos valores aceptables de oxigenación arterial y ventilación alveolar. Se dividen en: a) administración de oxígeno; b) ventilación no invasiva, y c) ventilación mecánica convencional o invasiva.
Los objetivos principales de las medidas de soporte de la IRA son conseguir: a) valores aceptables de oxigenación arterial, retirando la PaO2 de la zona peligrosa de la curva de saturación de la hemoglobina (en general alcanzando valores de PaO2 > 60-65 mmHg y/o saturación de hemoglobina > 90-92%), y b) cifras aceptables de ventilación alveolar, que dependerán de los tipos de pacientes y de las situaciones clínicas.
Administración de oxígeno
La administración de oxígeno es la medida básica de soporte de la IRA, especialmente en la no hipercápnica. Su justificación se basa en aumentar la FiO2 que reciben los pacientes.
Objetivos de la oxigenoterapia
Los efectos directos de la administración de oxígeno sobre la fracción ambiental (21%) son: a) tratar la hipoxemia y evitar el sufrimiento tisular; b) disminuir el trabajo respiratorio, y c) disminuir el trabajo miocár-
dico.
Fuentes de administración de oxígeno
Las cifras de FiO2 apropiadas para mantener una correcta oxigenación tisular varían según el tipo y cau sa de la IR. Por esto se dispone de dos tipos de sis temas:
Sistemas de alto flujo
Se consideran sistemas de alto flujo todos aquellos que permiten administrar el flujo de oxígeno necesario y en los que la FiO2 no se modifica con la ventilación del paciente, debido a que el flujo ha de ser más alto que los requerimientos ventilatorios del paciente. Los más utilizados en la clínica diaria son los que utilizan el sistema Venturi. Las mascarillas Venturi están indicadas en pacientes con IR que necesitan FiO2 exactas. Se dispone de diferentes valores de FiO2, que suelen oscilar entre un 24 y un 60%, pero no se recomienda utilizar concentraciones superiores al 40-50%, debido al bajo flujo que proporcionan con estas cifras. Variantes de estas mascarillas son las conexiones en «T», indicadas en pacientes con cánulas de plástico de traqueotomía o tubos de intubación endotraqueal, así como los colla rines Venturi, también llamados máscaras articuladas, que se utilizan en pacientes con cánulas de traqueotomía metálicas.
Sistemas de bajo flujo
Los sistemas de bajo flujo de oxígeno se definen como aquellos en que el flujo de gas no llega a satisfacer todas las necesidades inspiratorias, de forma que una parte del gas inspirado por el paciente procede del aire ambiente. Hay dos sistemas que se utilizan habitualmente:
Cánulas nasales. Indicadas en todo tipo de pacientes con insuficiencia respiratoria no hipercápnica sin grandes necesidades de oxígeno. Normalmente se utiliza un flujo de oxígeno entre 1 y 3 l/min, proporcionando una FiO2 aproximada entre un 24 y un 35%, respectivamente.
Mascarillas con bolsa-reservorio. Proporcionan la máxima FiO2 dentro de la modalidad de administración de oxígeno con máscara. Consisten en una mascarilla facial que dispone de unos orificios laterales con válvula unidireccional por donde sale el gas espirado y una bolsa-reservorio de oxígeno con una capacidad aproximada de 750 ml conectada a la mascarilla por una válvula unidireccional que impide la entrada a la bolsa del gas espirado. Este sistema está recomendado en pacientes con insuficiencia respiratoria grave que necesitan FiO2 superiores al 50%.
Criterios de aplicación clínica de la oxigenoterapia
En referencia a los pacientes hospitalizados, hay que administrar oxígeno cuando la PaO2 basal (respirando aire ambiente) es inferior a 60 mmHg. En la práctica clínica, hay que diferenciar entre:
Pacientes con insuficiencia respiratoria aguda no hipercápnica
Ejemplos de enfermedades con este patrón gasométrico son las neumonías, el edema pulmonar cardiogénico o el SDRA. En estos casos, el principal mecanismo fisiopatológico causante de hipoxemia arterial es el shunt intrapulmonar. Hay que iniciar la oxigenoterapia con sistemas de alto flujo tipo Venturi a concentración elevada (35-40%). Si esto es suficiente para alcanzar cifras de PaO2 > 60 mmHg, hay que ajustar la FiO2 a la cifra más baja posible. Si con estas concentraciones no es suficiente, habrá que aumentarlas, bien con sistemas tipo Venturi (hasta un 50%), bien con sistemas de bajo flujo y bolsa-reservorio. En el último caso, es importante recordar que la concentración de oxígeno adminis-
trada oscila entre un 60 y un 80%, aunque no se puede determinar con exactitud.
Pacientes con insuficiencia respiratoria hipercápnica
El ejemplo más paradigmático son las reagudizaciones de la EPOC. En este caso hay que iniciar la oxigenoterapia con un sistema de alto flujo tipo Venturi a la concentración más disminuida posible (24%). Este sistema es preferible a las cánulas nasales, y tiene la finalidad de evitar el efecto depresor del centro respiratorio que se asocia a la administración de concentraciones elevadas de oxígeno en estos pacientes. Si con este sistema no se consigue mantener la PaO2 por encima de 60 mmHg, se puede incrementar la FiO2 controlando la posible aparición de hipercapnia exagerada.
Ventilación no invasiva
La ventilación no invasiva (VNI) se define como toda forma de soporte ventilatorio sin la creación de una vía aérea artificial mediante la intubación traqueal o una traqueotomía y los problemas asociados a ésta2,3.
Modalidades de tratamiento
Hay dos modalidades principales:
CPAP/PEEP
La aplicación de una presión positiva al final de la espiración (positive end-expiratory pressure [PEEP]) mejora la oxigenación arterial en pacientes con hipoxemia grave. Cuando se aplica PEEP en un paciente que respira espontáneamente suele denominarse presión positiva continua sobre las vías aéreas (continuous positive-airways pressure [CPAP]) o CPAP/PEEP. Para ello se necesita una fuente de alto flujo que garantice la ventilación minuto del paciente y permita administrar valores elevados de FiO2. Es necesario utilizar mascarillas nasobucales firmemente sujetas para evitar las fugas. En este tipo de sistemas, todo el trabajo respiratorio es realizado por el propio paciente. El desarrollo en los últimos años de nuevos equipos de VNI que permiten la administración de cifras elevadas de FiO2 de forma controlada ha hecho que los sistemas clásicos de CPAP/PEEP se utilicen cada vez menos en la práctica clínica diaria
Ventilación no invasiva
Se caracterizan por aportar directamente parte del trabajo respiratorio, incrementando como resultado la ventilación alveolar. Existen dos tipos básicos de equipos según su funcionamiento:
1. Ventilación controlada por volumen. Estos equipos tienen un funcionamiento muy similar al de los ventiladores convencionales. Se puede pautar el volumen corriente y la frecuencia respiratoria. También disponen de alarmas y son equipos más pesados y complejos. Estos ventiladores compensan con mayor dificultad las fugas aéreas y se adaptan menos a la demanda del paciente. En cambio, permiten asegurar un volumen minuto predeterminado.
2. Ventilación limitada por presión. Esta modalidad es similar a la presión de soporte inspiratorio. Se pauta una presión inspiratoria predeterminada y, mediante un patrón de flujo descendente, se mantiene una cifra de presión constante a lo largo de la inspiración. En general, son equipos ligeros y se pueden trasladar con facilidad a la cabecera del paciente. Se adaptan bien a los requerimientos ventilatorios variables de los pacientes y compensan mejor las fugas que los ventiladores volumétricos.
En ambos tipos de ventiladores se puede emplear PEEP. En el momento actual, se dispone de equipos de VNI de última generación que incorporan las diversas modalidades descritas, sistemas de estimación y compensación de fugas y están dotados de sistemas de alarmas completas. También permiten la administración de valores elevados de FiO2 de forma controlada.
Mascarillas
Las mascarillas son un punto clave en la VNI, ya que de ellas depende la tolerancia del paciente y el control de las fugas, aspectos clave de la eficacia del tratamiento. Existen modelos nasales y nasobucales. Todas se fijan firmemente a la cabeza del paciente con arneses o correajes elásticos. La eficacia de los distintos modelos es similar, aunque presentan diferencias en su aplicación práctica. Así, las mascarillas nasales son más confortables y permiten la deglución, el habla y la eliminación de secreciones, aunque su eficacia puede disminuir debido a fugas por la boca. Este problema es menor con las mascarillas nasobucales. Para cada paciente hay que seleccionar la mascarilla más adecuada, y se busca la máxima tolerancia y comodidad junto con una buena adaptación a la anatomía facial y las mínimas fugas posibles.
Indicaciones de la CPAP/PEEP y la ventilación no invasiva con FiO2 altas4-7
Este tipo de soporte está indicado en la IRA de pacientes con hipoxemia refractaria a la oxigenoterapia convencional, con shunt intrapulmonar o atelectasias recurrentes con disminución de la capacidad residual funcional. Se puede utilizar en pacientes despiertos y colaboradores con capacidad de desarrollar un trabajo respiratorio aceptable. El objetivo principal es mantener una PaO2 y una saturación arterial adecuadas que garanticen un correcto aporte tisular de oxígeno. Las indicaciones específicas son: a) SDRA; b) edema pulmonar cardiogénico8; c) neumonía grave, y d) atelectasias posquirúrgicas. El tratamiento puede estar contraindicado en presencia de barotrauma, hipovolemia o inestabilidad hemodinámica grave, hipertensión endocraneal, y cuando el paciente no puede proteger de forma adecuada la vía aérea o presenta signos clínicos de fatiga muscular progresiva.
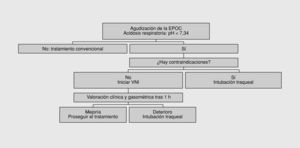
Indicaciones de la ventilación no invasiva con FiO2 baja (fig. 3)
Fig. 3. Algoritmo para la indicación de soporte ventilatorio en la enfermedad pulmonar obstructiva crónica (EPOC) agudizada. VNI: ventilación no invasiva.
En la IRA, las principales indicaciones son: a) IRA hipercápnica en pacientes con EPOC10-12; b) enfermedades torácicas restrictivas agudizadas; c) enfermedades neuromusculares agudizadas, y d) facilitar el weaning de la ventilación mecánica en pacientes con EPOC13. Estas situaciones clínicas tienen en común la presencia de hipercapnia y el hecho de que pueden ser reversibles o mejorar en el plazo de pocos días hasta una situación de mayor estabilidad clínica. La indicación principal y completamente consolidada de la VNI es el soporte ventilatorio de pacientes que presentan una agudización de una EPOC. Hay suficientes estudios controlados en que se demuestra que la VNI puede evitar la intubación y disminuir la morbimortalidad global, así como la duración del ingreso hospitalario. La VNI se indica cuando aparece acidosis respiratoria, taquipnea progresiva, incoordinación toracoabdominal y signos de encefalopatía hipercápnica. En estas condiciones, el riesgo de deterioro clínico es elevado si no se instaura un tratamiento de soporte ventilatorio, inicialmente con VNI, siempre que sea posible.
Hay otras situaciones clínicas que cursan con IRA en las que la VNI puede ser eficaz y en las que se puede intentar su uso, aunque todavía se necesitan más estudios clínicos controlados que permitan establecer con mayor firmeza la indicación: a) deterioro clínico después de la extubación poscirugía; b) insuficiencia cardíaca congestiva, y c) hipoventilación asociada al uso de sedantes del sistema nervioso central cuando se mantiene un nivel de conciencia aceptable.
La aplicación de la VNI se asocia a un cambio del patrón ventilatorio con disminución de la frecuencia respiratoria y un aumento del volumen corriente, junto con disminución de la taquicardia, la incoordinación toracoabdominal, mejoría de la disnea y de los signos de encefalopatía hipercápnica. Dentro de las primeras horas disminuyen los valores de PaCO2 y el pH tiende a la normalización con desaparición de la acidosis. Un paciente que no responda clínicamente ni mejore la gasometría arterial en las primeras horas difícilmente se beneficiará de este soporte ventilatorio. Las pautas de aplicación de la VNI no están claramente definidas. En el paciente ingresado en una UCI ésta se utiliza durante las primeras 48-72 h el máximo tiempo posible, y se realizan períodos breves de descanso para administrar nebulizaciones o facilitar la tolerancia del paciente.
Contraindicaciones de la ventilación no invasiva
Hay una serie de situaciones en las que la VNI puede estar contraindicada: a) pacientes en coma o con disminución del nivel de conciencia en los que la VNI no permite asegurar una adecuada protección de la vía aérea; b) inestabilidad hemodinámica marcada, la VNI no está indicada en situaciones de shock, arritmias graves o isquemia miocárdica aguda; c) pacientes con retención de gran cantidad de secreciones que no pueden eliminar adecuadamente; d) pacientes agitados o no colaboradores, y e) traumatismos faciales que impiden una correcta aplicación de la mascarilla.
La VNI ha de administrarse siempre bajo vigilancia estricta de la evolución del paciente, y hay que tener disponible equipo y personal necesarios para proceder al soporte ventilatorio convencional en caso de mala respuesta o deterioro clínico. Por estos motivos, este tipo de soporte ventilatorio debe utilizarse, siempre que sea posible, en una unidad de cuidados intensivos con monitorización de constantes vitales básicas. El éxito de la VNI depende de una correcta selección de los candidatos y de la aplicación adecuada de la técnica. La VNI exige un mayor esfuerzo por parte de todos los que atienden a este tipo de pacientes. En condiciones adecuadas, la VNI es un arma terapéutica valiosa en el tratamiento de pacientes con IRA y permite evitar las complicaciones asociadas a la ventilación mecánica convencional.
Ventilación mecánica invasiva14
La ventilación mecánica invasiva es una técnica de soporte vital avanzada. En este caso, además del soporte de la ventilación, hay que crear una vía aérea artificial, en general la intubación traqueal15.
Indicaciones de intubación traqueal (IT) y ventilación mecánica (IT-VM)
La VM invasiva está indicada en las siguientes situaciones clínicas: a) parada respiratoria o cardíaca; b) insuficiencia respiratoria grave con riesgo vital inmediato, como las pausas respiratorias con pérdida de conciencia o signos de jadeo o preparo respiratorio, aspiración masiva, imposibilidad para el manejo de secreciones respiratorias, bradicardia extrema con pérdida del estado de alerta, inestabilidad hemodinámica sin respuesta a fármacos vasoactivos, y c) disminución del nivel de conciencia para proteger la vía aérea.
Intubación traqueal y creación de una vía aérea artificial
Una vez se ha tomado la decisión de IT, es necesario disponer de una vía aérea permeable, segura y permanente. En general, la IT se realiza con la colocación de un tubo orotraqueal; es más infrecuente la realización de una traqueotomía urgente.
El material necesario incluye laringoscopios de diferentes medidas, para la visualización de las cuerdas vocales; bolsa de resucitación manual (AMBU) con máscara y conexiones al oxígeno para ventilación manual; cánulas faríngeas («tubos de Mayo») para facilitar la ventilación manual manteniendo permeable la vía aérea superior, y tubos orotraqueales de diferentes medidas. El procedimiento para la IT incluye la monitorización del electrocardiograma y saturación arterial por pulsioximetría; administración de fármacos sedantes y curarizantes; visualización de las cuerdas vocales mediante el laringoscopio; introducción del tubo orotraqueal con posterior hinchado del neumotaponamiento con control de la presión; ventilación manual con la bolsa de resucitación manual, comprobando la correcta ventilación de ambos campos pulmonares, y conexión al ventilador.
Cuando no se puede intubar por vía orotraqueal, está indicado el acceso quirúrgico a la vía aérea mediante la realización de una traqueotomía urgente, mediante dos posibles técnicas: a) cricotomía, en situación de emergencia, y b) traqueotomía, tras la cricotomía, para garantizar una vía aérea permanente.
PEEP
El uso de PEEP es muy frecuente en ventilación mecánica, con dos finalidades principales: a) en enfermedades con ocupación alveolar (SDRA, neumonías, edema pulmonar cardiogénico), para mantener una presión positiva durante todo el ciclo respiratorio, ayudar a prevenir el colapso alveolar espiratorio, mejorar el intercambio de gases y prevenir el colapso-reclutamiento alveolar cíclico, y b) en enfermedades que cursan con limitación al flujo aéreo (EPOC, asma bronquial), el uso de PEEP disminuye la sobrecarga de los músculos respiratorios debido a la hiperinsuflación pulmonar dinámica con presencia de PEEP intrínseca.
Traqueotomía en ventilación mecánica
Además de las situaciones de emergencia en el fracaso de la maniobra de IT, la indicación de traqueotomía en ventilación mecánica viene dada por las siguientes situaciones clínicas: a) ventilación prolongada sin evolución positiva del proceso de retirada de la ventilación mecánica; b) evidencia clínica de imposibilidad para un buen manejo de las secreciones respiratorias (p. ej., expectoración ineficaz, etc.), y c) disminución del nivel de conciencia que no es previsible que mejore a corto-medio plazo.
Abordaje clínico de las diferentes situaciones clínicas de insuficiencia respiratoria aguda
Insuficiencia respiratoria hipercápnica de la enfermedad pulmonar obstructiva crónica
La IR hipercápnica secundaria a la EPOC agudizada es la más frecuente en la práctica diaria hospitalaria. Dado que el principal mecanismo responsable de hipoxemia arterial son los desequilibrios VA/Q16, está recomendado el uso de fuentes de oxígeno tipo Venturi a baja concentración (24-28%), que en general será suficiente para que la PaO2 aumente hasta valores aceptables. Además, dado que en pacientes con hipercapnia crónica el principal estímulo del centro respiratorio es la hipoxia, hay que evitar una excesiva corrección de la hi-
poxemia arterial, que podría causar depresión asociada del centro respiratorio. Además, hay que tratar los factores desencadenantes o agravantes de la agudización, si están presentes.
Hay situaciones clínicas con aumento de la gravedad en que la oxigenoterapia puede ser insuficiente como medida de soporte de la IR. En general, ello se da cuando: a) la hipoxemia arterial no se corrige hasta unos niveles aceptables con fuentes convencionales de oxígeno, y b) los pacientes desarrollan acidosis respiratoria, ya sea a la llegada al área de urgencias o bien una vez iniciado el tratamiento convencional, siendo la oxigenoterapia el principal desencadenante de la aparición de la acidosis respiratoria. En estos casos se indicará el soporte ventilatorio según los criterios descritos en la figura 3.
Ventilación no invasiva
La VNI se aplicará preferentemente con modalidades cicladas por presión (tipo BiPAP o presión de soporte), junto con suplementos de oxígeno a baja concentración (hasta un 30-35% como máximo). Durante las primeras 24-48 h es conveniente mantener la VNI el máximo tiempo posible para mejorar la eficacia del tratamiento, aunque se puede interrumpir para la nebulización de fármacos o para descansar. La principal indicación de la VNI en esta situación clínica es evitar la intubación traqueal y la necesidad de ventilación mecánica invasiva, así como mejorar la disnea. El parámetro predictor más importante de éxito de la VNI es la mejoría de la acidosis respiratoria en las primeras horas de la aplicación de la VNI. A partir de las 24-48 h, en función de la evolución clínica y gasométrica, se puede iniciar la retirada intermitente de la VNI si desaparece la acidosis respiratoria en respiración espontánea, primero durante el día manteniendo el soporte ventilatorio nocturno durante algunos días más hasta su completa retirada.
Ventilación mecánica invasiva
En general, se necesitan cifras poco elevadas de FiO2, frecuencia respiratoria y volumen corriente para minimizar la hiperinsuflación dinámica y la PEEP intrínseca durante las primeras horas de ventilación mecánica. Después de la estabilización de los pacientes, es frecuente que sea necesaria una retirada progresiva de la ventilación mecánica, también denominado weaning. En esta fase en general, es recomendable el uso de cifras moderadas de PEEP para facilitar los esfuerzos inspiratorios espontáneos de los pacientes, así como el uso de modalidades de soporte ventilatorio parcial, como la ventilación con presión de soporte. Asimismo, es recomendable hacer intentos diarios de retirada de la ventilación mecánica mediante pruebas de respiración espontánea con oxígeno en «T» tipo Venturi.
Insuficiencia respiratoria hipercápnica por asma aguda grave
En las fases iniciales se puede instaurar oxigenoterapia con fuentes tipo Venturi a concentración variable (24-28%). Es un signo de gravedad el aumento de la PaCO2 y la disminución del pH arterial. Además, está indicado el tratamiento con broncodilatadores inhalados y corticoides. En situaciones graves, la VNI es poco eficaz y hay que instaurar la ventilación mecánica invasiva si la evolución clínica es desfavorable. En este último caso hay que extremar las medidas de prevención del barotrauma (neumotórax) con una monitorización muy cuidadosa de los valores de PEEP intrínseca, el uso de volumen corriente y la frecuencia respiratoria baja para minimizar la hiperinsuflación pulmonar dinámica, así como sedación y analgesia a dosis altas acompañadas, si es necesario, de paralización muscular. En general, la retirada de la ventilación mecánica suele ser menos dificultosa que en la EPOC, aunque el uso de dosis elevadas de corticoides y relajantes musculares puede causar una miopatía que dificulte la retirada de la ventilación mecánica y la recuperación del estado general.
Insuficiencia respiratoria hipercápnica con parénquima pulmonar sano
Especialmente en intoxicaciones de fármacos depresores del centro respiratorio (opiáceos, sedantes). En este caso, el grado de coma guiará las indicaciones clínicas. La indicación de oxígeno está limitada por el hecho de que, en el coma profundo, la prioridad es la utilización de ventilación mecánica a FiO2 baja para la protección de las vías aéreas y mejorar la ventilación alveolar. Si el nivel de conciencia es aceptable, se pueden utilizar mascarillas de alto flujo a baja concentración (24%) o lentillas nasales. Si los pacientes han presentado una broncoaspiración pueden presentar hipoxemia arterial grave que precisa FiO2 elevada.
En pacientes con síndrome de apneas durante el sueño, está indicada la aplicación de presión positiva continua sobre la vía aérea alta con el uso de CPAP nasal o VNI en situaciones de agudización. En la IRA asociada a trastornos neuromusculares puede ser necesario el uso de VNI a través de mascarilla nasal o bien ventilación invasiva, si la situación es más grave. El uso de oxígeno seguirá una pauta parecida a la IR hipercápnica de la EPOC.
Insuficiencia respiratoria no hipercápnica en enfermedades pulmonares crónicas
En este caso se incluyen pacientes con EPOC sin retención de CO2, bronquiectasias difusas bilaterales y lesiones residuales extensas de tuberculosis pulmonar antigua. La administración de oxígeno seguirá pautas parecidas a la EPOC agudizada con IRA hipercápnica, aunque hay menos restricción al uso de FiO2 elevadas con sistema Venturi. Las indicaciones de VNI y de ventilación mecánica invasiva también son parecidas, aunque en este caso hay que esperar menor eficacia de la VNI que en pacientes con IR hipercápnica. En las crisis de asma bronquial, en general se puede utilizar oxígeno con máscara tipo Venturi con FiO2 más elevada (hasta un 50%) si es necesario, junto con el tratamiento de la enfermedad de base. Los criterios de intubación traqueal son los mismos que en el asma aguda grave con hipercapnia. En las enfermedades intersticiales difusas, además de las máscaras Venturi con FiO2 elevada puede ser necesario el uso de máscaras de alta concentración con reservorio si hay hipoxemia muy grave. En general, la VNI y la intubación traqueal son poco recomendadas en las enfermedades intersticiales, a causa de los pobres resultados clínicos y la elevada mortalidad asociada.
Insuficiencia respiratoria no hipercápnica en enfermedades pulmonares agudas
Diversas enfermedades pueden causar IRA no hipercápnica sin enfermedades pulmonares crónicas de base. En el edema pulmonar cardiogénico, el oxígeno a alta concentración (con sistema Venturi o con bolsa-reservorio) es necesario con frecuencia, junto con el tratamiento de la enfermedad de base. En este caso, el uso de CPAP y la VNI con alta concentración de oxígeno pueden mejorar los resultados clínicos, en especial con una resolución más rápida del cuadro agudo y una disminución de las necesidades de intubación traqueal y ventilación mecánica invasiva. Los criterios de intubación traqueal no son diferentes que en otras enfermedades. En ventilación mecánica, se recomienda el uso de valores moderados de PEEP para facilitar la función del ventrículo izquierdo y para facilitar la reabsorción del edema alveolar hacia el intersticio pulmonar.
En las neumonías graves, se pueden utilizar fuentes de oxígeno tipo Venturi a la concentración necesaria para normalizar la saturación arterial de hemoglobina o mascarillas de alta concentración con bolsa-reservorio. La VNI se puede utilizar cuando no se corrige la hipoxemia arterial si no hay criterios inmediatos de intubación traqueal, aunque los resultados favorables solamente se han demostrado en el caso de pacientes con EPOC de base, en especial si la IR es hipercápnica. Si es necesaria la intubación traqueal, en general, hace falta utilizar valores variables de PEEP para una correcta oxigenación arterial. Medidas adyuvantes para mejorar la oxigenación arterial en situación de hipoxemia refractaria cuando los infiltrados son de predominio en un pulmón son las medidas posturales, como el decúbito lateral del lado menos condensado, aunque no hay ninguna evidencia de que éstas mejoren el pronóstico de los pacientes.
En el SDRA, el manejo de la oxigenoterapia y los resultados de la VNI son similares a los pacientes con neumonía, aunque en general la eficacia de estas medidas es menor y el número de pacientes que deberán ser intubados es mayor. El manejo de la ventilación mecánica en el SDRA tiene una serie de particularidades que hay que tener en cuenta: a) es recomendable utilizar valores elevados de PEEP (en general >= 10 cmH2O) para conseguir una correcta oxigenación arterial y disminuir el colapso alveolar espiratorio, así como minimizar el ciclo continuado de colapso alveolar espiratorio-reclutamiento alveolar inspiratorio, y b) una limitación del volumen corriente con valores entre 6-8 ml/kg de peso ideal, que permita limitar el valor de presiones en las vías aéreas y el parénquima pulmonar para prevenir, junto con las cifras elevadas de PEEP, el daño pulmonar inducido por la ventilación mecánica. Medidas adyuvantes en caso de hipoxemia refractaria de riesgo vital que no mejora con las medidas convencionales son: a) la posición de decúbito prono, que permite una mejoría del intercambio de gases en una gran proporción de pacientes y podría disminuir, también, el daño pulmonar inducido por la ventilación mecánica a través de una distribución más homogénea de la ventilación pulmonar, y b) el uso de óxido nítrico (NO) inhalado, un potente vasodilatador selectivo de la circulación pulmonar cuando se administra por vía inhalatoria, que solamente llega a las unidades alveolares parcial o totalmente ventiladas, disminuyendo el grado de shunt intrapulmonar, aunque ningún estudio clínico ha demostrado mejoría del pronóstico de los pacientes que han sido tratados con esta medida.