Diagnosticada de carcinoma ductal infiltrante en noviembre de 2008. En febrero de 2009 se realizó tumorectomía con biopsia selectiva del ganglio centinela y oncoplastia, con el diagnóstico de carcinoma ductal infiltrante triple negativo. Recibió quimioterapia adyuvante con antraciclinas y ciclofosfamida, seguida de radioterapia.
En mayo de 2011 presentó recaída a distancia con afectación pulmonar, ganglionar y ósea, motivo por el que inició quimioterapia dentro de ensayo clínico TRIO.
En RM de enero 2012 se observó la aparición de metástasis cerebral, carcinomatosis dural y metástasis durales focales frontal izquierda y en órbita izquierda con exoftalmos izquierdo secundario. Inició 40Gy de radioterapia holocraneal.
En marzo de 2012 inició doxorubicina liposomal y ciclofosfamida. Ingresó después del cuarto ciclo por neutropenia y trombocitopenia febril. Se inició tratamiento con antibióticos de amplio espectro y factor estimulante de las colonias granulocíticas (1 vial/día), permaneciendo afebril.
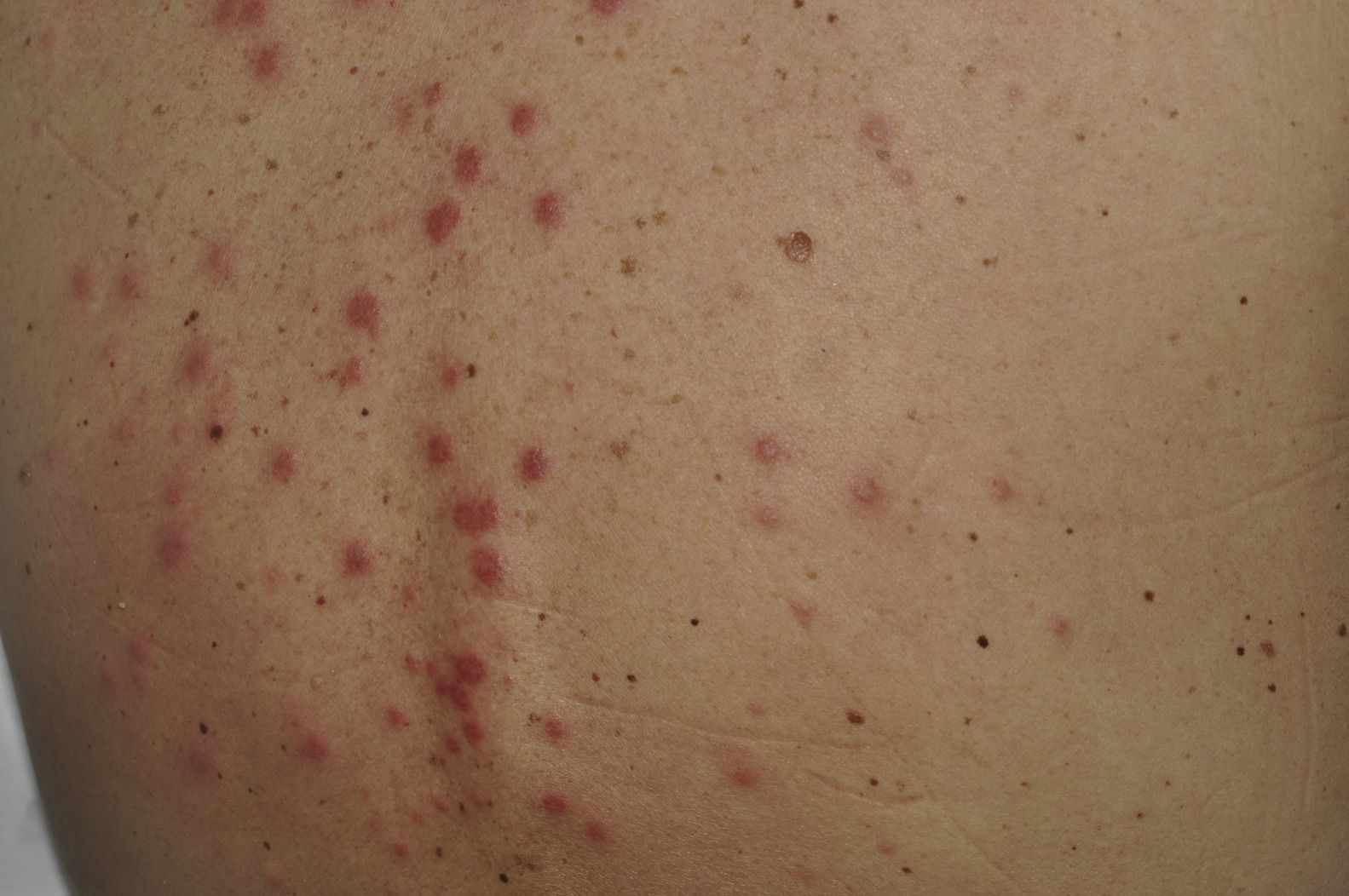
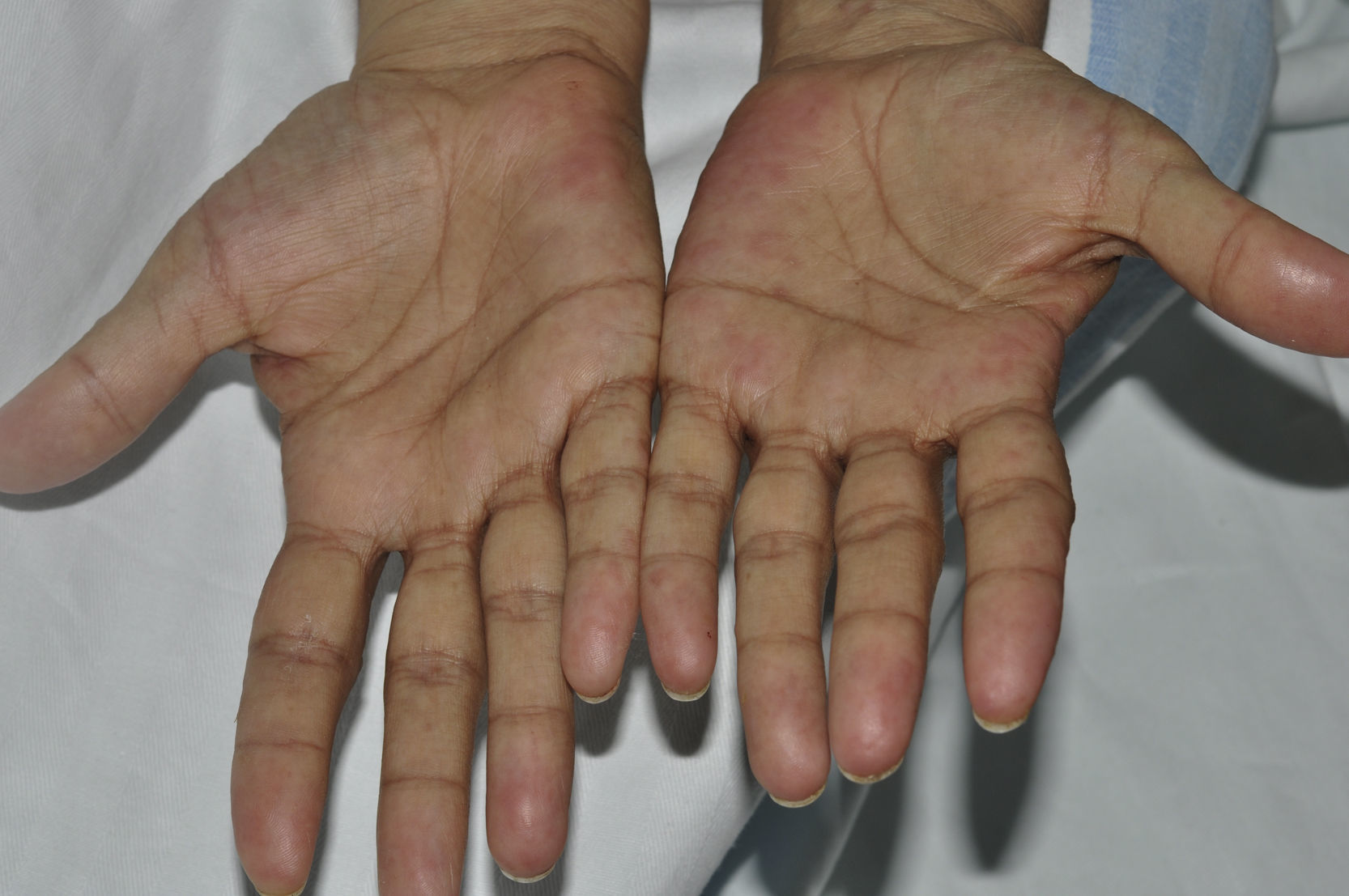
A los 10 días de hospitalización y en el contexto de un nuevo pico febril, le aparecieron lesiones eritematosas, pruriginosas, inicialmente en cara anterior del tórax, seguidas de la afectación de zona dorsal, parte más proximal de las extremidades superiores y región tenar de ambas palmas de las manos. En la exploración física se encontraron múltiples pápulas y placas eritematoedematosas en dorso de manos, zona tenar palmar, tórax y espalda (figs. 1 y 2), coincidiendo con la fiebre y recuperación de los neutrófilos (cifra absoluta de neutrófilos de 3×103/mm3 el día de la aparición de las lesiones, y de 60 el día del ingreso). Se hizo punch-biopsia cutánea de 4mm y se inició tratamiento con prednisona, 60mg/día.
ComentariosLas lesiones cutáneas en un paciente neoplásico avanzado no son infrecuentes, sobre todo en neoplasias de mama y melanomas. En el caso estudiado, teniendo en cuenta el contexto, la primera opción a descartar fue el síndrome de Sweet, que se confirmó en la biopsia con la presencia de una dermatitis neutrofílica.
El síndrome de Sweet es una dermatosis neutrofílica febril aguda. Su forma clásica aparece después de una infección gastrointestinal o respiratoria. Hasta un 20% de los casos se asocian a neoplasia maligna1, apareciendo más frecuentemente relacionado con la leucemia mieloide aguda, pero hasta un 15% de los casos se asocia con tumores sólidos; aunque su incidencia sigue aumentado2. Otra forma de presentación puede ser secundaria al uso de determinados fármacos, siendo el factor estimulante de colonias granulocíticas (G-CSF) uno de los principales implicados3, del cual existe algún caso publicado en la literatura médica4. El G-CSF participa en la patogenia del síndrome de Sweet, propiciando la proliferación y diferenciación de los neutrófilos, provocando una vasculitis y una dermatosis cutánea propia de las lesiones cutáneas típicas de este síndrome. En cuanto al tratamiento, el uso de los corticoides sistémicos sigue siendo el gold standard, existiendo una rápida remisión de las lesiones cutáneas, aunque en algunos casos la resolución puede ser espontánea en semanas o meses. En los casos paraneoplásicos su resolución es más lenta y el control de la neoplasia sólida conduce a la desaparición de las lesiones cutáneas.
Retomando el caso, se trata de una mujer con neoplasia de mama avanzada, con múltiples líneas de tratamiento, que en el curso de una neutropenia febril, ingresa y recibe G-CSF, resolviéndose la neutropenia y la fiebre, pero a los pocos días, coincidiendo con la recuperación de los neutrófilos, presenta un nuevo pico febril y la aparición de múltiples pápulas y placas eritematoedematosas en dorso de manos, zona tenar palmar, tórax y espalda. Por las características clínicas se trata de un síndrome de Sweet, la etiología del cual es atribuible tanto a un proceso paraneoplásico en el contexto de una neoplasia de mama avanzada, como al uso de G-CSF, uno de los principales fármacos implicados en el desarrollo de dicho síndrome. No obstante, la asociación con malignidad puede reforzarse por la utilización de G-CSF5.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.