Tradicionalmente, el dolor ha sido y sigue siendo un fenómeno frecuente y temido relacionado con el cáncer. El dolor irruptivo es una entidad vinculada al dolor crónico oncológico que se conoce desde hace tiempo, pero que ha tenido una diferente consideración según el contexto en el que se haya estudiado. En los últimos años se ha hecho un importante esfuerzo colaborativo para definirlo, caracterizarlo, conocer su prevalencia y efectuar un abordaje terapéutico individualizado, que ha culminado con el metaanálisis de 2014. Las características que lo definen requieren que haya un dolor crónico de base, bien controlado con analgesia pautada y que aparezcan episodios de exacerbación de este, con o sin desencadenante identificado. Los datos epidemiológicos sugieren que entre un tercio y la mitad de los pacientes lo van a padecer durante la evolución de su proceso oncológico.
Pain has traditionally been a common and dreaded phenomenon in cancer and continues to be so. Breakthrough pain is an entity related to chronic cancer pain that was first recognized some time ago. However, depending on the context in which it has been studied, breakthrough pain has been viewed from distinct perspectives. In the last few years, major efforts have been made to define and characterize breakthrough pain from a multidisciplinary perspective, determine its prevalence, and provide an individualized therapeutic approach, culminating with a meta-analysis in 2014. The criteria for breakthrough pain are the presence of background pain that is well controlled with scheduled background analgesia and episodes of pain exacerbations with or without an identified trigger. The data suggest the at least one out of every two cancer patients (nearly one in three) will experience breakthrough pain at some time during the course of their disease.
Tradicionalmente, el dolor ha sido, y sigue siendo, uno de los síntomas más temidos y molestos por los pacientes con cáncer. Las razones las encontramos en su extraordinaria frecuencia, especialmente en fases avanzadas de la enfermedad. Estudios relativamente antiguos notificaban la incidencia en rangos amplios, aunque de frecuencia elevada, en torno al 50-80%1–3. En comunicaciones más recientes se reportan cifras que son algo inferiores, del 24-60%, en poblaciones en tratamiento activo4–7, y mayor incidencia, del 60-90%, en población con enfermedad avanzada o en fase terminal8–12. Estas cifras hablan por sí solas de la magnitud del problema, máxime teniendo en cuenta la elevada prevalencia y mejoría en las cifras de supervivencia por cáncer en nuestra época13.
El alivio sintomático del dolor se puede alcanzar en un buen número de pacientes siguiendo las directrices establecidas en las diferentes guías clínicas, como las de la Organización Mundial de la Salud y las elaboradas por diferentes sociedades científicas de cuidados paliativos o de oncología14–16. No obstante hay un elevado porcentaje de pacientes que sufren síndromes dolorosos de difícil manejo, con un típico patrón temporal de agudización17. El dolor irruptivo (DI) está firmemente establecido como un factor de riesgo para un mal control analgésico en enfermos de cáncer18–21. Se estima una incidencia de DI en rango variable del 40-80% según diferentes encuestas. Estas amplias diferencias pueden deberse tanto a la propia definición del DI como al contexto en el que estas encuestas están elaboradas17,22–24. En una encuesta internacional sobre características y diferentes síndromes dolorosos en pacientes con cáncer se encontraron grandes diferencias en la caracterización del DI por parte de los profesionales a lo largo de los distintos países, sugiriéndose la idea de que este se diagnostica de manera diferente en cada nación18.
Prevalencia del dolor oncológicoLa presencia del dolor y su inadecuado manejo en enfermos de cáncer se ha documentado de manera extensa25–28. En 2007 se publicó un metaanálisis que incorporó 52 estudios, con una población representativa de enfermos oncológicos en diferentes situaciones clínicas: después de un tratamiento curativo, durante tratamiento antitumoral, pacientes con enfermedad metastásica y enfermos terminales. En este trabajo se comprobó que la prevalencia es variable en función de la definición empleada de dolor, pero que en cualquier caso es superior al 50% en todos los tipos de cáncer analizados; destaca por su elevada prevalencia el dolor en pacientes con cáncer de cabeza y cuello (70%). En 2 revisiones sistemáticas recientes, las cifras de dolor se disparan a rangos del 62-86% en estadios avanzados de la enfermedad (prevalencia media del 71%)6,29.
Las estimaciones realizadas sobre el infratratamiento del dolor en pacientes con cáncer oscila en cifras en torno al 25-43% a nivel global30,31.
Dolor no relacionado con cáncer en pacientes oncológicosNo hay muchos datos publicados en la literatura médica sobre la prevalencia del dolor crónico no oncológico en enfermos de cáncer. En un estudio de cribado del dolor publicado en 2012, los autores documentaban que, entre los pacientes con dolor crónico con intensidad moderada o grave (EVA 4-10), hasta un 45% no recibía tratamiento para el dolor con analgésicos opioides, por lo que se supuso que una de las posibles causas de ese infratratamiento fuera su consideración de no relacionado con el cáncer32,33.
Una auditoría llevada a cabo en el mismo año en la provincia canadiense de Ontario, para evaluar los registros de dolor en centros oncológicos, demostró que al menos el 8% de los casos documentados se refería a dolor no relacionado con cáncer, con un 5% adicional de pacientes que indicó que el dolor que padecía era de tipo crónico y un 2% tratado de manera no específica en dichos centros oncológicos. Esto hace complicado discernir si ese 7% de pacientes presentaba dolor por cáncer, lo que elevaba la posibilidad de que entre un 8 y un 15% de los pacientes con dolor moderado o intenso no presentara dolor relacionado con cáncer, sino por otras patologías. Esto podría ser un factor de confusión en los estudios epidemiológicos, que lleve a una sobreestimación de las cifras. En cualquier caso, la proporción de pacientes con dolor crónico, sea relacionado con cáncer o no, que no recibe tratamiento adecuado sigue siendo elevada34.
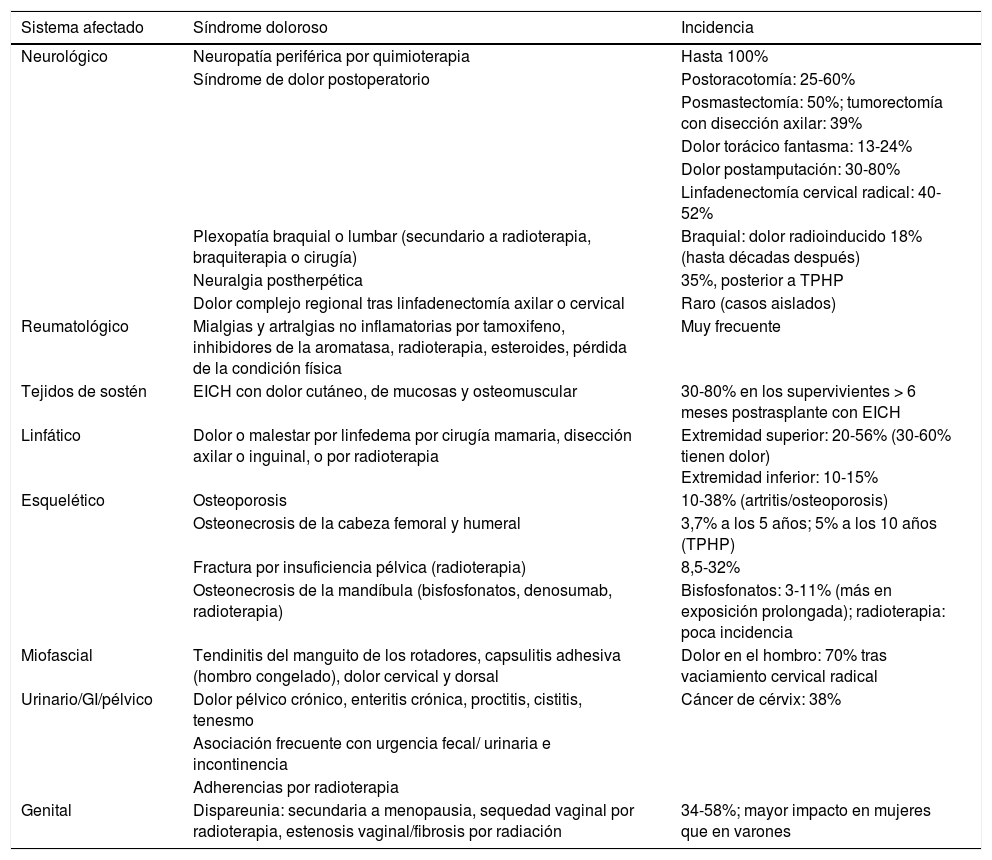
Dolor secundario al tratamiento oncológicoEl dolor es un problema habitual en los supervivientes de cáncer, sobre todo los primeros años posteriores al tratamiento recibido sea cual sea la naturaleza de este (cirugía, irradiación, citostáticos, trasplante de progenitores hematopoyéticos [TPHP], hormonales, etc.). Aunque en la práctica no hay estudios completos sobre la prevalencia de dolor persistente en esta población, hay estudios de cohortes que están actualmente en fase de desarrollo35,36, y en alguna publicación se identifica algún síndrome doloroso que interfiere con el desempeño cotidiano hasta en un tercio de los pacientes que han superado un cáncer37. Se encuentra una mayor incidencia en algunas patologías, como cáncer de mama, debido a su elevada frecuencia y a sus elevadas tasas de curación y/o largos períodos de supervivencia. Los factores clínicos que pueden asociarse con problemas de dolor en supervivientes varían en función del tipo de tumor, su invasividad local, la(s) modalidad(es) de tratamiento recibido, el tiempo transcurrido desde su finalización, las comorbilidades previas y el manejo inicial del dolor, tanto el ocasionado por el tumor como el surgido por el tratamiento35. Cualquier intervención terapéutica es susceptible de ocasionar dolor, con un enfoque para su tratamiento análogo al empleado para otras modalidades de dolor crónico. La tabla 1 resume los posibles síndromes de dolor crónico que pueden presentar los pacientes tratados por cáncer en sus diferentes modalidades de tratamiento. En la tabla 2 se muestran, por sistemas, una serie de síndromes dolorosos descritos en supervivientes de cáncer.
| Cirugía |
| Neuralgia intercostal |
| Neuromas |
| Miembro fantasma |
| Dolor postoracotomía |
| Dolor por disección cervical |
| Dolor posmastectomía |
| Dolor relacionado con implantes y/o reconstrucción mamaria |
| Linfedema |
| Radioterapia |
| Opresión/dolor torácico |
| Fibrosis cutánea/miofascial |
| Cistitis |
| Enteritis/proctitis |
| Esofagitis |
| Formación de fístulas |
| Formación de adherencias (digestivas, genitourinarias, otras) |
| Mielopatía |
| Plexopatías |
| Compresión de nervios periféricos |
| Osteonecrosis rádica |
| Fracturas óseas |
| Hormonoterapia |
| Artralgias/mialgias |
| Calambres musculares/espasmos |
| Síndrome del túnel carpiano |
| Dedo en gatillo |
| Quimioterapia |
| Artralgias/mialgias |
| Osteoporosis |
| Osteonecrosis |
| Neuropatía periférica |
| Calambres musculares |
| Esteroides |
| Osteoporosis |
| Osteonecrosis (necrosis avascular en cabeza femoral, humeral o en la rótula) |
| Bisfosfonatos |
| Osteonecrosis mandibular |
| Trasplante de progenitores hematopoyéticos (enfermedad crónica injerto contra huésped) |
| Dolor abdominal, adherencias gastrointestinales |
| Artralgias/mialgias |
| Contracturas dolorosas y pérdida de movilidad |
| Úlceras corneales, sequedad y quemazón ocular |
| Cistitis |
| Eritema |
| Dolor retroesternal esofágico por úlceras |
| Fibrosis/esclerodermia con contracturas dolorosas y pérdida de movilidad |
| Infecciones |
| Inflamación/edema |
| Inflamación, adelgazamiento, estrechamiento y ulceración de mucosas (oral, GI, vaginal) |
| Calambres musculares |
| Neuropatía periférica |
| Osteonecrosis articular |
GI: gastrointestinales.
| Sistema afectado | Síndrome doloroso | Incidencia |
|---|---|---|
| Neurológico | Neuropatía periférica por quimioterapia | Hasta 100% |
| Síndrome de dolor postoperatorio | Postoracotomía: 25-60% | |
| Posmastectomía: 50%; tumorectomía con disección axilar: 39% | ||
| Dolor torácico fantasma: 13-24% | ||
| Dolor postamputación: 30-80% | ||
| Linfadenectomía cervical radical: 40-52% | ||
| Plexopatía braquial o lumbar (secundario a radioterapia, braquiterapia o cirugía) | Braquial: dolor radioinducido 18% (hasta décadas después) | |
| Neuralgia postherpética | 35%, posterior a TPHP | |
| Dolor complejo regional tras linfadenectomía axilar o cervical | Raro (casos aislados) | |
| Reumatológico | Mialgias y artralgias no inflamatorias por tamoxifeno, inhibidores de la aromatasa, radioterapia, esteroides, pérdida de la condición física | Muy frecuente |
| Tejidos de sostén | EICH con dolor cutáneo, de mucosas y osteomuscular | 30-80% en los supervivientes > 6 meses postrasplante con EICH |
| Linfático | Dolor o malestar por linfedema por cirugía mamaria, disección axilar o inguinal, o por radioterapia | Extremidad superior: 20-56% (30-60% tienen dolor) Extremidad inferior: 10-15% |
| Esquelético | Osteoporosis | 10-38% (artritis/osteoporosis) |
| Osteonecrosis de la cabeza femoral y humeral | 3,7% a los 5 años; 5% a los 10 años (TPHP) | |
| Fractura por insuficiencia pélvica (radioterapia) | 8,5-32% | |
| Osteonecrosis de la mandíbula (bisfosfonatos, denosumab, radioterapia) | Bisfosfonatos: 3-11% (más en exposición prolongada); radioterapia: poca incidencia | |
| Miofascial | Tendinitis del manguito de los rotadores, capsulitis adhesiva (hombro congelado), dolor cervical y dorsal | Dolor en el hombro: 70% tras vaciamiento cervical radical |
| Urinario/GI/pélvico | Dolor pélvico crónico, enteritis crónica, proctitis, cistitis, tenesmo | Cáncer de cérvix: 38% |
| Asociación frecuente con urgencia fecal/ urinaria e incontinencia | ||
| Adherencias por radioterapia | ||
| Genital | Dispareunia: secundaria a menopausia, sequedad vaginal por radioterapia, estenosis vaginal/fibrosis por radiación | 34-58%; mayor impacto en mujeres que en varones |
EICH: enfermedad injerto contra huésped; GI: gastrointestinal; TPHP: trasplante de progenitores hematopoyéticos.
Diferentes revisiones sitúan la prevalencia del dolor en supervivientes de cáncer en torno a un 40%38, pero existe un cierto sesgo de selección en las encuestas empleadas en cuanto al tiempo desde la finalización del tratamiento, pues el dolor disminuye conforme transcurre el tiempo y los diferentes tejidos dañados por el tratamiento reparan el daño ocasionado. Así, en una gran encuesta llevada a cabo en Estados Unidos en más de 10.000 adultos supervivientes de cáncer infantil, con una mediana de seguimiento de 16,5 años, el 21% de los encuestados presentaba dolor en la semana previa, que ellos consideraban atribuible al cáncer o al tratamiento recibido por este; solo el 11% refirió dolor de intensidad media o alta39. Similar a este trabajo, una encuesta realizada en Australia con supervivientes a los 5 años del diagnóstico arrojaba cifras de intensidad como «bastante o mucho dolor» en el 6% de los pacientes, con un 4% que admitió que ese dolor provocaba una interferencia en su vida cotidiana40. La prevalencia del dolor es diferente en función de la patología estudiada, y es mucho más alta entre las supervivientes de cáncer de mama, donde el 30-42% de las pacientes refieren dolor por encima de la media en largos seguimientos, que es de mayor entidad en mujeres más jóvenes o que hayan recibido radioterapia41,42.
El dolor no suele ser un síntoma aislado y los supervivientes suelen referir otra serie de síntomas molestos o invalidantes43,44. Al año del diagnóstico, hasta el 90% de los pacientes encuestados continúan refiriendo síntomas relacionados con el cáncer y/o el tratamiento36. Una cuarta parte de los pacientes se podrían clasificar como portadores de alta carga sintomática; el dolor, la depresión y la astenia son los factores que más impactan en la calidad de vida de estos pacientes. En el estudio australiano anteriormente referido destacaban como síntomas más prevalentes el insomnio (13,1%), el cansancio (12,9%) y los problemas de memoria (8,8%). El 18% presentaba 2 o más de estos síntomas40. En un estudio danés entre las supervivientes de cáncer de mama, aparte de dolor crónico (29%), las pacientes también referían parestesias (47%), edema locorregional (25%) o sensaciones de miembro fantasma (19%), entre otros síntomas42. Además de estos síntomas múltiples, la diversidad de síndromes dolorosos por cáncer, como los mostrados en la tabla 1, pueden constituir una gran dificultad a la hora de instaurar un tratamiento.
Dolor irruptivoEl DI comúnmente se describe como una exacerbación transitoria del dolor que ocurre, bien espontáneamente, bien en relación con un desencadenante conocido o no, pese a padecer un dolor crónico estable y bien controlado. Los primeros trabajos que hacen referencia a esta entidad se publican a finales de la década de los ochenta del siglo pasado, identificando un fenómeno que se intuía frecuente pero escasamente estudiado en los enfermos con cáncer y que afectaba negativamente al éxito terapéutico en el control del dolor crónico17,46.
Los posteriores estudios realizados, tanto epidemiológicos como clínicos, no han sido homogéneos en su definición de DI, y se han descrito diferentes condiciones en cuanto a intensidad del dolor basal, analgesia pautada habitual e intensidad de los episodios de DI. En algunos estudios, los episodios de agudización del dolor se han reseñado independientemente de la analgesia de base (p. ej., diferente uso de opioides débiles o dosis bajas de opioides mayores)47. En otros estudios no se ha discriminado de manera unívoca entre dolor crónico de base y DI48. Para poder establecer una terminología común inequívoca es preceptivo optimizar el tratamiento analgésico de base antes de poder hablar de DI49. La variabilidad antes mencionada en la selección de pacientes se ha identificado como factor de confusión en varios ensayos clínicos, en los que la variación en la intensidad de un dolor de moderada intensidad se ha confundido con episodios de DI47,50,51. En una encuesta llevada a cabo en población oncológica en países del norte de Europa, con una definición estandarizada de DI, en el 44% de los pacientes se diagnosticó DI relacionado con desencadenantes identificados, un 39% lo presentaba de manera idiopática y un 17% por la combinación de ambos. La intensidad del episodio era grave en el 60% de los encuestados, siendo en un 40% moderado o leve; la mayoría de los pacientes tenía un dolor leve de base. Este estudio no es informativo para prevalencia en población general52.
El fenómeno del DI en dolor crónico no oncológico se tratará como un epígrafe aparte al final de este artículo, debido a sus especiales características y a las controversias que puede suscitar su manejo e incluso su propia consideración como entidad real53,54.
Dolor irruptivo oncológicoEl DI oncológico (DIO) se ha definido por la Association for Palliative Medicine of Great Britain and Ireland task group como «una agudización transitoria del dolor que sucede espontáneamente o en relación con un desencadenante específico, predecible o no, pese a un dolor crónico relativamente estable y adecuadamente tratado»55, definición que comparte la European Association for Palliative Care en su documento de consenso sobre el manejo de opioides para el tratamiento del dolor oncológico15.
En los últimos años ha progresado mucho el conocimiento y estudio del DIO y ha aumentado el número de publicaciones en esta área. Una búsqueda en PubMed con los términos de búsqueda «breakthrough cancer pain» arroja 617 referencias. Destacan, por su relevancia, las referentes a la terapéutica con preparaciones que mimetizan en su farmacocinética las características del episodio de DIO56–61. Sin embargo, pese a la extensa bibliografía comunicada, no se conoce con seguridad su prevalencia real, con grandes variaciones en su incidencia, estimada entre diferentes estudios y circunstancias (se han comunicado cifras dentro de un amplio rango, que va del 19 al 95%)53. Dentro de las razones para tal variabilidad en las cifras comunicadas se identifican concepciones culturales, la terminología empleada, el diseño de los estudios y el diferente contexto de los pacientes. Se hace, por tanto, necesario incrementar el estudio del DIO, tanto cualitativa como cuantitativamente18,62–65.
En el año 2010 se publicó una extensa revisión, en la que se valoraron las características de la literatura científica sobre DIO hasta la fecha. En dicha revisión se llegaron a identificar 51 artículos que incluían algún tipo de definición de DIO; de estas, 42 incluyeron algún tipo de clasificación. Sin embargo, solo se detectaron 2 herramientas de identificación del DIO que hubieran sido parcialmente validadas. Las conclusiones de los autores fueron concluyentes: no existe ninguna definición, sistema de clasificación o herramienta de evaluación validada para el DI relacionado con cáncer, aunque hay una fuerte evidencia de concordancia en sus características principales. Esto eleva la necesidad de hacer un esfuerzo colaborativo internacional para desarrollar un sistema de clasificación para el DIO, con unas bases estandarizadas para la aproximación a su estudio y manejo terapéutico66.
Metaanálisis de 2014Partiendo de 2 importantes revisiones publicadas una década antes —una de la Cochrane64 en 2006 y otra de Svendsen et al67 en 2005—, ambas basadas en publicaciones hasta 2004, en 2014 se publicó un metaanálisis que se puede considerar el estudio más importante hasta la fecha en DIO68.
En este metaanálisis se seleccionaron estudios en las bases de datos médicas MEDLINE y EMBASE posteriores a los trabajos anteriores de revisión, desde enero de 2004 hasta diciembre de 2012. Los criterios de inclusión fueron: a) que fueran estudios originales, y b) que incluyeran datos sobre prevalencia del DIO en población adulta; se permitieron estudios observacionales y experimentales; se permitía la inclusión de estudios con la terminología de exacerbación o agudización del dolor. Tras filtrar los resultados según los criterios de inclusión y con un nivel de calidad válido para estudios epidemiológicos6,69,70, 33 publicaciones fueron aptas para el metaanálisis.
Se incluyeron estudios entre 1988 y 2012 representativos de diferentes áreas geográficas (India, Australia, Europa, Norteamérica), 27 de estos fueron observacionales y 6 experimentales. La media de edad de los pacientes fue de 62 años (rango, 49-73), con antecedentes de una amplia variedad de tumores (solo 2 estudios enfocados a un tipo de cáncer concreto). Aunque la definición de DI fue heterogénea entre los trabajos, todos consideraron de manera consistente principios básicos uniformes: exacerbación de un dolor preexistente, naturaleza episódica del evento, necesidad de medicación pautada en intervalo regular para el dolor basal y posibilidad de desencadenarse el evento con el movimiento. La prevalencia global del DIO fue de 59,2% (intervalo de confianza [IC] del 95%, 58,0-60,4), con amplia heterogeneidad. El análisis por subgrupos mostraba las cifras inferiores en población ambulatoria (39,9%; IC del 95%, 35,8-44,0; p = 0,098) frente a las mayores cifras diagnosticadas en unidades de hospitalización (hospice) (80,5%; IC del 95%, 77,9-83,1; p < 0,001). Aplicando una definición más laxa para DI (exacerbación de un dolor basal controlado o moderadamente controlado), la prevalencia aumenta casi en 10 puntos (68,9%; IC del 95%, 66,7-71,1). Como se podía suponer por trabajos previos, en el contexto del cáncer metastásico la prevalencia es mayor (70%) que en estadios iniciales (58,2%) (IC del 95%, 56,3-60,0), así como con dolor basal moderado (57,2%) frente a leve (49,7%). Resulta llamativo el descenso progresivo de las cifras comunicadas conforme los estudios analizados son más modernos, pasando del 75% inicial (de 1990 a 1994) al 49% de los trabajos más recientes (en 2012), aunque no son significativas en metarregresión. Probablemente, esta variación en las cifras sea consecuencia de una mejor definición del DIO y la exclusión de casos mal diagnosticados, como por ejemplo el dolor por final de dosis, que inicialmente se confundía con episodios de DI.
Dolor irruptivo no oncológicoLa definición de DI, sus características, su tratamiento y su prevalencia se han descrito de manera habitual para dolor crónico oncológico17,23,55,71. Resulta llamativa, sin embargo, la escasa presencia en la literatura médica del DI no oncológico (DINO) en aspectos como definición, prevalencia, relevancia, características y aproximación terapéutica. Incluso resulta controvertida la propia consideración como entidad dolorosa en algunas sociedades con alta preocupación por el abuso de fármacos opioides55,67,72–76.
En un estudio de Portenoy et al se sugiere que el DI en pacientes con dolor crónico tratado con analgésicos opioides puede tener características similares, tanto en DIO como en DINO72. Sin embargo, en dolor crónico no canceroso hay mayor evidencia de comportamientos adictivos o abuso de fármacos, lo que produce cierta inquietud a la hora de prescribir opioides de liberación rápida para el DINO77–80. La Alberta Breakthrough Pain Assessment Tool (una herramienta validada para el diagnóstico del DI a través de un panel internacional de expertos basado en el método Delphi) se ha tratado de aplicar para dolor crónico no oncológico, pero no ha sido validada hasta la fecha en este contexto. En este momento, no hay una definición de consenso aceptada por grupos independientes, por lo que no se puede considerar en estos momentos de manera rigurosa la presencia de DI dentro del dolor crónico no oncológico81.
Pese a estas consideraciones hay algunos trabajos que han intentado arrojar cifras que traten de aclarar cuál puede ser la magnitud del DINO. Se comunicó un trabajo en 2012 elaborado en unidades del dolor (con pacientes con dolor crónico o agudo), en el que el 66,9% de los pacientes no eran enfermos oncológicos; las cifras totales (sin discernir si DIO o DINO) fueron del 56,4% de los pacientes, y la prevalencia de DINO de un 49,5%. En este trabajo, la definición de DI aceptada fue la de exacerbación diaria del dolor. Los autores concluyen que el DI está presente de manera significativa tanto en dolor grave oncológico como por otras causas y la necesidad de validar herramientas para el diagnóstico y tratamiento del DI en enfermos con dolor transitorio no oncológico54.
ConclusionesEl dolor es uno de los síntomas más temidos de cuantos afectan a los pacientes diagnosticados de cáncer, con unos porcentajes de frecuencia que explican su consideración como el síntoma más preocupante en muchos escenarios. Desgraciadamente, pese a un tratamiento con intención curativa de la neoplasia, el dolor puede no llegar a resolverse, e incluso puede empeorar o producirse por la propia intervención terapéutica, manteniendo cifras considerables de prevalencia en muchos largos supervivientes.
El DIO ha pasado a un primer plano en la escena de los cuidados paliativos y es el tratamiento de soporte en los pacientes con cáncer. Desde las primeras descripciones formales de Portenoy en 1989, en apenas 2 décadas y media el panorama ha cambiado radicalmente. El establecimiento de una terminología de consenso y su tipificación como entidad dolorosa por sí misma han permitido una mejor comprensión de este factor de mal pronóstico del dolor, lo que conlleva, en siguiente término, el desarrollo de estrategias terapéuticas que puedan controlarlo con eficacia. Las cifras de prevalencia, si bien han sido muy variables en los diferentes trabajos comunicados, llevan a concluir que más de la mitad de los pacientes oncológicos son candidatos a presentar episodios de DIO; las cifras se acercan a 2 de cada 3 afectados por cáncer. Mayor prevalencia se identifica en pacientes con enfermedad avanzada, explicable probablemente por alguno de los siguientes factores: mayor gravedad de la enfermedad en el contexto de los cuidados paliativos, número y tamaño de los implantes metastásicos, diferentes mecanismos patogénicos del dolor y mayor sensibilidad para reconocer los síntomas por parte de los médicos paliativistas frente a otras especialidades.
Todavía hay un campo por explorar, el del controvertido DINO. Al igual que se ha llegado a un consenso por parte de diferentes grupos de estudio y sociedades para poder establecer la identidad del DIO, será necesario un esfuerzo colaborativo para definir correctamente el DINO y en qué contexto se debe considerar y elaborar una consecuente estrategia terapéutica específica. De lo contrario se corre el riesgo de retroceder décadas de normalización del uso de opioides como magníficos analgésicos, garantizando a su vez un estricto control en su empleo para un buen uso terapéutico y minimizar los riesgos de sobreutilización o abuso.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.