El delirium es un síntoma frecuente en pacientes con cáncer avanzado, a pesar de estar infradiagnosticado y por tanto no adecuadamente tratado. Su correcta identificación mediante escalas y la detección de posibles factores desencadenantes es fundamental para mejorar el control de síntomas.
ObjetivoDeterminar la prevalencia de delirium empleando Memorial Delirium Assessment Scale (MDAS) como herramienta de cribado y diagnóstico, valorar la reversibilidad de los episodios e identificar sus factores desencadenantes.
MétodoEstudio prospectivo y observacional de los pacientes diagnosticados de enfermedad oncológica avanzada, ingresados consecutivamente en una Unidad de Cuidados Paliativos (UCP), durante un período de 4 meses con seguimiento de los mismos hasta el alta o el fallecimiento. Se excluyeron pacientes con deterioro cognitivo moderado-severo y situación de últimos días. Se realizó un cribado de delirium al ingreso y semanalmente con la escala MDAS, se valoraron los posibles factores desencadenantes, el tratamiento y la reversibilidad del episodio durante la semana posterior a su detección.
ResultadosSe incluyeron 90 de los 124 pacientes oncológicos que ingresaron en el período de estudio. La prevalencia de delirium fue del 75%; el 29% de los casos se diagnosticaron al ingreso y el 71% durante el mismo, siendo el subtipo mayoritario el hipoactivo (56%). Un 73% de los episodios constituyeron un evento terminal y el 27% revirtió o mejoró. Los principales factores precipitantes fueron fármacos (98,8%): opioides, esteroides y benzodiacepinas; seguido de infecciones (46%) y deshidratación (28%). El principal factor predisponente fue el antecedente de depresión/ansiedad/insomnio (72%). La hipercalcemia fue más frecuente en pacientes con delirium reversible (p=0,04). El tratamiento primordial fue la hidratación (69%), seguido de disminución de fármacos, antibióticos y rotación de opioides, siendo esta más habitual en los pacientes que ingresaron en delirium (p=0,003). Los principales fármacos administrados fueron haloperidol (81%), midazolam (81%) y levomepromazina (54%); estos dos últimos con mayor frecuencia en pacientes que fallecieron en situación de delirium. El exitus se produjo en el 95,5% de los pacientes con delirium frente al 65% de los pacientes sin delirium (p < 0,001), sin diferencias entre ellos en la estancia media.
ConclusionesEl delirium es un síntoma prevalente en los pacientes oncológicos hospitalizados en una UCP y su principal desencadenante son fármacos. La resolución del episodio es más frecuente en pacientes con hipercalcemia. La reversibilidad en nuestra muestra es inferior a la de otras series, posiblemente debido al alto porcentaje de pacientes que ingresaron en situación de delirium y fallecieron en el contexto de ese mismo episodio.
Delirium is a common symptom in patients with advanced cancer, despite being under diagnosed and therefore not appropriately treated. Its correct identification using scales and the detection of the possible risk factors is critical to improve symptoms control.
ObjectiveTo determine the prevalence of delirium using the Memorial Delirium Assessment Scale (MDAS) as a screening and diagnostic tool, to assess the reversibility of episodes and to identify its risk factors.
MethodProspective and observational study of patients diagnosed with advanced oncologic disease, consecutively admitted to a Palliative Care Unit (PCU), during a period of 4 months with follow-up of same until discharge or death. Patients with moderate-severe cognitive impairment and agony status were excluded. Delirium screening was performed on admission and weekly with the MDAS scale. The possible risk factors, treatment and reversibility of the episode during the week after its detection were assessed.
ResultsWe included 90 of the 124 oncology patients who were hospitalized during the study period. The prevalence of delirium was 75%, 29% of the cases were diagnosed on admission, and 71% were diagnosed during admission, with the majority subtype being hypoactive (56%). Seventy-three percent of the episodes constituted a terminal event and 27% were reversed or improved. The main precipitating factors were drugs (98.8%): opioids, steroids and benzodiazepines; followed by infections (46%) and dehydration (28%). The main predisposing factor was a history of depression/anxiety/insomnia (72%).
Hypercalcaemia was more frequent in patients with reversible delirium (P=.04). The primary treatment was hydration (69%), followed by a reduction of drugs, antibiotics and rotation of opioids, which is more common in patients admitted in delirium (P=.003). The main drugs administered were haloperidol (81%), midazolam (81%) and levomepromazine (54%); the latter two drugs more frequently in patients who died in delirium. Exitus occurred in 95.5% of patients with delirium compared to 65% of patients without delirium (p <0.001), with no difference in either group in the length of stay.
ConclusionsDelirium is a prevalent symptom in oncology patients hospitalized in a PCU and its main risk factors are drugs. The episode is more frequently resolved in patients with hypercalcaemia. The reversibility in our sample was lower than in other series, possibly due to the high percentage of patients diagnosed with delirium on admission and who died during the same episode.
El delirium es la complicación neuropsiquiátrica más frecuente en pacientes con cáncer avanzado, con una prevalencia en torno al 26-62% al ingreso en unidades de cuidados paliativos (UCP) que se incrementa hasta un 88% en situación de últimos días (SUD)1. Se ha comprobado que el subtipo hipoactivo es el más prevalente en el ámbito de los cuidados paliativos, en ocasiones difícil de distinguir de trastornos del ánimo, efectos secundarios o sintomatología asociada a la evolución de la enfermedad.
Estudios prospectivos sugieren una etiología multifactorial2-5, de forma que un 30-50% de estas situaciones son potencialmente reversibles, de ahí la importancia de su identificación prematura6. Entre estos factores destacan la edad, el deterioro cognitivo, la enfermedad orgánica cerebral, alteraciones metabólicas, anemia, infecciones y gran cantidad de fármacos. Además, el delirium ha sido identificado por la mayor parte de los autores2,6 como un claro factor de mal pronóstico, asociado a una disminución de la supervivencia7; de forma que el delirium refractario es una de las principales causas de sedación paliativa.
El diagnóstico de delirium es eminentemente clínico en base a criterios establecidos en el Diagnostic and Statistical Manual of Mental Disorders (DSM-5). Disponemos de herramientas de cribado como Confusion Assessment Method (CAM), escalas para detección de deterioro cognitivo, como el Mini-Mental State Examination (MMSE) y otras para monitorizar la gravedad del episodio: Delirium Rating Scale (DRS-R-98) o Clinical Global Impression Scale (CGI). La Nursing Delirium Screening Scale (NuDESC) se utiliza para el diagnóstico y valoración de la gravedad. La Memorial Delirium Assessment Scale (MDAS) diseñada por Breitbart et al.8, validada en pacientes con cáncer avanzado9, en cuidados paliativos10 y en castellano11, se emplea para evaluar la gravedad del delirium, aunque se ha propuesto también su aplicación diagnóstica9. Las 10 variables medidas se distribuyen en 2 subgrupos en virtud de la esfera que exploran: neuroconductual y cognitiva global. A pesar de los criterios y todas las herramientas disponibles, el delirium sigue estando infradiagnosticado y por tanto no tratado adecuadamente3.
Conocemos de la existencia de algunas medidas específicas que contribuyen a la reversibilidad1,12. La ausencia de factores reversibles facilita la identificación precoz de una situación refractaria, lo que mejora el control de síntomas en SUD y permite optimizar la aplicación de la sedación paliativa.
El propósito de nuestro estudio fue determinar la frecuencia de delirium en pacientes oncológicos hospitalizados en una UCP, empleando MDAS como herramienta de cribado, diagnóstica y de seguimiento; identificar los principales factores desencadenantes de delirium en nuestra muestra y su influencia en la reversibilidad, así como describir las medidas terapéuticas aplicadas.
Material y métodoSe realizó un estudio prospectivo observacional de los pacientes ingresados en una UCP desde abril a julio de 2015. Fueron seleccionados pacientes oncológicos mayores de 18 años, excluyendo a quienes estaban en SUD al inicio del estudio, aquellos con deterioro cognitivo moderado o grave previo, los que no podían colaborar en la aplicación de la escala (por barrera idiomática o astenia grave) y los que rechazaron participar.
Fueron recogidas las siguientes variables: edad, sexo, tipo de tumor, metástasis y su localización, índice de comorbilidad de Charlson y Palliative Performance Scale (PPS) al ingreso, días de estancia, causa de ingreso y alta. Los pacientes fueron valorados en las primeras 24h con MDAS y después semanalmente. Los casos de delirium (corte diagnóstico: 7 puntos)9 se reevaluaron al menos 3 veces en los 7 días posteriores según criterio del investigador. Se consideró resolución del episodio una puntación menor de 7 y mejoría una disminución de al menos un 20%. Finalizado el período de inclusión los pacientes fueron seguidos clínicamente (sin emplear MDAS) hasta el fallecimiento o el alta hospitalaria.
De los casos de delirium diagnosticados fueron analizados los siguientes datos: factores desencadenantes farmacológicos (incluyendo la Anticholinergic Risk Scale13) y alteraciones metabólicas; otros desencadenantes como anemia, infecciones, enfermedad cerebrovascular aguda, abstinencia de alcohol o drogas, y factores predisponentes como enfermedad orgánica cerebral (primaria o metastásica), quimioterapia o radioterapia en las 2 semanas previas, privación sensorial, deterioro cognitivo previo y antecedentes de depresión, ansiedad, insomnio o delirium. Finalmente, los tratamientos implementados y la necesidad de sedación paliativa.
El análisis descriptivo de la muestra se realizó utilizando frecuencias y porcentajes para variables cualitativas y la mediana o la media y desviación estándar para las cuantitativas. El análisis comparativo de variables cualitativas entre grupos se realizó con el test de la Chi-cuadrado y el test exacto de Fisher según el tamaño de los grupos. Para comparar variables cuantitativas, la t de Student y el test U de Mann-Whitney si su distribución no era normal. Para comparar más de 2 grupos se empleó el análisis de la varianza (ANOVA) y el test de Kruskal-Wallis. Se estableció una significación estadística de p<0,05. Los análisis se realizaron con el programa estadístico SPSS 20.0 (IBP Corp.).
El presente estudio no precisó ser sometido al Comité de Ética de Investigación Clínica por ser observacional descriptivo sin ninguna intervención específica. Los pacientes fueron tratados según la práctica clínica habitual del centro. Debido a que fue requerida la colaboración del paciente en la aplicación de MDAS se solicitó su consentimiento, siendo excluidos quienes no lo otorgaron. Se siguieron los principios éticos de la Declaración de Helsinki de la Asociación Médica Mundial.
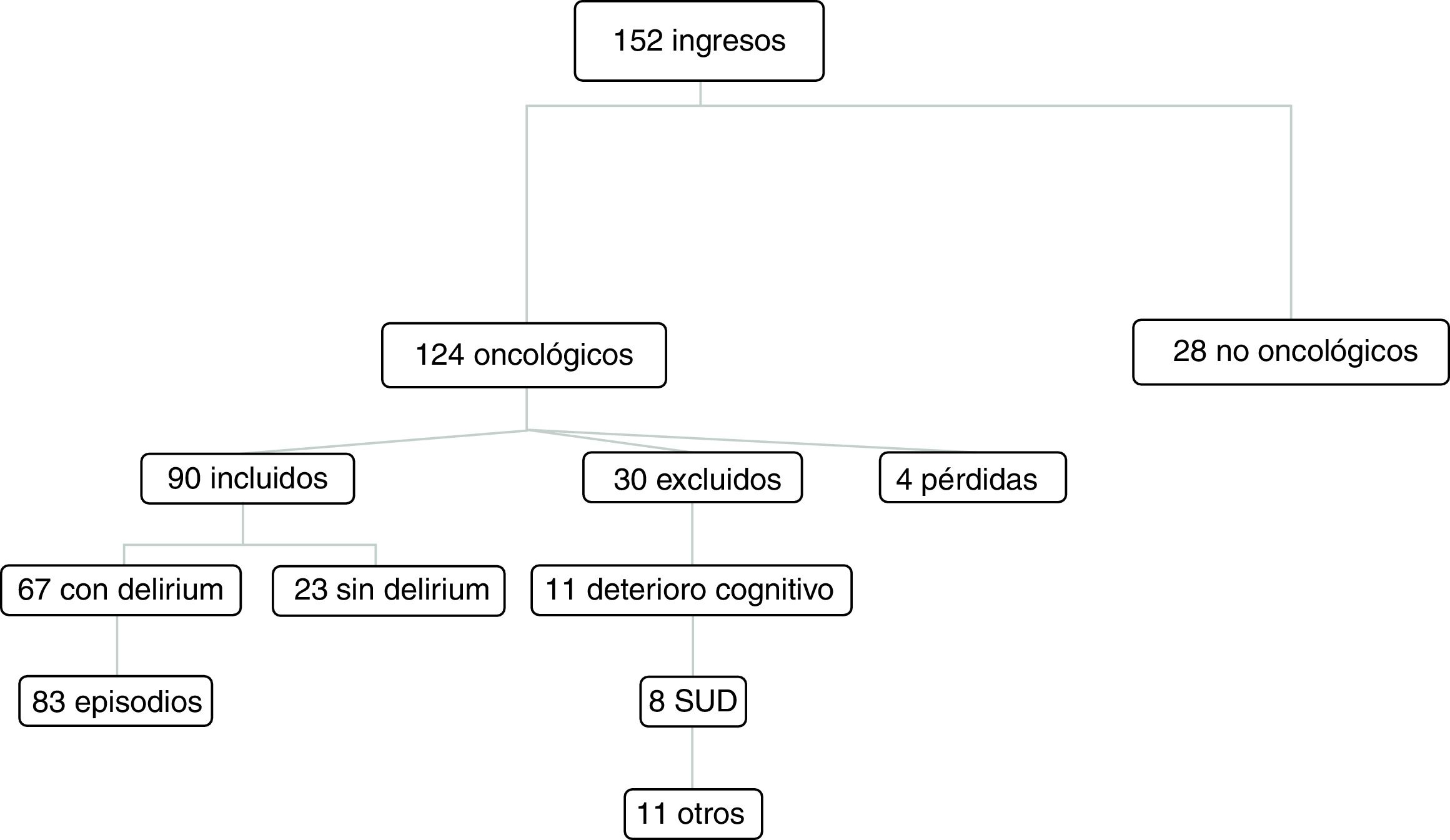
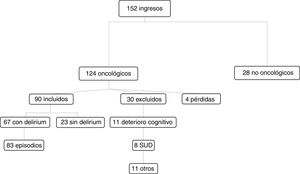
ResultadosDe los 152 pacientes ingresados en el período de estudio, el 82% eran oncológicos y el 76% cumplían los criterios de inclusión. El principal motivo de exclusión fue el deterioro cognitivo previo moderado o grave (37%), seguido de la SUD al ingreso (27%), dificultad para hablar (13%), astenia extrema (7%), rechazo del paciente (7%) o de la familia (7%). De estos pacientes, 67 (75%) desarrollaron delirium, estudiándose 83 episodios, ya que un 15% presentó más de uno durante el seguimiento. Fueron excluidos 4 pacientes por continuar hospitalizados al finalizar el período de seguimiento (fig. 1).
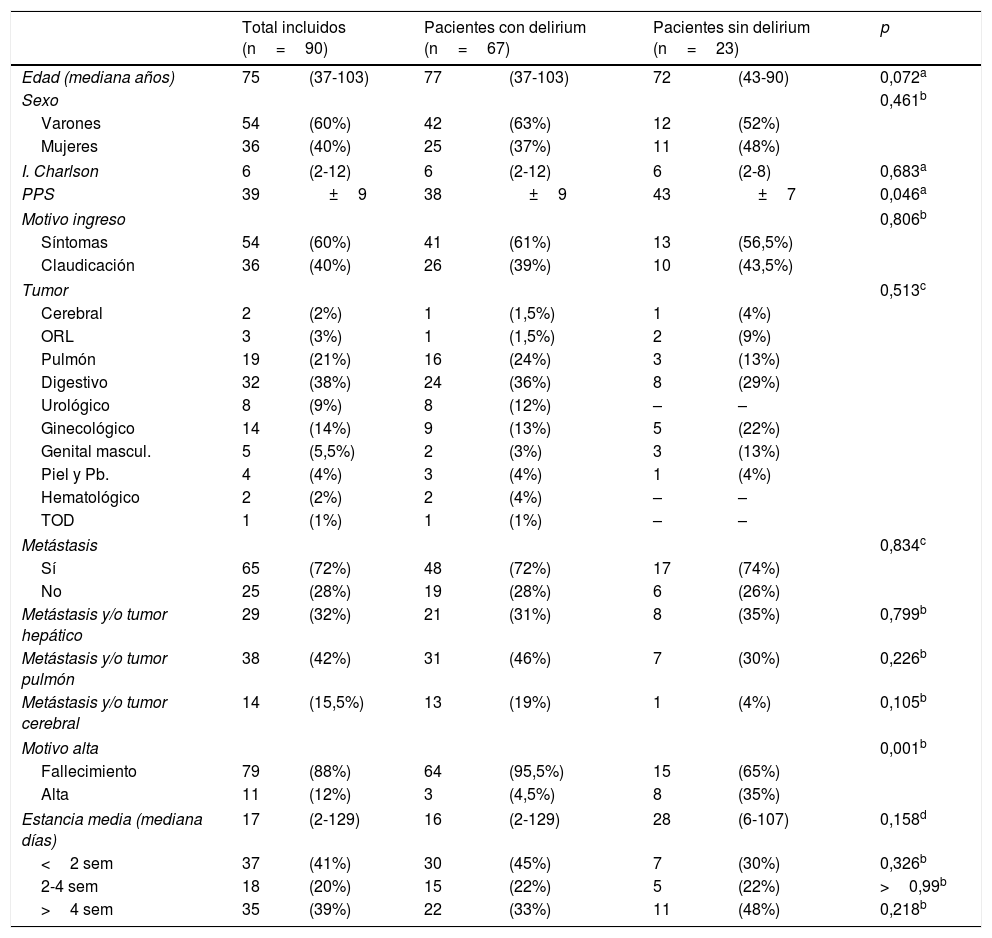
Las características generales de los sujetos se muestran en la tabla 1. En 24 de los episodios (29%) se diagnosticó delirium en las primeras 24h (DI), el 72% restante se desarrolló durante el ingreso (DDI), siendo la mediana hasta la detección del delirium de 15 días (2-126 días). Un 73% de los episodios constituyeron un evento terminal, el 35% revirtió y el 4% mejoró sin resolución completa. El subtipo mayoritario fue el hipoactivo (56%), seguido del mixto (33%) e hiperactivo (11%). No se detectaron diferencias significativas en la reversibilidad de los 3 subtipos de delirium.
Características generales de los pacientes oncológicos ingresados en UCP durante el período de estudio. Comparación entre pacientes con y sin delirium
| Total incluidos (n=90) | Pacientes con delirium (n=67) | Pacientes sin delirium (n=23) | p | ||||
|---|---|---|---|---|---|---|---|
| Edad (mediana años) | 75 | (37-103) | 77 | (37-103) | 72 | (43-90) | 0,072a |
| Sexo | 0,461b | ||||||
| Varones | 54 | (60%) | 42 | (63%) | 12 | (52%) | |
| Mujeres | 36 | (40%) | 25 | (37%) | 11 | (48%) | |
| I. Charlson | 6 | (2-12) | 6 | (2-12) | 6 | (2-8) | 0,683a |
| PPS | 39 | ±9 | 38 | ±9 | 43 | ±7 | 0,046a |
| Motivo ingreso | 0,806b | ||||||
| Síntomas | 54 | (60%) | 41 | (61%) | 13 | (56,5%) | |
| Claudicación | 36 | (40%) | 26 | (39%) | 10 | (43,5%) | |
| Tumor | 0,513c | ||||||
| Cerebral | 2 | (2%) | 1 | (1,5%) | 1 | (4%) | |
| ORL | 3 | (3%) | 1 | (1,5%) | 2 | (9%) | |
| Pulmón | 19 | (21%) | 16 | (24%) | 3 | (13%) | |
| Digestivo | 32 | (38%) | 24 | (36%) | 8 | (29%) | |
| Urológico | 8 | (9%) | 8 | (12%) | – | – | |
| Ginecológico | 14 | (14%) | 9 | (13%) | 5 | (22%) | |
| Genital mascul. | 5 | (5,5%) | 2 | (3%) | 3 | (13%) | |
| Piel y Pb. | 4 | (4%) | 3 | (4%) | 1 | (4%) | |
| Hematológico | 2 | (2%) | 2 | (4%) | – | – | |
| TOD | 1 | (1%) | 1 | (1%) | – | – | |
| Metástasis | 0,834c | ||||||
| Sí | 65 | (72%) | 48 | (72%) | 17 | (74%) | |
| No | 25 | (28%) | 19 | (28%) | 6 | (26%) | |
| Metástasis y/o tumor hepático | 29 | (32%) | 21 | (31%) | 8 | (35%) | 0,799b |
| Metástasis y/o tumor pulmón | 38 | (42%) | 31 | (46%) | 7 | (30%) | 0,226b |
| Metástasis y/o tumor cerebral | 14 | (15,5%) | 13 | (19%) | 1 | (4%) | 0,105b |
| Motivo alta | 0,001b | ||||||
| Fallecimiento | 79 | (88%) | 64 | (95,5%) | 15 | (65%) | |
| Alta | 11 | (12%) | 3 | (4,5%) | 8 | (35%) | |
| Estancia media (mediana días) | 17 | (2-129) | 16 | (2-129) | 28 | (6-107) | 0,158d |
| <2 sem | 37 | (41%) | 30 | (45%) | 7 | (30%) | 0,326b |
| 2-4 sem | 18 | (20%) | 15 | (22%) | 5 | (22%) | >0,99b |
| >4 sem | 35 | (39%) | 22 | (33%) | 11 | (48%) | 0,218b |
Pb: partes blandas; PPS: Palliative Performance Scale; TOD: tumor de origen desconocido.
No hubo diferencias significativas en la puntuación de MDAS al diagnóstico en función de la reversibilidad o no del delirium (13,3±5,8 vs. 14±6,4); aunque sí fue inferior en aquellos con delirium hipoactivo (11,8±5,3) respecto a mixtos (16,7±6,7) e hiperactivos (15±5,9), p=0,040, a expensas de una menor puntuación en el factor I o neuroconductual de los delirium hipoactivos (5±3 vs. 8,3±3,2 vs. 7,2±1,6, respectivamente, p=0,005). El 50% de los pacientes con delirium no completaron las 3 evaluaciones con MDAS propuestas por fallecimiento en la primera semana desde el diagnóstico.
En 82 de los 83 episodios de delirium estudiados (98,8%) hubo al menos un fármaco potencialmente precipitante: opioides (77%), esteroides (60%), antipsicóticos y/o antidepresivos (59%) y benzodiacepinas (49%). Al menos un factor metabólico en el 66%: deshidratación (28%), insuficiencia renal y hepática (19%), hipoxia (12%) e hipercalcemia (7%). Del resto de factores precipitantes destacan las infecciones (42%), la anemia (12%) y los catéteres (15%); entre los predisponentes, la presencia de depresión, ansiedad y/o insomnio (51%), el delirium previo (21%) o los tumores cerebrales primarios o metastásicos (17%). Se detectó un mayor uso de corticoesteroides en los delirium no reversibles, así como más casos de hipercalcemia en los sí reversibles (tabla 2). Los antecedentes de depresión, ansiedad y/o insomnio son más frecuentes en el grupo de DDI que en el de DI (tabla 3).
Factores precipitantes de delirium. Comparación entre episodios de delirium reversibles y no reversibles
| Delirium no reversible (n=61) | Delirium reversible (n=22) | ||||
|---|---|---|---|---|---|
| N.o | % | N.o | % | pa | |
| Fármacos | |||||
| Opioides | 45 | 74 | 19 | 86 | 0,375 |
| Corticoesteroides | 41 | 67 | 9 | 41 | 0,042 |
| Antipsicóticos / Antidepresivos | 37 | 61 | 12 | 54,5 | 0,229 |
| Benzodiacepinas | 29 | 47,5 | 12 | 54,5 | 0,625 |
| Factores metabólicos | |||||
| Deshidratación | 20 | 33 | 3 | 14 | 0,102 |
| Insuf. renal | 13 | 21 | 3 | 14 | 0,541 |
| Insuf. hepática | 14 | 23 | 2 | 9 | 0,215 |
| Hipoxia | 9 | 15 | 1 | 4,5 | 0,277 |
| Hipercalcemia | 2 | 3 | 4 | 18 | 0,040 |
| Otros | |||||
| Anemia | 6 | 10 | 4 | 18 | 0,444 |
| Catéteres | 10 | 16 | 2 | 9 | 0,502 |
Factores predisponentes al delirium. Comparación entre episodios de delirium diagnosticados al ingreso y desarrollados durante el ingreso
| Delirium al ingreso (n=24) | Delirium durante ingreso (n=59) | ||||
|---|---|---|---|---|---|
| N.o | % | N.o | % | pa | |
| Depresión / ansiedad/ insomnio | 3 | 12,5 | 31 | 52,5 | 0,001 |
| Ansiedad | – | – | 10 | 17 | 0,049 |
| AP delirium | 2 | 8 | 15 | 25 | 0,132 |
| Tumor cerebral | 5 | 21 | 9 | 15 | 0,533 |
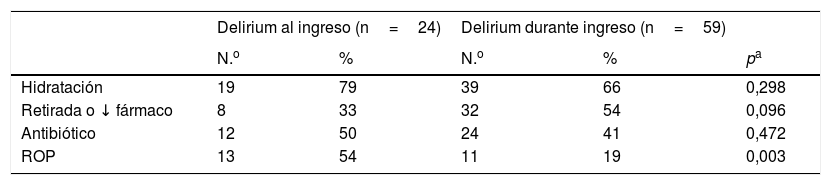
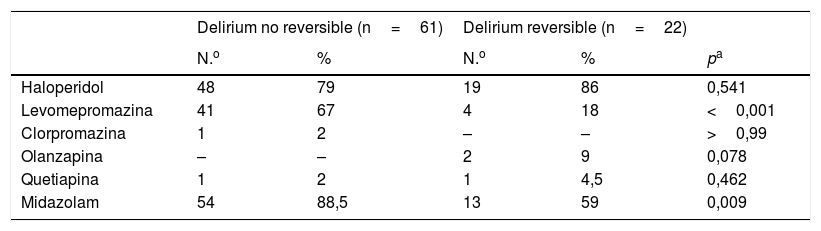
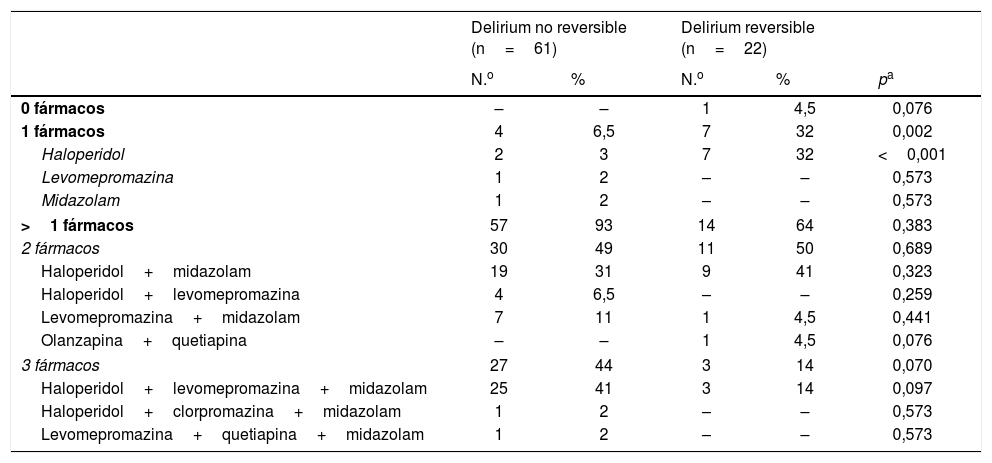
El 92% de los pacientes recibieron algún tratamiento etiológico: hidratación (69%), retirada o disminución de fármacos (48%), antibióticos (43%) y rotación de opioides (ROP) (29%). Los pacientes con DI requieren ROP con mayor frecuencia que los DDI (tabla 4); 82 episodios de delirium (98,8%) fueron tratados con algún fármaco: haloperidol (81%), midazolam (81%) y levomepromazina (54%). El uso de clorpromazina fue escaso (1%), al igual que el de antipsicóticos atípicos como olanzapina y quetiapina (2%). Los delirium no reversibles recibieron midazolam más frecuentemente que los reversibles, en los que se usó más el haloperidol. La administración de levomepromazina fue menor en los delirium reversibles (tabla 5). El 13% de los episodios fueron tratados en monoterapia, principalmente con haloperidol. El 87% restante precisó más de un fármaco, mayoritariamente haloperidol y midazolam. El porcentaje de pacientes en monoterapia fue mayor entre los delirium reversibles (tabla 6).
Tratamiento etiológico empleado en los episodios de delirium. Comparación entre episodios de delirium diagnosticados al ingreso y desarrollados durante el ingreso
| Delirium al ingreso (n=24) | Delirium durante ingreso (n=59) | ||||
|---|---|---|---|---|---|
| N.o | % | N.o | % | pa | |
| Hidratación | 19 | 79 | 39 | 66 | 0,298 |
| Retirada o ↓ fármaco | 8 | 33 | 32 | 54 | 0,096 |
| Antibiótico | 12 | 50 | 24 | 41 | 0,472 |
| ROP | 13 | 54 | 11 | 19 | 0,003 |
ROP: rotación de opioides.
Tratamiento farmacológico administrado en los episodios de delirium. Comparación entre episodios de delirium reversibles y no reversibles
| Delirium no reversible (n=61) | Delirium reversible (n=22) | ||||
|---|---|---|---|---|---|
| N.o | % | N.o | % | pa | |
| Haloperidol | 48 | 79 | 19 | 86 | 0,541 |
| Levomepromazina | 41 | 67 | 4 | 18 | <0,001 |
| Clorpromazina | 1 | 2 | – | – | >0,99 |
| Olanzapina | – | – | 2 | 9 | 0,078 |
| Quetiapina | 1 | 2 | 1 | 4,5 | 0,462 |
| Midazolam | 54 | 88,5 | 13 | 59 | 0,009 |
Número y combinación de fármacos administrados en los episodios de delirium. Comparación entre episodios de delirium reversibles y no reversibles
| Delirium no reversible (n=61) | Delirium reversible (n=22) | ||||
|---|---|---|---|---|---|
| N.o | % | N.o | % | pa | |
| 0 fármacos | – | – | 1 | 4,5 | 0,076 |
| 1 fármacos | 4 | 6,5 | 7 | 32 | 0,002 |
| Haloperidol | 2 | 3 | 7 | 32 | <0,001 |
| Levomepromazina | 1 | 2 | – | – | 0,573 |
| Midazolam | 1 | 2 | – | – | 0,573 |
| >1 fármacos | 57 | 93 | 14 | 64 | 0,383 |
| 2 fármacos | 30 | 49 | 11 | 50 | 0,689 |
| Haloperidol+midazolam | 19 | 31 | 9 | 41 | 0,323 |
| Haloperidol+levomepromazina | 4 | 6,5 | – | – | 0,259 |
| Levomepromazina+midazolam | 7 | 11 | 1 | 4,5 | 0,441 |
| Olanzapina+quetiapina | – | – | 1 | 4,5 | 0,076 |
| 3 fármacos | 27 | 44 | 3 | 14 | 0,070 |
| Haloperidol+levomepromazina+midazolam | 25 | 41 | 3 | 14 | 0,097 |
| Haloperidol+clorpromazina+midazolam | 1 | 2 | – | – | 0,573 |
| Levomepromazina+quetiapina+midazolam | 1 | 2 | – | – | 0,573 |
El 37% de los episodios requirieron rotación de neuroléptico. En el 48% se rotó de haloperidol a levomepromazina y un 23% precisó combinarlos. En el 52% se añadió midazolam al tratamiento inicial. El resto no precisaron rotar el neuroléptico, aunque únicamente el 23% debido al control con uno o ningún fármaco, puesto que el 77% recibió doble terapia desde el inicio. Al comparar los factores precipitantes entre estos 2 grupos, encontramos un mayor porcentaje de pacientes que recibían opioides entre los que no precisaron rotar el neuroléptico frente a los que sí (61% vs. 85%, p=0,035); así como más casos de deshidratación en el grupo en el que se rotó el neuroléptico (42% vs. 19%; p=0,025).
El 88% de los pacientes evaluados fallecieron, con una mediana de supervivencia de 17 días (2-129). El porcentaje de fallecimiento fue superior en los pacientes con delirium (95,5% vs. 65%), y su mediana de estancia en la unidad fue inferior a la de aquellos que no lo padecieron (tabla 1). De todos los sujetos con delirium, este constituyó un evento terminal más frecuentemente en varones que en mujeres (85% vs. 64%; p=0,039). En el subgrupo de los que fallecieron en delirium la mediana de estancia en la unidad fue de 13 días (2-112), frente a los 48 días (7-129) de los pacientes en los que el episodio revirtió (p=0,001). El 54% de aquellos estuvieron hospitalizados menos de 2 semanas, frente a un 13% del grupo de pacientes recuperados, de los cuales hasta el 73% lo estuvo más de 4 semanas. La mediana de supervivencia desde el diagnóstico fue de 7 días (0-128 días), superior en los pacientes con DI (10 días, 2-128) frente a los DDI (6 días, 0-97) y mayor en los delirium reversibles frente a los irreversibles (32 días [6-128] vs. 5 días [0-32]; p<0,001).
En los casos estudiados se llevaron a cabo 24 sedaciones paliativas (27%), y su indicación fue el delirium terminal en un 83% de ellas. Los fármacos utilizados fueron: midazolam (63%), levomepromazina (13%) o una combinación de ambos (25%).
DiscusiónMás del 70% de nuestros pacientes desarrollaron delirium durante el seguimiento, hallazgo similar al resultado de investigaciones previas1, aunque las cifras son variables en función de la diversidad de los diseños de estudio. La reciente publicación de Farriols et al.14 obtuvo una prevalencia mucho menor (27%), si bien el diagnóstico se estableció en este caso sin ayuda de ninguna herramienta diagnóstica. Un estudio realizado en 2014 en nuestro mismo centro15, con la finalidad de conocer la prevalencia de delirium en base al criterio clínico, detectó un 64% con 45% de delirium mixtos, 42% hiperactivos y 11% hipoactivos. Algunos autores16 ya han puesto en cuestión el hecho de que, incluso en entornos de alta frecuencia, la detección rutinaria del delirium es rara y los profesionales admiten una baja confianza en su tratamiento. Nuestros resultados fueron similares a los obtenidos por Fang et al.17 utilizando Delirium Rating Scale-Chinese version (DRS-C). La aplicación de MDAS de forma protocolizada facilita el diagnóstico de delirium hipoactivo, subtipo con mayores dificultades para su detección1,16, que supone un similar sufrimiento para el paciente18 y una presencia inesperadamente alta de alucinaciones19. Contemplamos la posibilidad de que la alta prevalencia obtenida se deba a que la escala empleada fue diseñada para seguimiento, de forma que su elevada sensibilidad pueda incluir en el diagnóstico subsíndromes de delirium.
Al igual que otros estudios14 no hubo diferencias en la prevalencia de delirium en función de la edad y el número de casos resultó mayor entre los varones, aunque en nuestra muestra esta diferencia no fue estadísticamente significativa. Casi en la totalidad de los episodios estudiados había implicado al menos un fármaco potencialmente precipitante; aun así, la causalidad cronológica no siempre pudo establecerse debido a la multiplicidad de factores implicados y a la recogida retrospectiva de estos datos. Nuestros pacientes suelen precisar opioides con sus potenciales efectos secundarios, incluida la neurotoxicidad por opioides cuyos síntomas son fácilmente solapables a los del delirium. Insistimos por tanto en la necesidad de un diagnóstico precoz así como en la identificación de posibles desencadenantes entre los fármacos administrados. El hallazgo de un mayor uso de corticoesteroides en pacientes con delirium no reversible es concordante con su ya conocido potencial delirogénico20, no así su asociación con la irreversibilidad que podría deberse en nuestra muestra al avanzado estado de enfermedad en que ingresan los pacientes. Los opioides y la deshidratación son los principales factores desencadenantes, aunque, a diferencia de la mayoría de investigaciones previas al respecto5, no evidenciamos asociación de estos con la reversibilidad. En nuestra muestra hay una clara mayor frecuencia de delirium reversibles asociados a hipercalcemia6 como factor precipitante, que consideramos se debe a que la accesibilidad al diagnóstico y tratamiento de dicha alteración metabólica facilita la reversibilidad de estos episodios. Este hallazgo apoya la necesidad de valorar la presencia de hipercalcemia en nuestros pacientes por la relevancia que su tratamiento puede tener en la evolución a corto plazo.
Aunque existe poca evidencia de que la corrección de factores precipitantes como la deshidratación, las infecciones, la hipoxia o los opioides puedan ser útiles prolongando la supervivencia, existen estudios que sí han demostrado su capacidad de retardar el deterioro de la función cognitiva12 y continúan considerándose parte irrenunciable del tratamiento16. De ahí que el 92% de nuestros pacientes recibieran al menos un tratamiento etiológico, principalmente hidratación, que si bien algunos autores arguyen podría alargar innecesariamente la vida21, es considerada por otros como imprescindible en la eficacia de fármacos con capacidad para revertir el episodio22. Algunas publicaciones se refieren al delirium como el único síntoma al final de la vida que se beneficia de tratamiento con hidratación parenteral, siempre y cuando se acompañe de una clarificación al paciente y la familia respecto al objetivo de la misma y su necesidad se reconsidere en caso de que aparezcan efectos secundarios23. La segunda herramienta terapéutica más empleada fue la retirada o disminución de fármacos, medida considerada esencial24, aunque su eficacia en cáncer avanzado no haya sido plenamente demostrada25. La evidencia disponible es que incluso en la fase avanzada del cáncer el 50% de los episodios de delirium podrían ser reversibles3,5, especialmente cuando se asocian con toxicidad farmacológica. Todos los fármacos implicados deberían, por tanto, ser retirados o disminuir su dosis26. Incluso cuando el pronóstico del paciente es poco claro, una prueba terapéutica de los posibles desencadenantes del delirium sería apropiada23. La ROP fue necesaria en mayor medida al ingreso, posiblemente porque la detección precoz es más factible en un entorno hospitalario; sin olvidar el hecho de que el delirium es uno de los síntomas que con mayor frecuencia motivan el traslado a una UCP.
El 99% de los episodios estudiados recibieron algún tratamiento farmacológico, cifras superiores a las descritas en la literatura27, lo que consideramos debido a que nuestro limitado número de delirium reversibles requiere con mayor frecuencia tratamiento farmacológico. El principal fármaco empleado fue el haloperidol (81%), tal y como recomiendan las principales guías28,29. Múltiples revisiones consideran la clorpromazina una alternativa razonable2,30, de escaso uso en nuestro medio, no así la levomepromazina administrada al 54% de nuestros pacientes con delirium, especialmente útil por su alto poder sedante y su administración por vía subcutánea31,32, no siempre posible en el caso de otros antipsicóticos. El papel de las benzodiacepinas en el tratamiento del delirium, más allá del contexto de privación, parece quedar circunscrito a casos en que los antipsicóticos no consiguen controlar los síntomas23, especialmente cuando se requiere sedación. En esta línea interpretamos nuestros hallazgos, pues el uso de midazolam fue más frecuente en los pacientes que fallecieron en delirium llegando a superar incluso al haloperidol, no así en los episodios reversibles. La escasa cifra de pacientes en monoterapia podría estar motivada por un cómputo del número de fármacos independiente de la administración concomitante o no de los mismos. La mayor proporción de pacientes con DDI que se controlaron con un único fármaco frente a los DI estaría en relación con una mayor precocidad diagnóstica facilitada por la hospitalización. Del mismo modo, los pacientes con delirium reversible se controlaron en monoterapia con significativa mayor frecuencia, debido a la presencia de más causas tratables no solo con neurolépticos. También en este grupo fue superior el uso de haloperidol en monoterapia, en relación con menos sintomatología hiperactiva subsidiaria de fármacos más sedantes. De ahí el llamativo descenso de uso de la combinación haloperidol–levomepromazina–midazolam en ellos. Estos hallazgos nos llevan a plantear la cuestión de si la necesidad de un solo fármaco para el control del delirium pueda ser un factor predictor de reversibilidad del mismo. Llama la atención el alto porcentaje de casos (80%) que han requerido más de un fármaco en el grupo de delirium hipoactivo. Su tratamiento es ciertamente controvertido: la guía clínica canadiense33 no lo recomienda y la americana29 no lo menciona específicamente. Algunos estudios12 han sugerido que estos pacientes requieren tratamiento diferente al mixto o al hiperactivo, porque son más vulnerables a los efectos adversos de la sedación y tienen peor pronóstico. Otros sugieren el uso regular de dosis bajas de haloperidol de forma protocolizada34. La posible presencia de alteraciones de la percepción e ilusiones en el delirium hipoactivo de pacientes con cáncer avanzado18, junto con la evidencia del sufrimiento que este supone y la posibilidad de alucinaciones17,35, consideramos sustenta suficientemente la indicación de tratamiento neuroléptico en el delirium hipoactivo. Aun así, ello no explicaría el alto número de pacientes que recibieron benzodiacepinas, sin poder descartar cierta sobreestimación de delirium hipoactivos en relación con el horario de aplicación de MDAS.
El reciente estudio de Shin et al.36 no ha conseguido identificar ningún factor predictor de la necesidad de rotar el neuroléptico. En nuestra muestra hemos detectado un mayor uso de opioides y un menor uso de antipsicóticos en los pacientes que no precisaron rotarlo, lo que plantea una posible asociación entre control de dolor y delirium. También objetivamos mayor prevalencia de deshidratación en los pacientes en quienes se rotó el neuroléptico, explicable por una peor distribución del fármaco en estas condiciones.
La reversibilidad de los episodios que se obtuvo es similar a la expuesta en otras investigaciones6,26,37, aunque en la literatura se describe hasta un 50%5. Consideramos este resultado debido a que nuestros pacientes suelen ingresar en situación muy avanzada, no tanto para la resolución de complicaciones agudas. De hecho, el ya mencionado estudio retrospectivo realizado en 201417 obtuvo una mortalidad global del 93% en los pacientes con cáncer avanzado, constituyendo el delirium un evento terminal en el 85% de los casos.
Nuestros pacientes con delirium fallecieron en clara mayor proporción (96%) que quienes no lo tuvieron (hasta un 35% recibieron el alta hospitalaria). Este hallazgo es congruente con la literatura al respecto que ha demostrado sobradamente su carácter de mal pronóstico38. Aun así, no se encontraron diferencias significativas en la estancia media en el centro. En los casos estudiados, la supervivencia tras el diagnóstico fue de 7 días de mediana, con cifras claramente superiores en los delirium reversibles. El impacto del delirium en la supervivencia de pacientes con cáncer avanzado puede predecirse gracias a la experiencia de los facultativos, pero también con la ayuda de herramientas6,38. Consideramos útil su implementación en la valoración inicial y de forma protocolizada durante el ingreso, en orden a mejorar la estimación pronóstica y por tanto la adecuación de medidas terapéuticas.
El delirium es conocido como la primera indicación de sedación paliativa. Las cifras obtenidas en esta serie y los fármacos empleados para ella son congruentes con otras publicaciones6,39. La combinación de un antipsicótico como la levomepromazina y una benzodiacepina de vida media corta como el midazolam es una de las más usadas en el manejo de la agitación de los pacientes con delirium23.
Nuestra investigación tiene claras limitaciones. El tamaño muestral y la heterogenicidad de localizaciones tumorales no permiten asociar el delirium a ningún tipo de tumor14 y nos impiden obtener conclusiones sobre los factores de riesgo, dada la multifactorialidad del delirium. Aproximadamente la mitad de los pacientes que presentaron delirium no pudieron ser valorados con la herramienta diagnóstica elegida. Su complejidad de aplicación limita la colaboración del paciente en situaciones de elevada fragilidad y dependencia, lo que ha dificultado alcanzar el objetivo propuesto. La selección de un horario establecido para la aplicación de la escala también condiciona su capacidad diagnóstica, al no tener en cuenta la fluctuación de los síntomas del delirium. Por todo ello consideramos relevante la realización de otros estudios prospectivos con mayor número de pacientes, que incluyan la valoración por el personal médico y de enfermería, siendo posible emplear otras escalas diagnósticas validadas para este fin que no precisen participación activa del paciente40,41 o puedan ser manejadas por otros profesionales42,43.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.