Obtención de valores normales actualizados de parámetros bioquímicos y la osmolaridad en el plasma seminal y estudio de su correlación con los parámetros del perfil del seminograma.
Material y métodosSe han estudiado 37 plasmas seminales de pacientes que presentaban un seminograma normal, con una media de edad de 34,4 años (intervalo de confianza [IC] 95%: 32,5-36,3) procedentes del servicio de Esterilidad y Reproducción Asistida de nuestro hospital. Se evalúan los valores normales de una serie de parámetros bioquímicos, analizados mediante autoanalizador AU 5800 Beckman-Coulter y por un Cobbas Mira II. La osmolaridad es determinada mediante un osmómetro Advanced 2020 modelo 3MO.
ResultadosLas medias obtenidas de los parámetros estudiados muestran concentraciones en el plasma seminal: proteínas totales de 3,87g/dl (IC 95%: 3,5-4,3), albúmina de 0,67g/dl (IC 95%: 0,52-0,82), glucosa de 6,11mmol/l (IC 95%: 5,35-6,67), fructosa de 13,5mmol/l (IC 95%: 11,7-15,3), sodio de 122mmol/l (IC 95%: 119-125), potasio de 23 mmo/l (IC 95%: 22-25), cloro de 41mmol/l (IC 95%: 37-44), calcio de 27,1mg/dl (IC 95%: 23,7-30,5), magnesio de 10,9mg/dl (IC 95%: 9,18-12,7), fósforo de 68,1mg/dl (IC 95%: 58,6-77,6) y Zn de 1,5mmol/l (IC 95%: 1,25-1,73). La osmolaridad presentó un valor normal de 422mOsmol/kg (IC 95%: 407-439). Los parámetros de Na, K, Ca, Mg y Zn presentaron una correlación positiva significativa con los parámetros de calidad del semen (recuento, movilidad y morfología espermática/eyaculado).
ConclusionesSe han hallado los valores normales actualizados con los nuevos métodos de análisis que incorporan los modernos autoanalizadores, que permitirán estudiar las variaciones de estos parámetros bioquímicos que se puedan producir en diversas patologías. El cálculo de las correlaciones de los parámetros bioquímicos con los componentes del seminograma nos ha permitido establecer qué componentes bioquímicos estaban relacionados positivamente con los parámetros de calidad del semen.
An updated review is presented on some biochemistry and osmolality reference values in seminal plasm. These values were also compared with the seminogram values.
Material and methodsA study was made of 37 normal seminal plasma from patients attending the Sterility and Assisted Reproduction Service of our Hospital. The mean patient age was 34.4 years, with a 95% confidence interval (CI) from 32.5 to 36.3. The reference values of the biochemical parameters were obtained using a Beckman-Coulter AU 5800 chemistry analyser and a Cobas-Mira II analyser. Seminal plasma osmolality was measured using an Advanced Osmometer 2020 3MO.
ResultsThe mean concentration for the biochemical parameters were: total proteins 3.87g/dl (95% CI; 3.5-4.3), albumin 0.67g/dl (95% CI; 0.52-0.82), glucose 6.11mmol/l (95% CI; 5.35-6.67), fructose 13.5mmol/l (95% CI; 11.7-15.3), sodium 122mmol/l (95% CI; 119-125), potassium 23mmo/l (95% CI; 22-25), choride 41mmol/l (95% CI; 37-44), calcium 27.1mg/dl (95% CI; 23.7-30.5), magnesium 10.9mg/dl (95% CI; 9.18-12.7), phosphorous 68.1mg/dl (95% CI; 58.6-77.6), and zinc 1.5mmol/l (95% CI; 1.25-1.73). The reference values for the calculated osmolality were 422mOsmol/Kg (95% CI; 407- 439). Na, K, Ca, Mg, and Zn parameters showed a significant positive correlation with the quality semen criteria (sperm concentration, motility, and sperm morphology/ejaculate)
ConclusionsAn updated review is presented on reference values of some biochemical parameters in seminal plasma using new automated analysers. This may be useful to study the relationship between different pathologies and the biochemical and osmolality values in seminal plasma. A significant correlation has been calculated between these biochemical parameters and the quality semen values.
La Organización Mundial de la Salud (OMS) publicó en 2010 la actual edición del manual para el análisis y procesamiento del semen WHO (World Health Organization, 2010). En él se aconsejaba la determinación bioquímica de la fructosa y del Zn o cítrico como marcadores bioquímicos del funcionalismo de las glándulas exocrinas de la vesícula seminal y de la próstata, respectivamente.
En la actualidad el estudio proteómico de las proteínas que componen el plasma seminal constituye una nueva línea de investigación en el estudio de la infertilidad de la pareja y en patologías andrológicas descritas por varios autores (Sharma et al., 2013; Agarwal et al., 2015). En la literatura hay escasa alusión a otros componentes bioquímicos presentes en el semen, reportándose la presencia de poliaminas, aminoácidos, carnitina, glicerolcolina, colesterol, fosfato de espermina, prostaglandinas, ácido ascórbico, glutatión, testosterona, fosfatasas ácidas prostáticas, lactato-deshidrogenasa (LDH), alfaglucosidasa, seminogelinas, fibrolisina y otras enzimas proteolíticas prostáticas (PSA) (Tauber et al., 1975). También se han mencionado constituyentes minerales como Ca, Mg, Na, K, Cl, P, Zn (Adamopoulos y Deliyiannis, 1983; Gusani et al., 1988; Jeyendran y Van der Ven, 1982; Colagar et al., 2009). Aunque se ha descrito que muchos de estos componentes intervienen, en una mayor o menor medida, en procesos tan importantes como la capacitación, hiperactivación y la reacción acrosómica del espermatozoide (Krasznai et al., 2006; Suarez, 2008; Darszon et al., 2007), existe escasa y a veces antigua bibliografía de valores de referencia de dichos componentes (Jeyendran y Van der Ven, 1982; Adamopoulos y Deliyiannis, 1983; Gusani et al., 1988).
En este trabajo básico de laboratorio se presenta la actualización en las determinaciones de algunos componentes bioquímicos en el plasma seminal, como proteínas totales, albúmina, glucosa, fructosa, Na, K, Cl, Ca, Mg y P, y la osmolaridad, para establecer sus valores normales actuales con las nuevas tecnologías de análisis que permiten los modernos autoanalizadores bioquímicos, y así estudiar su posible utilización como nuevos marcadores bioquímicos en algunas patologías, principalmente andrológicas, o ayudar a entender los diversos mecanismos —recientemente descritos (Singh y Rajender, 2015)— de la existencia específica en el espermatozoide de un canal de iones catiónico (Catsperm) por el cual es esencial la presencia de estos iones para la hiperactivación del espermatozoide y la reacción acrosómica previo a la fecundación del óvulo.
Además, se ha estudiado qué componentes bioquímicos se correlacionan positivamente con los parámetros de calidad del semen y cómo la contribución de todos estos componentes bioquímicos modifican la osmolaridad del plasma seminal, así como su posible relación con la morfología espermática e indirectamente con la fertilidad del espermatozoide.
Material y métodosRecogida de muestra y anamnesis del pacienteLa recogida de la muestra de semen se ha realizado siguiendo la normativa general de la WHO y de la ESHRE (World Health Organization, 2010; ESHRE monographs, 2002) y la específicamente adaptada a nuestro entorno, recomendada por la Sociedad Española de Química Clínica y Patología Molecular (SEQC) (Aulesa et al., 2006). Cuando el clínico solicita un seminograma al paciente, le informa de la normativa de recogida de semen y le facilita un impreso del laboratorio, en el cual se especifican las condiciones de recogida y entrega de la muestra de semen, y además se le informa de que el laboratorio dispone de una sala de recogida específica. Cuando el paciente acude el día programado al laboratorio de Andrología para entregar la muestra de semen, se le realiza una encuesta personal en la cual se pregunta sobre los días de abstinencia sexual, el lugar de recogida, la hora de obtención de la muestra, y se completa la anamnesis, preguntándole también sobre tratamientos farmacológicos y el consumo de marihuana y otras drogas.
El paciente firma, en la entrega de la muestra, un impreso normalizado por el comité de bioética del hospital sobre el consentimiento informado de la utilización de los resultados del análisis para estudios epidemiológicos.
Los pacientes que no cumplían con la normativa de recogida de semen, así como las muestras incompletas y los pacientes en tratamiento farmacológico y consumidores de marihuana fueron excluidos en esta primera fase del estudio del grupo de los valores normales.
Población de estudioEl grupo inicial de estudio estaba compuesto por 62 pacientes. Las muestras para realizar el estudio de valores bioquímicos normales fueron recogidas durante un año. Estos pacientes procedían del servicio de Esterilidad y Reproducción Asistida de nuestro hospital, con un diagnóstico inicial de infertilidad.
Se descartó a 25 varones que presentaron alguna alteración en el seminograma o que en su historia clínica tenían referencias de infecciones urológicas u otras patologías relacionadas como varicocele o enfermedades sistémicas como diabetes. Así, este grupo final solo lo constituyeron 37 pacientes, que presentaban una media de edad de 34,4 años (IC 95%: 32,5-36,3) y un rango entre 22-45 años, con valores normales, según los criterios de la OMS, para el estudio del semen.
Análisis del semenLa concentración y la movilidad espermática se han determinado mediante el analizador automatizado de análisis de semen SCA 5.4 (Sperm Class Analyzer) (Micropctic SL, Barcelona, España) tipo CASA (Computer Assay Semen Analysis), utilizando cámaras Leja desechables de 10 micras de espesor y efectuando las lecturas de los campos necesarias para 1.000 espermatozoides, siguiendo las indicaciones de Aulesa et al. (2009). La vitalidad se ha analizado siguiendo el método recomendado por la WHO (World Health Organization, 2010) con la tinción de colorantes supravitales eosina-nigrosina al 10% y efectuando la lectura de 200 espermatozoides. El estudio de la morfología se ha realizado siguiendo los criterios estrictos de Kruger (Kruger y Coetzee, 1999), empleando el método rápido de tinción Hemacolor (Merck), y con un recuento manual de un mínimo de 200 espermatozoides, y por duplicado. Los valores de referencia que se han adoptado son los establecidos por el manual de la WHO 2010 (World Health Organization, 2010). Se clasifica una muestra de semen como normal cuando el volumen obtenido es superior a 1,5ml, la concentración de espermatozoides por eyaculado es superior a 39×106 espermatozoides/eyaculado, la movilidad progresiva (a+b) supera el 32%, la vitalidad espermática es superior al 55% de espermatozoides vivos y la morfología normal es mayor de un 4%.
El laboratorio de Andrología está acreditado en el Programa Español de Evaluación Externa de la Calidad del Seminograma de Ceifer, lab 08100 registro 5D4704241006, desde hace 5 años. La acreditación Ceifer está certificada a nivel europeo por la Sociedad Europea de Reproducción Humana y Embriología (ESHRE). Los resultados medios anuales de los últimos 5 años nos muestran desviaciones del ±12% para el recuento respecto al valor diana. Concretamente, la movilidad de espermatozoides progresivos, con lecturas de video remitido, presentaron una desviación de un ±15%. La vitalidad de las lecturas de las preparaciones pertenecientes al control de calidad mostraron desviaciones de un ±5-10% respecto al valor diana y, finalmente, la cuantificación de las formas normales en preparaciones teñidas y sin teñir presentaron desviaciones de un ±15-20% respecto al valor diana.
Determinaciones bioquímicas de los parámetros a estudiarAntes de las 2h desde la recogida del semen, se realiza el recuento y motilidad espermática de la muestra y además se hacen las extensiones para valorar la vitalidad y morfología del espermatozoide. La muestra de semen es centrifugada a 4°C a 1.000g, se separa del plasma seminal y es congelada a –20°C. Las determinaciones bioquímicas fueron realizadas al final de la misma semana de la entrega del semen. Las muestras fueron descongeladas a temperatura ambiente y se volvían a centrifugar 10min, 1.000g a 4°C. Los plasmas seminales se procesaban sin efectuar ningún pretratamiento ni dilución.
Las determinaciones bioquímicas se han realizado con el autoanalizador AU 5800 Beckman-Coulter que efectúa automáticamente las diluciones necesarias de la muestra, para que la concentración de analito de la muestra entre dentro de los márgenes de linealidad de cada metodología. Los métodos de análisis utilizados para las determinaciones han sido para proteínas totales (PT) (colorimetría, iones cúpricos OSR6132), albúmina (colorimetría, verde de bromocresol CRM470), glucosa (hexoquinasa OSR6521), Na y K (fotómetro de lámpara halógena MU855000), y para el Cl (electrodo policloruro de vinilo), Ca (colorimetría, Arsenazo III, OSR60117), Mg (colorimetría, azul de xilidil, OSR6189) y P (colorimetría, Heptamolibdato amónico, OSR6122). Las determinaciones bioquímicas de fructosa (hexoquina/fosfoglucosa isomerasa, Lab. BioSystem, Barcelona, España) y Zn (Zinc Bromo-paps, Lab. BioSystem, Barcelona, España) se han realizado con el analizador Cobas Mira II. La osmolaridad del plasma seminal ha sido medida con un osmómetro Advanced 2020 modelo 3MO.
El laboratorio de Bioquímica está inscrito en el programa RIQAS (bioquímica-suero), que está acreditado en el Programa Español de Evaluación Externa de la Calidad de la SEQC. La acreditación de la SEQC está certificada a nivel europeo por la European Federation of Clinical Chemestry and Laboratory Medicin (EFLM). Los resultados promedio anuales nos muestran para la glucosa un coeficiente de variación (cv) de 1,5%; potasio: 1,8%(cv); sodio: 1,5%(cv); cloruro: 1,1%(cv); calcio: 1,7%(cv); magnesio: 1,9%(cv); fosfato 1,9%(cv); albúmina: 2,1%(cv); proteínas totales: 2,7%(cv); fructosa: 5,2%(cv), y Zn: 4,5%(cv).
Métodos de evaluación y estadísticosLos cálculos de los resultados se efectuaron con los programas estadísticos SPSS 19.0 (SPSS, Chicago, IL, EE.UU.) y MedCalc 10.0.2.0 (MedCalc. Software. Mariakerke, Bélgica).
ResultadosResultados de parámetros bioquímicosSe ha realizado el estudio estadístico final de 37 plasmas seminales de pacientes procedentes del servicio de Esterilidad y Reproducción Asistida de nuestro hospital. La media de edad de los pacientes fue de 34 años (IC 95%: 32-36) y el volumen medio de semen de 3,4ml (IC 95%: 2,9-3,8), con un recuento medio de 50millones/ml (IC 95%: 42-59) y expresado por eyaculado de 157millones/eyaculado (IC 95%:126-188). Presentaron una media de movilidad progresiva (a+b%) de 49% (IC 95%: 45-54) y expresado en progresivos por eyaculado de 78millones/eyaculado (IC 95%: 62-94), así como una media de vitalidad de 57% (IC 95%: 51-59). Finalmente, respecto a la morfología presentaron una media de 5% (IC 95%: 4-6) y expresado en espermatozoides normales por eyaculado de 8millones/eyaculado (IC 95%: 5-11).
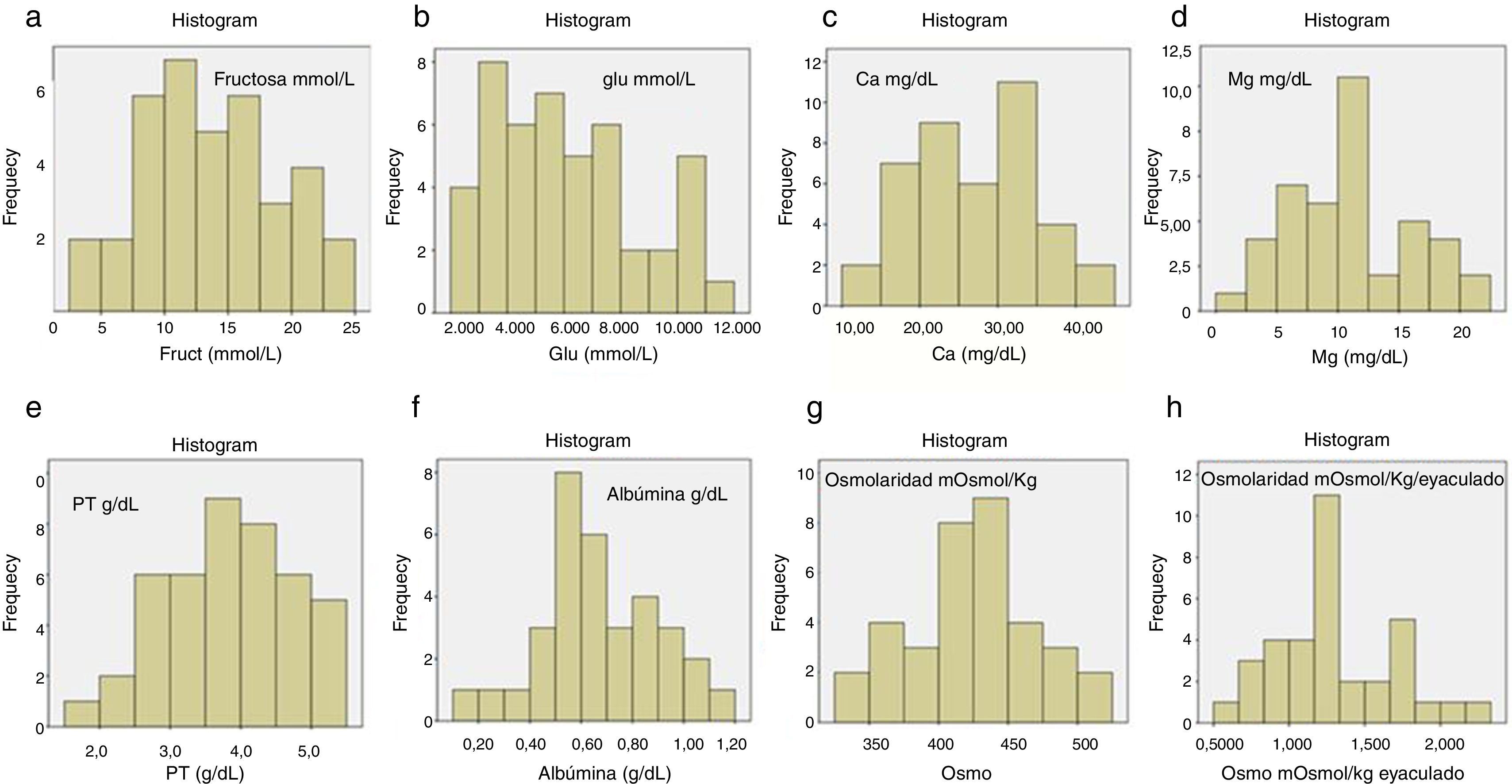
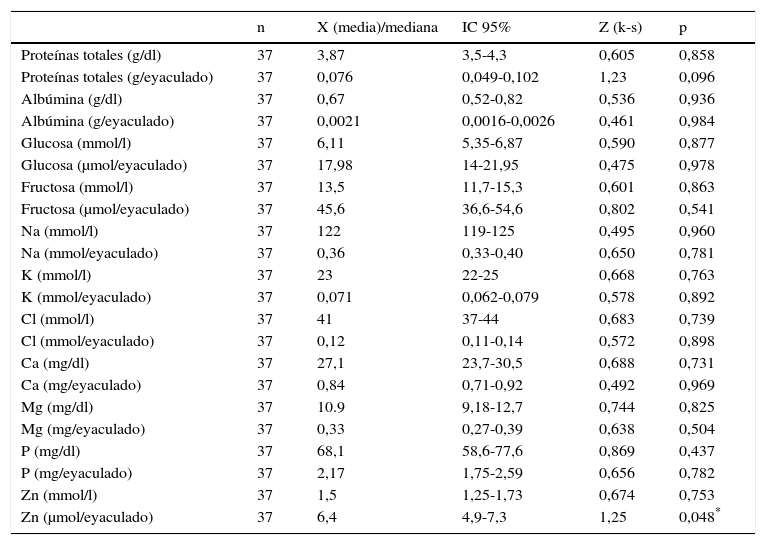
En la tabla 1 se muestran los resultados de la media y/o mediana y el IC 95% de los parámetros bioquímicos analizados: proteínas totales, albúmina, glucosa, fructosa, Na, K, Cl, Ca, Mg, P y Zn de los 37 pacientes normales y el test de Kolmogorov-Smirnov Z (k-s), que ha estudiado la distribución normal de cada parámetro. Para calcular el IC 95% del Zn que no presentaba una distribución gaussiana (k-s p<0,05), se ha utilizado la mediana. Se expresan los resultados en unidades internacionales de volumen y por eyaculado. Dado que el volumen del semen varía en función de diferentes variables, como días de abstinencia, madurez y actividad sexual del individuo, entre otras, la WHO ha aconsejado en su última edición del 2010 (World Health Organization, 2010), como más idónea para mimetizar estas variaciones, la expresión final de los resultados por eyaculado. En la figura 1 se representan los histogramas de frecuencias de los parámetros bioquímicos más representativos, expresados en unidad de volumen y osmolaridad por volumen y por eyaculado.
Valores de la media y la mediana para los parámetros bioquímicos estudiados en plasma seminal. Resultado del test de Kolmogorov-Smirnov Z (k-s) y significación estadística (p)
| n | X (media)/mediana | IC 95% | Z (k-s) | p | |
|---|---|---|---|---|---|
| Proteínas totales (g/dl) | 37 | 3,87 | 3,5-4,3 | 0,605 | 0,858 |
| Proteínas totales (g/eyaculado) | 37 | 0,076 | 0,049-0,102 | 1,23 | 0,096 |
| Albúmina (g/dl) | 37 | 0,67 | 0,52-0,82 | 0,536 | 0,936 |
| Albúmina (g/eyaculado) | 37 | 0,0021 | 0,0016-0,0026 | 0,461 | 0,984 |
| Glucosa (mmol/l) | 37 | 6,11 | 5,35-6,87 | 0,590 | 0,877 |
| Glucosa (μmol/eyaculado) | 37 | 17,98 | 14-21,95 | 0,475 | 0,978 |
| Fructosa (mmol/l) | 37 | 13,5 | 11,7-15,3 | 0,601 | 0,863 |
| Fructosa (μmol/eyaculado) | 37 | 45,6 | 36,6-54,6 | 0,802 | 0,541 |
| Na (mmol/l) | 37 | 122 | 119-125 | 0,495 | 0,960 |
| Na (mmol/eyaculado) | 37 | 0,36 | 0,33-0,40 | 0,650 | 0,781 |
| K (mmol/l) | 37 | 23 | 22-25 | 0,668 | 0,763 |
| K (mmol/eyaculado) | 37 | 0,071 | 0,062-0,079 | 0,578 | 0,892 |
| Cl (mmol/l) | 37 | 41 | 37-44 | 0,683 | 0,739 |
| Cl (mmol/eyaculado) | 37 | 0,12 | 0,11-0,14 | 0,572 | 0,898 |
| Ca (mg/dl) | 37 | 27,1 | 23,7-30,5 | 0,688 | 0,731 |
| Ca (mg/eyaculado) | 37 | 0,84 | 0,71-0,92 | 0,492 | 0,969 |
| Mg (mg/dl) | 37 | 10.9 | 9,18-12,7 | 0,744 | 0,825 |
| Mg (mg/eyaculado) | 37 | 0,33 | 0,27-0,39 | 0,638 | 0,504 |
| P (mg/dl) | 37 | 68,1 | 58,6-77,6 | 0,869 | 0,437 |
| P (mg/eyaculado) | 37 | 2,17 | 1,75-2,59 | 0,656 | 0,782 |
| Zn (mmol/l) | 37 | 1,5 | 1,25-1,73 | 0,674 | 0,753 |
| Zn (μmol/eyaculado) | 37 | 6,4 | 4,9-7,3 | 1,25 | 0,048* |
Las concentraciones medias de glucosa y fructosa (tabla 1) indican que la fructosa, con una concentración media de 13,5mmol/l (IC 95%: 11,7-15,3) y una distribución normal (fig. 1a), es el hidrato de carbono de mayor concentración del plasma seminal. Encontramos que la glucosa presenta una concentración media de 6,11mmol/l (IC 95%: 5,35-6,87), con una distribución normal (fig. 1b). Los valores de Na, K y Cl (tabla 1) presentan unas medias de concentración de Na: 122mmol/l (IC 95%: 119-125); K: 23mmol/l (IC 95%: 22-25) y Cl: 41mmol/l (IC 95%: 37-44), con una distribución normal.
Respecto a los valores medios de Ca: 27,1mg/dl (IC 95%: 23,7-30,5), Mg: 10,9mg/dl (IC 95%: 9,18-12,7) y P: 68,1mg/dl (IC 95%: 58,6-77,6) (tabla 1), el Ca y el Mg presentan también una distribución normal (fig. 1c,d). La concentración media de Zn analizada es de 1,5mmol/l, y expresado por eyaculado no presenta una distribución normal ya que el test de k-s que se utiliza para establecer la normalidad de una distribución muestra una p=0,048, y al ser la p<0,05 indica que se trata de una distribución no gaussiana, por lo tanto, el IC 95% se ha calculado con la mediana.
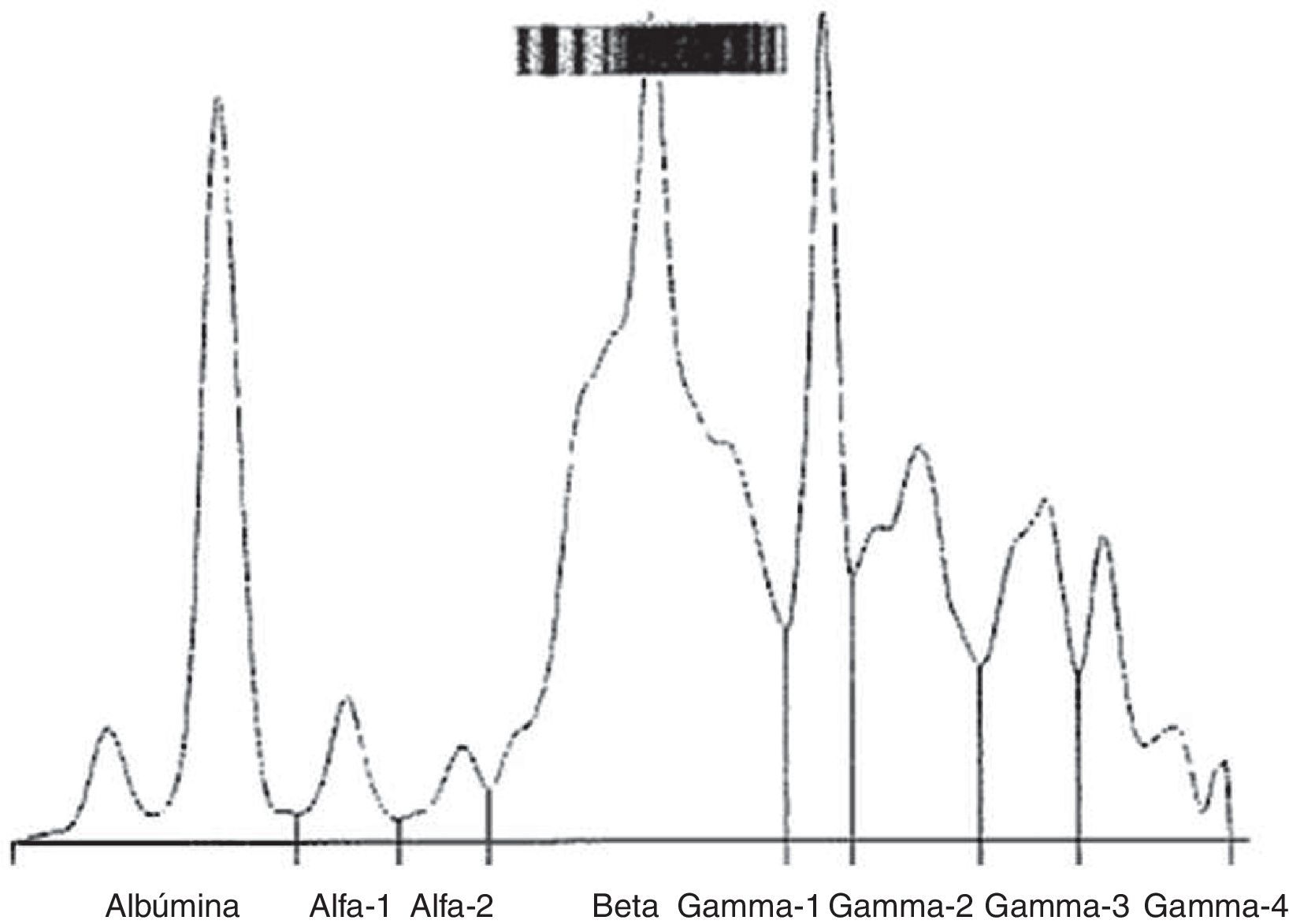
Análisis de proteínasEl análisis de los resultados de la tabla 1 nos ha mostrado que el plasma seminal tiene una concentración de proteínas totales elevada, con una media de 3,87g/dl (IC 95%: 3,5-4,3) y una distribución normal (fig. 1e). La albúmina presentaba una media de 0,67g/dl (IC 95%: 0,52-0,82) y una distribución normal (fig. 1f). Dado que hemos hallado que la albúmina es 1/5 de la concentración de proteínas totales del plasma seminal, hemos realizado un estudio complementario, en el que se realiza un proteinograma de varias muestras de sémenes, que nos permita establecer el perfil básico de las proteínas que componen el plasma seminal normal. Al realizar el proteinograma a 15 de los pacientes con seminograma normal, en todos ellos se obtuvo un perfil común (fig. 2). Las proteínas totales mostraron una media de 3,10g/dl, y las diferentes fracciones del proteinograma fueron las siguientes; albumina 0,41g/dl (13,2%); Alfa1 0,05g/dl (1,6%); Alfa2 0,05g/dl (1,6%); Beta 0,95g/dl (30,7%), y Gamma 1,64g/dl (52,9%).
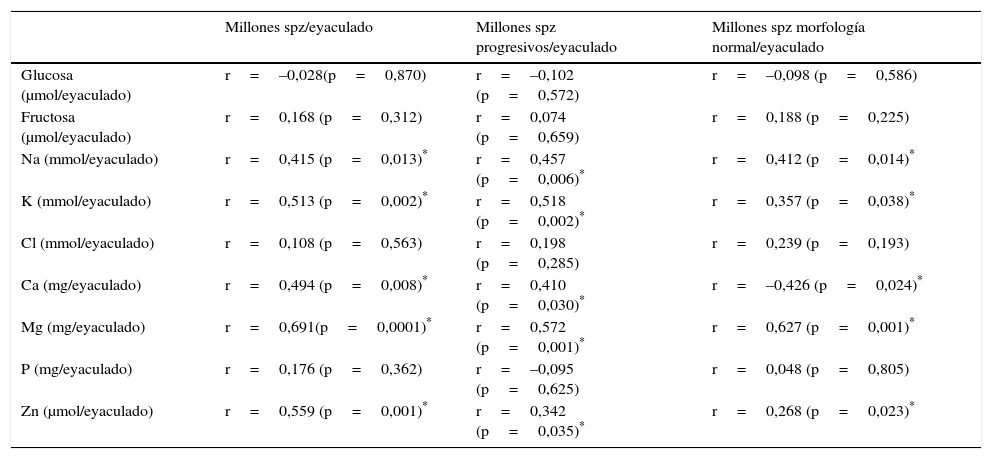
Análisis de las correlaciones de los componentes bioquímicos del plasma seminal con los parámetros del seminogramaCon el objetivo de estudiar qué componentes bioquímicos del plasma seminal podían tener relaciones significativas con los parámetros del seminograma, se han calculado los coeficientes de correlación de Pearson (r) entre los parámetros de calidad del seminograma: recuento de espermatozoides, movilidad y morfología espermática/por eyaculado, de los 37 pacientes normales estudiados, con los nuevos parámetros bioquímicos obtenidos también expresados por eyaculado.
En la tabla 2 se muestran las correlaciones de los parámetros del seminograma y los parámetros bioquímicos, siendo el Mg y el Ca los que mayor coeficiente de correlación y significación estadística (p) presentan. El Zn, Na y K muestran menores coeficientes de correlación, pero también significativos (p<0,05). La glucosa y la fructosa, Cl y P no se correlacionan significativamente con los parámetros de calidad del seminograma (p>0,05). En nuestro trabajo también se ha observado una correlación significativa entre la álbumina (g/eyaculado) y el recuento de espermatozoides (millones spz/eyaculado) de r=0,538 (p=0,032).
Correlaciones de Pearson y su significación de los parámetros básicos del seminograma y de los componentes bioquímicos del semen
| Millones spz/eyaculado | Millones spz progresivos/eyaculado | Millones spz morfología normal/eyaculado | |
|---|---|---|---|
| Glucosa (μmol/eyaculado) | r=–0,028(p=0,870) | r=–0,102 (p=0,572) | r=–0,098 (p=0,586) |
| Fructosa (μmol/eyaculado) | r=0,168 (p=0,312) | r=0,074 (p=0,659) | r=0,188 (p=0,225) |
| Na (mmol/eyaculado) | r=0,415 (p=0,013)* | r=0,457 (p=0,006)* | r=0,412 (p=0,014)* |
| K (mmol/eyaculado) | r=0,513 (p=0,002)* | r=0,518 (p=0,002)* | r=0,357 (p=0,038)* |
| Cl (mmol/eyaculado) | r=0,108 (p=0,563) | r=0,198 (p=0,285) | r=0,239 (p=0,193) |
| Ca (mg/eyaculado) | r=0,494 (p=0,008)* | r=0,410 (p=0,030)* | r=–0,426 (p=0,024)* |
| Mg (mg/eyaculado) | r=0,691(p=0,0001)* | r=0,572 (p=0,001)* | r=0,627 (p=0,001)* |
| P (mg/eyaculado) | r=0,176 (p=0,362) | r=–0,095 (p=0,625) | r=0,048 (p=0,805) |
| Zn (μmol/eyaculado) | r=0,559 (p=0,001)* | r=0,342 (p=0,035)* | r=0,268 (p=0,023)* |
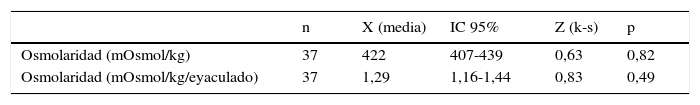
Se ha realizado el estudio complementario de la osmolaridad del plasma seminal (tabla 3), que nos indica que el plasma seminal muestra una osmolaridad media de 422mOsmol/kg (IC 95%: 407-439), con una distribución normal ya que el test de k-s presenta una p=0,82, que también se cumple al expresarse por eyaculado (fig. 1g,h). Se ha calculado la correlación de Pearson entre la osmolaridad expresada por eyaculado y todos los parámetros estudiados, con el fin de averiguar qué componente bioquímico puede influir mayoritariamente en ella. En la tabla 3 se muestran los coeficientes de correlación de la osmolaridad con los componentes estudiados y sus significaciones estadísticas. Según estos resultados, se observa que el componente que más influye en la osmolaridad del plasma seminal es el Na, con un coeficiente de correlación de 0,865 (p=0,0001), y el K, con un coeficiente de correlación de 0,855 (p=0,0001). Les siguen en importancia la glucosa, el P, las proteínas totales, el Ca y el Cl, con correlaciones también significativas de 0,743, 0,704, 0,681, 0,608 y 0,588 respectivamente (p<0,001). La albúmina, la fructosa y el Mg también contribuyen a la osmolaridad del plasma seminal, pero con bajas correlaciones de 0,503, 0,487 y 0,387 respectivamente. Por último, el Zn, con un coeficiente de correlación de 0,307, no presenta ninguna correlación significativa (p>0,05) con la osmolaridad.
Osmolaridad media del plasma seminal e IC 95% y sus correlaciones de Pearson (r) con los componentes bioquímicos estudiados expresados por eyaculado
| n | X (media) | IC 95% | Z (k-s) | p | |
|---|---|---|---|---|---|
| Osmolaridad (mOsmol/kg) | 37 | 422 | 407-439 | 0,63 | 0,82 |
| Osmolaridad (mOsmol/kg/eyaculado) | 37 | 1,29 | 1,16-1,44 | 0,83 | 0,49 |
| r | p | |
|---|---|---|
| Na (mmol/eyaculado) | 0,865 | 0,0001 |
| K (mmol/eyaculado) | 0,855 | 0,0001 |
| Glucosa (mg/eyaculado) | 0,743 | 0,0001 |
| P (mg/eyaculado) | 0,704 | 0,0001 |
| Proteínas totales (g/eyaculado) | 0,681 | 0,0001 |
| Ca (mg/eyaculado) | 0,608 | 0,001 |
| Cl (mmol/eyaculado) | 0,588 | 0,001 |
| Albúmina (g/eyaculado) | 0,503 | 0,047 |
| Fructosa (μmol/eyaculado) | 0,487 | 0,002 |
| Mg (mg/eyaculado) | 0,387 | 0,029 |
| Zn (μmol/eyaculado) | 0.307 | 0,07* |
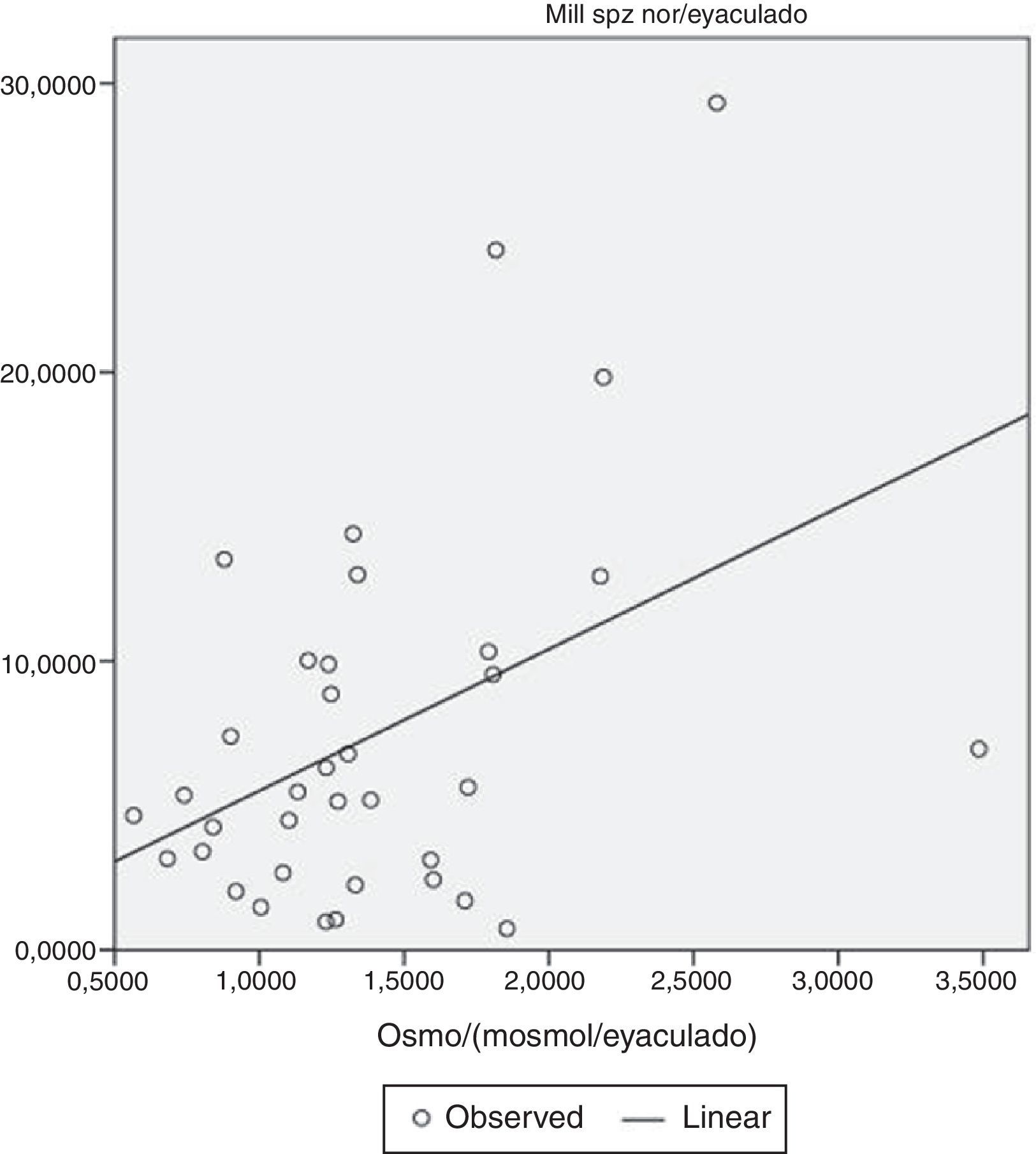
Finalmente, dado que en este trabajo se plantea la hipótesis de que la morfología del espermatozoide podría estar condicionada por la propia osmolaridad del semen, en el corto espacio de tiempo que el espermatozoide depositado en la vagina está en contacto con el plasma seminal, se ha analizado para estas mismas 37 muestras la correlación de la osmolaridad y el parámetro de morfología del espermatozoide. La representación gráfica de los resultados (fig. 3) muestra una correlación positiva significativa entre osmolaridad/eyaculado y el número de espermatozoide normales/eyaculado (r=0,433; p=0,008), lo que parece validar la hipótesis de que hay una cierta relación significativa entre la osmolaridad del semen y la morfología espermática normal.
DiscusiónSe han establecido los valores normales actualizados de un conjunto de parámetros bioquímicos en el plasma seminal, con antiguas y escasas referencias bibliográficas (Jeyendran y Van der Ven, 1982; Adamopoulos y Deliyiannis, 1983; Gusani et al., 1988). La fructosa, con un valor medio de 13,5mmol/l (IC9 5%: 11,7-15,3mg/dl), es el principal sustrato energético de los espermatozoides (Wein et al., 2008). Este monosacárido se metaboliza en las mitocondrias, combinando la fructólisis con el ciclo de los ácidos tricarboxílicos (TCA) (Plessis et al., 2015). La síntesis de fructosa se produce en la vesícula seminal a partir de glucosa plasmática a través de 2 vías de formación: la primera vía parte de sorbitol y mediante un proceso de conversión se obtiene fructosa. La segunda vía de formación se lleva a cabo a partir de la vía clásica de la glucólisis. Estos procesos son testosterona dependiente (Wein et al., 2008). La producción de ATP por estas vías metabólicas es esencial para la capacitación, hiperactivación del espermatozoide y la creación del ROS (reactive oxygen substances), además de necesario para la fertilización del oocito (Suarez, 2008; Darszon et al., 2007; Singh y Rajender, 2015).
La determinación de fructosa es utilizada como ayuda diagnóstica y como marcador plasmático del funcionalismo de la vesícula seminal del sistema urogenital masculino (World Health Organization, 2010; Wein et al., 2008). Las concentraciones de fructosa encontradas en la población estudiada son equivalentes a las de otros autores, aunque con pequeñas diferencias y expresadas en otras unidades (Jeyendran y Van der Ven, 1982); estas diferencias creemos que son debidas a la cambiante metodología analítica utilizada desde 1982, en la que la determinación de fructosa se efectuaba manualmente, previa dilución manual y desproteinización del plasma seminal y con el denominado reactivo de indol (ácido benzoico más reactivo de indol), preparando una solución madre de fructosa y realizando la determinación colorimétrica manual, con los factores correspondientes. Actualmente esta determinación se efectúa en el analizador Cobbas Mira con el equipo comercial Lab BioSystem, basado en una metodología enzimatica cinética fructosa hexoquina/fosfoglucosa isomerasa y que no requiere desproteinización, con coeficientes de variación entre un 5-6%.
La media de los valores de glucosa encontrados en este trabajo, de 6,11mmol/l (IC 95%: 5,35-6,87), hace cuestionarse cuál es la función de los monosacáridos en el plasma seminal. Varios autores (Fernández-Novell et al., 2011) indican que además del soporte energético alternativo a la fructosa, la glucosa y otros monosacáridos como el sorbitol podrían tener un protagonismo relevante. La bibliografía indica que podrían actuar como reguladores funcionales del espermatozoide tras la eyaculación, ya que la adicción de glucosa en ensayos in vitro produce en los espermatozoides un incremento en la fosforilación de muchas proteínas (Fernández-Novell et al., 2011), como se ha visto que ocurre en la protein-tirosina, que favorece la capacitación del espermatozoide. Por estas razones se postula que estos monosacáridos podrían actuar como reguladores funcionales metabólicos del espermatozoide en el proceso de capacitación, en el tracto reproductivo femenino y la adquisición de proteínas de capacitación (Singh y Rajender, 2015). Los valores obtenidos de glucosa son coincidentes con los de otros autores (Williams y Ford, 2001) y no se han hallado correlaciones significativas de la fructosa y la glucosa con los parámetros de calidad de semen estudiados.
Los valores de Na, K y Cl obtenidos llaman la atención al presentar unas concentraciones medias elevadas: Na 122mmol/l (IC 95%: 119-125mmol/l), Cl 41mmol/l (IC 95%: 37-44mmol/l) y sobre todo de K con una media de 23mmol/l (IC 95%: 22-25mmol/l). Estas concentraciones son similares a las concentraciones descritas por Colagar et al. (2009), aunque estos autores empleaban la absorción atómica como método de análisis, y son también coincidentes con las descritas por otros autores (Gusani et al., 1988; Skandhan y Mazumdar, 1981). Se ha descrito que el tránsito de estos cationes en el espermatozoide permite el cambio en la composición iónica intracelular y extracelular, permitiendo variaciones en el potencial funcional. Colagar et al. (2009) plantean que el K es la llave de la hiperpolarización de la membrana plasmática del espermatozoide, y esta dependencia de K es esencial para la inducción de la depleción del Ca en el buen funcionamiento del canal de iones catiónico Catsperm (Singh y Rajender, 2015). La activación de este canal es fundamental en la regulación de los hechos biológicos que conducen a la hiperactividad, capacitación y reacción acrosómica del espermatozoide, por lo que tienen una acción fundamental en la fertilización (Krasznai et al., 2006; Suarez, 2008; Darszon et al., 2007; Singh y Rajender, 2015). Concluimos que valores elevados, especialmente nuestros resultados obtenidos de K, validarían el papel fundamental que tiene la composición del plasma seminal en el metabolismo del espermatozoide.
Finalmente, cabe señalar la controvertida opinión sobre la acción de estos iones sobre el funcionalismo espermático. Varios investigadores (Gusani et al., 1988) han descrito que los niveles de Na son más elevados en varones fértiles y que el Na tiene una acción positiva en la motilidad. Sin embargo, esta afirmación no es compartida por Colagar et al. (2009), porque en los grupos de varones infértiles y fértiles estudiados por ellos no encuentran diferencias significativas y ninguna correlación entre los niveles de Na, K y los parámetros de calidad espermática. Nuestros resultados coincidirían con Gusani et al. (1988), al encontrar una correlación positiva y significativa entre los niveles de Na y K con los parámetros de calidad del semen. Creemos que las diferencias observadas por diversos autores pueden ser debidas al cambio que ha sufrido la metodología analítica de determinación de Na y K. Inicialmente determinada con métodos de fotómetro de llama y actualmente con electrodos selectivos de Na y K que aumentan la fiabilidad de las determinaciones.
Respecto a los valores elevados de Ca (27,1mg/dl [IC 95%: 23,7-30,5]) y Mg (10,9mg/dl [IC 95%: 9,18-12,7]), Singh y Rajender (2015) describen la función metabólica del Ca a través de la existencia específica en el espermatozoide de un canal de iones catiónico (Catsperm) cuya función es controlar la entrada de iones de Ca. La presencia de este canal se ha localizado en la zona intermedia del flagelo del espermatozoide y parece esencial tanto para la hiperactivación del espermatozoide como para la reacción acrosómica previo a la fecundación del oocito (Krasznai et al., 2006; Darszon et al., 2007). Además, ratifica que la alta concentración de Ca en el plasma seminal es indispensable para el correcto funcionamiento del canal Catsperm. Fortaleciendo esta teoría se ha descrito que la mutación del gen Catsperm es responsable de infertilidad (Chung et al., 2011). Otros autores indican que los niveles de Ca entre varones fértiles e infértiles son significativamente diferentes (Adamopoulos y Deliyiannis, 1983). Los resultados obtenidos en este estudio son coincidentes con los niveles de Ca y Mg hallados por Colagar et al. (2009), aunque, a diferencia de ellos, se observa una correlación significativa entre los niveles de Ca y Mg con los parámetros del seminograma, con un coeficiente de correlación superior en el caso del Mg frente al del Ca (tabla 2). Estas diferencias podrían explicarse por la introducción en los últimos años de métodos analíticos de recuento y análisis de la movilidad automatizados (SCA analyzer) de semen, que presentan unos menores coeficientes de variación y exactitud frente a los métodos manuales de 2009. Finalmente, cabe señalar que las técnicas de reproducción asistida requieren de suplementos de estos iones en los medios de cultivo para los procesos de fecundación y desarrollo embrionario (Meniru, 2004), lo que también validaría la importancia del Ca y del Mg en todo el proceso.
Los valores elevados de P (68,1mg/dl [IC 95%: 58,6-77,6]) parecen extraordinariamente altos si se comparan con sus valores del plasma sanguíneo. La bibliografía los relaciona con la intensa actividad metabólica del catabolismo del espermatozoide y con la alta concentración que el plasma seminal contiene de compuestos como fosfato de espermina poliaminas, aminoácidos y carnitinas (Jeyendran y Van der Ven, 1982). Todas estas moléculas incorporan fosfato en sus moléculas. Estos niveles elevados de P encontrados ratificarían que se deben al aumento del metabolismo del espermatozoide, tanto en los procesos de producción de ATP previos a la capacitación e hiperactivación como para llevar a cabo la reacción acrosómica y la fertilización del oocito que se producen cuando el plasma seminal está en contacto con los espermatozoides en la vagina. Los valores obtenidos en este estudio son coincidentes con los descritos por Adamopoulos y Deliyiannis (1983). No se ha encontrado ninguna correlación significativa con los parámetros del seminograma.
Los valores de Zn encontrados, con una concentración media de 1,5mmol/l (IC 95%: 1,25-1,73), son coincidentes con la bibliografía (Colagar et al., 2009), y los valores de este catión son utilizados como marcador del funcionalismo prostático del sistema urogenital masculino (Wein et al., 2008). Hay una extensa evidencia de que el Zn del plasma seminal tiene un importante papel en la fisiología del espermatozoide, estabilizando la membrana y la cromatina nuclear. Valores disminuidos de Zn en plasma seminal reducen la tasa de fertilidad (Caldemone et al., 1979). No obstante, otros estudios indican que no hay diferencias entre la concentración de Zn en varones infértiles o fértiles (Marmar et al., 1975).
Otro de los puntos controvertidos es el efecto del Zn respecto a los parámetros de calidad del semen. Colagar et al. (2009) describen una correlación positiva entre el Zn y los parámetros de calidad del semen, en cambio, otros autores no encuentran dicha relación entre el Zn del plasma seminal y la calidad del semen (Lewis-Jones et al., 1996). Los resultados de este estudio coinciden con Colagar et al. (2009) en que existe una relación positiva significativa entre los parámetros del seminograma y los niveles de Zn (tabla 2).
Una de las principales líneas de investigación actual en el campo de la proteómica (Sharma et al., 2013) son las proteínas del plasma seminal, en donde se han descrito actualmente 1.600 proteínas (Agarwal et al., 2015). Los resultados de este estudio muestran que el plasma seminal presenta concentraciones de proteínas totales significativamente elevadas de 3,87g/dl (IC 95%: 3,5-4,3). La albúmina presenta una media de 0,67g/dl (IC 95%: 0,52-0,82). Las técnicas de capacitación que se utilizan en reproducción asistida para favorecer la fecundación del oocito (Meniru, 2004) prestan especial importancia a incorporar suplementos proteicos, debido a la importante función que las proteínas ejercen en los procesos de capacitación e hiperactivación (Suarez, 2008; Darszon et al., 2007; Singh y Rajender, 2015). Por esta importante función, en este estudio se lleva a cabo un estudio complementario básico de las proteínas que componen el plasma seminal.
El estudio consiste en analizar 15 proteinogramas de plasmas seminales normales y valorar el perfil obtenido. Se ha hallado un patrón común en todos ellos, en el que hay un aumento de la fracción beta, la cual podría corresponder a la seminogelina, que se ha descrito como la proteína encargada de la coagulación del plasma seminal, y además se encuentra en mayor concentración (Lilja et al., 1989; Lundwall et al., 2002). Por otro lado, se observa un aumento importante de la fracción gamma sin un perfil común, pero sí que en algunos plasmas seminales existe una fracción pre-gamma que se podría corresponder con la IgA. En la bibliografía se ha descrito además que el antígeno especifico de próstata (PSA) del plasma seminal es una glicoproteína que también migra en la fracción gamma del proteinograma, por lo que podría coincidir con el aumento de esta fracción observada. Nos proponemos ampliar el estudio por inmunodifusión radial de esta fracción gamma y pre-gamma de estos plasmas seminales para dilucidar su composición. Finalmente la correlación positiva que se ha observado en este trabajo entre la albúmina (g/eyaculado) y el recuento de espermatozoides (millones spz/eyaculado), de r=0,538 (p=0,032), justificaría la práctica habitual (Meniru, 2004) de la adicción de suplementos de albúmina a los medios de cultivo en reproducción asistida.
El estudio de la osmolaridad del plasma seminal, no descrito con anterioridad en la bibliografía consultada, muestra valores medios de 422mOsmol/kg (IC 95%: 407-439) y expresado por eyaculado de 1,29mOsmol/kg/eyaculado (IC 95%: 1,16-1,24). El componente que más influye en la osmolaridad del plasma seminal es el Na, con un coeficiente de correlación de 0,865 (p=0,0001), y el K, con un coeficiente de correlación de 0,855 (p=0,0001), seguidos en importancia por: glucosa, P, proteínas totales, Ca, Cl, albúmina, fructosa y Mg, con correlaciones también significativas (p<0,0001). No se encuentra correlación significativa con el Zn (r=0,307; p=0,077).
Finalmente, respecto a la morfología espermática, se confirma la hipótesis de que existe una cierta relación entre la osmolaridad del plasma seminal y la morfología, a pesar del corto período de tiempo que el plasma seminal permanece en contacto con el espermatozoide en la vagina. Se observa una correlación positiva significativa entre osmolaridad/eyaculado y número de espermatozoides normales/eyaculado (r=0,433; p=0,008) (fig. 3). Estos resultados hacen plantear la realización de nuevos estudios experimentales de laboratorio, para estudiar las alteraciones morfológicas, que pudieran ocasionar el aumento o disminución de la osmolaridad de un plasma seminal in vitro, y así poder confirmar la relación entre osmolaridad y morfología (Menkveld et al., 2011) que podría ser importante indirectamente, desde el punto de vista de la capacidad de fertilidad del semen.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.