Objetivo: Mostrar una técnica quirúrgica modificada para asegurar el retiro adecuado de la membrana limitante interna (MLI), y determinar el éxito anatómico y funcional en el tratamiento del agujero macular idiopático (AMI).
Métodos: Estudio descriptivo, prospectivo, transversal, observacional, no comparativo y no ciego. Involucró 31 ojos de 31 pacientes con diagnóstico de AMI, de espesor total (grados 3 y 4). A todos los pacientes se les practicó cirugía de facoemulsificación de cristalino, colocación de lente intraocular y vitrectomía pars plana transconjuntival con incisión de calibre de 25. Utilizamos acetónido de triamcinolona libre de conservadores, en el marcaje de la hialoides posterior y de la MLI. Se demostró retiro adecuado de la MLI, al lograr la aposición completa de los bordes del agujero utilizando líquido perfluorocarbonado como estabilizador y protector del agujero.
Resultados: Después de 72 horas del procedimiento, todos los ojos (100%) mostraron una completa desaparición del líquido subretiniano y el cierre completo de los bordes del AMI basados en la fondoscopia, corroborados mediante OCT a los siete días posteriores al procedimiento.
Conclusiones: Nuestra técnica modificada, demostró el adecuado retiro de la MLI en el 100% de los casos, determinó el éxito en los resultados anatómicos de nuestros pacientes, mostrando que los resultados funcionales mejoraron un mínimo de más de dos líneas de visión.
Objective: To show a modified surgical technique which assures the complete removal of the internal limiting retinal membrane (ILM) and to determine the anatomical and functional success in treating the idiopatic macular hole (IMH).
Methods: Descriptive, prospective, transversal, observational, non-comparative and no blind study of 31 eyes from 31 patients with a diagnosis of a complete IMH (grades 3 and 4). All patients underwent a combined surgical procedure, which consisted of a phacoemulsification, intraocular lens implant and 25 gauge transconjuntival pars plana vitrectomy. Preservative free triamcinolone acetonide was used to identify the posterior hyaloid and the ILM. The complete removal of the ILM was demonstrated after showing the apposition of the hole borders using as a retinal stabilizator heavy perfluorocarbon liquid.
Results: Seventy-two hours after surgery, all eyes (100%) showed a total disappearance of the subretinal fluid and the complete closure of the IMH based on fundoscopy. These results were corroborated seven days after the procedure based on the OCT images.
Conclusions: Our modified surgical technique demonstrated an adequate removal of the IML in 100% of our cases, determined the success in the anatomical results in all patients and showed positive functional results in all patients based on the improvement of a minimum of two lines of vision.
Introducción
El agujero macular (AM) es una causa de pérdida de visión central, puede ocasionar una pérdida irreversible de la agudeza visual. El AM puede ser idiopático o bien secundario a diversas causas que incluyen: traumatismo contuso del globo ocular, miopía, inflamación ocular, cirugía por desprendimiento de retina y rotura de quistes en el edema macular diabético. El AM idiopático (AMI) es la forma más común, se presenta con mayor frecuencia en mujeres durante la sexta o séptima década de la vida.1
La presentación clínica inicial del AMI puede ser paucisintomática, en ocasiones con metamorfopsia. La agudeza visual se encuentra poco afectada en estadios iniciales, pero se va perdiendo progresivamente en la medida en la cual evoluciona el grado del AMI, hasta llegar a ocasionar la pérdida de la visión central y de la capacidad de estereopsia. Aunque la presentación más frecuente de AMI es la unilateral, los pacientes con un ojo afecto tienen mayor riesgo de desarrollar AM en el ojo contra-lateral.1
El pronóstico funcional de los ojos afectos por AMI en su evolución espontánea es malo, ya que el tamaño del agujero tiende a aumentar, y la agudeza visual va empeorando progresivamente. Han sido pocos los casos de AMI de espesor total, en los que se ha observado una resolución espontánea.2
El tratamiento del AM ha sufrido múltiples variaciones a lo largo de su historia. A partir de 1988, cuando Gass publicó su teoría sobre la tracción tangencial generada por el vítreo cortical sobre la fóvea (según la cual el vítreo tiene un papel importante en la patogénesis del AM), se consideró a la vitrectomía como una opción terapéutica.3 Inicialmente se propuso la vitrectomía con disección de la hialoides posterior, aunada al uso de un taponador. Durante la última década del siglo XX, en diversos estudios se observaron buenos resultados en pacientes con AMI en quienes se realizó vitrectomía, con porcentajes de éxito en el cierre del AM y en la mejoría de la agudeza visual de hasta un 73%.4,5 Posteriormente, se propuso el uso de factores de crecimiento celular para estimular la adhesión coriorretiniana a nivel foveal.6 Entre los factores de crecimiento celular que han sido utilizados con este propósito, se encuentran el factor de crecimiento beta, suero autólogo, trombina y concentrado de plaquetas.6-12
En los últimos años, la tomografía de coherencia óptica (OCT, por sus siglas en inglés) ha puesto de manifiesto que el desprendimiento perifoveal de la hialoides posterior, en el que ésta queda adherida al centro de la fóvea, podría ser el primer factor determinante en la formación del AM.13-15
Con el conocimiento actual sobre la patogenia del AMI, se ha propuesto a la disección de la membrana limitante interna (MLI) aunada al uso de taponadores, como el tratamiento de elección para este proceso patológico.16-19 Con la finalidad de eliminar la tracción tangencial que provoca y perpetúa el AMI, se han utilizado procedimientos para la separación de la hialoides posterior y la disección de la MLI, la cual parece jugar un papel importante también en la estimulación del crecimiento glial reparador del defecto.20-30
El perfluorocarbono es un liquido pesado, inerte que estabiliza la retina durante cirugías para el tratamiento de vitreoretinopatías proliferativas, desgarros retinianos gigantes, drenajes de hemorragias supracoroideas, desprendimiento de retina traccional con componente regmatógeno, lente dislocado, extracción de cuerpo extraño en cavidad vítrea y desprendimiento de retina asociado con coloboma coroideo. El perfluorocarbono tiene un índice refractivo cercano al agua y su baja viscosidad facilita la manipulación, inyección y remoción del tejido. Tomando en cuenta las propiedades de este líquido pesado, consideramos que al ser utilizado en procedimientos quirúrgicos para el tratamiento del AM, podría contribuir al cierre completo del borde del mismo y mejorar así, los resultados en la recuperación de la agudeza visual.
El presente estudio fue realizado con la finalidad de evaluar la eficacia de una técnica quirúrgica modificada con el uso de perfluorocarbono, en el tratamiento pacientes con AMI de espesor total.
Métodos
Realizamos un estudio prospectivo en 31 pacientes (31 ojos) con diagnóstico de AMI, de espesor total en estadios 3 y 4. Previa obtención del consentimiento informado, incluimos pacientes mayores de 40 años de edad, sin antecedente de cirugía oftalmológica previa, con ausencia de otras patologías maculares, con datos subjetivos de AMI de menos de seis meses de evolución y diámetro del agujero no mayor a 700 micras. El tiempo de evolución fue estimado en base a la pérdida de visión subjetiva, referida por los pacientes. Consideramos como criterios de exclusión: AMI intervenido previamente, agujero macular postraumático, agujero macular miópico (miopía mayor de -1D), agujero macular asociado a desprendimiento de retina, ojos con ambliopía, otras patologías que afectan la agudeza visual (glaucoma, atrofia de papila), seudofaquia y agujero macular asociado a otras maculopatías (maculopatía diabética, atrofia de epitelio pigmentado por degeneración macular asociada a la edad).
Procedimientos de evaluación
Previo al procedimiento quirúrgico, en todos los pacientes se realizaron evaluaciones del ojo seleccionado para el estudio, las cuales consistieron en determinación de la agudeza visual mejor corregida (AVMC) mediante cartilla de Snellen, biomicroscopía de segmento anterior y posterior, toma de tensión intraocular (TIO) con tonómetro de Goldmann, fotografía de fondo de ojo (Visucam®, Zeiss) y tomografía de coherencia óptica (OCT-Stratus®, Zeiss).
Los ojos intervenidos fueron revisados en los días dos, siete, 15, 30, 42 y 90, posteriores al procedimiento quirúrgico. Se realizó una revisión adicional al sexto mes de la cirugía. En cada una de las visitas de seguimiento, se evaluaron la AVMC y la TIO y se realizó biomicroscopía de segmento anterior y posterior. Adicionalmente, se obtuvo fotografía de fondo de ojo y se realizó OCT en el día siete y a los tres y seis meses posteriores a la cirugía.
Para fines de la evaluación de la respuesta al procedimiento quirúrgico, definimos como éxito anatómico a la completa desaparición del líquido subretiniano con el cierre completo del borde del agujero AM y como éxito funcional, a la mejoría de la agudeza visual mejor corregida de dos líneas de visión.
Técnica quirúrgica
A todos los pacientes se les practicó cirugía de facoemulsificación de cristalino, colocación de lente intraocular en bolsa capsular o surco y vitrectomía pars plana transconjuntival con incisión de calibre 25. Todas las cirugías fueron realizadas en régimen ambulatorio en el mismo quirófano, con el mismo equipo quirúrgico (Accurus®, Alcon) y por el mismo cirujano.
Se realizó doble procedimiento con retiro de catarata mediante facoemulsificación e implante inmediato de lente intraocular en bolsa capsular o surco, y cierre del puerto central con nylon 10-0. Se procedió a retiro de vítreo cortical y separación total de la hialoides posterior, utilizando cuando fue necesario, acetónido de triamcinolona libre de conservadores (ATLC®, Grin de México) como marcaje vítreo.
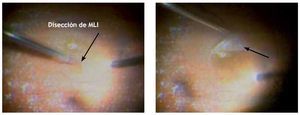
A continuación, se realizó la disección de la MLI (limitorexis macular) con pinzas de limitorexis (End-Grasping Forceps Tip, Grieshaber®, Alcon), de un área aproximada mínima de 2 500 micras de diámetro, utilizando ATLC® como marcador de la misma en todos los casos, el cual se aplicó directamente en la zona macular sin necesidad de intercambio líquido-aire (Figura 1).
Figura 1. Se muestra la limitorexis utilizando como marcaje acetónido de triamcinolona libre de conservadores.
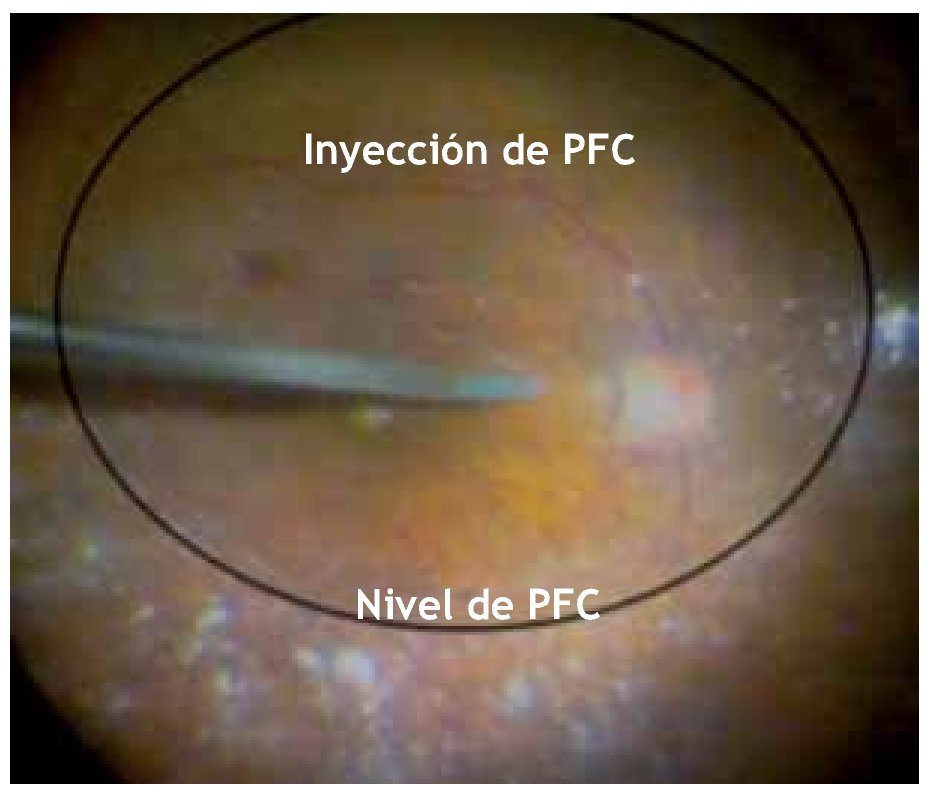
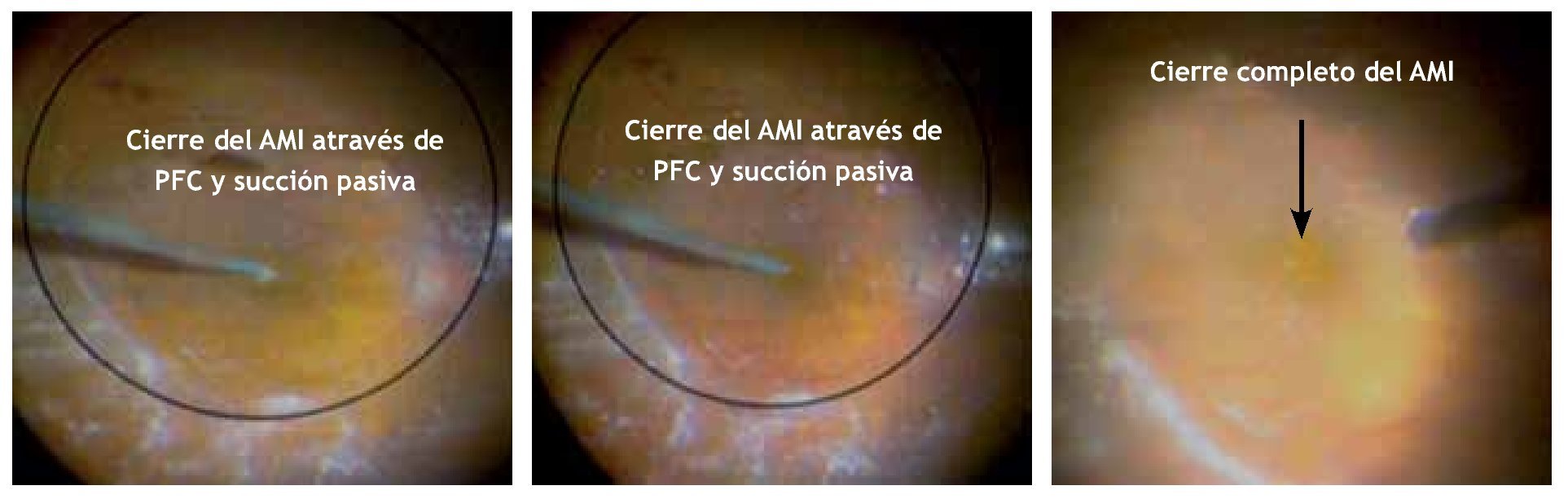
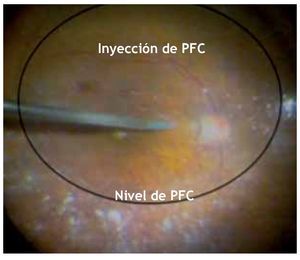
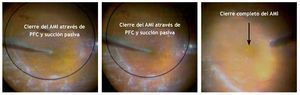
Posteriormente, con la finalidad de lograr una completa estabilidad de los bordes del AM e inducir el menor grado posible de tracción y traumatismo, se inyectó lentamente 1.5 mL de líquido perfluorocarbonado (Decaline®, Bausch and Lomb) en el plano del nervio óptico, con una cánula 25 g de punta suave de silicón (valorando la TIO basados en el pulso arterial del nervio óptico). Después de la inyección del líquido perfluorocarbonado, se realizó una prueba para evaluar el cierre completo del agujero (Figura 2). Esta prueba consiste en acercar lentamente la cánula calibre 25 con punta suave de silicón mediante succión pasiva hacia el centro del AM, cuidando tocar lo menos posible los bordes del agujero (esto último con la finalidad de no estimular el sobrecrecimiento glial por manipulación extrema de tejidos). Se consideró como prueba positiva cuando el agujero quedaba libre de tracción tangencial por retiro adecuado de la MLI y se observaba con sus bordes elevados aplanados y completamente cerrado en forma regular (Figura 3). Se consideró como prueba negativa cuando el agujero quedaba aún con tracción tangencial por falta de retiro o retiro incompleto de la MLI y, aunque con aplanamiento de los bordes elevados mostraba, ya sea una mayor apertura (en el caso de falta de retiro), o bien, un cierre irregular incompleto con tracción sutil hacia el área de la persistencia de fragmento de la MLI (Figura 4).
Figura 2. inyección de líquido pesado mediante cánula de punta suave de silicón.
Figura 3. Prueba a través del líquido pesado, muestra el cierre completo del AMI lo que indica una disección total de la MLI.
Figura 4. Prueba a través del líquido pesado, muestra persistencia del AMI, lo cual indica una disección inadecuada de la MLI.
En los casos en los cuales se observó una prueba positiva, se retiró totalmente el líquido perfluorocarbonado y se procedió a un intercambio total líquido-aire-gas (hexafluoruro de azufre al 20%- SF6), dando por concluido procedimiento. En los casos en los que la prueba fue negativa, se procedió a marcar nuevamente la MLI con ATLC® y se repitió el procedimiento antes descrito. En ningún caso se utilizó colorante para comprobación.
En todos los casos se realizó indentación periférica en busca de desgarros de retina. Tanto en presencia como en ausencia de desgarros, se realizó la aplicación de dos líneas de coagulación con láser. Todos los pacientes fueron colocados en posición decúbito prono durante las primeras 72 horas posteriores a la cirugía.
Análisis estadístico
La tasa de éxito anatómico fue basada en el porcentaje del cierre completo del AM, mientras que la tasa de éxito funcional se baso en la ganancia de agudeza visual medida en el logaritmo de ángulo mínimo de resolución (logMAR). Para el análisis estadístico se utilizó la prueba t pareada y se consideró estadísticamente significativa una p<0.05.
Resultados
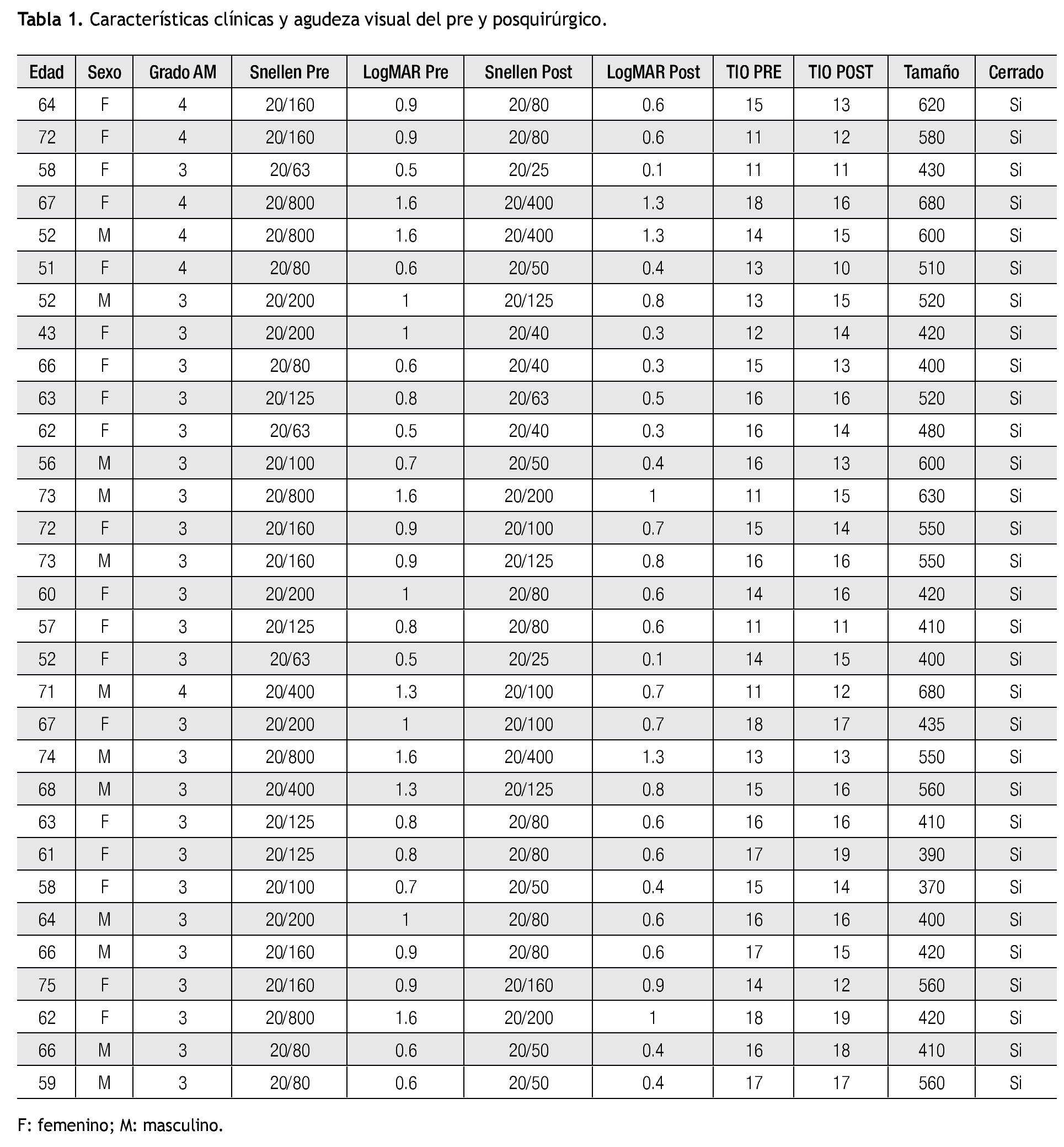
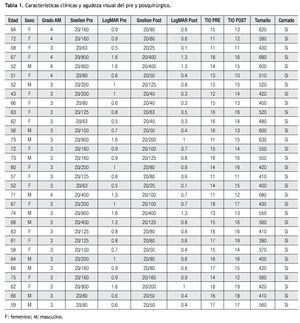
De los 31 pacientes incluidos, 19 pacientes fueron de sexo femenino (61%). En 20 de ellos, se intervino el ojo izquierdo (65%) y en el resto el derecho (35%). Veinticinco de los ojos tenían AMI grado 3 (81%) y seis grado 4 (19%), lo cual fue corroborado durante el acto quirúrgico. La media del diámetro del AMI fue de 500 micras (rango de 370-680 micras). La AVMC (logMAR) media preoperatoria fue de 0.9 (rango de 0.5-1.6).
Durante el procedimiento quirúrgico, en 28 ojos (90.3%) se obtuvo una prueba positiva después de la administración del líquido perfluorocarbonado en un primer intento, mientras que en los tres restantes (9.7%) se observó una prueba negativa. En estos últimos casos, se revaloró la adecuada disección de la MLI mediante un nuevo marcaje con ATLC®, encontrándose en un paciente ausencia de retiro y en los otros dos un retiro inadecuado. Después de la correcta disección de la MLI, se demostró la presencia de una prueba positiva.
Durante el procedimiento quirúrgico, en dos pacientes se generó una ruptura capsular posterior en el ojo intervenido, por lo cual se procedió a la colocación de un lente intraocular en surco. En dos de los ojos tratados se desarrollaron varios desgarros periféricos de retina, durante la separación del hialoides posterior.
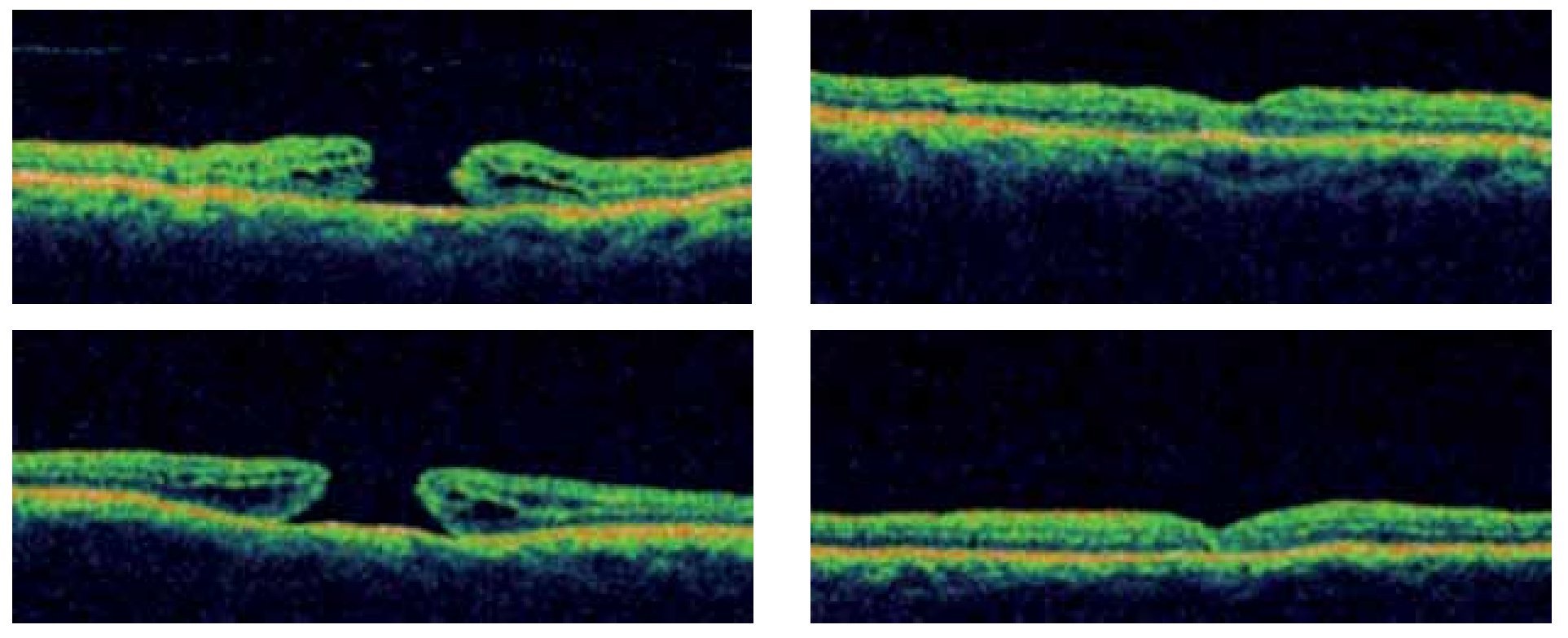
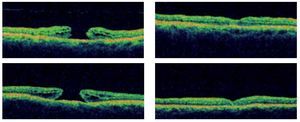
Después de 72 horas de la realización del procedimiento, en todos los ojos intervenidos se observó mediante fundoscopia una completa desaparición del líquido subrretiniano y el cierre completo de los bordes del AM. Estos hallazgos fueron corroborados mediante OCT realizada en el día siete, posterior al procedimiento quirúrgico (Figura 5).
Figura 5. Se muestra la tomografía de coherencia óptica de dos ojos con AMI completo en el preoperatorio, con el cierre total de ambos a los siete días del posoperatorio.
La AVMC (logMAR) media después de seis meses de la cirugía fue de 0.6 (rango de 0.1-1.3), lo cual representó una mejoría estadísticamente significativa en la agudeza visual con respecto a la medición basal prequirúrgica (p<0.001) (Tabla 1).
Dos pacientes presentaron blefaroedema posicional posquirúrgico principalmente en el ojo operado, el cual desapareció totalmente en ambos pacientes después de la primera semana de seguimiento. Seis ojos mostraron residuos de ATLC® en la glia central, los cuales no estaban ya presentes en el tercer mes de seguimiento. Un ojo mostró ATLC® subfoveolar, el cual había desaparecido para el tercer mes de seguimiento. Ningún ojo mostró reapertura del AMI durante el periodo de seguimiento.
Discusión
Hasta ahora, la cirugía convencional del AMI ha consistido en realizar una vitrectomía con disección del vítreo cortical de la zona macular con o sin retiro de MLI y tras ésta, introducir un taponador (aire, gas o aceite de silicón) en la cavidad vítrea. En la mayoría de los casos, el paciente debe realizar un posicionamiento de la cabeza en decúbito prono durante una a tres semanas, dependiendo del tipo de taponador utilizado. Los índices de éxito descritos en la literatura médica con esta técnica quirúrgica varían de 45% a 73%.31,32
Por otro lado, se han reportado índices de éxito de 91% a 97% cuando se han utilizado factores de estimulación del crecimiento, tales como el factor de crecimiento beta-2 o concentrado de plaquetas.6,10-12 En una serie similar a la nuestra, Santos y colaboradores reportaron el 100 % de cierre anatómico del AMI, sin importar la cronicidad del mismo.30
Nuestro estudio, aunque incluyó una muestra mínima necesaria para demostrar nuestros objetivos, ofrece pocas debilidades metodológicas por ser de naturaleza prospectiva y por el hecho de estandarizar las diferentes variables posibles de fracaso.
Basados en los mecanismos para la creación de la tracción tangencial en la mácula propuestos por Guyer y Green (incluyendo el movimiento de los fluidos intraoculares y las contracorrientes, el remodelado celular del vítreo cortical, y la contracción de una membrana fibrocelular en la interfase entre el vítreo cortical y la MLI),14 no hay duda de que la hialoides posterior debe ser retirada. Sin embargo, ha existido la duda de si la MLI debe o no ser retirada también, y en caso de ser retirada, cuál es la mejor sustancia o colorante para lograr una adecuada identificación y una segura disección de la misma. Diferentes artículos sugieren el retiro de la MLI y describen las ventajas y desventajas de los diferentes colorantes para identificar la misma.33-45
Estudios recientes han reportado el beneficio de la microplasmina en el AMI en etapas tempranas (grado 1 y 2).46,47 Esto orienta a pensar que el factor etiopatológico responsable de los AMI en fases tempranas es solamente la interfase vitreomacular, pudiendo en estos casos lograrse un éxito quirúrgico sin necesidad de disecar la MLI.
Hillencamp y colaboradores48 en un estudio en el que incluyeron 28 ojos con cierre posquirúrgico fallido, encontraron durante la reintervención quirúrgica, una adecuada disección primaria de la MLI. En este trabajo, los autores sugieren que la falta de uso de adyuvantes y de sobrerregulación glial inducida por el procedimiento quirúrgico per se, son los probables factores de fracaso en los casos un taponamiento inadecuado.
Yooh analizó ultraestructuralmente el material extraído mediante la cirugía de AMI y encontró un aumento en la frecuencia de éxito en el cierre quirúrgico a un 88%, sin retiro de la MLI.49 Por otra parte, Da Mata y colaboradores obtuvieron un 98% de éxito con retiro de la misma.50,51 Basados en estos antecedentes y en el 100% de éxito obtenido en nuestro estudio, creemos que la extracción de la MLI no solamente es razonable como tratamiento etiopatogénico, sino que es un paso necesario y decisivo para lograr el éxito anatómico en los casos de AMI grado 3 y 4.
Posiblemente el uso de colorantes como el verde de indocianina, azul de tripano o el azul brillante, aseguren la identificación más exacta de la MLI que el ATLC® utilizado en este estudio. Sin embargo, esta comparación no fue el propósito del mismo. A diferencia del éxito funcional, es posible que el éxito anatómico no dependa del tipo de marcador utilizado, sino de la pericia del cirujano.
Otros factores probables de fracaso son la larga evolución del AMI,4,37,52,53 y el grado avanzado del mismo.52,53 En distintos estudios realizados por Santos, Hillecamp y Scott, no se encontró una significancia estadística relacionada con estos factores.30,48,54 En nuestro estudio eliminamos este riesgo de fracaso al sólo incluir pacientes con datos subjetivos de evolución del AMI de menos de seis meses.
En relación al taponador y la posición del paciente en las primeras horas posteriores a la cirugía, en la mayor parte de los estudios reportados se ha utilizado gas hexafluoruro de sulfuro (SF6) al 20% o gas perfluoropropano (C3F8) al 15%, y los pacientes permanecen en posición decúbito prono por lo menos durante 48 horas. Existen reportes que aseguran un éxito quirúrgico de 90% a 93% en una sola cirugía con el uso de gas SF6 o C3F8, sin la necesidad de guardar una posición prona.55-58 Gesser reportó un éxito de 79% utilizando solamente aire como taponeador, con posición prona por un periodo de tiempo corto.59 Por otra parte, Rizzo y Lappas han descrito las bondades del uso de aceite de silicón pesado (Densiron-68) en el tratamiento de AMI fallido.60,61
En un estudio reciente de 33 pacientes operados de AMI, Eckardt reportó un cierre del 54.5% en las primeras 24 horas del posoperatorio y de 77.8% durante las primeras 48 horas, colocando al paciente en posición decúbito prono.62 Estos datos estuvieron basados en imágenes tomadas mediante OCT modificado. El autor concluye que usando un monitoreo con OCT, más de la mitad de sus pacientes (54%) lograron dejar la posición prono después de 24 horas, mientras que esto ocurrió en 21% después de 48 horas y en 24% después 72 horas. En nuestro estudio, todos los pacientes mantuvieron una posición prona durante 72 horas. Estos resultados, sugieren que en los casos en los que no se pueda monitorizar los ojos mediante OCT modificado, debe indicarse una posición en decúbito prono durante por al menos 72 horas.
Los reportes de Muqit y Oster basados en imágenes tomadas mediante OCT durante el seguimiento posquirúrgico, ayudan a entender mejor la dinámica de los fluidos en la interfase "mácula-taponeador". Sus observaciones sugieren que el mejor taponeador es el que mantenga esta interfase lo más estrecha posible, para impedir el tránsito de fluidos a través de la misma.63,64 Pensamos que el gas SF6 es el mejor material posible para mantener esta interfase libre de fluidos o "seca", por el tiempo mínimo necesario para cerrar el agujero.
Conclusión
Mediante la técnica quirúrgica utilizada en este estudio, la mejoría en la visión de nuestros pacientes fue de más de dos líneas. La escasa manipulación de tejidos mediante el uso de líquido perfluorocarbonado, ofrece una menor inducción en la sobreproducción de glia y genera un menor traumatismo tisular, que el producido con otras técnicas (aposición de bordes de agujero por medio de manipulación mecánica).
La prueba realizada mediante el uso del líquido pesado, demostró un adecuado retiro de la MLI en el primer intento, en el 90.3% de los casos. Adicionalmente, aseguró el éxito en el retiro inadecuado (no identificado) de la MLI, ocurrido en el 9.7% de nuestros casos. El éxito obtenido en los resultados anatómicos fue de 100%.
Conflicto de intereses
Los autores no tienen interés comercial o financiero con las casas comerciales de los medicamentos, aparatos o instrumental quirúrgico utilizados en el presente estudio
Recibido: Agosto 2011. Aceptado: Enero 2012
Correspondencia:
Dr. Med. Jesús Hernán González Cortés.
Madero y Gonzalitos S/N.
Mitras Centro.
Monterrey, N.L., México.
Teléfono: (81) 8346 9259. Fax: (81) 8348 7229.
Correo electrónico: drjesusgzz@gmail.com