Candida parapsilosis ha emergido como agente importante de fungemia en varias regiones geográficas, incluido México. En el entorno clínico esta levadura oportunista se ha asociado con las manos de trabajadores del área de salud, y es particularmente frecuente en infecciones sistémicas en neonatos prematuros de bajo peso, pacientes cateterizados, además de sujetos bajo esquemas de hiperalimentación intravenosa. C. parapsilosis es un complejo de tres especies: Candida parapsilosis sensu stricto, Candida orthopsilosis y Candida metapsilosis, con diferencias importantes en cuanto a virulencia y susceptibilidad antifúngica.
Candida parapsilosis has emerged as an important agent of fungemia in various geographic regions, even in Mexico. In the clinical setting, this opportunistic yeast has been associated with the hands of healthcare workers, and is particularly related to bloodstream infections in low weight birth neonates, catheterized patients and subjects under intravenous hyperalimentation schemes. C. parapsilosis is a complex of three species named: Candida parapsilosis sensu stricto, Candida orthopsilosis and Candida metapsilosis, with important differences in virulence and antifungal susceptibility.
Introducción
Candida parapsilosis es un hongo levaduriforme que fue aislado por primera vez en 1928, a partir de las heces de un paciente con diarrea en Puerto Rico.1 La levadura fue nombrada originalmente Monilia parapsilosis y aunque en un principio se le consideró el anamorfo del ascomiceto Lodderomyces elongisporus, diversos estudios probaron que se trataba de un taxón distinto.2,3
C. parapsilosis es un microorganismo diploide morfológicamente caracterizado por células redondeadas, ovales o alargadas y producción de seudohifas.4 Éstas últimas se encuentran vinculadas de manera importante a un conjunto específico de aminoácidos, particularmente citrulina, la cual origina cambios importantes en la morfología celular y colonial del microorganismo.5C. parapsilosis es incapaz de formar hifas verdaderas.4
Este microorganismo se ha aislado frecuentemente de piel y uñas de las manos de enfermeras y otros profesionales del área de salud, de donde forma parte de la flora comensal humana normal. También se ha aislado de dispositivos médicos tales como catéteres intravasculares, líneas de nutrición parenteral, entre otros dispositivos prostéticos.6,7 Recientemente se le ha considerado a C. parapsilosis como un importante patógeno emergente, asociado de manera creciente a un amplio espectro clínico de infecciones.6
Variabilidad genética
En 1987, Scherer y Stevens8 propusieron la aplicación de la técnica molecular "Fragmentos de Restricción de Longitud Polimórfica" (RFLP, por sus siglas en inglés), para el análisis de variabilidad genética en aislamientos clínicos de C. parapsilosis. En sus estudios descubrieron tres distintos patrones de restricción no reportados previamente en la literatura médica, con lo cual se sugirió que C. parapsilosis poseía una elevada variabilidad genética. Posteriormente, en 1992, Lehmann y colaboradores9 utilizando la técnica de "ADN Aleatoriamente Amplificado" (RAPD, por sus siglas en inglés), encontraron tres distintos patrones de bandeo en aislamientos de C. parapsilosis, los cuales fueron clasificados dentro de tres diferentes grupos bajo la misma especie (Candida parapsilosis grupo I, Candida parapsilosis grupo II y Candida parapsilosis grupo III).
Por su parte, en 1995 Lin y colaboradores10 basados en perfiles de actividad enzimática, además de la secuenciación del Espaciador Transcripcional interno 1 (ITS1, por sus siglas en inglés); y Roy y Meyer11 en 1998, apoyados en estudios de homología del ADN y patrones de restricción, confirmaron la existencia de tres distintos genotipos de C. parapsilosis pobremente relacionados a nivel de especie, apoyando con esto su división temprana en tres especies filogenéticamente independientes.
Finalmente, en 2005 Tavanti y colaboradores12 tras comparar la secuencia del ITS1 de los tres grupos de C. parapsilosis con la de otras 15 especies de Candida y Saccharomyces cerevisiae, reportaron que C. parapsilosis grupo II y C. parapsilosis grupo III se encontraban más relacionadas filogenéticamente entre ellos que con respecto a C. parapsilosis grupo I, y que la distancia filogenética que separaba a Candida dubliniensis de Candida albicans es la misma que separaba los tres grupos de C. parapsilosis. Motivo por el cual fue necesaria una reestructuración del complejo, por lo que se sugirió que todos los microorganismos anteriormente conocidos como C. parapsilosis grupo I se designaran únicamente como Candida parapsilosis sensu stricto, y propusieron la creación de dos nuevas especies: Candida orthopsilosis, para designar a aquellos microorganismos previamente conocidos como C. parapsilosis grupo II y Candida metapsilosis, para nombrar a aquellos microorganismos conocidos con anterioridad como C. parapsilosis grupo III.
Espectro clínico
C. parapsilosis se encuentra asociada a una amplia gama de entidades clínicas, desde infecciones superficiales, las cuales afectan principalmente el lecho ungüeal de uñas tanto de manos como de pies, piel, incluso oído medio, hasta infecciones sistémicas que pueden llegar a comprometer la vida del paciente. Eventualmente, se han reportado casos esporádicos de peritonitis, endoftalmitis, trastornos articulares, entre otros, debidos a este complejo de microorganismos.6
Infecciones superficiales
C. parapsilosis frecuentemente es responsable de lesiones en uñas y piel, con onicomicosis de tipo subungüeal distal.13,14 Dentro de los factores de riego significativamente asociados con colonización en pacientes se encuentran: trastornos crónico-degenerativos, particularmente la diabetes mellitus, así como la obesidad, inmunosupresión, antibioticoterapia prolongada, nutrición parenteral, alargadas estancias hospitalarias, cirugía y la utilización de dispositivos de asistencia médica.13,15
Infecciones en mucosa
La principal mucositis debida a C. parapsilosis es la vulvovaginitis.7 Después de la vaginosis bacteriana, la candidosis vaginal es la segunda causa de infección vaginal más común en mujeres en los Estados Unidos16 y C. albicans se encuentra asociada con el 85% al 95% de los casos. Sin embargo, recientemente hubo un incremento en el número de casos de vulvovaginitis debida a otras especies de Candida, particularmente C. parapsilosis, lo cual se vinculó principalmente al uso indiscriminado de derivados azólicos.6,17
El papel de C. parapsilosis como un patógeno vaginal y su relevancia como agente causal de vulvovaginitis normalmente tiende a ser cuestionable, particularmente por su papel como levadura comensal.17 Sin embargo, las cepas vaginopáticas se caracterizan por una mayor secreción de proteinasas aspárticas,18 lo cual conlleva una importante implicación clínica, ya que estas enzimas pueden comprometer la integridad normal de la vagina por hidrólisis de la inmunoglobulina A de la mucosa,19 una de las más efectivas barreras vaginales contra la infección.
Infecciones del tracto urinario
Las infecciones urinarias originadas por C. parapsilosis no son frecuentes.6 Sin embargo, han aumentado notablemente en los últimos años y se encuentran asociadas principalmente con la utilización de sistemas de drenaje urinario.20,21 La adherencia del microorganismo a la superficie de los mismos es un factor determinante en la colonización e infección.21
Infecciones sistémicas
Durante la década de los ochenta C. albicans fue considerada el principal agente etiológico de candidosis diseminada, representando más del 70% de la mayor parte de los casos de infección por Candida.22 Para los noventa, la incidencia había disminuido a cerca del 50% de todas las infecciones nosocomiales por hongos, razón por la cual se describió un notable cambio epidemiológico hacia otras especies que en conjunto se denominaron Candida no-albicans (entre las que se encuentran: C. parapsilosis, C. glabrata, C. tropicalis y C. krusei). Esta tendencia tiene implicaciones clínicas obvias, debido a que muchas de estas especies son usualmente menos susceptibles a los antifúngicos convencionales que C. albicans, lo cual puede requerir un abordaje terapéutico diferente.23
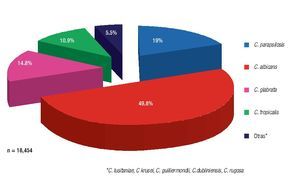
En 2008, Trofa y colaboradores6 reportaron el posicionamiento de C. albicans como el principal agente causal de la mayor parte de las fungemias alrededor del mundo, por lo menos en los últimos 17 años, con un 49.8% de aislamiento, encontrándose precedida por C. parapsilosis con un 19%, la cual es una de las más importantes especies no-albicans responsable de candidosis diseminada (Figura 1).
Figura 1. Frecuencia de aislamiento de Candida spp. en sangre a nivel mundial (1991-2008).
La frecuencia de candidosis diseminada debida a C. parapsilosis se ha incrementado en los últimos años, sobretodo en América Latina,24,25 en donde actualmente se cuenta con dos importantes estudios de vigilancia epidemiológica. En 2006, Colombo y colaboradores26 reportaron que con un 40.9% de incidencia, C. albicans era el principal agente etiológico de candidosis en Brasil, precedida por C. tropicalis y C. parapsilosis con un 20.9% y 20.5% de incidencia, respectivamente. Por otra parte, en México (particularmente en Monterrey, Nuevo León), González y colaboradores27 reportaron en 2008 que C. parapsilosis era el principal agente causal de candidosis en dicha región, con un 37.9% de incidencia, encontrándose precedida con un 31.9% y 14.8% de incidencia por C. albicans y C. tropicalis, respectivamente. Recientemente Treviño-Rangel y colaboradores28 reportaron que C. parapsilosis sensu stricto es la especie más frecuente del complejo C. parapsilosis en Monterrey, Nuevo León, siendo particularmente habitual en sangre. Además de la única especie en mostrar resistencia in vitro a fluconazol y las equinocandinas, principales antifúngicos utilizados para el manejo clínico convencional de la candidosis diseminada.
Las infecciones por C. parapsilosis se ha atribuido a varios factores de riesgo, incluyendo la capacidad selectiva del microorganismo para proliferar en soluciones para hiperalimentación intravenosa y su afinidad por dispositivos intravasculares y materiales prostéticos.
Los individuos inmunocomprometidos, como pacientes con VIH/SIDA y aquellos recientemente sometidos a procedimientos quirúrgicos, particularmente a cirugía del tracto gastrointestinal, se encuentran en alto riesgo de infección por C. parapsilosis. Adicionalmente, pacientes que requieren el uso prolongado de catéteres venosos centrales o dispositivos médicos, como pacientes con padecimientos oncológicos,29 se encuentran en elevado riesgo de infección por dicho microorganismo.6
La población que se encuentra en especial riesgo de infección nosocomial por C. parapsilosis son los neonatos prematuros de bajo peso.6 La colonización de la piel o del tracto gastrointestinal es frecuentemente el primer paso en la patogénesis de la candidosis diseminada, y los neonatos se encuentran especialmente propensos a la enfermedad dada la comprometida integridad de su piel, susceptibilidad frente a infecciones del tracto gastrointestinal, necesidad de catéteres venosos centrales por largo tiempo e intubación endotraqueal prolongada.30
Endocarditis
Entre las endocarditis relacionadas con levaduras, C. parapsilosis es la especie no-albicans más comúnmente aislada. Los factores de predisposición más relevantes son: la utilización de válvulas prostéticas, el consumo intravenoso de drogas, nutrición parenteral, antibioticoterapia prolongada, enfermedad preexistente de válvulas cardiacas, episodios previos de endocarditis y cirugía cardiovascular reconstructiva.31,32
El tejido cardiaco más comúnmente afectado es la válvula aórtica (56.9%), seguida de la válvula mitral (29.1%), válvula tricúspide (4.1%), pared ventricular (2.8%) y válvula pulmonar (1.4%), principalmente. El rango de mortalidad comprende del 42% al 65%. Las complicaciones más comunes son embolia periférica y eventos hemorrágicos (44%).31
Peritonitis
La peritonitis fúngica se asocia a una seria morbilidad y posee una tasa de mortalidad por encima del 44%,33 se trata de una complicación poco común pero potencialmente fatal de la diálisis peritoneal ambulatoria continua y C. parapsilosis se convirtió en los últimos años en el agente etiológico más prevalente de dicha entidad clínica.34 Este microorganismo posee la habilidad, bajo elevadas concentraciones de glucosa, de adherirse fácilmente a material prostético con extensa formación de biopelícula en la superficie de catéteres plásticos.7 El elevado contenido de glucosa del dializado y la implantación del catéter constituyen importantes factores que predisponen a pacientes que requieren de diálisis peritoneal a peritonitis fúngica debida a C. parapsilosis.34
Endoftalmitis
C. parapsilosis se encuentra con poca frecuencia vinculado con enfermedades oculares invasivas. La endoftalmitis causada por C. parapsilosis ha sido relacionada con extracción quirúrgica de catarata, trasplante de córnea, implantación de lentes intraoculares y tratamiento con esteroides.35
Trastornos articulares
La artritis fúngica es poco frecuente y se ha asociado al consumo intravenoso de drogas.36 La artritis causada por C. parapsilosis se encuentra relacionada principalmente con prótesis articulares, probablemente debido a la habilidad del microorganismo para adherirse al plástico,37 así como también a la inoculación directa del hongo en procedimientos de artrocentesis. La artritis fúngica se ha relacionado con individuos de edad avanzada y dentro de los factores de predisposición se encuentran: diabetes mellitus e inmunosupresión.38
Pancreatitis
La pancreatitis fúngica debida a especies de C. no-albicans ha incrementado su incidencia en los últimos años y es atribuible a diversos factores, entre los que destacan: el uso de antibióticos de amplio espectro, nutrición parenteral, así como el uso de agentes inmunosupresores.39 Se han descrito pocos casos de infecciones pancreáticas ocasionadas por C. parapsilosis, principalmente necrosis y abscesos pancreáticos.40,41
Meningitis
Las infecciones fúngicas del sistema nervioso central conllevan riesgos serios y potencialmente fatídicos y pueden ser causadas por una amplia gama de hongos,6 siendo las especies del género Candida las típicamente relacionadas con cuadros clínicos de meningitis neutrofílica aguda.42C. parapsilosis es un agente poco frecuente de meningitis fúngica.6 La cirugía, terapia antibiótica, nutrición parenteral, foliculitis cutánea y el uso de catéteres intravasculares e intraventriculares constituyen importantes factores de riesgo para adquirir la enfermedad.43
Diagnóstico de laboratorio
La caracterización rigurosa de levaduras se efectúa principalmente por sus características fisiológicas o bioquímicas, mediante la utilización de ciertos métodos, los cuales se pueden clasificar de manera general, por una parte en sistemas de identificación manual, siendo el sistema API 20C AUX el más importante y por otro lado, en sistemas de identificación automatizada, de entre los que destacan el MicroScan y el Vitek.44
Debido a la elevada variabilidad genética inherente en C. parapsilosis, los métodos microbiológicos convencionales no son de gran utilidad para la diferenciación de las especies que conforman el complejo, por lo que se han implementado diversas metodologías de identificación molecular, basadas principalmente en RFLP,12,45 secuenciación de la región no codificante ITS,46,47 perfiles de ADN mitocondrial48 y la utilización de marcadores micro-satelitales.49 Por otro lado, el método "Amplificación de Fragmentos de Longitud Polimórfica" (AFLP, por sus siglas en inglés), también se ha utilizado no sólo para confirmar la identificación de especie, sino también para evaluar la relación genética de C. parapsilosis,50C. orthopsilosis51 y C. metapsilosis.52 Sin embargo, pese a su elevada sensibilidad y robustez, todas estas técnicas consumen mucho tiempo, haciéndolas poco prácticas y difícilmente adaptables a la rutina actual del diagnóstico clínico. En 2008 se desarrolló una "Reacción en Cadena de la Polimerasa" (PCR, por sus siglas en inglés), con la finalidad de identificar seis especies clínicamente relevantes de Candida, incluyendo C. parapsilosis.53 sin embargo, esta técnica no se optimizó para permitir la identificación precisa de las especies que conforman el complejo C. parapsilosis. Hays y colaboradores54 desarrollaron una prueba rápida utilizando la misma técnica molecular, capaz de discriminar mediante análisis de curvas "melting" las tres especies estrechamente relacionadas, por lo que este nuevo enfoque podría resultar muy útil para futuras investigaciones clínicas y epidemiológicas.
Virulencia
La patogénesis de la infección debida a C. parapsilosis se basa en diversos factores de virulencia que posee el microorganismo, primordialmente su adherencia a las células del hospedero, su capacidad de producir extensas biopelículas, así como la secreción de ciertas enzimas hidrolíticas.6 Adicionalmente, se ha señalado la capacidad de C. parapsilosis para la generación de seudohifas/"cambio fenotípico" como otro importante factor de virulencia del microorganismo.7 A pesar de intensos esfuerzos encaminados a la elucidación de los mecanismos de patogenicidad inherentes en hongos, se conoce relativamente poco acerca de los factores de virulencia de C. parapsilosis.6
Adherencia
La colonización e infección por C. parapsilosis dependen de la habilidad del microorganismo para adherirse a las células y tejidos del hospedero, particularmente superficies mucosas. La adherencia a dispositivos médicos facilita la formación de biopelículas y ocasiona daño en el hospedero.6 La hidrofobicidad de la superficie celular se ha asociado con la adherencia inicial de C. parapsilosis a superficies,55 así como la producción de limo se ha relacionado con la tendencia del microorganismo para adherirse a catéteres plásticos.56
Formación de biopelículas
Las biopelículas son comunidades de microorganismos asociadas a superficies dentro de una matriz extracelular, y son el tipo más prevalente de crecimiento microbiano.57 La mayoría de los estudios sobre formación de biopelículas se han efectuado en C. albicans, en donde se ha asociado con el cambio dimórfico de levadura a crecimiento hifal. La estructura de las biopelículas producidas por C. albicans involucra dos capas distintas: una delgada, capa basal constituida básicamente de levaduras, y una gruesa, capa hifal menos compacta.58 En contraste, C. parapsilosis no produce hifas verdaderas y genera cuantitativamente menos biopelícula y de menor complejidad que C. albicans.59
La formación de biopelículas es un importante factor de virulencia para varias especies de Candida, ya que limita la penetración de antifúngicos a través de la matriz, confiriendo resistencia significativa a la terapia, además de protección frente a la respuesta inmune del hospedero. La capacidad de diferentes aislamientos de C. parapsilosis para causar enfermedad en varios tejidos puede encontrarse influenciada por su habilidad para formar biopelículas.6
En 2005 song y colaboradores60 reportaron que C. parapsilosis sensu stricto era la única especie del complejo capaz de producir biopelículas. Sin embargo, Lattif y colaboradores61 reportaron que C. orthopsilosis y C. metapsilosis también eran capaces de producirlas. La topografía de superficie de las biopelículas generadas por las tres especies del complejo es muy similar y se encuentra conformada por conglomerados de levaduras dispuestos irregularmente.
Secreción de enzimas
En años recientes las enzimas secretadas de manera extracelular por patógenos microbianos han ganado creciente interés, debido a su papel potencial en la patogénesis de las enfermedades y como blancos terapéuticos para el diseño de inhibidores sintéticos, esto último como probable aplicación en el manejo clínico de la infección.6 Estas enzimas incluyen principalmente las proteinasas aspárticas, fosfolipasas y lipasas.
- Proteinasas aspárticas. Las proteinasas aspárticas facilitan la invasión y colonización de los tejidos del hospedero por ruptura de las membranas citoplasmáticas del mismo,62 y degradando importantes proteínas de defensa inmunológica y estructural, tales como las cadenas pesadas de las inmunoglobulinas G, macroglobulina a2, proteína C3, b-lactoglobulina, lactoperoxidasa, colágeno y fibronectina.63
La producción de proteinasas aspárticas varía entre aislamientos de C. parapsilosis y su papel en la patogénesis aún permanece sin esclarecerse.6
Sin embargo, hay cierta tendencia que relaciona la producción de estas enzimas y el sitio de aislamiento de C. parapsilosis, ya que las proteinasas aspárticas parecen ser menos importantes en la patogénesis de infecciones del torrente sanguíneo que en la enfermedad invasiva localizada, particularmente en infecciones de la mucosa vaginal.64,65
- Fosfolipasas. Las fosfolipasas son enzimas capaces de hidrolizar uniones tipo éster en glicerofosfolípidos.6 La función de las fosfolipasas durante el proceso infeccioso debido a C. parapsilosis aún no se comprende del todo, aunque se hipotetiza que se encuentran involucradas en la ruptura de las membranas de las células del hospedero.66,67
- Lipasas. Las lipasas catalizan tanto la hidrólisis como la síntesis de triacilgliceroles y se caracterizan por su estabilidad a altas temperaturas y en solventes orgánicos, elevada enantioselectividad y resistencia a la proteólisis.68 Algunas de las funciones más importantes de estas enzimas incluyen la digestión de lípidos para adquisición nutricional, adhesión a células y tejidos del hospedero, interacciones sinérgicas con otras enzimas y la autodefensa mediada por el lisado de la microflora competitiva.69
El único reporte publicado a la fecha referente a la evaluación in vitro de enzimas extracelulares por parte de las especies del complejo C. parapsilosis es el efectuado por Ge y colaboradores70 en 2011, en el cual se estudió una colección de 31 aislamientos clínicos (20 de C. parapsilosis sensu stricto y 11 de C. metapsilosis) y se encontró que la mayor parte de los aislamientos de ambas especies eran productores tanto de fosfolipasa como de proteinasa aspártica, mientras que la esterasa fue producida tan sólo por un aislamiento de C. parapsilosis sensu stricto y dos aislamientos de C. metapsilosis.
Formación de seudohifas/"cambio fenotípico"
La baja virulencia de C. parapsilosis comparada con C. albicans puede ser atribuida a su incapacidad para formar hifas verdaderas.7 Muchas especies de Candida, incluyendo C. parapsilosis existen como blastoconidias esféricas u ovoides,71 y son capaces en diversos grados de producir cadenas de blastoconidias alargadas, llamadas seudohifas, tanto in vivo, como bajo ciertas condiciones, in vitro.7 Las hifas verdaderas son más difíciles de fagocitar y las paredes celulares pueden ser más resistentes a la digestión. Adicionalmente, las hifas verdaderas se definen como más adhesivas a las células huésped que las seudohifas.72
El "cambio fenotípico" es un fenómeno de inestabilidad fenotípica específica, que permite a las cepas cambiar su morfología colonial sin afectar su genotipo identificable,73 y aunque se ha estudiado ampliamente en C. albicans, se ha determinado este fenómeno también en C. parapsilosis.74 Diversos reportes indican que existe cierta correlación entre el "cambio fenotípico" y la formación de biopelícula.71
Actualmente son escasos los estudios de virulencia en el complejo C. parapsilosis. En 2007 Gácser y colaboradores75 estudiaron el comportamiento in vitro de las tres especies del complejo en tejido epitelial oral y epidermis, y encontraron que C. parapsilosis sensu stricto y C. orthopsilosis ocasionaban alteraciones histopatológicas muy semejantes en ambos tejidos, principalmente reportaron el cambio en la arquitectura celular en el epitelio oral y desprendimiento de la lámina basal en la epidermis, mientras que C. metapsilosis fue la especie que menor daño tisular originó. Este hecho, aunado al hallazgo posterior de la elevada susceptibilidad de C. metapsilosis en comparación de C. parapsilosis sensu stricto y C. orthopsilosis frente a la actividad antifúngica (fagocitosis) de la línea celular Bv2 (microglia murina), permitió catalogar a C. metapsilosis como la especie menos virulenta del complejo.76 Sin embargo, a la fecha no se cuenta con ensayos in vivo que corroboren esta teoría y permitan esclarecer si es que existe o no diferencia en la patogénesis de la infección, ocasionada por éstos importantes patógenos oportunistas.
Tratamiento antifúngico y resistencia
Actualmente no hay consenso respecto al tratamiento de la enfermedad invasiva originada por C. parapsilosis, aunque el manejo terapéutico habitualmente incluye la extracción de cualquier cuerpo extraño removible, así como la administración de antifúngicos sistémicos,6 entre los que se encuentran: anfotericina B, ciertos compuestos azólicos, flucitosina y las equinocandinas.
Las equinocandinas son una nueva línea de agentes antifúngicos e incluyen la caspofungina, la micafungina y la anidulafungina. Estos fármacos interfieren en la síntesis de la pared celular por inhibición no competitiva de la b-1,3-D-glucano sintetasa, una enzima que genera polímeros de glucano, el principal componente de la pared celular fúngica.6 La caspofungina posee una potente actividad antifúngica y ha mostrado ser tan efectiva y de menor toxicidad que la anfotericina B en el tratamiento de la candidosis diseminada causada por C. albicans, C. parapsilosis, C. tropicalis, C. glabrata, C. krusei, C. guilliermondii, C. lipolytica y C. rugosa.77,78 Sin embargo, las concentraciones mínimas inhibitorias (CMI) de caspofungina para C. parapsilosis son altas en comparación a las otras especies de Candida, con valores promedio de CMI50 y CMI90 comprendidos entre 0.85 a 2 µg/ml y 2 a 2.33 µg/ml, respectivamente.57,79,80 Esta tendencia en susceptibilidad de C. parapsilosis se extiende también a otras equinocandinas. Por ejemplo, micafungina posee una CMi50 promedio de 1 µg/ml y una CMI90 promedio≥ 2 µg/ml para C. parapsilosis, 80,81 mientras que anidulafungina tiene una CMI50 promedio de 2 µg/ml y una CMI90 promedio ≥ 2 µg/ml.80,82
Aunque el origen de la resistencia in vitro de C. parapsilosis a las equinocandinas aún no se encuentra claramente comprendido, se hipotetiza que puede ocurrir debido a cambios en la subunidad FKS1 de la glucano sintetasa.83 El complejo C. parapsilosis posee frecuentemente un polimorfismo que resulta en la sustitución de una alanina en la posición 660 por una prolina conservada, presente en la subunidad FKS1 de otros hongos.84 La cadena respiratoria mitocondrial única de C. parapsilosis podría jugar también un papel importante para su baja susceptibilidad a las equinocandinas, como lo demostraron Chamilos y colaboradores85 al observar una disminución en la CMI de caspofungina, después de una inhibición simultánea de todas las vías respiratorias del microorganismo.
Pese a los reportes de resistencia in vitro de C. parapsilosis sensu stricto frente a las equinocandinas, actualmente son escasos los estudios en modelos animales que respalden la eficacia terapéutica de estos antifúngicos. Salas y colaboradores86 reportaron en 2011, que la anidulafungina administrada en una dosis de 5 y 10 mg/ Kg era capaz de prolongar significativamente la sobrevida de ratones infectados con una cepa de este microorganismo resistente in vitro (CMI = 2 µg/ml), respecto al grupo control, pero no fue capaz de reducir la carga fúngica a nivel tisular.
Conclusiones
Su amplio patrón de distribución en la naturaleza, su creciente incidencia en varias partes del mundo, su relativamente alta frecuencia de resistencia a las equinocandinas, además de la escasa información con la que se cuenta hasta el momento dejan en claro que C. parapsilosis es un importante patógeno oportunista, representando una amenaza desafiante que pone de manifiesto la necesidad de implementar programas locales y nacionales de monitoreo clínico-epidemiológico de candidosis, así como investigación básica y aplicada para un mejor entendimiento de la patogénesis de la infección ocasionada por este complejo de patógenos, facilitando con ello el desarrollo de nuevas estrategias terapéuticas.
Recibido: Febrero 2012. Aceptado: Junio 2012
Correspondencia:
M.C. Rogelio de J. Treviño-Rangel,
Departamento de Microbiología, Facultad de Medicina, Universidad Autónoma de Nuevo León.
Av. Madero y Dr. Eduardo A. Pequeño s/n, Colonia Mitras Centro.
C.P. 64460. Monterrey, N.L., México.
Teléfono: (5281) 8329 4177. Fax: (5281) 8676 8605.
Correo electrónico: roghe24@gmail.com