Introducción
El cáncer gástrico es una de las principales causas de muerte por cáncer en el mundo.1 En el 2007, murieron 11 388 personas en Estados Unidos a causa de ésta patología.2 En México, la frecuencia de cáncer gástrico disminuyó en los últimos 25 años de 59% a 38% en el Hospital General de México y ascendió de 32% a 34% en el Instituto Nacional de la Nutrición.3 La sobrevida a cinco años de los pacientes en los que se diagnostica el cáncer gástrico después de que ha invadido la muscular propia es de alrededor de 20%. En cambio, si el diagnóstico es en etapas tempranas (involucro de la mucosa y la submucosa), la tasa de sobrevida aumenta a 90%.4
En el modelo de progresión del cáncer gástrico distal, la mucosa gástrica se ve afectada por un proceso inflamatorio crónico, relacionado con infección por Helicobacter pylori,5 posteriormente presenta cambios que se manifiestan como atrofia de las glándulas en la región del cuerpo y antro. Eventualmente, la lesión progresa a metaplasia intestinal, displasia y por último, carcinoma.6 La gastritis crónica atrófica (GCA) está relacionada con el tipo más común de cáncer gástrico, que es el adenocarcinoma de tipo intestinal y el riesgo de cáncer se encuentra relacionado con la gravedad y la extensión de la atrofia.7,8
El estándar de oro para el diagnóstico de la GCA, es el estudio anatomopatológico de biopsias obtenidas por endoscopia. Las limitaciones de éste método son la variabilidad interobservador y la calidad variable de las muestras, además de la necesidad de realizar la endoscopia.9
Con el fin de realizar una adecuada evaluación de la GCA, así como de la infección por H. pylori, el sistema de Sydney sugiere que se obtengan cinco biopsias: dos del antro, una de la incisura angularis y dos del cuerpo del estómago.10 Otro método diagnóstico utilizado es la cromoendoscopia, la cual se realiza solamente en algunos centros y requiere más tiempo su realización que una endoscopía convencional.11
En los países de alta prevalencia de cáncer gástrico, como Japón, se realiza escrutinio a los individuos mayores de 40 años mediante endoscopia12 y la recomendación actual en este país es realizar el examen mediante fotofluorografía.13
Desde hace 20 años se ha estudiado la posibilidad de hacer el diagnóstico de GCA por medio de la medición de los niveles séricos de pepsinógeno I (PGI), Pepsinógeno II (PGII), 17- Gastrina (G-17) y anticuerpos anti- H. pylori.6,14 El nivel de PGI o la relación sérica de PGI/PGII refleja con alta confiabilidad el número de células y el número de glándulas oxínticas en el cuerpo del estómago, es decir, refleja el grado de atrofia a este nivel. Por otro lado, la secreción de G-17 puede ser estudiada mediante estimulación proteica. La falta de incremento del nivel sérico basal de G-17 posterior a la ingesta de proteínas demuestra pérdida de células G, lo cual es también un indicador de atrofia en la mucosa antral.15-18
Se ha propuesto que un panel serológico que incluya los niveles séricos de G-17, PGI y PGII en asociación con anticuerpos anti-H. pylori podría permitir el diagnóstico de atrofia gástrica y así poder identificar a los pacientes en riesgo de desarrollar cáncer gástrico. No obstante, dado que se ha encontrado un valor predictivo positivo bajo, existen dudas en cuanto a su utilidad en países con baja prevalencia de cáncer gástrico.19
Objetivo
Determinar si los niveles séricos de pepsinógeno I, pepsinógeno II, gastrina 17 y anticuerpos IgG contra H. pylori son de utilidad para el diagnóstico de gastritis crónica atrófica en una población del Noreste de México.
Métodos
Población de estudio: Se estudiaron de manera prospectiva 50 pacientes con una edad de entre 50 y 100 años (media de edad: 69 años, 36 mujeres y 14 hombres), los cuales tenían una indicación de endoscopia superior por síntomas dispépticos con un valor dentro de la escala de Glasgow mayor a seis, que aceptaron participar en el estudio con consentimiento informado. El presente trabajo fue aprobado por el Comité de Ética de nuestra institución. Se excluyó a los pacientes con examen endoscópico incompleto, indicación de endoscopia por otras causas diferentes a estudio diagnóstico, endoscopia en caso de emergencia o sangrado, así como en el caso de pacientes en donde el resultado requiriera tratamiento inmediato.
Diseño del estudio: Se validaron los síntomas dispépticos mediante la aplicación de la escala de Glasgow,20 posteriormente se realizó una endoscopia superior y cromoendoscopia con azul de metileno para evaluar la presencia de metaplasia intestinal. Se obtuvieron al menos 12 biopsias gástricas, correspondientes al antro, incisura angularis, cuerpo y cardias. Las biopsias fueron evaluadas de acuerdo al sistema actualizado de Sídney por un anatomopatólogo cegado a los resultados de las pruebas serológicas y la endoscopia.10 Se estudió mediante cromoendoscopia la presencia de datos que sugirieran metaplasia intestinal y se tomaron biopsias dirigidas. Todas las muestras se fijaron en formalina a 10% y se incluyeron en parafina, los cortes histológicos fueron teñidos con eosina-hematoxilina.
Prueba de estimulación para gastrina-17 y determinación de PGI, PGII, y anticuerpos anti-H. pylori: Después de haber obtenido una muestra basal de sangre, se realizó la prueba de estimulación para gastrina-17. Dicha prueba consistió en dar a beber al paciente una solución proteica (Casec) equivalente a 10 g de proteína en 100 ml de agua, 20 minutos después se tomó una nueva muestra de sangre. La diferencia entre la muestra basal y post-estimulación se consideró como el valor de respuesta de la Gastrina-17.
Para la determinación de PGI, PGII, Gastrina-17 y anticuerpos anti-H. pylori, se empleó el kit comercial de ELISA (BIOHIT) de acuerdo a las indicaciones del fabricante. Un resultado positivo de la prueba serológica se definió por un nivel de pepsinógeno menor de 25 mg/L, una relación de PGI/PGII menor de 2.5 y una gastrina-17 menor de 10 pmol/L.
Finalmente, se compararon de manera cegada los resultados obtenidos de las biopsias, los cuales fueron considerados como estándar de oro, con los de las pruebas serológicas.
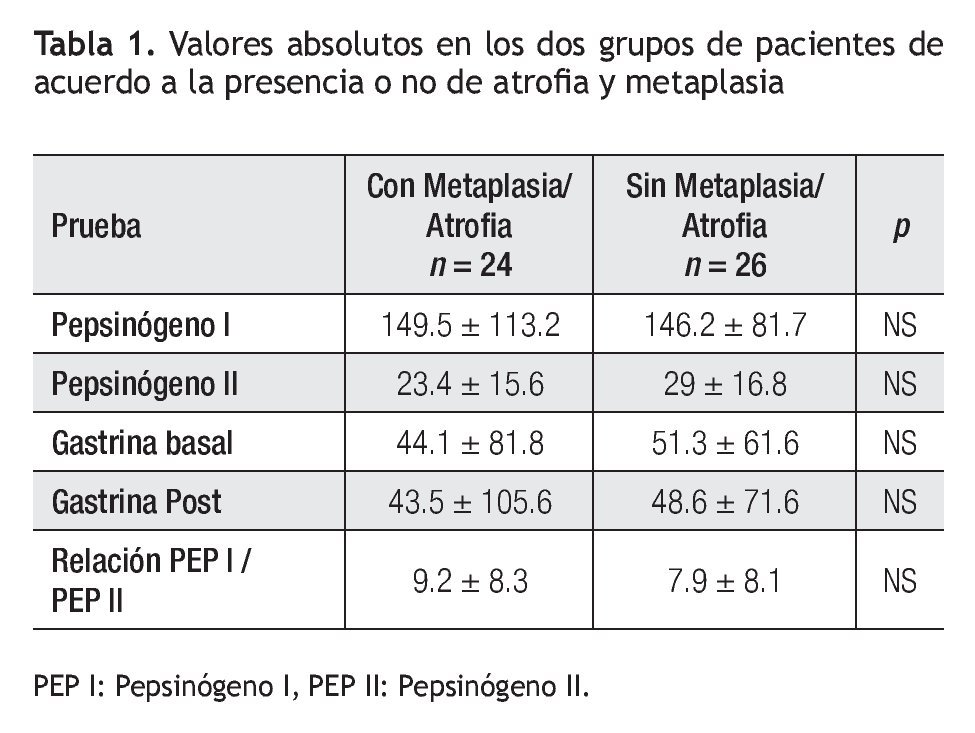
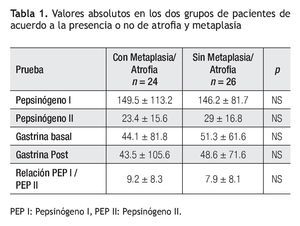
Análisis estadístico: Se utilizó estadística descriptiva expresando los valores promedio y su desviación estándar para variables dimensionales y la frecuencia relativa para variables categóricas, haciendo las comparaciones entre los valores de PGI, PGII y relación de PGI/PGII entre el grupo con y sin atrofia usando la prueba de U de Mann Withney, (p < 0.05).
Se determinó la sensibilidad, especificidad, VPP y VPN de cada una de las pruebas serológicas así como el cociente de probabilidad positivo y negativo (likelihood ratio) vs. el diagnóstico histológico, así como su intervalo de confianza de 95%. Se evaluó además el grado de concordancia de la cromoendoscopia con la histopatología para la predicción de metaplasia intestinal mediante un índice de kappa.
Resultados
Correlación de los hallazgos histopatolológicos y la serología: En 42 pacientes (84%) no se detectó atrofia en el análisis histológico y en ocho (16%) pacientes sí. De acuerdo a la distribución topográfica, en 10 pacientes (20%) se observó gastritis atrófica en antro, en cinco (10%) en cuerpo y en uno (2%) tanto en antro como en cuerpo. En 6% de los pacientes se reportó una biopsia normal.
Los valores de concentración sérica de PGI, PGII, relación de PGI/PGII y niveles de G-17 de cada uno de los grupos con y sin atrofia se muestran en la Tabla 1.
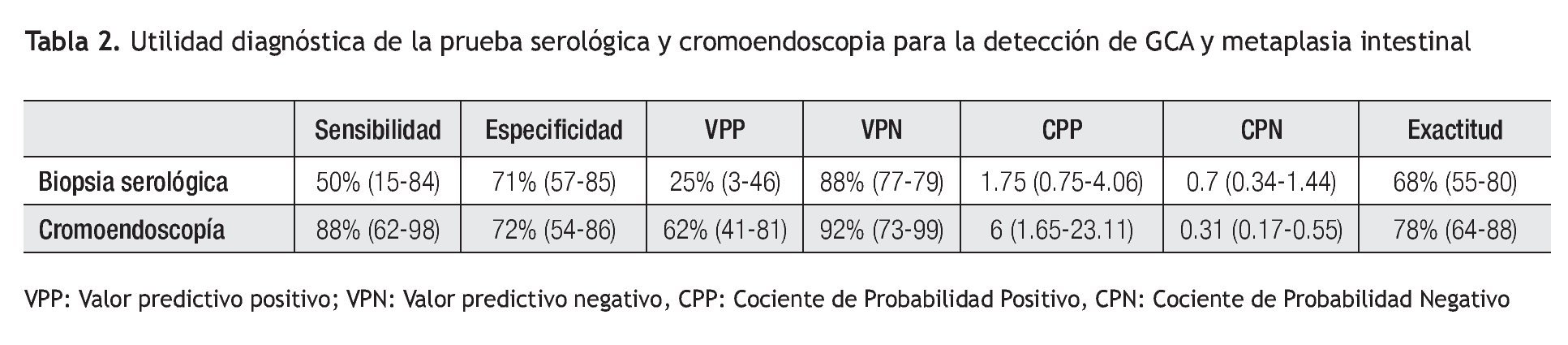
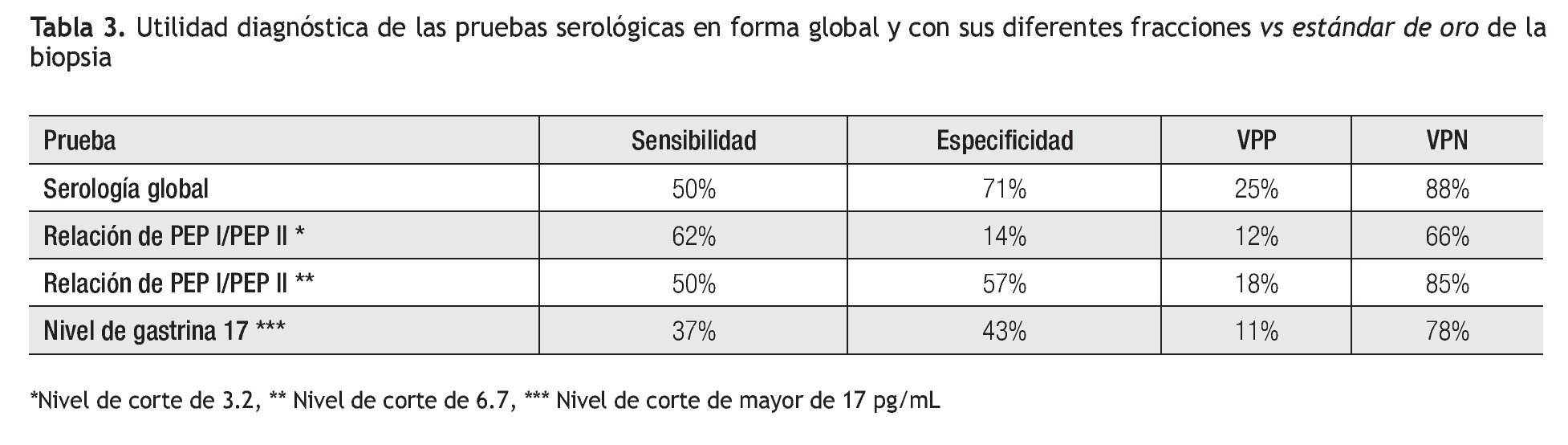
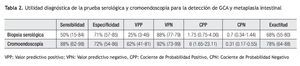
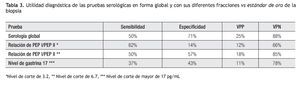
Tomando en cuenta los resultados anteriores, se calculó la utilidad del análisis serológico para el diagnóstico de gastritis atrófica. Estos resultados se muestran en la Tabla 2. De manera análoga, la utilidad de la biopsia dirigida por la cromoendoscopia en el diagnóstico de metaplasia intestinal se muestra en la Tabla 3. El grado de concordancia de la cromoendoscopia con la histopatología para la presencia de metaplasia es significativo con un índice de kappa de 0.55 y una p <0.0001.
Discusión
El cáncer gástrico constituye una de las neoplasias con mayor letalidad, ya que la sobrevida a cinco años en pacientes con enfermedad avanzada es de 20%.1 Hasta ahora, la detección temprana constituye la única medida que permite un pronóstico favorable; sin embargo, los métodos actuales de detección temprana son invasivos, costosos, no están ampliamente disponibles y dependen de la experiencia de cada centro.
La determinación sérica de G-17, PGI, PGII, y evaluación de anticuerpos anti H. pylori ha sido llamada también biopsia serológica. Diversos estudios realizados en población sajona han mostrado una sensibilidad que oscila entre 50% y 65%, con un VPN de entre 88% y 98% y exactitud de 68% a 75% para el diagnóstico de gastritis crónica atrófica.6,21-23 Estas cifras concuerdan en términos generales con los resultados de nuestro estudio. No obstante, nuestros resultados tienen la limitante de una baja sensibilidad, así como un valor bajo del VPP de la determinación aislada de PGI y de la relación PGI/PGII, lo que se puede explicar, al menos en parte, por la baja prevalencia de atrofia en nuestra población. Es importante resaltar que si bien el tamaño de muestra fue baja, (n = 50), la población fue cuidadosamente seleccionada, con una media de edad de 69 años y 90% de los pacientes presentaban infección por H. pylori, ambas condiciones podrian haber predicho un mayor riesgo de tener una GCA.
Otros grupos han sugerido que la infección por H pylori tiene mayor correlación con desarrollo de cáncer (odds ratio de 2.4; p = 0.04), que los niveles séricos de PGI.24
En nuestro país, Ley C. y colaboradores, en una población de Chiapas, encontraron que la relación PGI/PGII mayor de 2.5 tenía una especificidad alta (96% a 100%) pero la sensibilidad fue igualmente baja (6% a 14%).19 Un hallazgo adicional en nuestro estudio es que la utilidad diagnóstica de las pruebas serológicas, varío de acuerdo con diferentes niveles de corte, como se muestra en la Tabla 3, en donde se observa que los mejores resultados se encuentran con los valores globales de la prueba y con la relación de PGI/PGII mayor a 6.7.
Aunque la GCA fue poco frecuente en nuestra población, la realización de la biopsia serológica a la población adulta en riesgo, mayor de 50 años, podría evitar la realización de un gran número de endoscopías, pues los resultados de un examen normal tienen un margen de seguridad razonable para predecir la ausencia de ésta condición (VPN de 88%), proporcionando un mejor balance costo beneficio de ambas pruebas.
Considerando lo anterior, pensamos que es necesario llevar a cabo más estudios para determinar la eficacia de las pruebas serológicas como escrutinio de GCA y cáncer gástrico, en una muestra mayor de pacientes. Además, sería conveniente tomar en cuenta otras variables asociadas al desarrollo de cáncer gástrico, tales como una historia familiar positiva para cáncer gástrico, virulencia del H. pylori, polimorfismos de IL1-B, los cuales, junto con la biopsia serológica, podrían permitir detectar de manera oportuna el riesgo a desarrollar cáncer gástrico.25-2
Conclusión
La biopsia serológica mostró un valor predictivo negativo alto, por lo que este método puede ser útil en el estudio de una población en la que a pesar de una alta prevalencia de infección por H, pylori exista una baja frecuencia de metaplasia intestinal y gastritis atrófica crónica.
El uso de cromoendscopia puede ayudar a guiar las biopsias gástricas y diagnosticar la metaplasia intestinal.
Correspondencia: Dr. Francisco J. Bosques Padilla.
Av. Madero y Gonzalitos s/n Colonia Mitras Centro. Monterrey Nuevo León, México. CP. 64460.
Teléfono y Fax: +52 (81) 8333 3664.
Correo electrónico:fbosques58@hotmail.com
Aceptado: Enero 2011