Introducción
El laboratorio clínico es una herramienta básica en el apoyo al diagnóstico del médico en la atención médica del paciente. Los resultados de laboratorio se ha estimando que afectan hasta 70% el diagnóstico médico, generando así un impacto en el curso del tratamiento y pronóstico de los pacientes. Por lo tanto, es necesario contar con un excelente control de calidad durante todo el proceso del laboratorio para asegurar que los resultados que se liberan al clínico son confiables y verídicos.1 Existen modelos de acreditación como la serie ISO 9000 que asegura la calidad en la producción, instalación y servicio de procesos, los cuales incluyen un número de cláusulas que proveen una guía para la implementación de sistemas de calidad. El laboratorio clínico pertenece a un tipo de servicio en donde se puede aplicar una norma ISO.2
Un evento adverso, puede definirse como un defecto o error que se puede presentar en cualquier fase del proceso de laboratorio. Históricamente, los eventos adversos de laboratorio han sido clasificados tanto por su causa, fase de la prueba en el que se presenta, responsabilidad e impacto en el paciente.1-3 Se ha demostrado que la mayor parte de las incidencias se dan en la fase pre-analítica y pos-analítica debido al poco control que el laboratorio aún tiene sobre estas fases.4 Aún y cuando casi 70% no afecta al paciente, 19% se encuentra asociado a costos injustificados y 6.3% terminó en una terapia inadecuada.2 La importancia de un manejo de calidad y reducción de errores siempre ha sido reconocida en la medicina de laboratorio, tratando de reducir los eventos adversos en los resultados de los pacientes.1
Los esfuerzos en la reducción de errores han sido guiados, por requerimientos regulatorios de diversas agencias acreditadoras. The Clinical Laboratory Improvment Amendments of 1988 (CLIA 1988), así como la Joint Comimission (JC) y The College of American Pathologists (CAP) han elaborado estándares para los laboratorios clínicos como controles de calidad, programas de eficiencia e inspecciones periódicas.1 Organizaciones de Laboratorios Profesionales como The Clinical and Laboratory Standards Institute e International Organization for Standardization, también han elaborado guías que presentan una influencia positiva en la calidad de los laboratorios clínicos.1,5 Existen actualmente muy pocos estudios que evalúen la frecuencia y los tipos de errores que se presentan en las fases del proceso del laboratorio clínico. De los pocos estudios que hay, todos presentan una gran heterogeneidad en cuanto a la prevalencia de estos errores, incluso la evidencia de que se reporten de forma adecuada no está bien establecida. En nuestro país no se han publicado estudios que evalúen los eventos adversos.
Objetivo
Identificar y clasificar los eventos adversos de nuestro laboratorio clínico así como evaluar su frecuencia, justificando así el diseño de estrategias para su reducción y prevención; promoviendo la mejora en la calidad de la atención médica y la seguridad del paciente.
Métodos
El departamento de patología clínica del Hospital Universitario de la ciudad de Monterrey, Nuevo León cuenta con un servicio de laboratorio central que procesa las pruebas básicas de hematología y coagulación, química clínica, serologías, urianálisis, parasitología y microbiología (el departamento de microbiología se excluyó del estudio por encontrarse en un área física separada del laboratorio central). Recibe más de 478 913 solicitudes de estudios por año, procesa hasta 1275 211 pruebas y da servicio a un hospital de tercer nivel que atiende a más 700 camas.
Para fines de este estudio se seleccionaron los departamentos de Medicina interna, Unidad de Cuidados intensivos y Emergencias Adultos, ya que representan de 40% a 60% de los estudios totales realizados durante el año. Se analizó de forma prospectiva durante tres meses (28 de septiembre a 28 de noviembre de 2009) todas las muestras recibidas en el laboratorio central procedentes de las salas antes mencionadas. Se le solicitó al personal de enfermería, médicos residentes y estudiantes de medicina prestaran especial atención en la detección de eventos adversos al analizar los resultados de laboratorio recibidos y se les proporcionó un diario especial para la re- colección de datos necesarios. En el laboratorio central (desde recepción y estaciones de trabajo por área) también se notificó al personal la existencia de un diario especial para reportar las incidencias en la fase pre-analítica y analítica del proceso que detectaran.
El diario de cada uno de los departamentos seleccionados, tanto dentro como fuera del laboratorio, fue diseñado para la recolección de datos tanto registro de la muestra problema, como el registro del paciente, estudio solicitado, tipo de evento y su clasificación, descripción de la acción correctiva realizada en el momento cuando se detectó dicho error y si generó algún cambio en la terapia del paciente. De forma adicional, un médico especialista en medicina de laboratorio revisaba los diarios de forma periódica y se aseguraba de que se realizaran las acciones correctivas pertinentes.
Los eventos se clasificaron por fase del proceso en donde se presentó tomando como: a) error pre-analítico, desde el momento de la toma de la muestra hasta que se recibe en la estación de trabajo, b) error analítico, desde el momento en que llega a la estación de trabajo hasta la validación de los resultados dentro del laboratorio (análisis propiamente dicho) y c) error pos-analítico: desde la salida de los resultados hasta su interpretación por el médico tratante. La recolección de los datos se realizó en una base de datos de Access 2010. Se calculó la sumatoria de los eventos adversos encontrados, además de calcular sus frecuencias relativas en comparación con el total de las muestras presentándose como porcentajes y gráficos utilizando Excel 2010.
Resultados
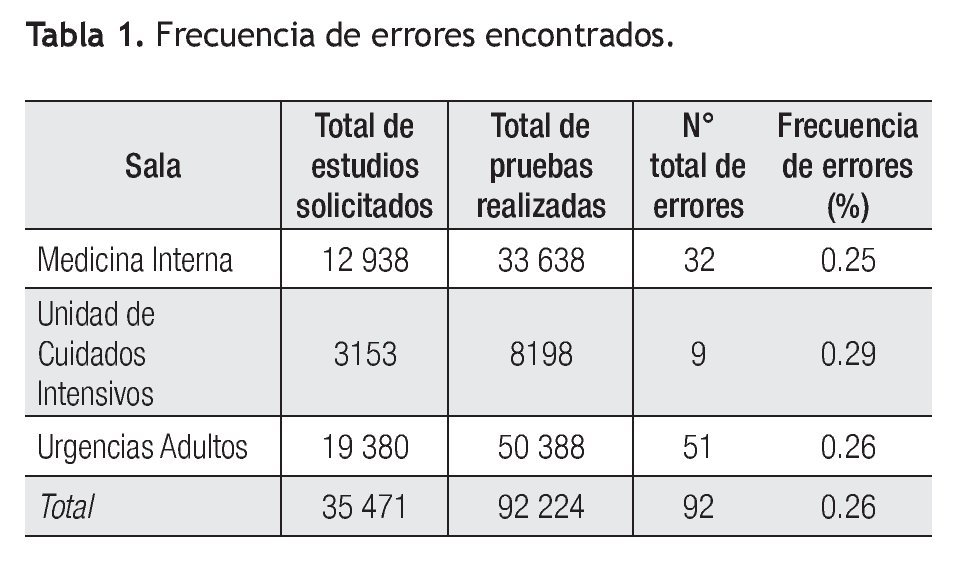
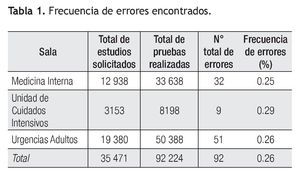
De un total de 35 471 pacientes y 87 160 de pruebas solicitadas al laboratorio central durante los tres meses de estudio, se identificaron 92 eventos adversos, representando una frecuencia relativa total de 0.26% (92/33, 523) (Tabla 1).
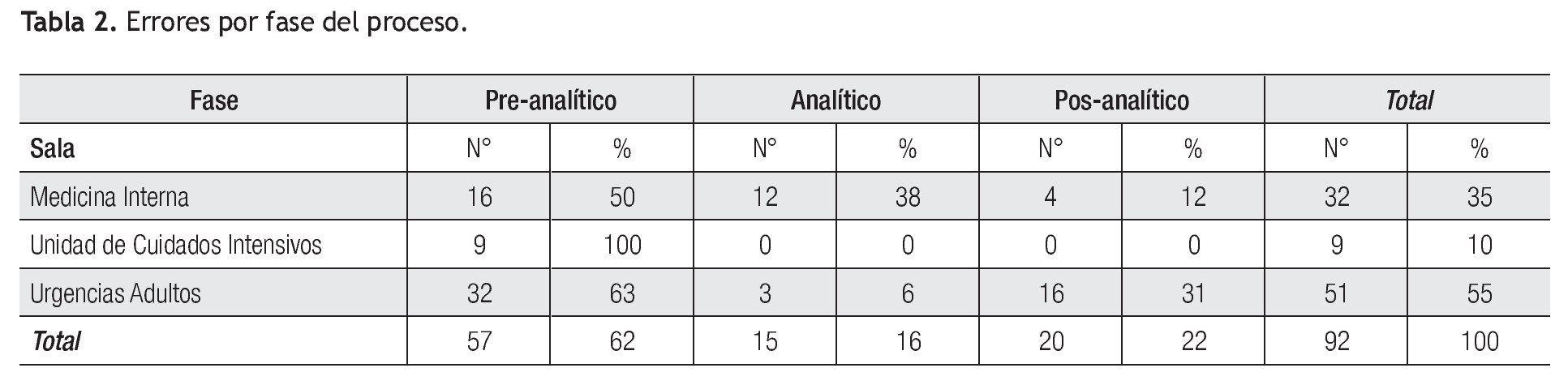
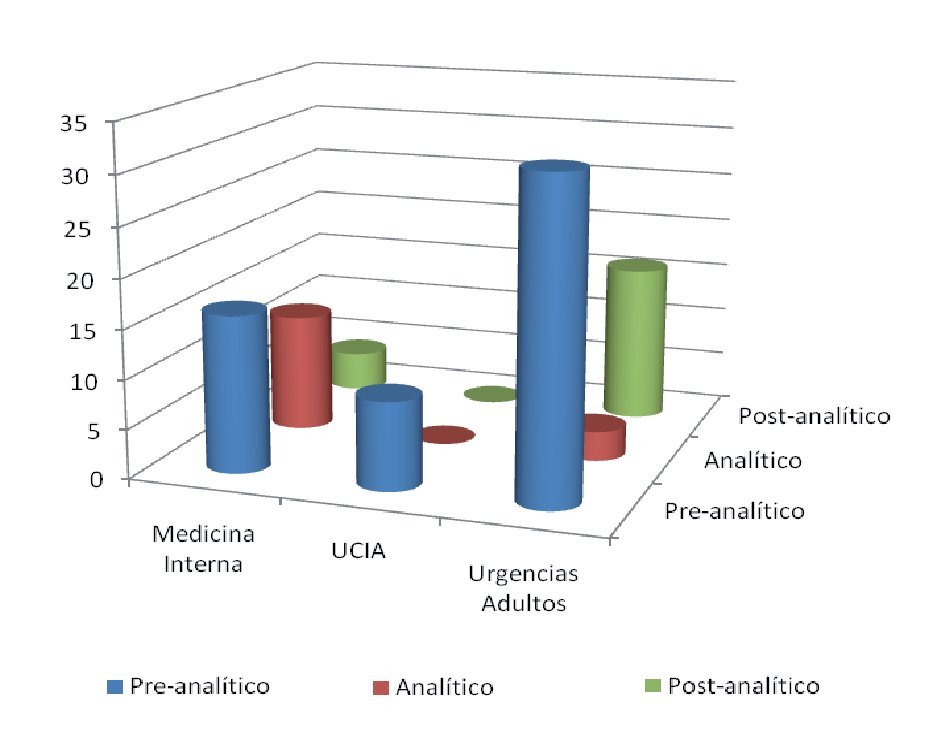
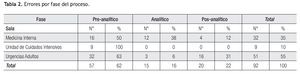
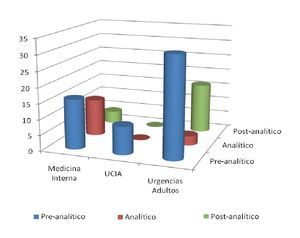
Siendo clasificados por fase del proceso, de esos 92 eventos adversos encontrados, la fase pre-analítica ocupó 62% (n = 57) (Tabla 2, Figura 1).
Figura 1. Frecuencias de errores por sala y fase del proceso.
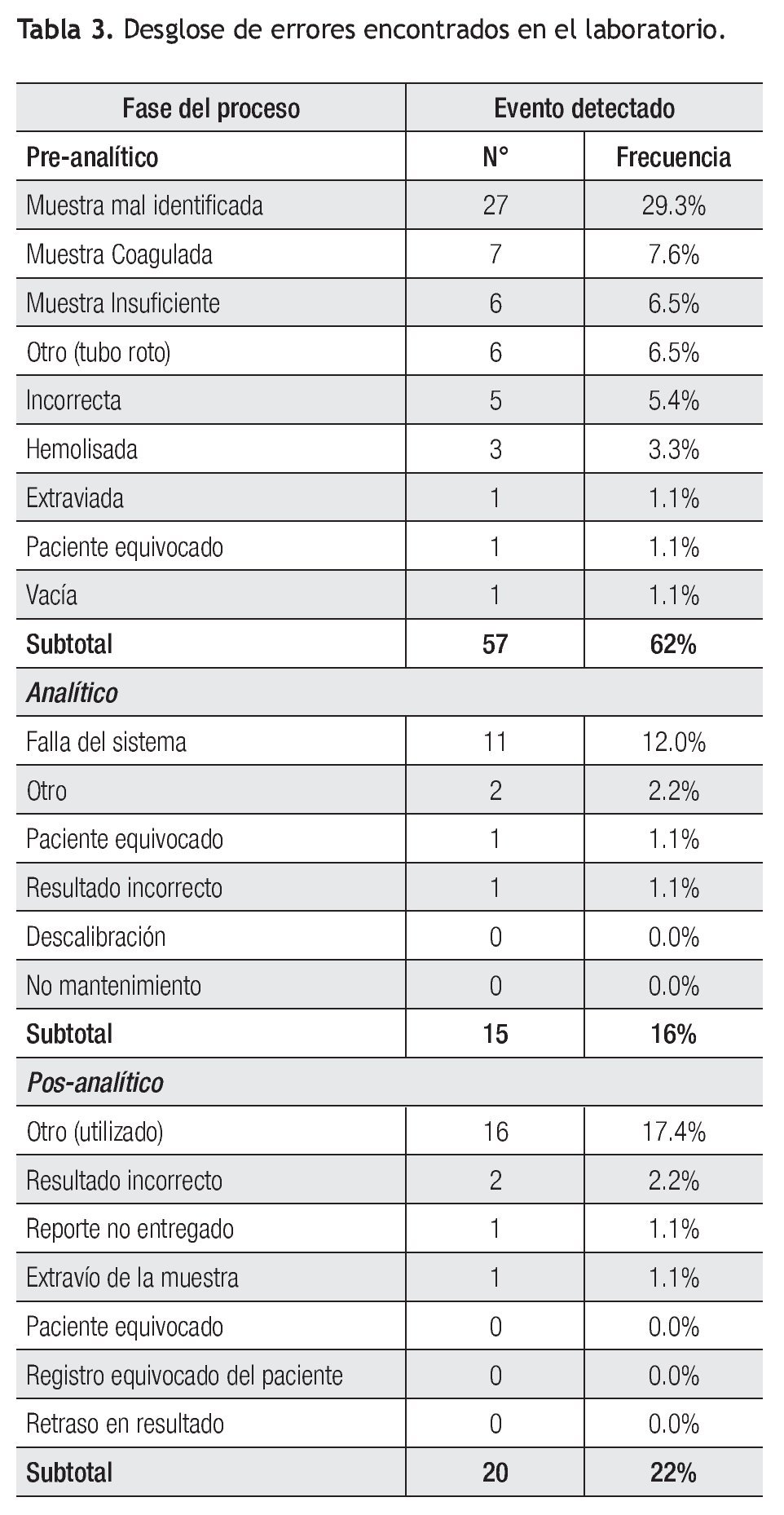
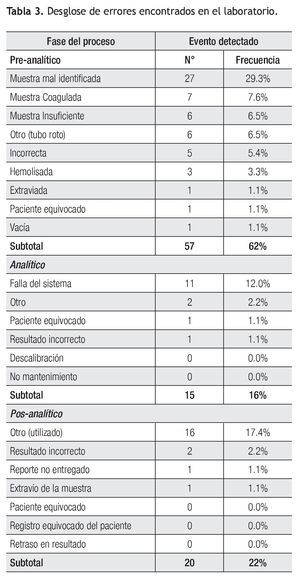
De esta fase la identificación errónea de la muestra ocupó 29.3% de las incidencias en total seguido de muestras de mala calidad (17%). Dentro de la fase analítica el mayor evento adverso fue la falla en el sistema por falta de mantenimiento del equipo (n = 11, 12%), principalmente en el equipo de química clínica. Finalmente en la fase post-analítica, los reportes no utilizados ocuparon el 17.4% (n = 16) de los eventos (Tabla 3).
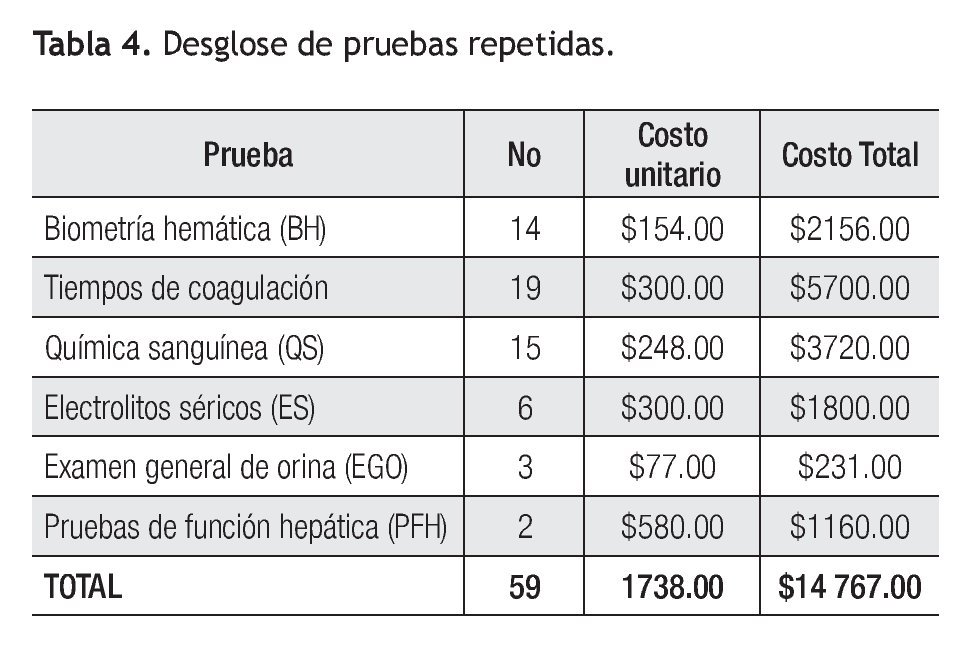
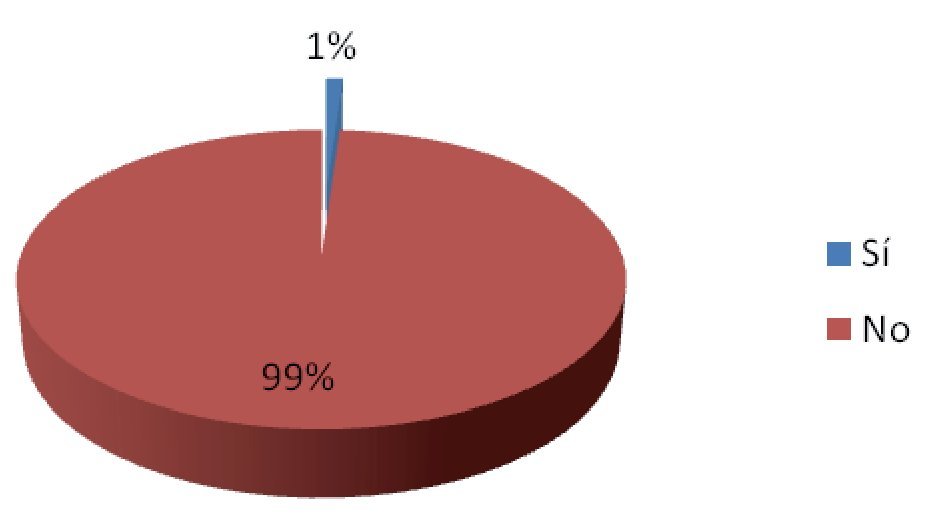
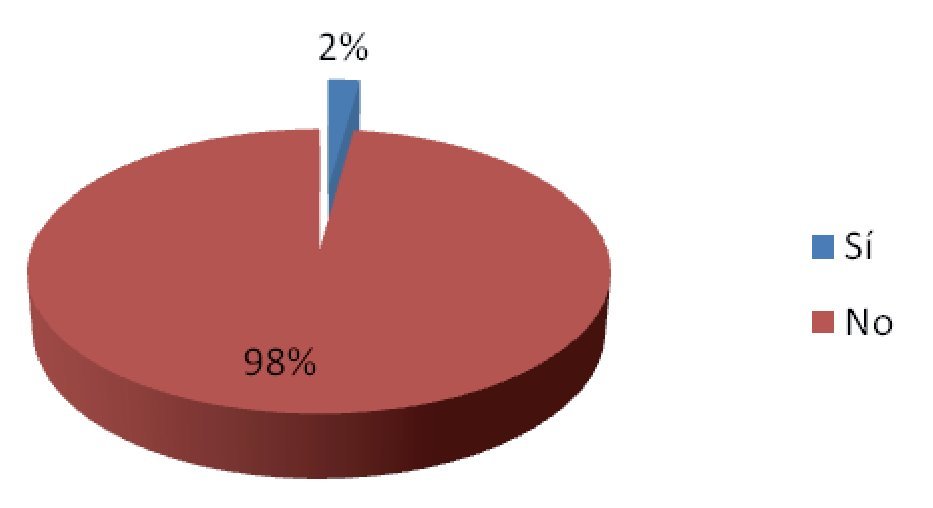
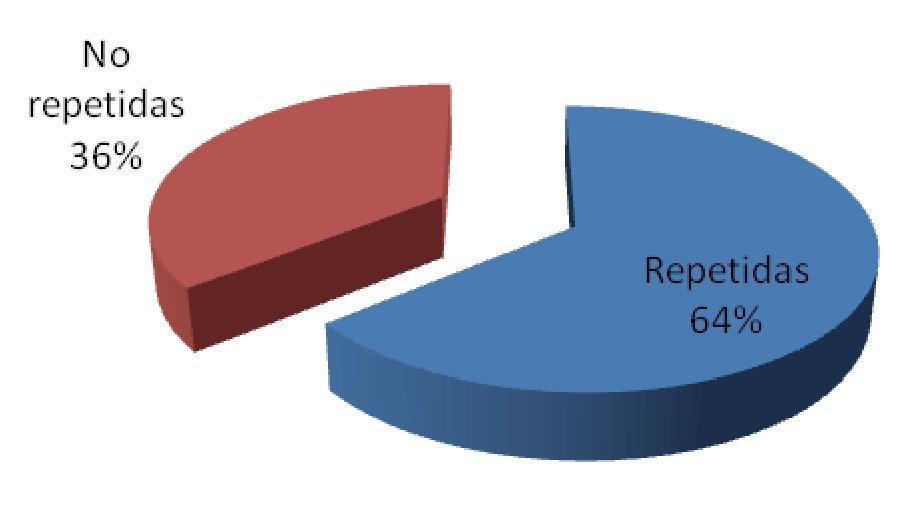
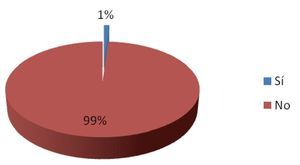
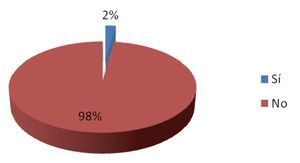
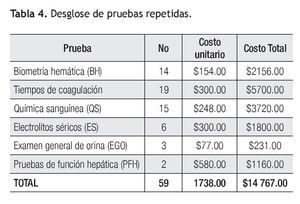
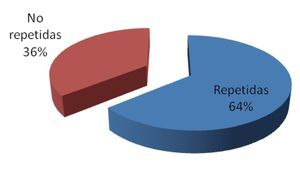
De los 92 eventos adversos en total, 55% (n = 51) se dieron en el departamento de urgencias, 35% (n = 32) en el área de medicina interna y 10% (n = 9) en la unidad de cuidados intensivos. Se encontró un evento adverso (1%) en un caso reportado, que generó retraso en el diagnóstico por ser un resultado no recogido (Figura 2). Dos eventos adversos en el pos-analítico (2%) generaron cambios en la terapia de dos pacientes, por ser resultados incorrectos (Figura 3). Se repitieron 14 biometrías hemáticas, 19 tiempos de coagulación, 15 químicas sanguíneas, seis electrolitos séricos, tres urianálisis y dos pruebas de función hepática, dando un total de 59 muestras (64%) (Tabla 4, Figura 4), generando un costo extra al laboratorio de $14 767.00, incluyendo costo reactivo, consumibles, mano de obra e infraestructura. Se encontró además una pobre cultura en el reporte de eventos adversos, tanto en las salas del hospital como en las áreas del laboratorio.
Figura 2. Evento adverso en el paciente.
Figura 3. Cambio en la terapia.
Figura 4. Muestras repetidas del total.
Discusión
Los resultados que nuestro estudio arrojó concuerdan con los presentado por Plebani y Carraro3 que, durante tres meses de estudio, de 40 490 pruebas realizadas detectaron 189 eventos adversos, de los cuales 68.2% pertenecían a la fase pre-analítica, 13.3% a la fase analítica y 18.5% a la fase pos-analítica. También ellos encontraron que 74% no tenía ningún efecto en los pacientes, pero 19.6% ocasionó la solicitud de nuevos estudios y 6.4% afectó la terapia del paciente. A diferencia de ellos, nosotros no encontramos que algún efecto adverso generara alguna modificación en el manejo y pronóstico del paciente. Pero aún así, existe en nuestro medio una pobre cultura sobre el reporte de los eventos adversos, lo cual fue una gran limitante en este estudio, ya que por la experiencia previa, se esperaba una mayor frecuencia de errores, asumimos que no se detectaron y/o informaron en realidad todos los eventos producidos.
En nuestro estudio también demostramos que el área de urgencias es dónde más se presentan los eventos adversos en la fase pre-analítica, muchas veces por las enormes cargas de trabajo y falta de personal, se entorpecen la comunicación médico-laboratorio. Además, la necesidad de resultados inmediatos, hace que el no tener establecido un buen sistema de trabajo con el laboratorio central, se genere retraso en la entrega de resultados o incluso pérdida de ellos, lo que aumenta el riesgo de complicaciones en los pacientes con manejos tardíos e incremento en los costos de la institución al mantener más tiempo a los pacientes esperando dichos resultados o solicitando nuevos.
Según lo evidenciado en nuestro estudio, hemos sugerido para nuestro hospital la instauración de mejores programas de control de calidad, sobre todo para las fases pre-analítica y pos-analítica del laboratorio, que son las más abandonadas en los actuales programas que manejamos. También se justifica el desarrollo de un mejor sistema de informática intranet para la interfaz con el expediente electrónico, de esta forma agilizar la liberación de los resultados vía electrónica sobre todo en el departamento de urgencias, donde es vital contar con un resultado rápido y veraz.
Ante todo, la comunicación y cooperación del personal del laboratorio con el clínico y personal de enfermería sigue siendo la mejor opción para la mejora en la calidad de los servicios, atención y seguridad de nuestros pacientes, además de fomentar la cultura del reporte de eventos adversos en todas las fases y sensibilizar al personal del impacto que estos eventos pueden llegar a tener.
Conclusiones
Como recomendación final, se elaboraron estrategias para la reducción de eventos adversos y su aplicación en esta población específica, siendo las siguientes:
Uso de un sistema de código de barras para el etiquetado rápido de las muestras y ligado por interfaz con la base de satos de los pacientes para su ingreso inmediato.
Elaboración de un manual de procedimientos institucional para la toma de muestras.
Elaboración de un catálogo de las pruebas de laboratorio que se integrará en el manual.
Sistema de informe vía electrónica, e interfaz con el expediente electrónico.
Diarios donde se registrará el personal encargado de recoger los resultados impresos.
Carteles con la información básica para el adecuado llenado de los tubos.
indicadores de control de calidad.
Agradecimientos
El autor agradece a los jefes de departamento de las áreas de medicina interna, unidad de cuidados intensivos y urgencias adultos, así como al personal de médicos residentes y enfermería, por su colaboración. Agradece de forma especial al personal de laboratorio del hospital universitario Dr. José E. González por su gran apoyo en la realización de este estudio.
Correspondencia: Marlene Perales Quintana.
Departamento de Patología Clínica, Hospital Universitario Dr. José E. González. Av. Madero y Gonzalitos s/n Col. Mitras Centro Monterrey, N.L. C.P. 64460.
Tel: 8348 5711.
Correo electrónico: marleneperales@gmail.com
Recibido: Junio 2011.
Aceptado: Julio 2011