Introducción
La habilidad de los individuos de metabolizar sustancias depende de numerosos factores incluyendo el medio ambiente, el género, la edad, el estado nutricional y el perfil genético. Este último es de suma importancia ya que puede causar cambios en la estructura de las enzimas que participan en el metabolismo de fármacos, las cuales llevan a cabo la biotransformación de los mismos, modificando la concentración plasmática y produciendo dos escenarios: una respuesta pobre y un tratamiento inefectivo o una respuesta exagerada y un riesgo de toxicidad potencialmente deletéreo, según sea el caso.1
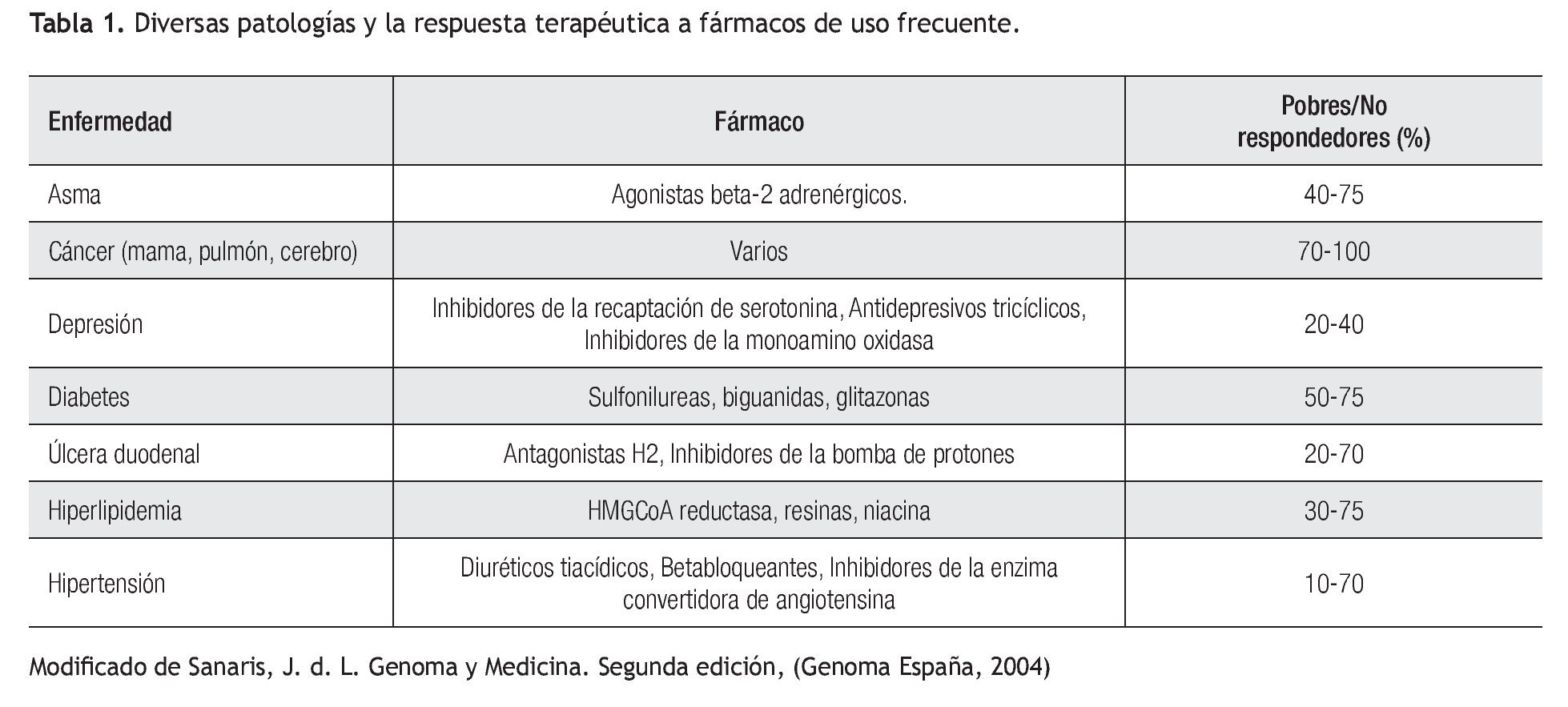
Se reporta que la mayoría de los medicamentos son efectivos en un rango que oscila entre 25% a 60%.2 Hay una población de pacientes que reacciona de manera diferente, ya sea que no responden al medicamento o desarrollan una toxicidad a éste, denominándose: reacción idiosincrática, la cual se define como una reacción adversa que no deriva de una interacción fármaco-fármaco y que cumple con varios criterios: Ocurre en una fracción pequeña de personas expuestas al medicamento (<5%), no están relacionadas al efecto farmacológico del medicamento per se, no demuestran una relación obvia con la dosis y ocurren con patrones inconsistentes y temporales en relación a la exposición de la droga.3
El descubrimiento del genoma humano marcó la pauta para el desarrollo de la farmacogenética y la farmacogenómica, las cuales han dado resultados prometedores e invitan al clínico a prescribir una medicina individualizada con la finalidad de optimizar la respuesta al tratamiento y reducir los efectos adversos que se pudieran presentar.
Las reacciones adversas a los medicamentos tienen una base metabólica que involucra algunos polimorfismos genéticos en las enzimas clave de la transformación de los mismos. Por lo anterior, es importante comprender los avances en la farmacogenética de patologías clínicas frecuentes, tales como las enfermedades cardiovasculares, tromboembólicas, psiconeuropatológicas y gastrointestinales, por mencionar algunas. La caracterización genotípica, fenotípica o ambas de las enzimas clave del metabolismo de los fármacos empleados en el manejo de estas enfermedades, sería de beneficio para la selección terapéutica y mejorar el desenlace clínico del paciente enfermo.
El objetivo de este artículo es presentar aspectos fundamentales de la farmacogenética y farmacogenómica, abordando de forma breve el caso de la enzima tiopurina S-metil transferasa y su papel en la toxicidad por las tiopurinas. Asimismo, se revisará la importancia de la enzima CYP2C19 y su relación con los inhibidores de la bomba de protones (IBPs), mostrando la prevalencia de su polimorfismo en algunos países del mundo y en México, citando el análisis farmacogenético de esta enzima en una muestra de pacientes del noreste de México realizada en nuestro centro y su repercusión clínica.
Principios genéticos: farmacogenómica y farmacogenética: Antes de revisar las relaciones entre los distintos polimorfismos del CYP450 y su relación con la respuesta a los IBPs, se hará una revisión breve del tema iniciando por aclarar la definición de ambas disciplinas. Existe controversia acerca del uso de los términos farmacogenética y farmacogenómica. Algunos autores utilizan el término de manera indiscriminada, ya que la diferencia entre éstas dos disciplinas es pequeña. La farmacogenética estudia la relación de los factores genéticos que influyen en la respuesta variable de los individuos a cierto medicamento. En contraste, la farmacogenómica estudia la variación en la expresión de los genes relevantes para las enfermedades y la respuesta variable a cierto medicamento.
La farmacogenómica se remonta al año 510 a. C, cuando Pitágoras describió que la ingestión de habas resultaba en una reacción potencialmente fatal; sin embargo, ésta no ocurría en todos los individuos. Aquella reacción ahora se conoce como el resultado de una anemia hemolítica inducida por la deficiencia de la enzima glucosa 6-fosfato deshidrogenasa. En 1956, Friedrich Vogel introdujo el término Farmacogenética para explicar la variación individual en la respuesta a los medicamentos.4
Los objetivos de investigación en la farmacogenética son principalmente: a) Identificar las variaciones en el genoma relacionadas con la farmacocinética y farmacodinamia de los medicamentos. b) Evaluar su desenlace clínico. c) Desarrollar métodos de diagnóstico mediante el análisis del ADN para identificar pacientes que puedan presentar reacciones idiosincráticas antes de la administración de un fármaco, lo cual es denominado como terapia personalizada.5
El proyecto genoma humano inició en 1990 en Estados Unidos de América, bajo la dirección del National Institutes of Health (NIH) y se lograron codificar más de 2.91 billones de pares de bases y 30 000 genes presentes en los 46 cromosomas del ser humano.6 De manera sorprendente, sólo 1.5% expresan la información para la síntesis de proteínas.
Normalmente existen variaciones genéticas en el genoma. Si la frecuencia de la variación está presente en más de 1% de la población, se denomina polimorfismo; si está presente en menos de 1% de la población, es denominada mutación.7 Estos polimorfismos pueden ser funcionales o no funcionales, siendo los primeros los que se traducen en la expresión de la función de una proteína en el organismo. Existen diferentes tipos de polimorfismos: polimorfismo de un solo nucleótido (SNP) o repetición en tándem de número variable (VNTR). Los SNP son los más comunes e importantes ya que están ampliamente distribuidos a lo largo del genoma. Existen diferentes metodologías para la detección de estos polimorfismos. La mayoría de estas se basan en la reacción de cadena de la polimerasa.8
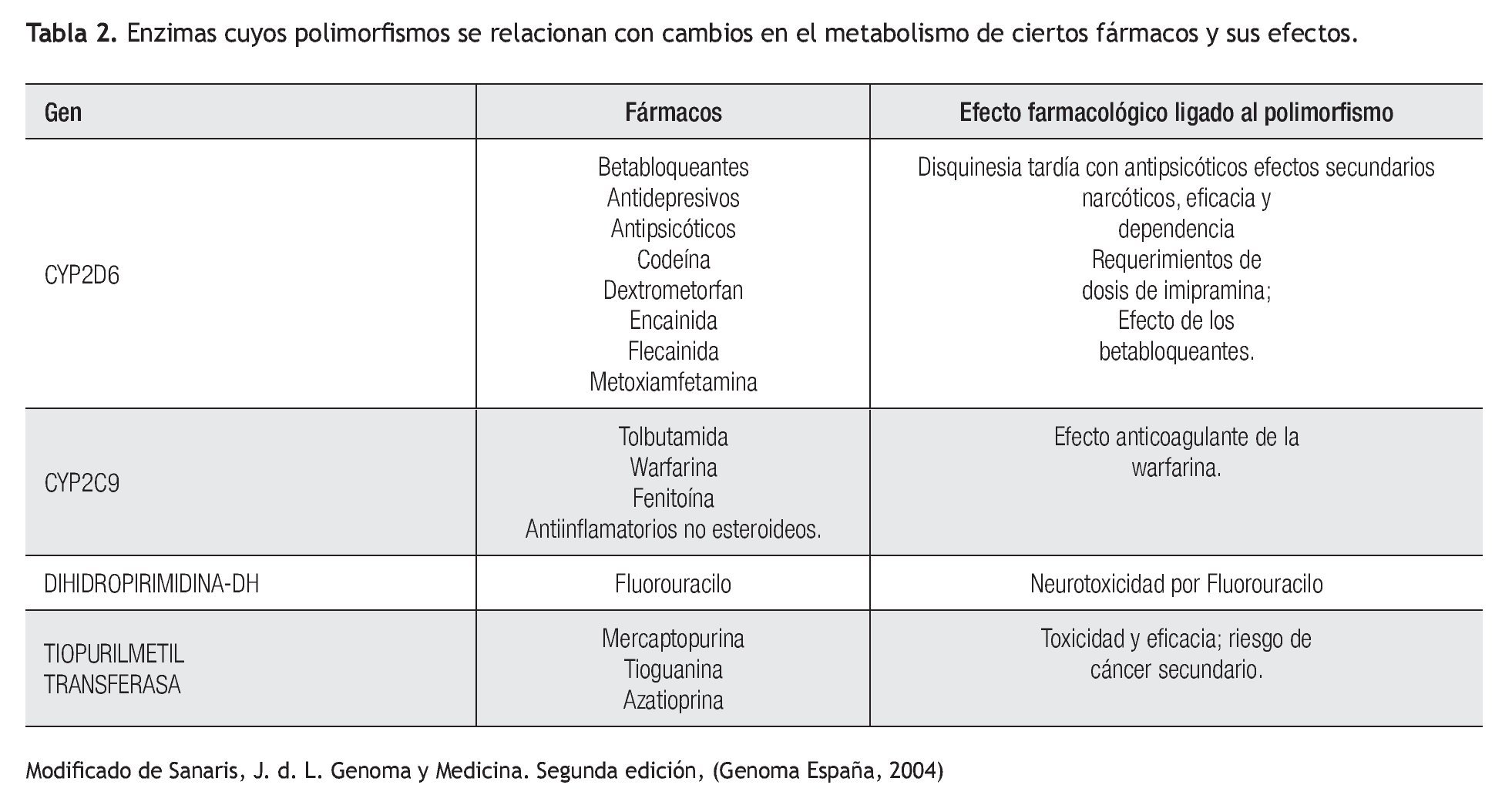
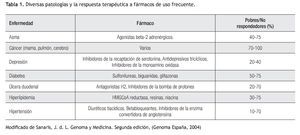
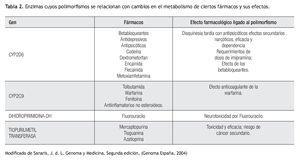
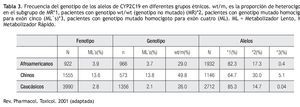
Aplicación clínica de la farmacogenética: La respuesta terapéutica a los fármacos de primera línea es pobre en muchas patologías prevalentes en la práctica clínica (Tabla 1). Los beta-bloqueadores, anti-arrítmicos, anti-psicóticos, entre otros, son sólo algunos ejemplos de fármacos cuyo metabolismo se puede ver alterado por diversos polimorfismos (Tabla 2). Lo anterior cobra importancia en medicamentos con un índice terapéutico estrecho.5
Polimorfismos de tiopurina S-metil transferasa y su papel en la toxicidad por tiopurinas: Las tiopurinas son fármacos inmunosupresores que se utilizan en el tratamiento de diversas enfermedades autoinmunes, así como en pacientes trasplantados.9 La 6-Mercaptopurina (6MP), la Azatioprina (AZA) y la 6-Tioguanina (6-TG) son tiopurinas ampliamente utilizadas en el manejo de la enfermedad inflamatoria intestinal.10-12 La eficacia de estos fármacos en el control de patologías gastrointestinales como la enfermedad inflamatoria intestinal, ha sido ampliamente demostrada.13,14 Sin embargo, estos fármacos generan efectos adversos en algunos individuos, por lo cual se puede suspender o modificar el tratamiento en 9% a 28% de los pacientes.15 Los efectos adversos pueden ser desde un malestar gastrointestinal como diarrea, hasta manifestaciones potencialmente letales como presencia de mielotoxicidad, hepatotoxicidad o pancreatitis.16,17
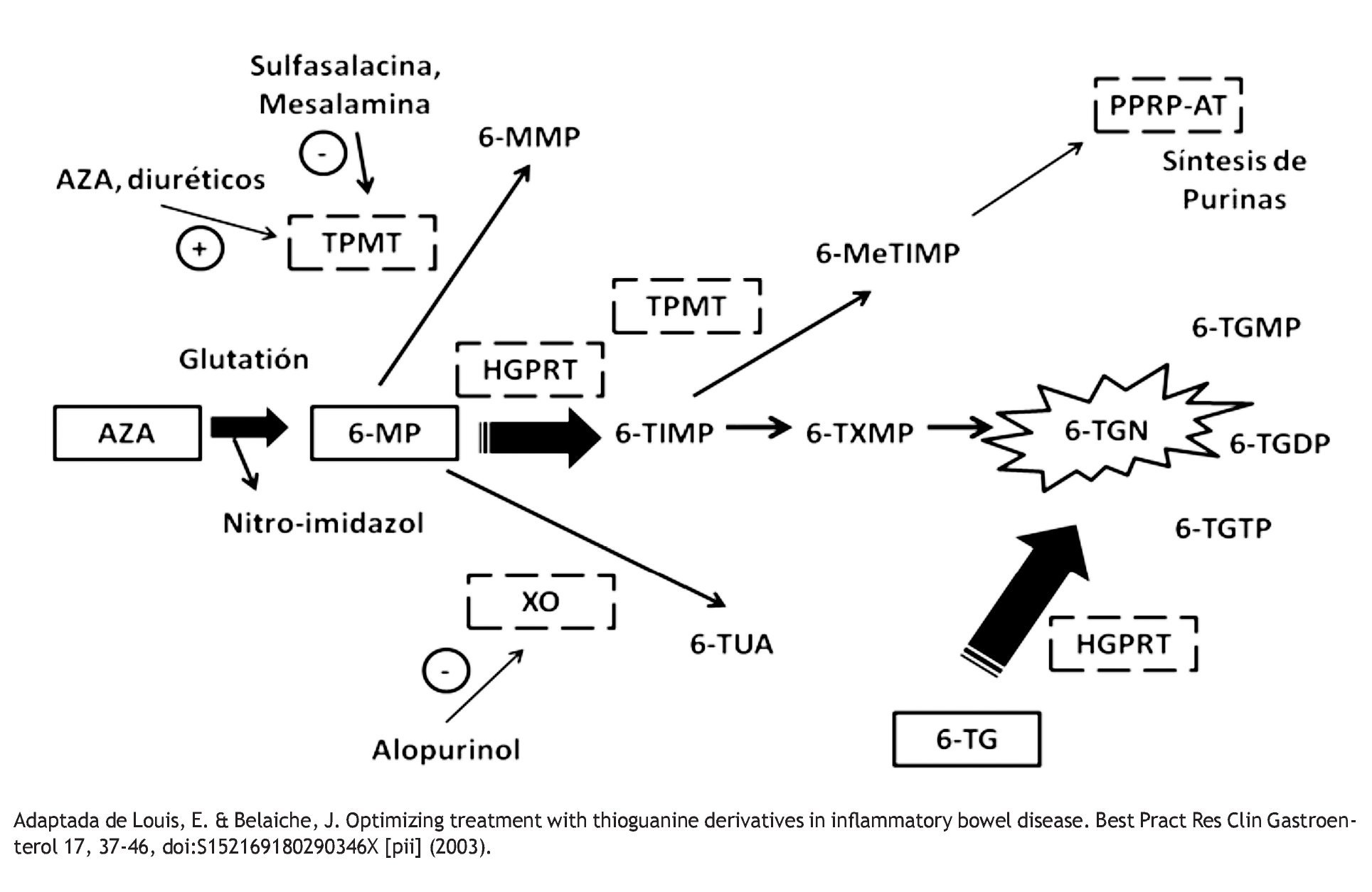
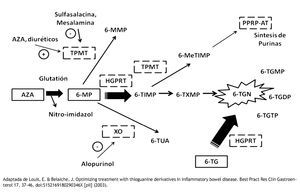
En la vía metabólica, la AZA es transformada a 6-MP mediante una reacción no enzimática que requiere de glutatión. Posteriormente, la 6-MP es metabolizada a través de tres vías enzimáticas: la tiopurina S-metil transferasa (TPMT), la xantina-oxidasa (XO) y la hipoxantina-guanina-fosforribosil-transferasa (HGPRT). La TPMT genera 6-metilmercaptopurina (6-MMP) y la HGPRT produce nucleótidos de 6-Tioguanina (6-TGN). Los niveles elevados de 6-MMP se han correlacionan con hepatotoxicidad, mientras que niveles altos de 6-TGN producen mielotoxicidad18 (Figura 1).
Figura 1. Metabolismo de las Tiopurinas. La Azatioprina (AZA), la 6-Mercaptopurina (6-MP) y la 6-Tioguanina (6-TG) son metabolizadas por las enzimas Tiopuril Metil Transferasa (TPMT), Hipoxantina Guanina Fosforribosil Transferasa (HGPRT) y Xantina Oxidasa (XO). Los metabolitos activos son nucleotidos de 6-tioguanina (6-TGN), Mono-di y trifosfato de 6-tioguanina (6-TGMP, 6-TGDP, 6-TGTP) y 6-metil monofosfato tioinosínico. (6-MeTIMP). El último interfiere con la síntesis de purinas, los demás se incorporan al DNA y RNA. Los metabolitos tóxicos que producen mielotoxicidad y hepatotoxicidad son los 6-TGN y la 6-Metil mercaptopurina (6-MMP) respectivamente. 6-Tioinosin Monofosfato (6-TIMP) 6-Tioxantin Monofosfato. (6 TXMP) Ácido Tioúrico (6-TUA)
Se han descrito 17 alelos diferentes para la enzima TPMT. De la población 10% presenta actividad reducida y uno de cada 300 pacientes tienen actividad nula.19 Los alelos TPMT*2, TPMT*3A, TPMT*2B y TPMT*3C representan 80% a 95% de las variantes con actividad disminuida.20 Lo anterior, condiciona una producción excesiva de 6-TGN por la HGPRT, generando los efectos adversos antes descritos.21
En la actualidad existen tres maneras de dosificar las tiopurinas. La forma empírica se basa en una dosificación cuidadosa, comenzando con dosis orales bajas (50 mg/d de 6-MP o 100 mg/d de AZA). Posteriormente, se ajusta la dosis en base a la cuenta de leucocitos en la biometría hemática.22
A los pacientes que no responden al tratamiento después de varios meses se les puede aumentar la dosis, manteniendo la leucopenia en un grado leve.23 Se ha demostrado que si la 6-MP es iniciada y se realizan biometrías hemáticas semanales, se puede detectar a los pacientes con deficiencia de TPMT ya que ellos rápidamente desarrollan leucopenia, pudiendo disminuir la dosis antes de que se presente riesgo de infección. Estos pacientes pueden requerir solamente 25 mg de 6-MP cada dos o tres días.
La farmacogenética brinda una forma más personalizada de dosificar las tiopurinas. Se puede identificar a los metabolizadores lentos antes de iniciar el tratamiento mediante la medición del genotipo de TPMT y el nivel de metabolitos de la misma enzima. En caso de encontrar una actividad nula de TPMT, no se deben de indicar las tiopurinas en ese paciente debido a que presenta un riesgo elevado de neutropenia grave. Los metabolizadores lentos pueden recibir dosis menores (30% a 50% de la dosis estándar) para después elevar la dosis en base al monitoreo de la biometría hemática.
A pesar de estas ventajas teóricas ofrecidas por la dosificación de las tiopurinas en base al perfil genético, la utilidad de la medición de la TPMT aun es controversial. Dos estudios intentaron demostrar la premisa, sin embargo, no obtuvieron resultados concluyentes.24-26
CYP2C19 y su relación con los IBPs: El sistema citocromo P450 (CYP450) representa una familia muy grande de enzimas que catalizan el metabolismo de una gran diversidad de medicamentos, más que cualquier otra familia enzimática y comprende varias isoenzimas dentro de las cuales se incluye la CYP2C19.27 Esta enzima cataliza el metabolismo de diferentes medicamentos prescritos frecuentemente como el diazepam, algunos barbitúricos, antidepresivos tricíclicos, así como el omperazol y sus análogos estructurales.28
Se han identificado distintas variaciones alélicas de la CYP2C19. El alelo CYP2C19*1 corresponde al gen silvestre o no mutado, el alelo CYP2C19*2 representa una mutación puntual de bases (G→A) en el exón cinco resultando en una proteína no funcional y el alelo CYP2C19*3 representa una mutación puntual (G→A) en el exón cuatro la cual produce un codón de detención prematuro.29
La combinación de genotipos de las mutaciones en los exones cuatro y cinco se ha asociado con variaciones genotípicas. Los individuos con el genotipo CYP2C19 *1/*1 se definen como Metabolizadores Rápidos (MR) homocigotos, aquellos con genotipo *1/*2 o *1/*3 se definen como MR heterocigotos y por último, aquellos con genotipo *2/*3, *2/*2 o *3/*3 como Metabolizadores Lentos (ML).30 La expresión clínica de estos resultados fenotípicos se traduce en la concentración sérica final del fármaco que se alcanza en el paciente.
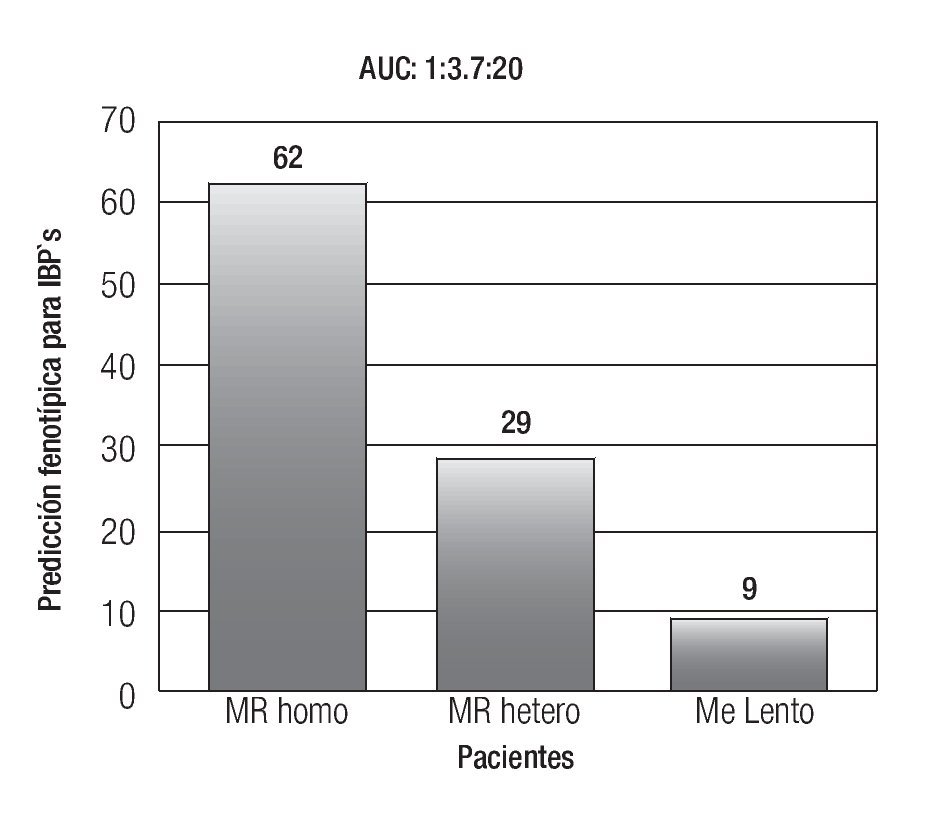
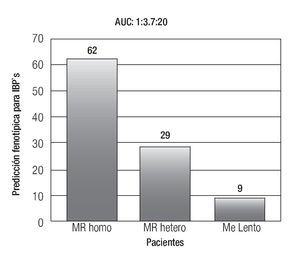
La farmacocinética de los distintos IBP, así como algunos antibióticos utilizados para la erradicación de Helicobacter pylori (H. pylori) son dependientes del sistema enzimático del CYP2C19, por lo cual su estatus genotípico podría afectar la eficacia de estos medicamentos.31,32 En el caso de los IBP, el área bajo la curva del omeprazol que depende del grado de concentración sérica del fármaco, está determinado si el paciente es un ML, MR heterocigotos o MR, lo cual tiene una repercusión clínica, ya que el paciente que es MR, tendrá menos exposición al efecto del omeprazol que el ML o MR heterocigotos (Figura 2). Se ha demostrado que el porcentaje de erradicación de la infección por H. pylori es menor en pacientes con genotipo CYP2C19*1 (MR) que en pacientes con genotipo CYP2C19*2 o *3 (ML o MR heterocigotos) en la terapia dual con omeprazol y amoxicilina,33 así como en esquemas triples con omeprazol o lansoprazol aunado a amoxicilina y claritromicina.34
Figura 2. Que representa la distribución de metabolizadores para IBP's en un estudio realizado en nuestro centro. (Un metabolizador lento, tiene una exposición 20 veces mayor al IBP utilizado que un metabolizador rápido homocigoto). AUC: Área Bajo la Curva.
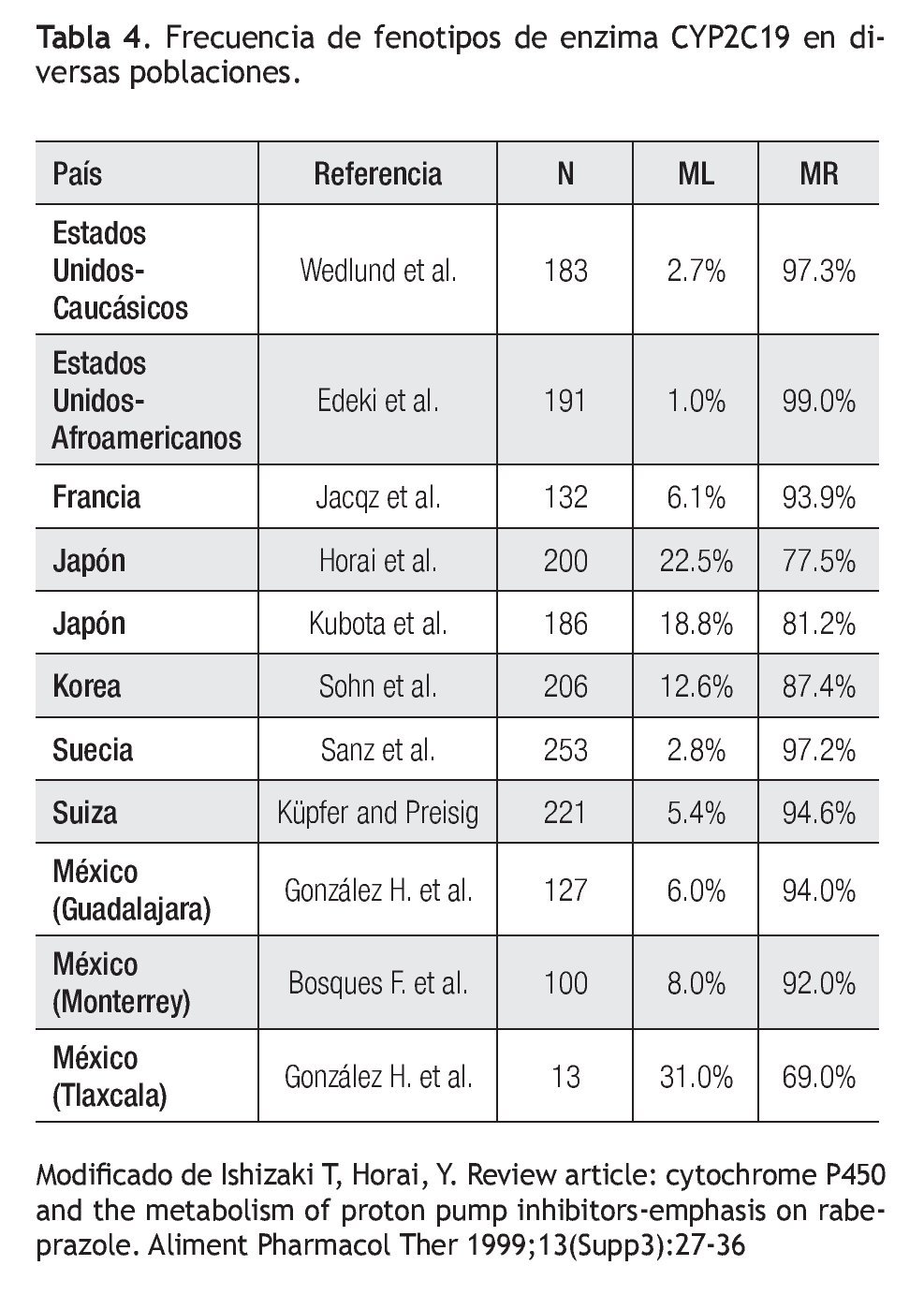
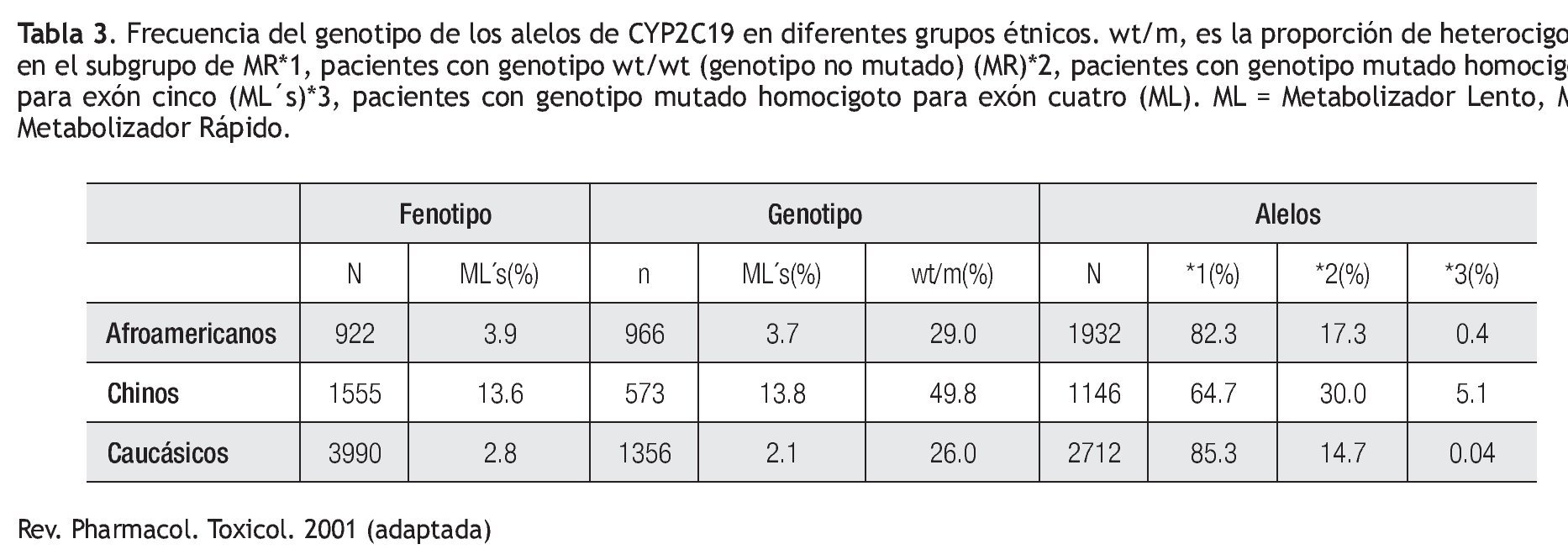
Existen variaciones étnicas en la frecuencia relativa de los genotipos y fenotipos de CYP2C19. La frecuencia reportada de CYP2C19*2 en población China es de 30%, lo cual representa casi el doble del valor reportado en población afroamericana (17%) o caucásica (15%), mientras que para el alelo CYP2C19*3, la frecuencia es de 5% para la población China, en contraste a 1% en pacientes afroamericanos y caucásicos (Tabla 3).29
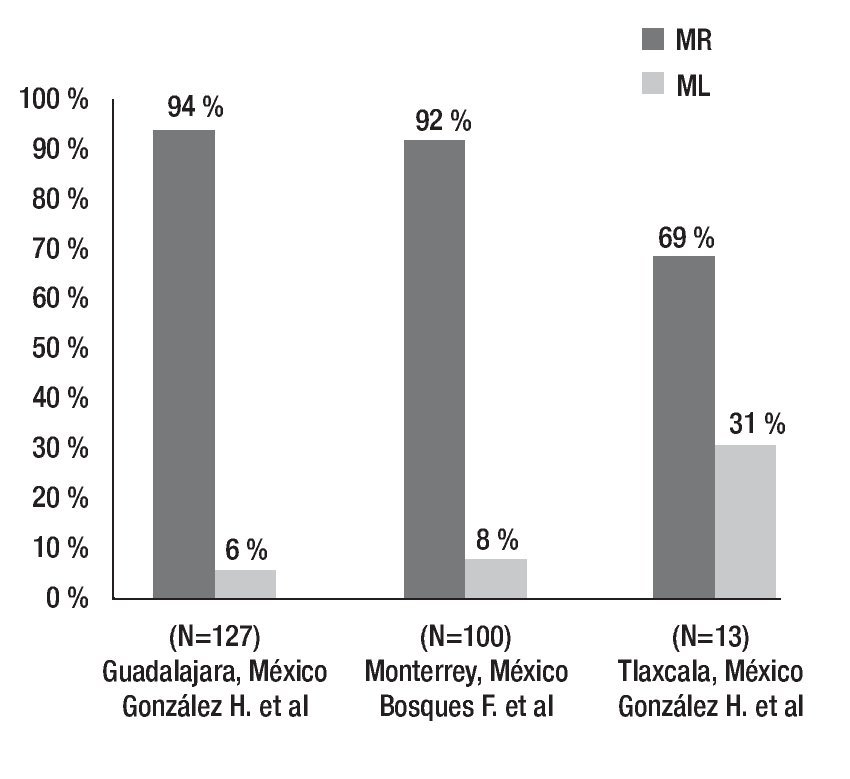
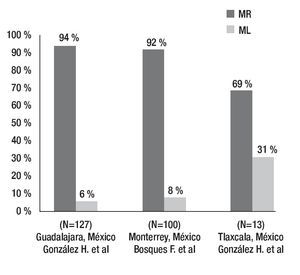
La prevalencia de dichos polimorfismos genéticos ha sido determinada en la población mexicana, tanto en un estudio llevado a cabo por nuestro grupo que incluyó individuos del noreste de México, así como en otra investigación en Guadalajara y otra más en Tlaxcala. Los resultados muestran una frecuencia de MR de 94% en Guadalajara, 92% en el noreste y 29% en la población de Tlaxcala. Este último trabajo tiene la limitante de que el número de pacientes es relativamente bajo (Figura 3).35-37
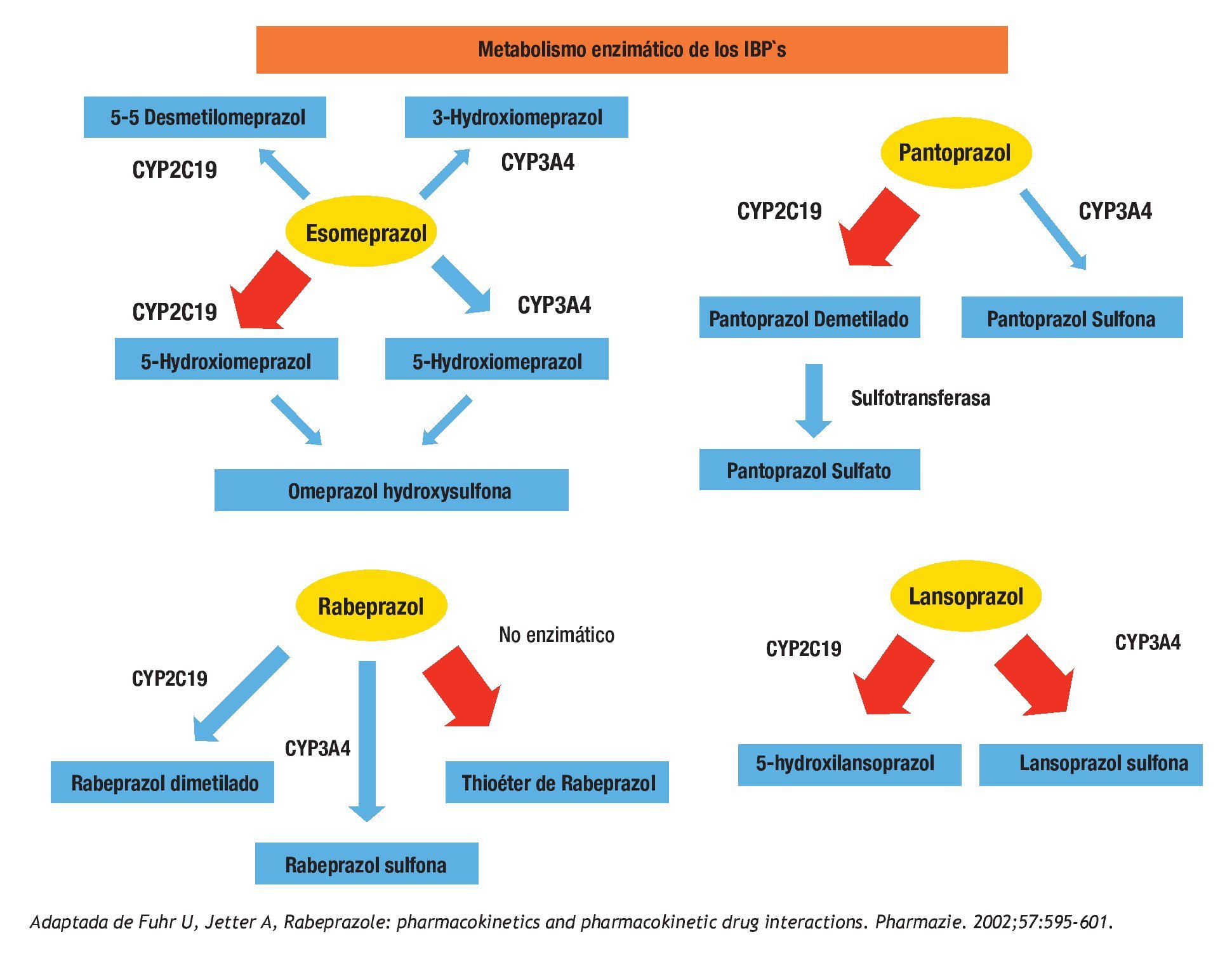
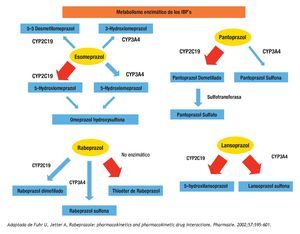
Figura 3. Se expresan gráficamente las vías de eliminación principales para el esomeprazol, pantoprazol, rabeprazol y lansoprazol. La flecha gruesa representa la vía enzimática más importante para la droga específica. Cabe mencionar que la vía metabólica más importante del rabeprazol es no enzimática.
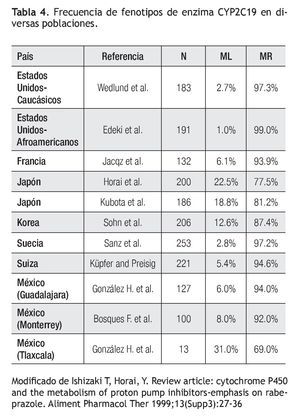
Experiencia fuera de México: Existe amplia diversidad mundial en la prevalencia del tipo de metabolizador respecto al polimorfismo de la enzima CYP2C19 (Tabla 4).38-43 Se ha descrito que algunos IBPs no son metabolizados por esta vía enzimática, así como que otros factores, tales como el tabaco, son más importantes sobre el efecto clínico final de los IBP que el polimorfismo de CYP2C19.44
Adachi y colaboradores, no encontraron diferencia en la inhibición de la acidez gástrica luego de la administración de rabeprazol entre los MR, ML y MR heterocigotos. De los 20 pacientes investigados 35% fueron MR, 45% fueron MR heterocigotos y 20% fueron ML. En contraste, sí se observaron diferencias entre los MR luego de la administración de lanzoprazol (Figura 3).45
En un estudio de 189 pacientes colombianos, se encontró que 83.6% son MR, 15.3% son MR heterocigotos y 1.1% son ML. Estos valores son muy semejantes a los reportados en nuestro país.46 El esquema estándar para la erradicación de H. pylori es una terapia triple con un IBP, amoxicilina y claritromicina y es utilizado en distintos países, entre ellos el nuestro. Además del metabolismo de los fármacos, otro de los factores clave para el éxito o fracaso en la erradicación de la bacteria es la presencia de cepas de H. pylori resistentes a la claritromicina.
Furuta y colaboradores, basándose en la premisa de que una terapia personalizada modificando las dosis dependiendo de la susceptibilidad al antibiótico y del tipo de metabolizador, podría impactar la tasa de erradicación, realizó un estudio aplicando este concepto. Encontró que la tasa de erradicación del H. pylori es más alta en el régimen modificado (96.6%), comparado con el grupo estándar (72.9%),47 subrayando la importancia práctica de este concepto.
En otro estudio realizado en nuestro centro explorando la misma idea en relación al polimorfismo del IBP y la respuesta al tratamiento con un esquema triple de amoxicilina, claritromicina y rabeprazol, no se encontró evidencia de que los genotipos de CYP2C19 o la resistencia de H. pylori a los antibióticos administrados afectaran la tasa de erradicación en esta población particular.35
Otros resultados en México: González y colaboradores, realizaron un ensayo clínico prospectivo, no aleatorizado en el cual administraron 20 mg de omeprazol a 127 pacientes mestizos del área metropolitana de la ciudad de Guadalajara, México. Se extrajeron muestras de sangre al momento de ingerir el fármaco y tres horas después y se midieron la concentración de omeprazol, hidroxyomeprazol y omeprazol sulfona, los cuales son metabolitos del CYP2C19 y CYP3A4. Determinaron tres tipos de fenotipos para cada enzima: metabolizadores ultra rápidos, MR, y ML. En 4% de la población fue metabolizador ultrarrápido, 90% MR y 11% fueron ML.35
Otro estudio realizado por el mismo grupo en una muestra pequeña de individuos de Tlaxcala, México, se encontró un aumento en el porcentaje de ML de 31%. Sin embargo, este trabajo posee una limitante, la población estudiada fue de sólo 13 pacientes, pero se podría esperar que existan diferencias en la prevalencia del polimorfismo, ya que la población mexicana posee un mestizaje importante y muy variable dependiendo la región geográfica que se desea estudiar (Figura 4).37
Figura 4. Prevalencia de diferentes fenotipos de CYP2C19 en poblaciones mexicanas. Frecuencia de metabolizadores rápidos (MR) y metabolizadores lentos (ML).
Conclusiones
La farmacogenética y la fármacogenómica son disciplinas nuevas y se encuentran en un proceso evolutivo. Gracias a la finalización del Proyecto Genoma Humano y la simplificación de las técnicas de aislamiento del ADN se esperan avances a pasos agigantados en esta área. El conocer el genotipo del paciente será de gran importancia para seleccionar el medicamento apropiado y para ajustar la dosis del mismo, con la finalidad de proporcionar el tratamiento y las dosis óptimas. Esto ayudará al clínico a tratar las enfermedades y reducir las reacciones adversas.
Actualmente existen tablas de recomendaciones de ajuste de dosis de fármacos metabolizados por las diferentes enzimas, las cuales están basadas en estudios publicados utilizando el análisis del genotipo o fenotipo. Incluso se menciona ya el término "pasaporte genético", el cual consistirá en una base de datos con la información genotípica del paciente, que será de gran importancia para el médico al momento de prescribir un medicamento, permitiendo el ajuste de dosis en forma individual. Se espera que poco a poco se modifique el proceso de cómo se prescriben y administran los medicamentos a los pacientes y así, que el desenlace clínico de éstos sea más certero y favorable.5
Como se mostró, existen diferencias en el polimorfismo de la CYP2C19 incluso en un mismo país, subrayando la heterogeneidad dependiendo de la población estudiada, por lo que no se puede generalizar un tratamiento sin conocer el bagaje genético de la población que uno atiende.
Correspondencia: Dr. Francisco Javier Bosques Padilla.
Avenida Francisco I. Madero y Avenida Gonzalitos s/n. Colonia Mitras Centro. Monterrey N. L. México. C. P. 64460.
Teléfono: (+52) 81 8346 2310 Fax: (+52) 81 8348 5981
Correo electrónico:fbosques58@hotmail.com
Recibido: Enero 2011.
Aceptado: Enero 2011