INTRODUCCIÓN
Los inmunomoduladores son sustancias que tienen la capacidad de aumentar o disminuir la respuesta inmune. Desde el punto de vista terapéutico, esta capacidad de modulación tiene un potencial amplio como terapia adyuvante en la enfermedad neoplásica, alérgica y por inmunodeficiencia. En las enfermedades infecciosas, el creciente problema de la resistencia a los agentes antibióticos y quimioterapéuticos, hace aún más patente el impacto benéfico que puede tener la modulación de la respuesta inmune en la resolución de la enfermedad. En esta revisión se presenta un panorama general sobre agentes inmunomoduladores de uso actual y algunos otros con potencial en la terapéutica médica.
Respuesta inmune
El sistema inmune es el sistema de defensa corporal involucrado en la protección contra microorganismos patógenos y neoplasias. Este sistema posee la capacidad de generar una gran variedad de células y moléculas capacitadas para el reconocimiento y la eliminación de diversos agentes patógenos. Estas actúan juntas en una red dinámica cuya complejidad asemeja la del sistema nervioso.
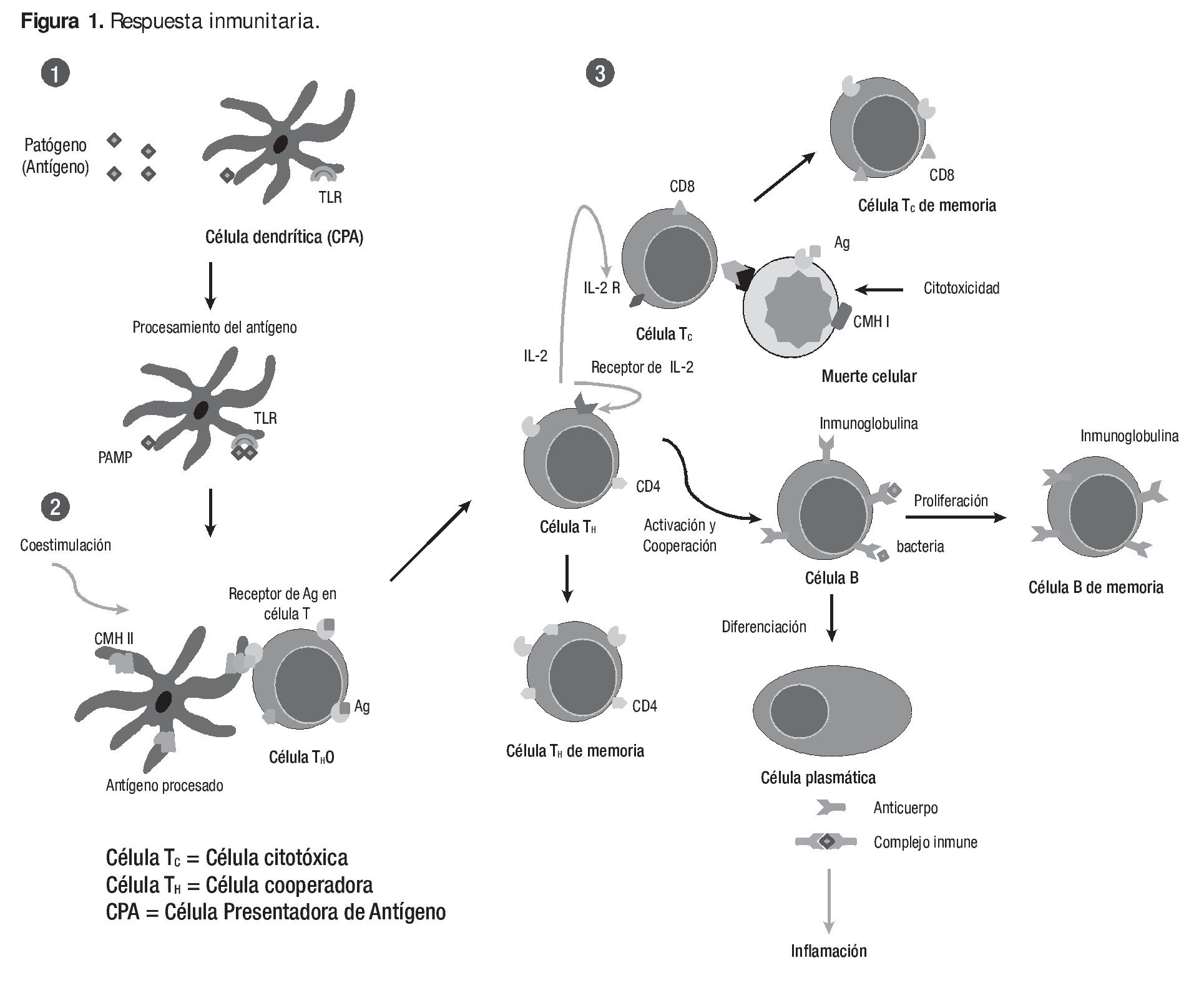
Funcionalmente, la respuesta inmune puede ser dividida en dos actividades secuenciales relacionadas: el reconocimiento de lo extraño y su reacción y consecuencia. El reconocimiento inmunológico está dado por la especificidad y es capaz de reconocer ligeras diferencias químicas que distinguen a un patógeno de otro, así como discriminar entre moléculas extrañas y componentes propios. Una vez que ha reconocido al organismo extraño, el sistema inmune desarrolla una respuesta apropiada denominada respuesta efectora para eliminar o neutralizar al organismo. Los linfocitos son las células centrales del sistema inmune, responsables de la inmunidad adquirida y los atributos de diversidad, especificidad, memoria y reconocimiento de lo propio y no propio, característicos de la respuesta inmune (Figura 1). Los otros tipos de leucocitos sanguíneos juegan papeles importantes fagocitando y destruyendo microorganismos, presentando antígenos y secretando citocinas. La entrada de un antígeno (Ag) al organismo pone en marcha la respuesta inmune, el Ag es captado y procesado por una célula presentadora de Ag (CPA), que lo muestra asociado al Complejo Principal de Histocompatibilidad (CPH). Dependiendo de la CPA que actúe y las señales que libere, se estimularán las células Th0, que posean el receptor en la célula T (RCT) adecuado para reconocer al Ag, expandiéndose y diferenciándose a Th1 o Th2. Las células Th1 están implicadas en la activación del receptor de la célula T y de macrófagos; las Th2 intervienen en la respuesta humoral. Sólo cuando existen suficientes Th2 que reconocen a un antígeno, cabe esperar una expansión importante de células B que también lo reconozcan.
Figura 1. La Respuesta Inmune. Inicia con la interacción del antígeno (Ag) con los componentes innatos de la inmunidad (1) donde las células dendríticas y/o macrófagos reconocen al agente patógeno por sus Patrones Moleculares Asociados a Patógenos (PAMP) a través de los Receptores de Patrones de Reconocimiento (PRR) como el receptor tipo Toll (TLR). A partir de la presentación del Ag a la célula T (2) se inicia la respuesta inmune adquirida (ver texto). Los inmunomoduladores pueden actuar a nivel de los mecanismos efectores de la respuesta inmune innata (1) o adquirida (3).
Los linfocitos Th1 secretan fundamentalmente IL-2, IFN-g y TNF, mientras que los Th2, secretan IL-4, IL-5, IL-6 y TGF-b. Las citocinas liberadas por un tipo de célula, tienden a excluir a la otra. Así, las células Th2 liberan IL-10 que inhibe la diferenciación hacia Th1. Y a su vez, las células Th1 liberan IFN-g que inhibe la diferenciación hacia Th2. Los antígenos intracelulares favorecen la respuesta Th1, mientras que los extracelulares y solubles favorecen hacia Th2. De la misma manera, la naturaleza del Ag y la vía de administración influyen en la diferenciación hacia Th1 o Th2. Las razones por las que la estimulación deriva a Th1 o Th2 no son conocidas con precisión, pero está claramente influenciado por algunos factores como el tipo de infección, la célula que presenta el antígeno y otras células implicadas en la respuesta inmune.
La enfermedad infecciosa
El ser humano está en constante reto contra una variedad de microorganismos (bacterias, virus, hongos y otros parásitos), causantes de diversas enfermedades infecciosas que se han convertido en uno de los principales problemas de salud pública, tanto para países desarrollados como en desarrollo. En los países en desarrollo el costo por individuo es inmediato y serio en términos de discapacidad transitoria o permanente, muerte, y en la disminución de la productividad económica. En el caso de los países industrializados, por mal uso y abuso de los antibióticos. La Organización Mundial de la Salud (OMS), en su reporte de Estadísticas Sanitarias 2009, muestra la notificación oficial de datos relativos a enfermedades infecciosas a escala mundial.1 De un total de 3,373,832 casos notificados del 2007 al 2009, la tuberculosis encabeza la lista de enfermedades infecciosas con un 76.47%, seguida de la parotiditis (12.10%), la rubéola (5.82%), tosferina (4.80%), tétanos (0.77%) y la poliomelitis (0.04%). El número de casos es un indicador impreciso de la carga de morbilidad; enfermedades como la gripe causada por el virus H5N1 y la peste presentan altas tasas de mortalidad; enfermedades como la poliomielitis y la lepra tienen tasas de mortalidad bajas, pero provocan pérdidas cuantiosas de años de vida sana.1
Uno de los logros más grandes de la medicina moderna ha sido el desarrollo de antimicrobianos para el tratamiento de las enfermedades infecciosas; desde la síntesis de las sulfas y el descubrimiento de la penicilina, hasta la diversidad de fármacos antibacterianos con que cuenta actualmente.2 Sin embargo, el problema de la resistencia es un inconveniente grave: la resistencia de Staphylococcus aureus a la penicilina se reportó desde 1947, cuatro años después del inicio de su producción a gran escala y desde entonces la cantidad y variedad de cepas patógenas resistentes a nuevas clases de antibióticos ha aumentado. Esto ha vuelto menos efectivos los diversos esquemas de tratamiento con medicamentos antimicrobianos. La transferencia horizontal de genes de resistencia a antibióticos entre bacterias, incluso entre especies diferentes, rápidamente crea poblaciones con una o más de las siguientes propiedades de resistencia a los antibióticos: a) habilidad incrementada para degradar o modificar los compuestos antimicrobianos; b) la alteración del sitio de unión del fármaco o proteína diana; c) la alteración de la ruta metabólica y d) la reducción de la acumulación del antibiótico a través de la disminución de la permeabilidad del fármaco o incrementando el flujo de diferentes antibióticos. De ahí que el interés en el desarrollo de nuevas alternativas para el tratamiento de infecciones bacterianas, se ha convertido en una emergencia global.2 La lucha por el control de las enfermedades infecciosas, lejos de salir adelante, ha adquirido una nueva intensidad.
Modulación de la respuesta inmune en la enfermedad infecciosa
Debido a que la búsqueda de agentes quimioterapéuticos seguros y efectivos ha sido entorpecida por la resistencia antimicrobiana y el riesgo de toxicidad, existe una necesidad de entender cómo el sistema inmune puede ser manipulado para controlar las infecciones, lo que ha dado como resultado una diversa colección de posibles agentes inmunomoduladores, que incluyen tanto agentes inmunoestimuladores como inmunosupresores. En algunos casos y dependiendo de la enfermedad, la finalidad de la modulación será aumentar la intensidad de la respuesta inmune que se encuentre disminuida por alguna causa (inmunosupresión, estrés, infecciones crónicas) mientras que en otros casos se tratará de reducirla cuando se encuentre fuera de regulación o control (enfermedades autoinmunes, alergias, transplantes, hipersensibilidad). En la terapia de las enfermedades infecciosas, restaurar una respuesta inmune que se encuentra disminuida o la potenciación de una respuesta normal, puede incrementar la resistencia a la infección, reducir la gravedad de la misma o acortar su periodo de recuperación.3 El objetivo se concentra en la activación del sistema inmune mediante el uso de moduladores con un efecto estimulador más que con un efecto inmunosupresor.
INMUNOMODULADORES
Para fines preventivos o terapéuticos, el sistema inmunológico puede ser manipulado de manera específica, por inmunización activa o inmunoterapia hiposensibilizante o de manera no específica mediante inmunomodulación. Los inmunomoduladores o inmunoestimulantes, que incluyen sustancias biológicas y compuestos químicamente definidos, han sido empleados satisfactoriamente en la prevención y el tratamiento de enfermedades virales y bacterianas producto de la inmunodeficiencia, cuando los tratamientos contra neoplasias (radio y quimioterapia) rompen el equilibrio del sistema inmune.4
La modulación de la respuesta inmune, puede ocurrir por mecanismos directos o indirectos. Los mecanismos directos de inmunomodulación involucran la interacción de un inmunomodulador y/o su metabolito con un componente de las células del sistema inmune. De esta manera, el estímulo modulador induce una modificación directamente en las funciones de las células del sistema inmune.4 Por otro lado, los mecanismos indirectos de la modulación involucran la interacción del inmunomodulador y/o su metabolito con un componente que no pertenece a las células efectoras del sistema inmunológico.5 Esta interacción con dicho componente, estimula o inhibe la liberación de un mensajero biológico que posee una actividad inmunomoduladora. Por lo tanto, un mecanismo directo de inmunomodulación es medible tanto in vivo como in vitro, mientras que un mecanismo indirecto es medible solamente in vivo.5
El modo de acción de muchos inmunomoduladores no es del todo conocido, aunque generalmente sus principales células blanco en el sistema inmune son los linfocitos T y B, monocitos/macrófagos, granulocitos y células NK.6 Sin embargo, se han propuesto diversas hipótesis que podrían explicar la acción de algunas de estas sustancias. Muchos de los mecanismos de acción de los inmunomoduladores están basados en la alteración que producen en la actividad de las células inmunes, tales como cambios en la expresión de genes, procesamiento del ARN mensajero, transporte intracelular de proteínas, síntesis proteica y la secreción y expresión de proteínas en la superficie celular, lo cual produce cambios celulares que pueden influir en la inducción, mantenimiento y regulación de la respuesta inmune.7 En muchos casos, se ha observado que la acción de los inmunomoduladores está relacionada con el mecanismo y equilibrio de segundos mensajeros que participan en las rutas de transducción de las señales celulares, como la adenosina-monofosfato cíclico (cAMP) y la guanina-monofosfato cíclico (cGMP). Por ejemplo, se ha demostrado que el aumento de los niveles de cAMP inhibe la función efectora de los linfocitos lo que produce inmunosupresión, mientras que niveles altos de cGMP promueven un incremento de la actividad de los linfocitos maduros lo que se traduce en inmunoestimulación.7, 8
Según la clasificación realizada por Mulcahy y Quinn y modificada años más tarde por Reddy y Frey en 1990, los inmunomoduladores pueden dividirse en tres categorías según su origen: a) procariótico o microbiológico; b) eucariótico o celular y c) de origen farmacológico o sintético.8, 9
Inmunomoduladores de origen procariótico o microbiológico
En este tipo de modificadores de la respuesta inmune, la inmunoterapia está dada por la administración de la forma no patogénica o atenuada de un microorganismo como en el caso del bacilo de Calmette-Guérin o por alguno de sus componentes bacterianos, como en el Adyuvante Completo de Freund, los lipopolisacáridos, el Muramil Dipéptido y el Lípido A.
El Bacilo de Calmette y Guérino BCG, es un inmunógeno altamente complejo que induce una respuesta inmune básicamente de tipo celular. En 1921 Calmette y Guérin, después de 13 años y de 230 pases de cultivo de una cepa de Micobacterium bovis, consiguieron un bacilo no patógeno pero sí inmunógeno, cuyo empleo logró, con eficacia variable, disminuir la incidencia de la tuberculosis y meningitis tuberculosa por su efecto inmunoestimulador protector sistémico.
Se piensa que una gran variedad de células inmunocompetentes, así como células uroepiteliales y aún las mismas células neoplásicas de la vejiga, participan en el mecanismo inmunológico que ocurre durante la terapia intravesical con el BCG.10 Los efectos anti-tumorales del BCG parecen estar relacionados a mecanismos inmunológicos, los cuales son reflejados por un incremento transitorio de varias citocinas y la presencia de leucocitos inmunocompetentes activados en la orina dentro de las 24 horas posterior a la instilación. Algunos estudios han reflejado una respuesta inflamatoria, por la presencia de citocinas IL-1, IL-6, IL-8, IL-18 y TNF-a mientras que otros datos indican una activación específica de células T, mediante la producción de IL-2 e IFN-g.11
Otros estudios han revelado que los linfocitos T CD4+ y los monocitos actúan como células accesorias en la citotoxicidad mediada por células inducidas por el BCG.12 Ciertamente, otro gran número de moléculas y células deben participar en la inmunomodulación inducida por el BCG, como la familia de moléculas de adhesión, las proteínas de choque térmico, los receptores tipo Toll, el óxido nítrico, las células dendríticas y sus subpoblaciones, las células T reguladoras (T-regs) y las recientemente descritas células Th17,10 todas ellas deben intervenir como efectoras y moduladoras tanto en la respuesta inmune innata como en la adaptativa. El BCG es un ejemplo de inmunomodulador que puede tener efecto en varios niveles del sistema inmune.
Los adyuvantes son sustancias utilizadas para aumentar la respuesta celular/humoral a un inmunógeno usado, ya sea de manera experimental o como vacuna para prevenir una enfermedad infecciosa. En general, entre los mecanismos que los adyuvantes utilizan para potenciar la respuesta inmune se encuentran: el efecto "depósito", la presentación de antígeno, la distribución del antígeno, una modulación/activación inmune y la inducción de linfocitos citotóxicos. El Adyuvante incompleto de Freund, es fundamentalmente aceite mineral. El Adyuvante Completo de Freund (ACF) desarrollado en 1937, es la combinación de una emulsión de aceite mineral y micobacterias muertas, uno de los adyuvantes más potentes conocidos para la estimulación de la inmunidad celular y humoral.13 El ACF modifica la respuesta inmunológica a través de los microorganismos muertos o sus productos bacterianos como Muramil Dipéptido (MDP), Lipopolisacáridos (LPS), Lípido A. Tiene la gran desventaja de que su uso está restringido únicamente para animales de laboratorio, debido a que contiene aceite mineral que no es metabolizado por el humano y los elementos micobacterianos pueden conducir a reacciones granulomatosas.
Con el descubrimiento de los receptores tipo Toll (TLR), se ha comprendido mejor el mecanismo celular de reconocimiento de las micobacterias y la respuesta, así como la acción del ACF. El TLR2 y el TLR4 son críticos para el reconocimiento inicial y para la respuesta inmune a las infecciones micobacterianas por los macrófagos y células dendríticas. La activación de diferentes TLRs conduce a diversas respuestas celulares y de citocinas, las cuales alteran la respuesta celular y humoral.14 Los componentes micobacterianos del ACF tienden a producir una fuerte reacción de hipersensibilidad retardada y dirigen la respuesta inmune hacia un perfil tipo Th1.15
Los peptidoglicanos de las paredes bacterianas poseen propiedades inmunomoduladoras y su estudio como agentes inmunoestimuladores data desde 1974, cuando se estableció que la actividad inmunoestimulante del adyuvante de Freund depende de la fracción péptido muramil de la pared de Mycobacterium tuberculosis. El Muramil Dipéptido(MDP) es la unidad estructural más pequeña responsable de la actividad adyuvante del peptidoglicano de las paredes celulares bacterianas. El MDP ha mostrado diversos efectos biológicos sobre las células inmunocompetentes in vitro y un aumento en las actividades fagocíticas y microbicidas de monocitos y macrófagos.16 Puede también inducir la respuesta mitogénica de las células B, e incrementar la expresión de moléculas inmunoestimuladoras, como moléculas del Complejo Mayor de Histocompatibilidad clase II, el CD40 y moléculas de adhesión-1 sobre monocitos y células B.17
Otros componentes bacterianos que actúan como inmunoestimulantes, son los lipopolisacáridos (LPS), constituyentes característicos de la pared celular de las bacterias gramnegativas. El LPS contiene una fracción llamada lípido A, integrada por ácidos grasos unidos por enlace estérico a moléculas de N-acetilglucosamina. Otra fracción es la región R, que está compuesta de hexosas, y la tercera fracción es el denominado antígeno O, que es específico para cada especie bacteriana. En algunas bacterias se encuentra además una proteína de unos 7.2 KDa., localizados en el exterior de la membrana. La actividad adyuvante de los lipopolisacáridos fue descrita por primera vez por Johnson y colaboradores, en 1956 y representan las endotoxinas de las bacterias gramnegativas. La mayoría de los estudios reportan que activan directamente a los macrófagos, y su propiedad adyuvante puede deberse a su habilidad para estimular la producción y liberación de citocinas como la IL-1.18 Los LPS tienen efectos directos sobre los linfocitos, son mitógenos de células B independientes de células T y poseen una variedad de actividades biológicas en organismos superiores, incluso en los humanos: por ejemplo, la pirogenicidad y toxicidad letal. Desde otro punto de vista, los LPS muestran funciones fisiológicas esenciales para las bacterias y su supervivencia.19 Estos polímeros complejos tienen sitios de unión para anticuerpos y otros componentes del suero, por lo tanto están involucrados en el reconocimiento y la eliminación de bacterias que realiza el sistema de defensa del hospedero. Los LPS son considerados inmunomoduladores potentes por su capacidad de activar linfocitos B, granulocitos y células mononucleares.19 Tanamoto y colaboradores, propusieron que las propiedades biológicas de los LPS residen en la porción de lípido A de la molécula y esta hipótesis ha sido confirmada por la producción de una gran familia de compuestos sintéticos del lípido A con múltiples actividades incluyendo el fenómeno de Schwartzman, la pirogenicidad, mitogenicidad y letalidad.20
Los componentes de las paredes celulares de las bacterias gramnegativas tales como lipoproteínas, LPS y proteína I, constituyen componentes inmunológicamente activos y altamente funcionales, activando linfocitos B humanos y de ratón; así como macrófagos/monocitos.21
Varios laboratorios han preparado análogos sintéticos de los constituyentes de las paredes celulares bacterianas biológicamente activos; como el lípido A, parte de los LPS de las bacterias gramnegativas y el MDP (dipéptido muramil sintético) derivado de peptidoglicano bacteriano. Los estudios para la búsqueda de un inmunomodulador también se concentran en encontrar moléculas que sean inocuas para el humano, ya que esto es un referente importante en el estudio de moléculas de origen bacteriano.
En conclusión, sabemos que la superficie bacteriana tiene un arreglo de proteínas, lípidos y carbohidratos localizados principalmente en la pared celular; estos componentes pueden ser moduladores de la respuesta inmune y por tanto inducir protección. El proceso de identificación de estos dominios estructurales capaces de generar protección inmunológica, está bajo un intenso estudio; tradicionalmente la evaluación y eliminación de agentes candidatos para su uso como inmunomoduladores han estado basadas en el sistema de ensayo y error. La técnica tradicional realiza el análisis de las paredes celulares bacterianas completas, identificando proteínas inmunoreactivas mediante inmunotransferencia, purificación y determinación de secuencias parciales de aminoácidos, clonación y recientemente mediante el análisis nucleotídico de genes para su expresión mediante tecnología de ADN recombinante. Dichas metodologías consumen mucho tiempo y únicamente son identificados un número limitado de candidatos. Actualmente, el análisis de proteínas podría identificar estructuras con potencial modulador.6
Otros adyuvantes
En el caso de la vacunación, la interfase entre reconocimiento del antígeno por parte de los efectores del sistema inmune innato y la producción de efectores de la respuesta inmune adquirida, es la base de su eficacia protectora. Como se discutió anteriormente, los adyuvantes pueden mejorar enormemente la respuesta inmune protectora y en la actualidad su conocimiento profundo es la clave para el desarrollo de mejores vacunas. El adyuvante clásico de mayor uso en la actualidad, por su efectividad así como por su seguridad y efectos adversos mínimos en su uso humano y animal, son las sales de aluminio (fosfato de aluminio e hidróxido de aluminio), descubiertas en la primera mitad del siglo XX. Estos adyuvantes, además de depositarse de manera particulada en los tejidos e inducir la fagocitosis del antígeno, activan a los macrófagos, estimulan la respuesta Th2 y se utilizan frecuentemente cuando el efector inmunológico buscado son los anticuerpos, ya que estimulan la producción de IgG1. No estimulan de manera importante la inmunidad celular, ya que el adyuvante se adsorbe a proteínas, se debe tener en consideración las condiciones fisicoquímicas de antígeno y adyuvante en este proceso.22, 23 Recientemente, han sido descritos nuevos aspectos del mecanismo de acción del hidróxido de aluminio, incluyendo la activación del sistema inmune innato y la producción de IL-1, a través de la activación del complejo de proteínas NPLR3 en monocitos y la inducción a células dendríticas inmunogénicas.24 En este nuevo enfoque de adyuvantes en los llamados "Sistemas de Adyuvantes" (Adjuvant System, AS) se busca combinar uno conocido como el aluminio con una molécula inmunoestimulante; tal es el caso del sistema adyuvante llamado AS04 que combina a esta sal con un agonista del TLR4, el monofosforil lípido A (MPL). El MPL es producido por detoxificación y purificación de lipopolisacáridos (LPS), originando una molécula no tóxica con propiedades inmunoestimuladoras de TLR-4. El sistema AS04 origina una respuesta transitoria local de citocinas que incrementa la activación de monocitos, células dendríticas y células T específicas de antígeno.25 Este sistema de adyuvantes se ha incorporado a algunas vacunas tales como Cervarix, aprobada para el uso en contra del papilomavirus humano y en la vacuna de antígeno de superficie de hepatitis B (FENDrix), desarrollada para pacientes con enfermedad renal y alto riesgo de hepatitis B.
Asimismo, se evalúan adyuvantes naturales, sintéticos o modificados, que puedan utilizarse para modular la respuesta inmune contra patógenos específicos o en ciertas poblaciones. Tal es el caso de los adyuvantes MF59, una emulsión de escualeno-tween 80 y trioleato de sorbitan, el cual es un compuesto natural orgánico originalmente extraído del hígado del tiburón. El MF59 está aprobado en Europa y se encuentra presente en diversas vacunas tales como la de la influenza. Otro ejemplo es el AS03, emulsión de aceite-agua y vitamina E y el AS02 que contiene MPL y QS21 de emulsión aceite-agua. El QS21 es un producto natural, saponina, extracto de la corteza del árbol Quillaja saponaria, nativo de Sudamérica.
Este adyuvante se ha usado en la vacuna experimental contra la malaria, RTS,S, que contiene una proteína recombinante del parásito. Dentro de los adyuvantes que utilizan saponinas se incluyen los complejos inmunoestimulantes llamados ISCOM (Immunostimulating Complex), desarrollados desde los años 80. Los ISCOM son partículas dodecaédricas de 30 a 40 nm que se componen de saponinas, colesterol, fosfolípidos y el antígeno.23
En conclusión, el conocimiento detallado del modo de acción de los adyuvantes incorporados a las vacunas, permitirá un mejor diseño de las mismas, con el objetivo de generar una respuesta inmune celular y humoral más efectiva, inducir una protección de largo plazo y una mejor memoria inmunológica y permitir su uso efectivo en hospederos con un sistema inmune deteriorado por la edad y/o enfermedad concomitante. Y, como en toda inmunización activa, buscando que esto suceda sin efectos adversos.
Inmunomoduladores originados de células eucarióticas: Citocinas
Las citocinas son proteínas solubles no antígeno específicas, producidas mayoritariamente por leucocitos que regulan las células del sistema inmune y los procesos inflamatorios. Estas moléculas reguladoras intervienen en la respuesta protectora contra neoplasias y las infecciones. Aunque algunas citocinas son producidas por células mononucleares, ya sea constitutivamente o en respuesta a señales de activación, su inducción ha mostrado estar disminuida en pacientes con enfermedades infecciosas crónicas26 por lo que podrían beneficiarse mediante la administración exógena de estas moléculas. Cuando se utilizan citocinas para inducir una inmunoestimulación, las ventajas locales son: 1) generar altas concentraciones de citocinas de manera local, similar a la respuesta propia del organismo contra antígenos extraños; 2) aprovechar los efectos paracrinos de las citocinas en forma sostenida que activen el sistema inmune.14 Algunas citocinas estimulan la producción de otras, de manera que interactúan, ya sea en forma sinérgica o antagónica y así sus efectos locales y sistémicos, están íntimamente involucrados en el control de las infecciones del hospedero.
Los avances en el entendimiento del papel de las citocinas en los desórdenes inflamatorios e inmunes, han conducido al desarrollo de terapias basadas en citocinas, debido a sus múltiples funciones reguladoras y efectoras en muchas enfermedades. Éstas moléculas, sus receptores y sus rutas de señalización, son candidatos prometedores para una participación terapéutica.27 El entendimiento preciso del balance crítico entre citocinas pro-inflamatorias y reguladoras en las infecciones microbianas, es fundamental para poder usar y regular con certeza y seguridad los efectos benéficos que se buscan mediante la terapia con citocinas, explotando así su gran potencial para aumentar la resistencia contra diversos patógenos. Los linfocitos T cooperadores (Th1) son cruciales para orquestar las respuestas de citocinas y de suma importancia para la eliminación de las enfermedades infecciosas. Estas células producen IFN-g, TNF-b e IL-2 requeridas para el desarrollo efectivo de la respuesta inmune mediada por células contra microorganismos intracelulares. Por otro lado, las células T cooperadoras (Th2) producen IL-4 e IL-5 que potencian la inmunidad humoral a antígenos dependientes de células T y la inmunidad contra infecciones con helmintos.6 Por lo tanto, los pacientes en quienes la producción de citocinas está alterada o en aquellos que llevan a cabo tratamientos de quimioterapia (lo que causa un aumento de la susceptibilidad a las infecciones) pueden beneficiarse de la terapia con citocinas exógenas.
Las posibilidades terapéuticas de las citocinas han sido investigadas de manera más activa en neoplasias que en las enfermedades infecciosas, por ejemplo las que inducen la estimulación de la proliferación, diferenciación y activación de las células hematopoyéticas y linfoides, indican su posible papel terapéutico y profiláctico en las infecciones.28 A pesar del potencial terapéutico de las citocinas, es necesario reconocer que en algunos casos se requieren altas dosis para ser efectivas, lo que trae efectos adversos graves. Adicionalmente, algunos pacientes pueden no responder a una terapia de citocinas in vivo, debido a su estado inmunocomprometido o a factores inhibidores del hospedero que afectan la proliferación, activación y diferenciación de linfocitos.28 En estos casos, las citocinas pueden ser utilizadas para una activación de linfocitos in vitro y para la inducción de crecimiento y diferenciación de progenitores hematopoyéticos. Estas poblaciones, propagadas y activadas in vitro, pueden ser transferidas a pacientes para facilitar su defensa antimicrobiana.28 Otro uso de la terapia con citocinas que ha sido aplicado satisfactoriamente es el tratamiento de citocinas recombinantes. Un hallazgo importante observado por Arendse fue que ratones vacunados con IL-9 incrementaban la resistencia a la leishmaniasis cutánea29 y en otros estudios ratones vacunados con IL-12 eran protegidos contra la encefalomielitis experimental autoinmune.30
El IFN-g derivado de célula T, es una importante citocina secretada por el subtipo Th1 de las células T y al igual que otras citocinas, tiene una gran variedad de efectos sobre numerosos tipos celulares. Un efecto bien descrito, es la habilidad de aumentar la actividad microbicida y microbioestática del macrófago; este parece estar mediado por un incremento en la liberación de moléculas microbicidas como óxido nítrico e intermediarios reactivos del oxígeno. Las citocinas o sus combinaciones pueden tener uso terapéutico en algunas enfermedades infecciosas. Por ejemplo, la IL-1, IL-3 y los factores de crecimiento hematopoyéticos, solos o en combinación, pueden ser benéficos en el tratamiento de infecciones asociadas con neutropenias o septicemia neonatal; o en la prevención de infecciones que acompañan a la anemia aplásica, a la quimioterapia, en inmunodeficiencias o en quemaduras. La IL-2, la IL-12, el TNF-a y los interferones (IFNs), pueden ser útiles en potenciar la defensa antimicrobiana del hospedero estimulando sus células efectoras. Además, los IFNs pueden tener un efecto directo inhibitorio sobre la replicación del ciclo de ciertos agentes microbianos.28
Las citocinas también han sido descritas como una espada de doble filo, ya que se les han atribuido tanto efectos benéficos como dañinos. Entre los efectos adversos que se atribuyen a las citocinas, se han reportado que la IL-12 induce diferentes mecanismos que resultan tanto en protección como exacerbación. Por ejemplo, que la administración de IL-12 exógena confiere protección en ratones BALB/c susceptibles a la infección por Yersinia enterocolitica, pero exacerba la yersiniosis en ratones C57BL/6.31 La administración de IL-4 a un grupo de ratones un día previo a retarlos con Pseudonoma aureginosa, mejoró la supervivencia y disminuyó la producción de TNF-a; en cambio la IL-4 administrada simultáneamente a la infección con P. aeruginosa incrementó la mortalidad y los niveles de TNF-a en ratones subletalmente infectados.32 En ratones deficientes de IL-13 se demostró una superviviencia significativamente aumentada en la infección de Schistosoma mansoni, mientras que se observó una mortalidad incrementada en ratones deficientes de IL-4 y de IL-4/IL-13 sugiriendo un papel perjudicial de la IL-13.33 Se ha observado que una producción exagerada de citocinas inflamatorias como TNF, IL-1 e IL-6 juega un papel deletéreo en algunas infecciones como VIH, malaria y sepsis.
El síndrome de filtración capilar es la principal toxicidad dependiente de la dosis, en la terapia con citocinas, específicamente IL-2. Este síndrome se caracteriza por un incremento en la permeabilidad vascular acompañada por una extravasación de fluidos y proteínas que produce edema intersticial y falla orgánica. La patogénesis del daño a las células endoteliales es compleja y puede involucrar la activación o daño de células endoteliales y leucocitos, la liberación de citocinas y de mediadores de la inflamación, la alteración de la adhesión célula-célula, matriz-célula y en la función del citoesqueleto.34 La eficacia de las citocinas exógenas capaces de potenciar mecanismos normales de defensa del hospedero, puede estar reducida a pacientes inmunocomprometidos que carecen de células efectoras o que contienen factores relacionados con la enfermedad que impiden la activación de linfocitos.
Los interferones son citocinas descritas originalmente en 1957 con una acción que interfería con la replicación viral. Fueron clasificadas inicialmente según la célula que los secretaba: el IFN-a o leucocitario (producido por fagocitos mononucleares), el IFN-b o fibroblastoides (producido por fibroblasto) y el IFN-g (producido por linfocitos y células NK).35 En la actualidad se clasifican según sus receptores y la homología de sus secuencias. Los interferones tales como el IFN-a y el INF-b, y otros más son clasificados como tipo I, y el IFN-g es el único clasificado como tipo II.36 El mecanismo de acción del IFN-a y el INF-b se relaciona con la inhibición de la replicación y la propagación viral. Asimismo activa y regula la expresión del Complejo Mayor de Histocompatibilidad clase I. El IFN-g estimula y activa a los macrófagos, neutrófilos y células NK en sus funciones fagocíticas y citotóxicas, además de incitar la expresión de moléculas del Complejo Mayor de Histocompatibilidad de clase I.37 El IFN-a (INTRON A) está indicado en el tratamiento de hepatitis B y C y como adyuvante en mieloma. Por otro lado el IFN-g (ACTIMMUNE) está recomendado como terapia adyuvante en la enfermedad granulomatosa crónica, una inmunodeficiencia primaria con defecto en la función fagocítica en los neutrófilos y en la osteopetrosis maligna.
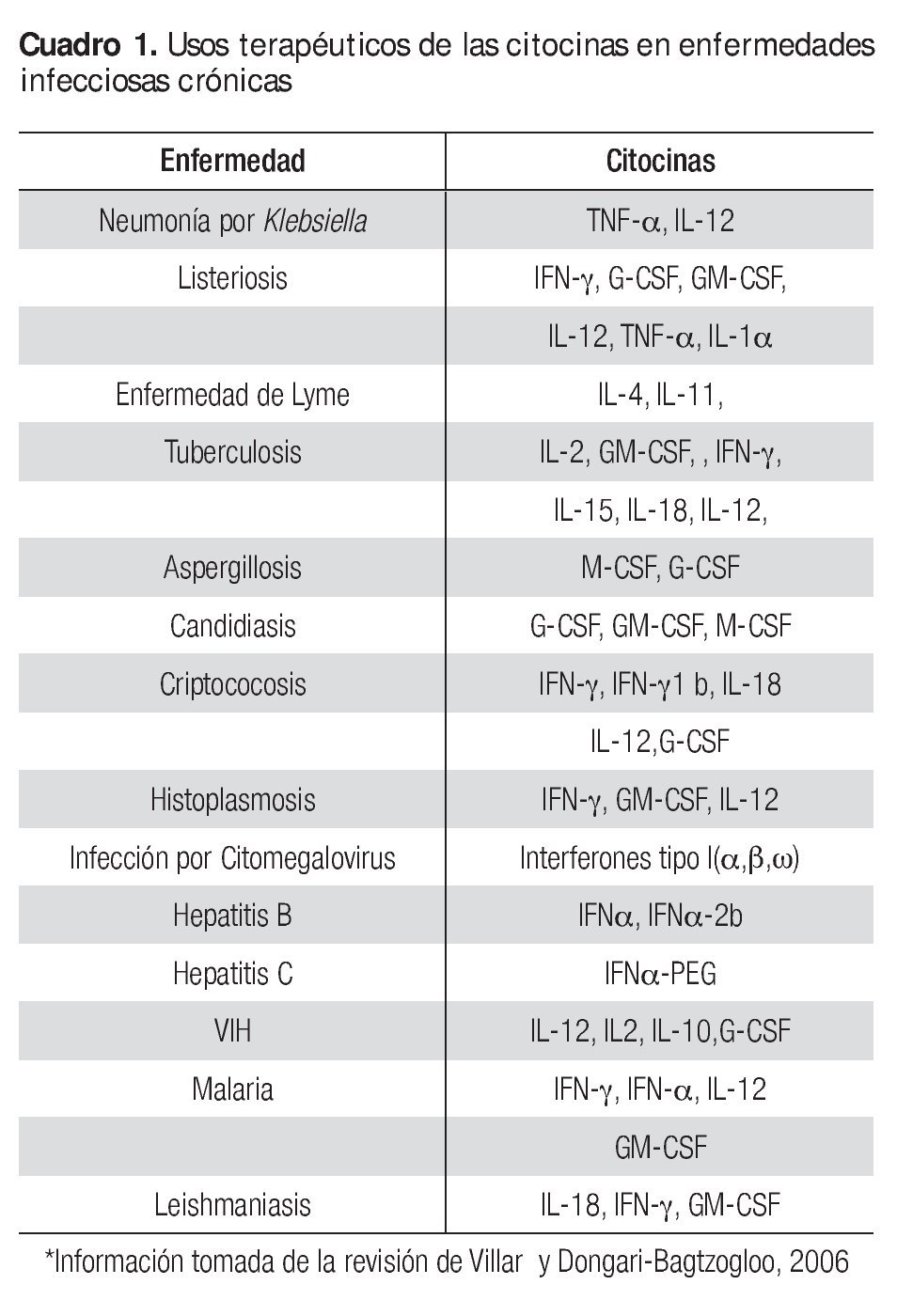
De acuerdo a la revisión realizada por Villar y Dongari-Bagtzogloo,37 existe información actual acerca de la aplicación de las citocinas en la terapéutica contra enfermedades infecciosas crónicas de origen bacteriano, parasítico, fúngico y viral (Cuadro 1). El conocimiento de nuevos métodos para la administración de citocinas es necesario para facilitar el tratamiento de las infecciones crónicas y limitar su toxicidad. Las adaptaciones del virus, bacterias y parásitos a la presencia de citocinas plantean problemas nuevos y será necesario elucidar los mecanismos moleculares responsables de proteger las actividades antagónicas de las citocinas. La aplicación juiciosa y el conocimiento de las limitaciones son imperativas en la terapia de citocinas utilizada en el manejo de las enfermedades infecciosas.6
Inmunomoduladores farmacológicos o sintéticos
La Talidomida se sintetizó por primera vez en 1954 por los laboratorios Chemie Grünenthal, en Alemania, con el nombre molecular de amida de ácido italiglutámico, conocida por sus efectos sedantes e hipnóticos y utilizada en el tratamiento de la hiperemesis gravídica. Sin toxicidad entonces reconocida, fue probada en ratones a dosis de hasta 10,000 mg/kg sin observar efectos colaterales fatales.38 Cuatro años después de su creación la talidomida fue retirada del mercado debido a graves problemas de teratogénesis en productos de madres tratadas con el fármaco. Las manifestaciones clínicas en el recién nacido incluyen amelia, focomelia, desarrollo defectuoso en brazos, piernas o bien alteraciones masivas internas.39 La FDA en Estados Unidos aprobó la comercialización del fármaco para uso en pacientes con lepra en 1998. El interés de la talidomida a más de cuatro décadas de haber sido retirada, resurgió por sus propiedades inmunológicas y antiinflamatorias, ya que modula la síntesis de citocinas, especialmente la del TNF-a in vitro e in vivo.38 Sampaio y colaboradores lograron demostrar la inhibición selectiva de la síntesis del TNF-a por los monocitos, al reducir la vida media del ARN mensajero de esta citocina, cuyo papel es de suma importancia en la respuesta del hospedero a procesos infecciosos de etiología viral, parasitaria, micótica o bacteriana, así como también en patologías autoinmunes.40 La talidomida también altera la densidad de las moléculas de adhesión en los leucocitos inducidas por el TNF-a. Inhibe también la fagocitosis realizada por los polimorfonucleares41 y tiene propiedades coestimuladoras con las células T con aumento de la producción de interleucina 2, la cual tiene un papel importante en el efecto antiangiogénico de la talidomida.42 Influye sobre la quimiotaxis leucocitaria al inhibir la migración de monocitos y linfocitos al tejido afectado, en relación directa con la dosis. La talidomina y sus análogos son potentes inhibidores de la producción de TNF-a por monocitos estimulados con LPS. Esta inhibición es debida al incremento de la degradación del ARNm del TNF-a por la talidomida. Niveles de otras citocinas como IL-1b, IL-6 y el factor estimulador de colonias de granulocitos también son inhibidos por la talidomida, mientras la IL-10 es estimulada.42 Esta droga ha mostrado coestimular a linfocitos T, induciendo su proliferación, producción de citocinas y actividad citotóxica. La coestimulación involucra la entrega de una segunda señal a células virgen para producir una respuesta antígeno-específica.43
Otro ejemplo de fármaco inmunomodulador es el Imiquimod, un producto farmacéutico de uso en dermatología, y aprobado en 1997. Este compuesto es una amina imidazolquinolina que potencia la respuesta inmune e induce IFN-a, IFN-g e IL-12.44 El imiquimod, posee actividad antiviral, antitumoral e inmunomoduladora.45 El imiquimod y sus compuestos relacionados como el S-28463, han mostrado estimular efectivamente la actividad leishmanicida (L. donovani) asociada con la síntesis de óxido nítrico (NO) en macrófagos in vitro e invivo en un modelo de ratón.46 Además de la inducción de IFN-a y otras citocinas, también son inducidos otros efectores de la respuesta innata. Esto incluye la estimulación de la actividad de las células NK, la activación de macrófagos para producir óxido y la inducción de linfocitos B para proliferar y diferenciarse.47 Las células de Langerhans, las principales células presentadoras de antígeno, también responden a la aplicación del imiquimod potenciando su migración a la región de los ganglios linfáticos, incrementando la presentación del antígeno a las células T. Se propone que la actividad antiviral y antitumoral del imiquimod en modelos animales proviene de la estimulación de la respuesta inmune innata y la inmunidad mediada por células. Se observó que los anticuerpos contra INF-a de ratón, bloquearon muchos de los efectos antivirales agudos y antitumorales, indicando que el IFN-a, como parte de la respuesta inmune innata, es parcialmente responsable de esta actividad.48
Inmunomoduladores farmacológicos: antiparasitarios
Ciertos fármacos antiparasitarios han mostrado tener una actividad inmunomoduladora; entre ellos se encuentran el levamisol, tiabendazol,49 fenvalerato,50 oxfendazol,51 fenbendazol,52 niridazol, metronidazol,53 carbofurano54 e ivermectina.55 Los efectos inmunomoduladores de estas drogas antiparasitarias, han sido estudiados en enfermedades infecciosas bacterianas, virales, micóticas y helminticas, así como en enfermedades neoplásicas y autoinmunes.3
Como un fármaco representativo de este grupo de agentes tenemos el levamisol, (6-fenil 2,3,5,6-tetrahidroinidazol [2,1-b] tiazol hidroclorato) y miembro de los tioimidazoles, inicialmente desarrollado como un antihelmíntico y usado extensamente para el tratamiento de helmintos gastrointestinales y tisulares. Se han efectuado diversos estudios para demostrar la actividad inmunomoduladora del levamisol, algunos de ellos con resultados contradictorios. Este fármaco, cuando fue administrado en combinación con la vacuna de parvovirus canino, potenció la producción de anticuerpos, incrementó la actividad fagocítica y estimuló la actividad de proliferación de linfocitos56 y de manera similar potenció la respuesta protectora de anticuerpos a la vacunación contra hepatitis B en pacientes con hemodiálisis.57 El efecto del levamisol sobre la inmunidad celular es principalmente sobre linfocitos T anérgicos, macrófagos y leucocitos polimorfonucleares.58 Como se mencionó, el efecto inmunomoestimulador del levamisol no ha podido ser demostrado por todos los investigadores dedicados a su estudio,3 y a pesar de su uso actual, es necesario establecer consistentemente su efecto benéfico y modulador.
Existen otros medicamentos antiparasitarios, además de los mencionados, que han sido evaluados como inmunomoduladores y muestran un potencial favorable para su uso como modulador positivo. Tal es el caso de la ivermectina y la dietilcarbamacina. Sajid et al3, al revisar los diversos fármacos antiparasitarios con propiedades moduladoras describe el levamisol y la ivermectina pero no la dietilcarbamacina, como drogas antiparasitarias con actividad inmunomoduladora, sin embargo algunos autores han encontrado putativamente un efecto inmunomodulador además de su efecto antiparásito.59-62
La IVM es un análogo semisintético de la Avermectina B1a (Abamectina), una lactona macrocíclica de administración oral de amplio espectro, similar a otros antibióticos macrólidos pero desprovista de acción antibacteriana y con gran acción contra una gran variedad de nematelmintos y ácaros: por ello ha sido usada tanto en animales como en humanos. La ivermectina se administra sólo por vía oral en humanos.
La IVM provoca la inmovilización de los parásitos induciendo una parálisis tónica de la musculatura.63 Esta parálisis es mediada por la potenciación y/o activación directa de los canales de Cloro (Cl-) sensibles a ivermectina, controlados por el glutamato. Esos canales están presentes sólo en los nervios y células musculares de los invertebrados y una vez elevados, acarrean un aumento en la permeabilidad de la membrana celular a los iones cloro mediante hiperpolarización de los nervios o células musculares, resultando en parálisis y muerte del parásito. Sin embargo, ha crecido la evidencia de que la actividad de la IVM puede influir el sistema inmune del hospedero.
Blakley y Rousseaux en 1991, evaluaron el efecto de la IVM sobre la respuesta de anticuerpos en ratones utilizando glóbulos rojos de carnero y la respuesta de anticuerpos independiente de células T, usando como antígeno el dinitro-ficoll, en ratones CD-1 y observaron que la respuesta dependiente de las células T era potenciada comparada con la respuesta independiente de T. Por lo que se relacionó su efecto con la función de los linfocitos T y su posible aplicación en diferentes grados de inmunosupresión asociados con estrés, enfermedades infecciosas o deficiencias nutricionales.64 Savanur encontró también que la IVM a una dosis terapéutica, altera la cuenta de linfocitos sin afectar la concentración de inmunoglobulinas totales del suero, de proteínas totales en el suero o el índice fagocítico en animales.65 Otros estudios sin embargo, mostraron que en conejos tratados con IVM se incrementaba la concentración de las inmunoglobulinas totales antígenoespecíficas y las proteínas totales en el suero.66
El tratamiento con IVM incrementó significativamente la producción de IL-1 b y TNF-a inducida por un antígeno de O. volvulus en células mononucleares de pacientes con oncocercosis; de la misma manera aumentó, un mes después del tratamiento, la producción de IL-2 e IL-4 inducida por fitohemaglutinina. Estos resultados sugieren que la inmunosupresión mediada por la oncocercosis es reversible, con la subsecuente eliminación permanente de las microfilarias de la piel, posterior al tratamiento con ivermectina. La inmunidad celular específica contra el parásito y la producción consistente de IL-2 e INF-g contribuyen al control de la re-infección. Aunque se considera que la ivermectina y la dietilcarbamacina ejercen su actividad antiparasitaria por mecanismos diferentes, se observó el mismo patrón de cambios serológicos en los pacientes tratados con cualquiera de los dos medicamentos para el control de la microfilaremia.67
En 1993 Tischendorf y colaboradores, estudiaron los efectos moduladores de tres diferentes drogas antihelmínticas, entre ellas la IVM, sobre las células efectoras eosinofílicas, específicamente la producción del anión superóxido y la generación de peróxido de hidrógeno in vitro. Ellos observaron que los eosinófilos pre-tratados con IVM (40 ng/ml) incrementaban la producción del anión superóxido y que con una dosis baja de IVM (20 ng/ ml) aumentaba hasta en 12% la producción de peróxido de hidrógeno. Por lo que concluyeron que estos efectos moduladores en la generación de radicales tóxicos de oxígeno por parte de los eosinófilos, mediante estos antihelmínticos, en especial la IVM, eran dosis-dependientes.
Debido a los diversos reportes acerca del efecto inmunopotenciador de la IVM, Sajid68 y colaboradores realizaron un estudio en conejos sanos, donde se evaluó la respuesta inmune celular y humoral posterior a un tratamiento con diversas dosis de IVM (200, 400 y 600μg/kg). La inmunidad celular evaluada a través de las pruebas de dinitroclorobenceno (DNCB) y ensayos de fagocitosis, aumentó en los conejos tratados con IVM. Se cree que puede ser debido al efecto inmunoestimulador de la IVM o a una mayor expresión de receptores de superficie de los fagocitos. La inmunidad humoral se determinó mediante hemaglutinación contra un antígeno de P. multocida y la formación de placas hemolíticas de Jerne. En este estudio la IVM tuvo un efecto significativo sobre la cinética de los anticuerpos de los conejos contra el antígeno específico. La conclusión del estudio fue que la IVM en dosis terapéuticas tenía un pequeño pero significativo efecto inmunoestimulador que coincidía con los estudios previos realizados por Blakley y Rousseaux.69
Dietilcarbamacina
La dietilcarbamacina (1-Dietilcarbamil-1-4-metil piperazina) ha sido utilizada en el tratamiento de enfermedades parasitarias humanas y veterinarias, particularmente infecciones por filarias. Su acción antifilarial fue descubierta y descrita por Hewitt en 1947.70 La dietilcarbamacina ha sido utilizada contra todas las filariasis humanas: Brugia malayi, Brugia timori, Loa loa, Mansonella ozzardi, Mansonella perstans, Mansonella streptocerca, Onchocerca volvulus y Wuchereria bancrofti. Mazzoti evaluó en México en 1947 su valor terapéutico contra la oncocercosis y observó asimismo efectos secundarios graves luego de la administración del fármaco en individuos altamente infectados con Onchocerca volvulus (medido esto por el número de microfilarias por mg de piel), en lo que posteriormente fue bautizado como "reacción de Mazzotti".71
La dietilcarbamacina (DEC) es un derivado carbamilo sintético de la piperazina, con efecto microfilaricida. La característica mas notable y sorprendente de la DEC es que sólo tiene efecto sobre las microfilarias in vivo y no in vitro.72 Originalmente se pensó que el mecanismo de acción de la DEC era el de una opsonina, modificando a las microfilarias, para su posterior captura y destrucción por células del sistema fagocítico mononuclear. La DEC induce la movilización de las microfilarias por efecto directo sobre el sistema neuromuscular de los parásitos.73 La administración de la DEC parece potenciar la acción de la acetilcolina microfilarial y resultar en un incremento en la movilidad parasitaria hacia la circulación general. La adherencia de las microfilarias a los capilares y a los fagocitos fijos (células de Küpffer) en presencia de DEC podría ser debido al mismo mecanismo por el cual se promueve la adhesividad de los eosinófilos in vitro.74 La DEC tiene efectos fisiológicos directos sobre los granulocitos; horas después del tratamiento con la DEC, los eosinófilos tisulares son hallados desgranulándose en la superficie de las microfilarias. La DEC induce la vacuolización de leucocitos in vitro de una manera dependiente de la dosis; los eosinófilos parecen ser más sensibles a esta acción que los neutrófilos.75 Estudios efectuados mediante microscopia electrónica, mostraron que la vacuolización de los neutrófilos puede darse a concentraciones terapéuticas de 10 µg/ml de DEC.76
La dietilcarbamacina como inmunomodulador
Las observaciones referidas sugieren que la DEC ejerce su mecanismo de acción in vivo actuando en estrecha relación con los sistemas de defensa del hospedero y ejerciendo funciones inmunomoduladoras. La DEC es un inhibidor de la vía lipooxigenasa en el metabolismo del ácido araquidónico, e inhibe, de manera dependiente de la dosis, la formación de leucotrienos A4, B4 y C4.72 Asimismo, se ha observado que la DEC inhibe de forma reversible la agregación plaquetaria, lo que sugiere así un posible efecto sobre la vía de la ciclooxigenasa.72 Estos ejemplos nos indican un comportamiento aparentemente paradójico del medicamento en lo que respecta al evento inflamatorio, ya que por una parte se observa una actividad estimulante y pro-inflamatoria con respecto a los efectores fagocíticos y por la otra se tiene un efecto antiinflamatorio hacia los mediadores derivados del ácido araquidónico. Por otro lado, con anterioridad se ha mostrado la producción in vitro de citocinas proinflamatorias estimuladas por la DEC y la producción in vitro e in vivo de la b-quimiocina RANTES (Regulated on Activation Normal T Cells Expressed and Secreted) en individuos sanos y en células obtenidas de ellos.77 Kitchen y colaboradores han estudiado algunos aspectos inmunomoduladores putativos de la DEC. Por ejemplo, estudiaron la producción de anticuerpos en gatos inmunizados bajo la influencia de la DEC y encontraron un aumento de títulos de los anticuerpos séricos.78 Igualmente reportaron el aumento de títulos de anticuerpos en gatos con peritonitis causada por coronavirus y en gatos expuestos a oncornavirus (virus de la leucemina felina).79, 80 Posteriormente en estudios donde se trató con DEC a ratones inmunosuprimidos farmacológicamente con ciclofosfamida e infectados experimentalmente con bacterias como Streptococcus pneumoniae y Heamophilusinfluenzae, y hongos como Cryptococcus neoformans y Aspergillus fumigatus, el tratamiento se relacionó con la disminución de los microorganismos infectantes en órganos como cerebro, riñón y pulmón.60 Asimismo, estudiaron el efecto de la DEC asociado con el antifúngico fluconazol en ratones infectados experimentalmente con C. albicans, C. neoformans y A. fumigatus, donde la DEC potenció el efecto terapéutico al disminuir el número de microorganismos en cerebro y riñón.61
Por otro lado, Guerrero-Ramírez81 realizó un estudio utilizando dosis terapéuticas de DEC en un modelo de ratones BALB/c, reconocidos como inmunocompetentes. Usando la dosis de 250 µg de DEC en ratones sanos, se indujo un estímulo en la respuesta fagocítica y el estallido respiratorio tanto de polimorfonucleares como células monocíticas, es decir, en la respuesta inmune innata. En cambio, con la dosis de 25 µg de DEC, equivalente a una dosis baja en el humano, hubo un incremento de la IL-2 e IL-12 en ratones inmunizados previamente con TT (toxoide tetánico). La DEC aumentó también la producción de IL-10 y de anticuerpos en los ratones inmunizados con LPS,81 sugiriendo que la dosis terapéutica baja de DEC induce un estímulo en la respuesta inmune humoral y celular (adquirida) y las dosis altas influyen en los mecanismos fagocíticos (innatos).81
La búsqueda de inmunomoduladores y adyuvantes es una tarea larga, difícil y costosa, y por ello las pruebas iniciales deben ser conducidas en modelos de ratón estables y conocidos, como el BALB/c. Si bien la experiencia indica que compuestos que parecen prometedores en modelos de ratón, pueden no funcionar en el humano, los resultados obtenidos al usar la DEC en dicho modelo81 sugieren que la DEC tiene potencial como inmunomodulador, con posible uso en individuos inmunocomprometidos, en la potenciación de medicamentos existentes y como posible adyuvante en la vacunación.60, 81
Conclusiones
En la clínica, el tratamiento antibiótico en las infecciones graves en pacientes inmunocomprometidos no siempre es satisfactorio. Varios factores contribuyen a esto. Un factor importante es la falla de los mecanismos de defensa del hospedero en proveer un soporte adecuado al tratamiento en el sitio de infección. Los medicamentos antimicrobianos han sido un instrumento que ha salvado la vida de millones de personas en el mundo; sin embargo, el valor terapéutico de los antibióticos está siendo desgastado por la resistencia emergente de los microorganismos a estos medicamentos. La lucha por el control de las enfermedades infecciosas, lejos de estar por terminar, ha adquirido una nueva intensidad; se necesitan nuevos enfoques e ideas terapéuticas que actúen junto con las terapias establecidas.
Los agentes inmunoestimuladores son capaces de potenciar los mecanismos de defensa del hospedero para proveer la protección contra la infección. La principal promesa de los nuevos inmunomoduladores radica en que su modo de acción, al estimular a los efectores inmunológicos del hospedero, es diferente de la acción microbicida directa de antibióticos, antivirales y antifúngicos conocidos. Medicamentos químicamente definidos y seguros, de uso actual en el humano, utilizados a dosis terapéuticas y con actividad inmunomoduladora, así como el uso de adyuvantes efectivos e inocuos en las nuevas vacunas que se desarrollan, representan una opción para el combate de las enfermedades infecciosas.
* Correspondencia: Dr. med Carlos E. Medina de la Garza.
Departamento de Inmunología. Facultad de Medicina y Hospital Universitario Dr. José Eleuterio González, Universidad Autónoma de Nuevo León. Avenida Gonzalitos No. 235 Norte. Colonia Mitras Centro. CP 64460. Monterrey, Nuevo León, México. Teléfono: (+52 81) 8329 4211.
Correo electrónico: carlos.medina@uanl.mx
Recibido: junio, 2009. Aceptado: agosto, 2009.