Introducción
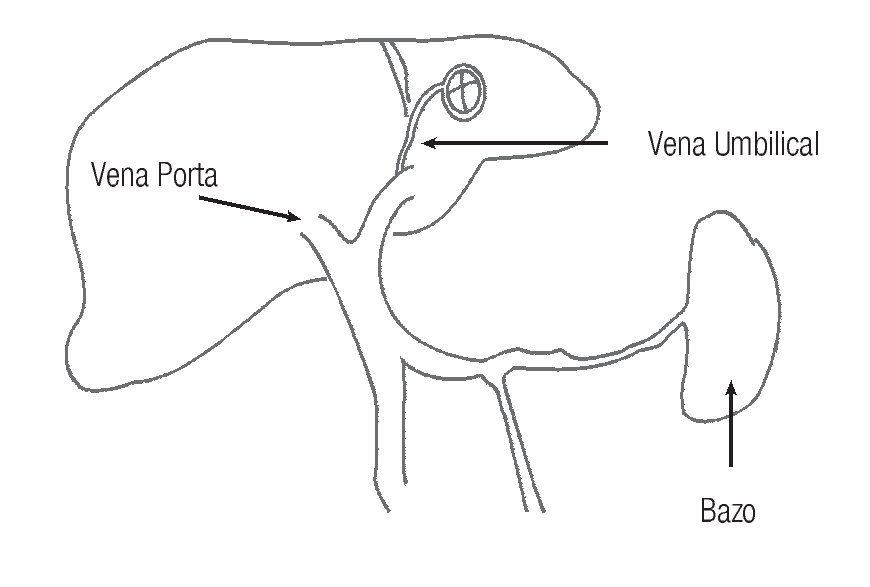
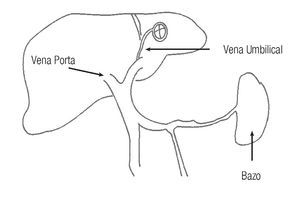
La cirrosis hepática es una causa importante de morbilidad y mortalidad, la cual presenta dos escenarios distintos o manifestaciones clínicas diferentes. Por un lado están las relacionadas con la insuficiencia hepática en la cual hay una disminución de la producción de albúmina, menor concentración de factores de coagulación, entre otras, y por otro lado están las manifestaciones secundarias a la hipertensión portal, que es una de las complicaciones de las etapas tardías de la cirrosis hepática. Este trastorno puede causar muchas otras complicaciones, como encefalopatía hepática, ascitis, hemorragia variceal, gastropatía hipertensiva, etcétera.1 Al considerar todo esto, los esfuerzos son cada vez mayores en aras de podercambiar el pronóstico lamentable que tienen estos pacientes. Existen diferentes herramientas diagnósticas para los pacientes con hipertensión portal con el fin de evitar o tratar esta lamentable complicación. En términos generales se puede decir que existen métodos directos e indirectos para poder determinar el grado de hipertensión portal que padecen los enfermos. Entre los métodos directos, los cuales han caído en desuso debido al porcentaje de complicaciones y al tipo de abordaje, hay tres tipos (Figura 1): 1) Canalización de la vena umbilical, de ser posible, la cual desemboca generalmente en la rama izquierda de la vena porta. 2) Punción en la pulpa del bazo con el fin de determinar la presión en la vena esplénica y, por consiguiente, en la vena porta. 3) Medir en forma directa por punción en la vena porta o en alguna de sus ramas.
Figura 1. Diferentes técnicas para determinar en forma directa la presión portal.
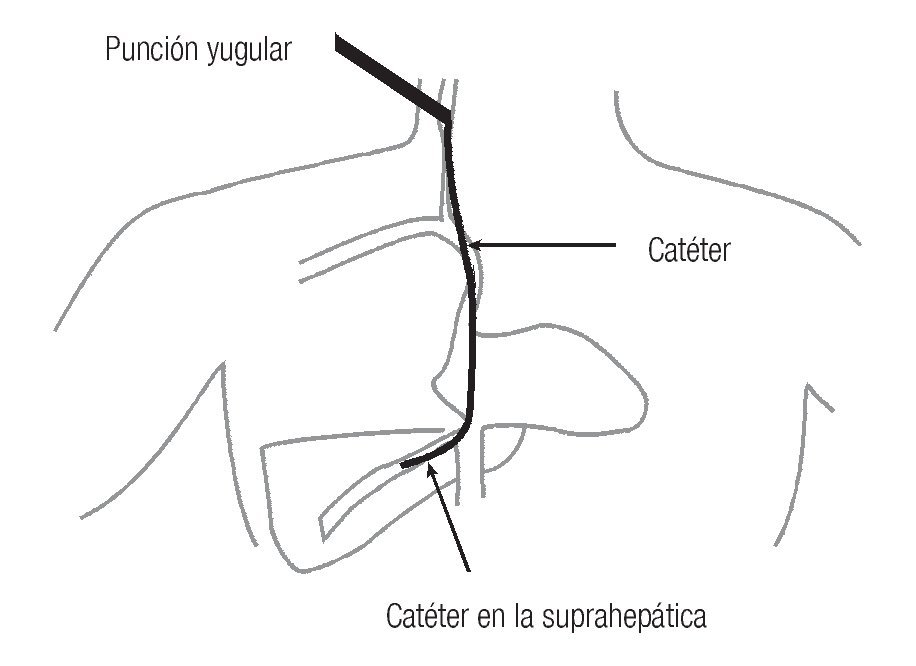
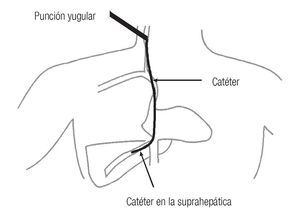
En la actualidad, existe la posibilidad de medir la presión portal en forma indirecta y menos compleja, pero sobretodo en forma confiable: a través de la vena yugular se accede a la vena suprahepática y se determina de manera indirecta la presión portal con un porcentaje de exactitud y similitud alto, por lo que hoy en día es el método de elección para los pacientes (Figura 2).
Figura 2. Se ilustra la canulación de la vena yugular y colocación del catéter en la vena suprahepática (método indirecto).
Fisiología de la circulación portal
La vena porta se forma por la afluencia de las venas mesentérica superior, mesentérica inferior y esplénica. Es una vena que inicia y termina como capilares, es decir, no va a terminar en otra vena o el corazón, sino que, a manera de una arteria, se ramifica y se capilariza en el hígado.2,3 Esta vena recibe la sangre del tubo digestivo, así como del bazo y del páncreas, para trasladarla al hígado, de donde pasa luego a las suprehepáticas y, posteriormente, al corazón.2
En la vena porta se vierten las siguientes venas: coronaria estomáquica, pilórica, pancreático duodenal superior, císticas, umbilical y conducto venoso de Arancio.2
Circulación colateral
El sistema portal tiene numerosas colaterales que llegan a la circulación sistémica. Cuando la presión portal pasa de 10 mmHg se incrementa potencialmente el desarrollo de estas colaterales. La formación de colaterales es un proceso complejo en el que hay apertura, dilatación e hipertrofia de canales vasculares preexistentes.4 Los sitios de desarrollo de vasos de circulación colateral son aquellas áreas de las venas que drenan en el sistema portal y se encuentran en yuxtaposición inmediata a las venas que se dirigen a la vena cava superior e inferior.
Los sitios más importantes para el desarrollo de vasos colaterales portosistémicos son 1) las venas esofágicas submucosas, 2) las venas paraumbilicales, 3) las venas rectales submucosas, 4) derivaciones esplenorrenales, 5) comunicantes entre las venas gástricas cortas con el plexo esofágico.
Fisiopatología de la circulación portal
La hipertensión portal en la mayoría de los pacientes con cirrosis proviene de una resistencia intrahepática incrementada ocasionada por la fibrosis hepática, y de un aumento en el flujo esplácnico, así como lo dice la ley de Ohm P = Q * R, donde P es el gradiente de presión portal, Q es el flujo sanguíneo portal y R es la resistencia vascular del sistema portal. Por tal razón, todas aquellas circunstancias que modifiquen la resistencia o el flujo sanguíneo modificarán la presión portal.4 La hipertensión se divide en tres: prehepática, intrahepática y posthepática. La intrahepática a su vez se divide en tres: presinusoidal, sinusoidal y postsinusoidal.5
Hipertensión portal clínicamente significativa
La historia natural de la cirrosis se caracteriza por ser de un curso largo, sin síntomas en sus fases iniciales, seguida de un rápido deterioro de la función hepática. En las fases tempranas de la enfermedad las presiones pueden ser normales o ligeramente altas. La ausencia de síntomas causa que muchas veces no se haga el diagnóstico a tiempo o se detecte por casualidad cuando el paciente acude al médico por alguna otra causa no relacionada con la cirrosis; en esta fase se llama "cirrosis compensada". El progreso de la enfermedad se acompaña de un incremento en la presión portal y un decremento de las funciones del hígado, por lo que los primeros síntomas son ascitis, hemorragia, encefalopatía e ictericia.6
Después de que se comienzan a manifestar estos síntomas, la función hepática se deteriora más rápidamente; a esta fase se le conoce como "cirrosis descompensada". Durante esta fase puede haber aún más complicaciones, como nuevas hemorragias, insuficiencia renal, ascitis refractaria, síndrome hepatorrenal, sepsis, peritonitis bacteriana espontánea, síndrome hepatopulmonar e hipertensión pulmonar.
Métodos de estudio
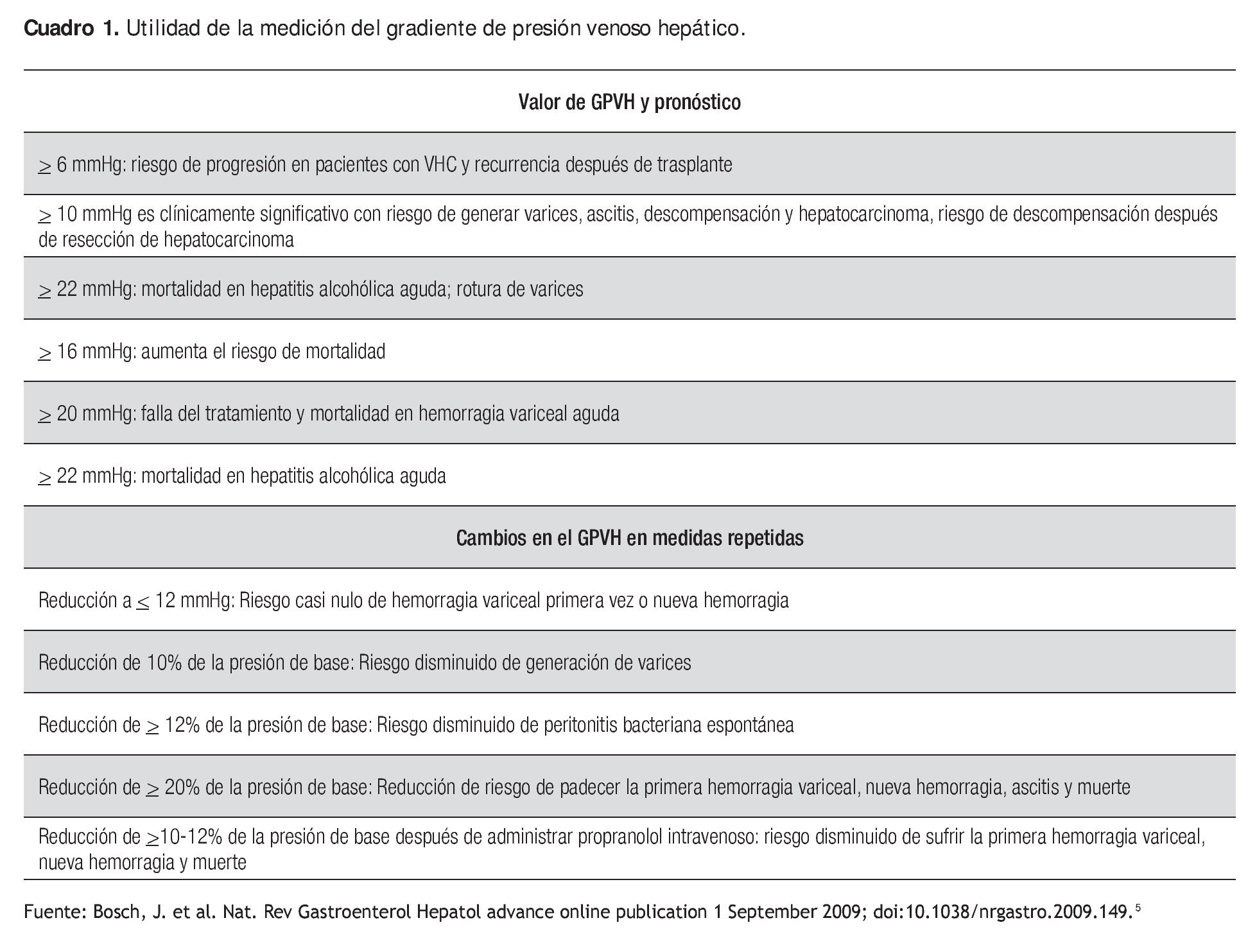
La hipertensión portal es la complicación más común en los pacientes con cirrosis. Se caracteriza por un incremento en la presión portal, seguida del desarrollo de circulación colateral y trastornos en la circulación sistémica. Se define como hipertensión portal un gradiente de presión venosa hepática mayor a 5 mmHg, y el valor de 12 mmHg es un factor de riesgo para predecir hemorragia variceal.
La presión portal sólo se puede medir por medio de métodos invasivos.4 La medida del gradiente de presión venosa hepática brinda importante información para elaborar un pronóstico de los pacientes con hipertensión portal. El parámetro que con más frecuencia se usa es el gradiente de presión venosa portal, el cual se define como la medida de la presión en cuña menos la presión libre; esta medición se efectúa mediante un polígrafo calibrado y muy sensible a los cambios más pequeños de presión, el cual se conecta a una computadora donde se registra la gráfica de dichas presiones. El transductor se debe colocar a la altura de la aurícula derecha del paciente y se calibra para que la presión 0 sea a esta altura.
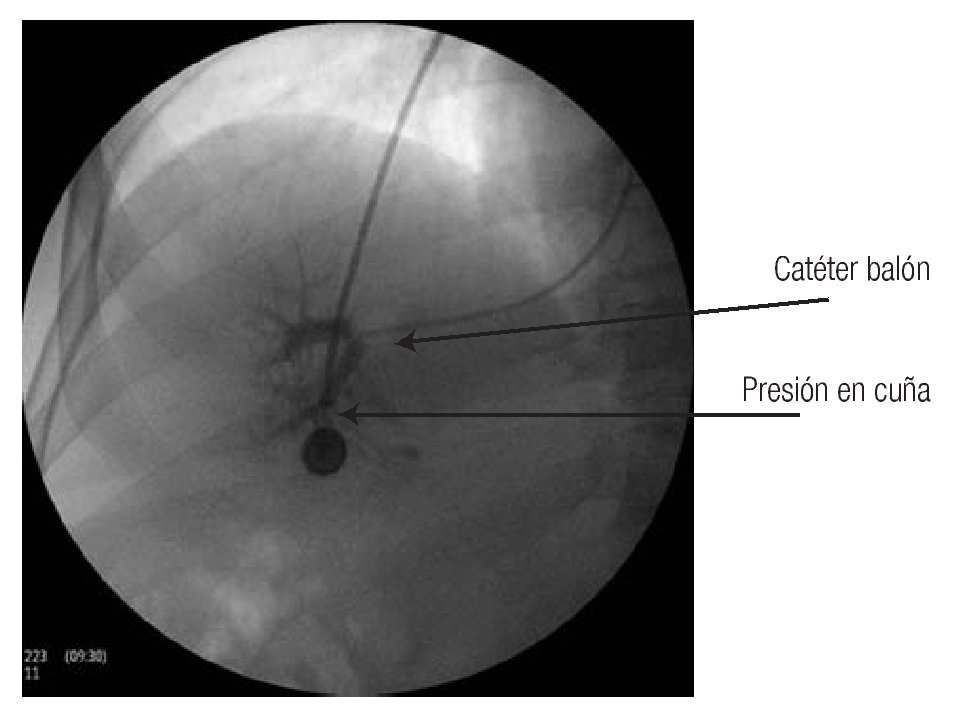
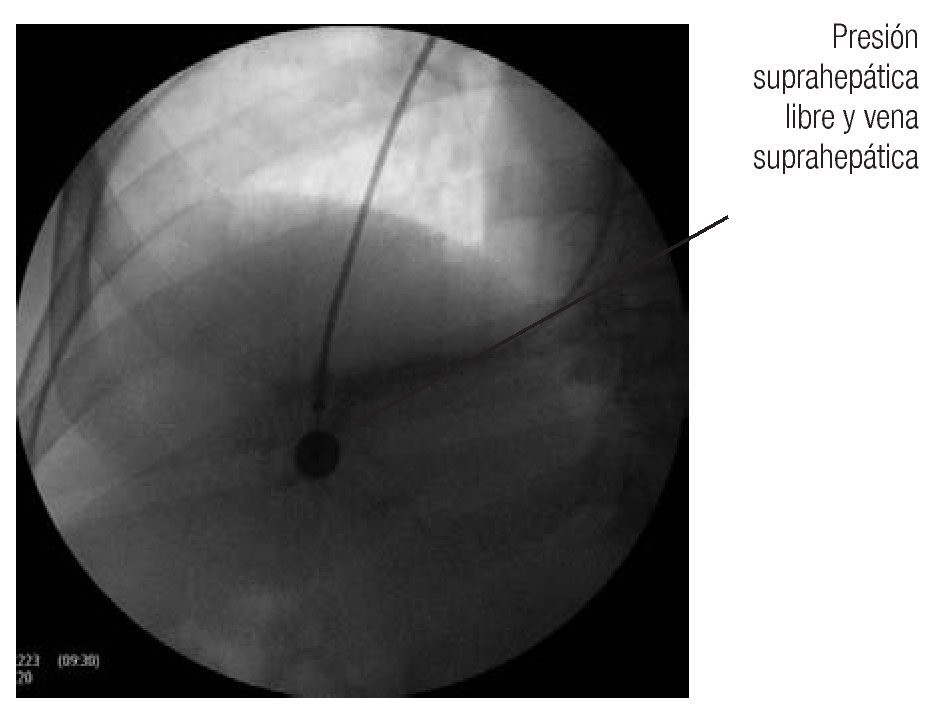
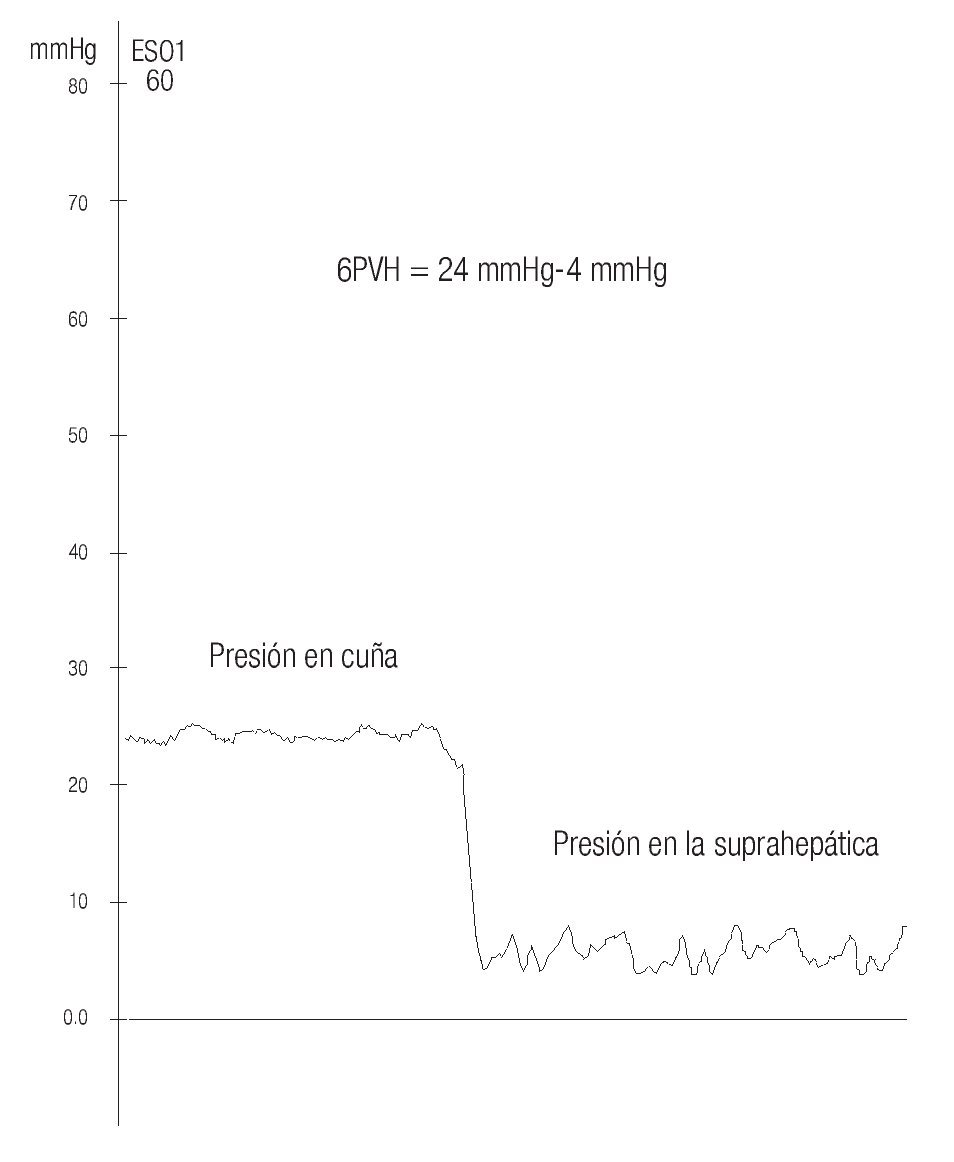
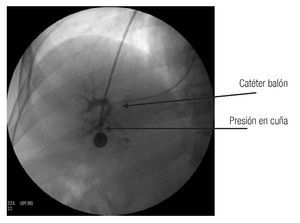
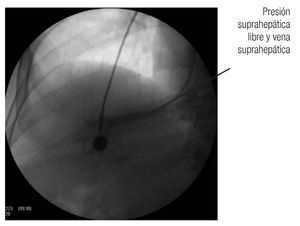
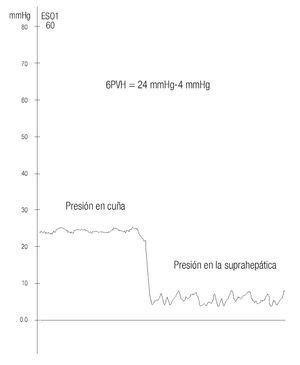
Hay diversas formas de medir el gradiente. Las que utilizan los autores aprovechan la vena yugular o el método en el que se introduce un catéter de balón de 6 Fr por la vena basílica y se avanza hasta llegar a la circulación hepática. Se prefiere la vena suprahepática derecha o la central. El balón se infla y se inyecta material de contraste para verificar la posición correcta (Figura 3). Si el catéter no ocluye completamente la vena se avanza hasta que esto suceda, se desinfla el balón (Figura 4) y se conecta el catéter con el transductor previamente calibrado, y se obtiene un trazo (Figura 5).
Figura 3. Catéter de balón el cual ocluye la vena suprahepática, lo cual se corrobora mediante la inyección de material de contraste.
Figura 4. Se libera el aire del balón, con lo que se muestra la vena suprahepática y se mide la presión libre en la vena.
Figura 5. Trazo que se obtiene a través del catéter; se obtiene la presión en cuña y la presión libre.
Importancia de la medida del HVPG y pronóstico sobre los pacientes
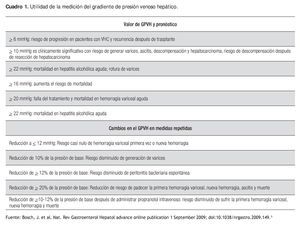
El GPVH se ha utilizado en diferentes escenarios a lo largo de la historia, desde su uso para seguir el desarrollo de varices esofágicas en un estudio en el cual un grupo de pacientes recibió timolol y otro grupo tomó placebo; no existió diferencia en el progreso de varices en ambos grupos. Sin embargo, vale la pena hacer notar el hecho de que aquellos pacientes con un GPVH mayor a 10 mmHg o un incremento de al menos 10% de la presión basal tuvieron una mayor incidencia de varices durante el seguimiento.7
En cuanto a la hemorragia aguda, se han realizado estudios con los cuales se demostró que determinar la hemodinamia hepática durante las primeras horas de estancia intrahospitalaria puede ayudar a predecir qué pacientes están en riesgo de sufrir una nueva hemorragia y muerte relacionada con la hemorragia, sobre todo aquellos pacientes con GPVH mayores a 20 mmHg.8,9
Está demostrado que los bloqueadores beta no selectivos reducen el riesgo de hemorragia variceal en el caso de profilaxis primaria y secundaria en pacientes con cirrosis.11 Una vez que el paciente manifiesta varices esofágicas hay dos tratamientos clínicos llamados profilaxis primaria y profilaxis secundaria, ya sea que el paciente no ha sufrido hemorragia por varices esofágicas o ya presentó este fenómeno y lo que se desea evitar es que el paciente sufra una nueva hemorragia. En este sentido está bien establecido el papel de la vigilancia en estos pacientes, sobretodo en la profilaxis secundaria donde una disminución de 20% del GPVH del valor basal o por debajo de 12 mmHg reduce el riesgo de nuevas hemorragias.10,11 Los pacientes que responden a la terapia farmacológica padecen menores descompensaciones, como ascitis, síndrome hepatorrenal y encefalopatía hepática.
Estudios recientemente publicados se relacionan con que si lo que se sabía previamente sobre la respuesta hemodinámica del 20%, tanto en profilaxis primaria como secundaria, tiene que ser de reducción de las cifras basales, suponiendo que en una respuesta aguda probablemente la respuesta del 10% sea efectiva, con lo cual se incrementaría el número de pacientes sensibles a los bloqueadores beta.12,13 Aunado a lo anterior hay resultados en estudios previos en los cuales aquellos pacientes que respondían al tratamiento farmacológico éste afectaba positivamente la sobrevida.14-16
La medida del gradiente de presión venosa hepática refleja la gravedad de la enfermedad y es un fuerte predictor de nueva hemorragia. Las mediciones repetidas sólo sirven para valorar la respuesta al tratamiento farmacológico, aunque tal vez a futuro la práctica de medir presiones en forma basal y un estudio de control al conseguir el bloqueo beta pueda cambiar debido a los recientes estudios con respuesta aguda a bloqueadores beta, tanto en profilaxis primaria como secundaria.13,17
Los cambios en el gradiente de presión venosa hepática se correlacionan con el grado de los cambios en el parénquima hepático. El HVPG también se usa en las terapias antivirales en cirrosis causada por virus de hepatitis B y hepatitis C (Cuadro 1).5
No hay datos suficientes para determinar el valor pronóstico de mortalidad que proporciona el GPVH en hepatitis de origen alcohólico, aunque estudios recientes dan a conocer que los pacientes con GPVH mayor a 22 mmHg tienen peor pronóstico.18
Es probable que en el futuro la utilidad clínica del GPVH sea aún mayor, sobre todo en predecir qué pacientes tienen mayores posibilidades de sufrir un episodio de descompensación, y en estos casos, aplicar medidas terapéuticas adecuadas y oportunas en este subgrupo de pacientes. De acuerdo con estudios previos, en los cuales se analizó un grupo de pacientes con cirrosis hepática compensada y sin varices esofágicas basales, se determinó que aquellos pacientes que tenían mayores posibilidades de descompensarse durante el seguimiento eran precisamente los que tenían un GPVH basal mayor. Por otro lado, se observó que aquellos pacientes que padecían hipertensión portal, significativa desde el punto de vista clínico, es decir, un GPVH mayor a 10 mmHg, tenían seis veces más posibilidades de descompensarse que aquellos con valores menores.19 Recientemente se informó que aquellos pacientes sin antecedentes de ascitis, que se trataron con bloqueadores beta para prevenir la hemorragia variceal y que dieron una respuesta a éstos menor al 10% de la cifra basal tenían mayor riesgo de padecer ascitis y síndrome hepatorrenal.20 Está demostrado que en pacientes con hipertensión portal es un predictor de desarrollo de varices, descompensación clínica (ascitis, hemorragia variceal, encefalopatía) o de hepatocarcinoma. En relación con este último, es clara la ventaja que ofrece en aquellos pacientes con buena reserva hepática y que sufrirán un procedimiento quirúrgico de resección de la lesión donde los pacientes con gradiente superior a 10 mmHg tienen mayores posibilidades de padecer complicaciones.21 Recientemente ha surgido información relacionada con los datos que aporta la medición del GPVH al identificar al subgrupo de pacientes en riesgo de llegar a padecer aquella enfermedad.22
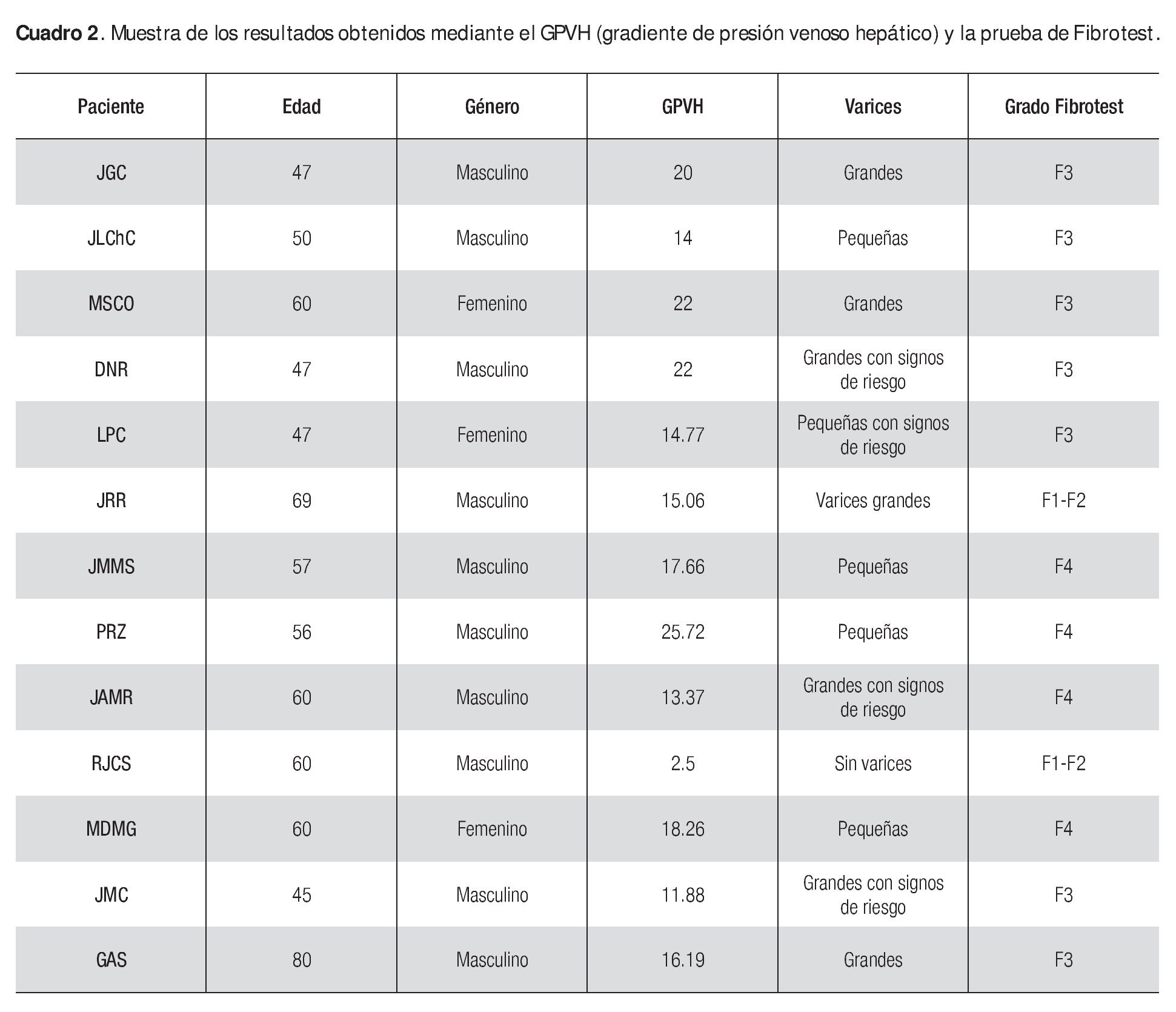
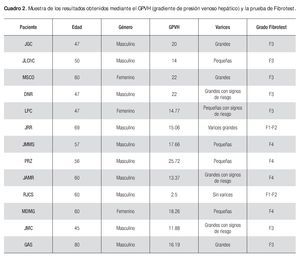
En este centro se están realizando ya estudios con bloqueadores beta, así como otros, en los cuales se trata de establecer la utilidad de pruebas no invasivas y su relación con el GPVH con el fin de poder determinar qué pacientes presentan varices esofágicas que requieran una medida terapéutica. Hasta el momento se han enrolado 13 pacientes, 10 varones y tres mujeres, los cuales fueron sometidos a un cateterismo hepático, biopsia hepática transyugular, medición de la presión en la vena suprahepática y se les tomó sangre para realizar una prueba de Fibrotest. Es importante señalar que los procedimientos fueron realizados en forma ambulatoria y sin complicaciones. Los resultados preliminares indican que, probablemente, los pacientes F3-F4 son los que presentan valores mayores de GPVH y varices esofágicas de mayor tamaño. Tal vez la circulación colateral desempeñe un papel importante en aquellos pacientes F3-F4 con varices pequeñas (Cuadro 2).
Correspondencia: Dr. Carlos Alejandro Cortez Hernández.
Centro Regional para el Estudio de las Enfermedades Digestivas. Servicio de Gastroenterología, Facultad de Medicina y Hospital Universitario Dr. José Eleuterio González, Universidad Autónoma de Nuevo León. Edificio Dr. Rodrigo F. Barragán. 2º Piso. Avenida Francisco I. Madero y Gonzalitos s/n. Colonia Mitras Centro. CP 64460. Monterrey, Nuevo León, México. Teléfono: (+52 81) 348 6068, 8333 3664.
Correo electrónico: drcarloscortezz@hotmail.com
Recibido: noviembre 2009. Aceptado: noviembre 2009.