Introducción
La tuberculosis (TB) constituye un problema de salud pública en el mundo. A pesar de los avances en el diagnóstico, prevención y tratamiento, sigue produciendo más de dos millones de muertes al año en todo el mundo.1
En México, esta epidemia crece aceleradamente en la frontera con los Estados Unidos de Norteamérica. Mientras que en el interior del país, la incidencia de tuberculosis es de 16 casos por 100 mil habitantes, en las ciudades de la frontera se eleva a 30 casos por cien mil habitantes.2,3 En las últimas décadas se ha observado un incremento en el número de casos de tuberculosis extrapulmonar (15% a 25%), debido a diferentes factores, entre los cuales destacan los movimientos migratorios, pacientes con inmunodeficiencias y la resistencia a fármacos antituberculosos.4
La tuberculosis peritoneal ocurre en 1% a 3% de los casos de tuberculosis y representa la sexta causa más frecuente de las formas extrapulmonares de la misma. La mayoría de los casos ocurre secundaria a una infección pulmonar primaria diseminada por vía linfática, hematógena o por contigüidad de lesiones tuberculosas intestinales o de la trompa de Falopio. Se puede presentar de tres formas: a) húmeda, que cursa con ascitis libre; b) loculada, y c) fibroadhesiva o seca, en la cual existe la presencia de masas abdominales compuestas por mesenterio y peritoneo engrosado. Lo más común es una combinación de estos tres tipos.5
El diagnóstico de tuberculosis pélvica puede ser difícil, ya que las manifestaciones clínicas son inespecíficas y puede imitar al cáncer de ovario por sus síntomas vagos y hallazgos radiográficos no específicos, tales como la presencia de masa anexial y carcinomatosis peritoneal, así como en los resultados de laboratorio, particularmente la elevación del marcador CA 125.6,7 El diagnóstico definitivo depende del cultivo de Mycobacterium.8,9 El presente caso comunica la importancia de que la tuberculosis peritoneal debe incluirse dentro de los diagnósticos diferenciales de tumores epiteliales de ovario en países donde la patología es endémica.
Caso clínico
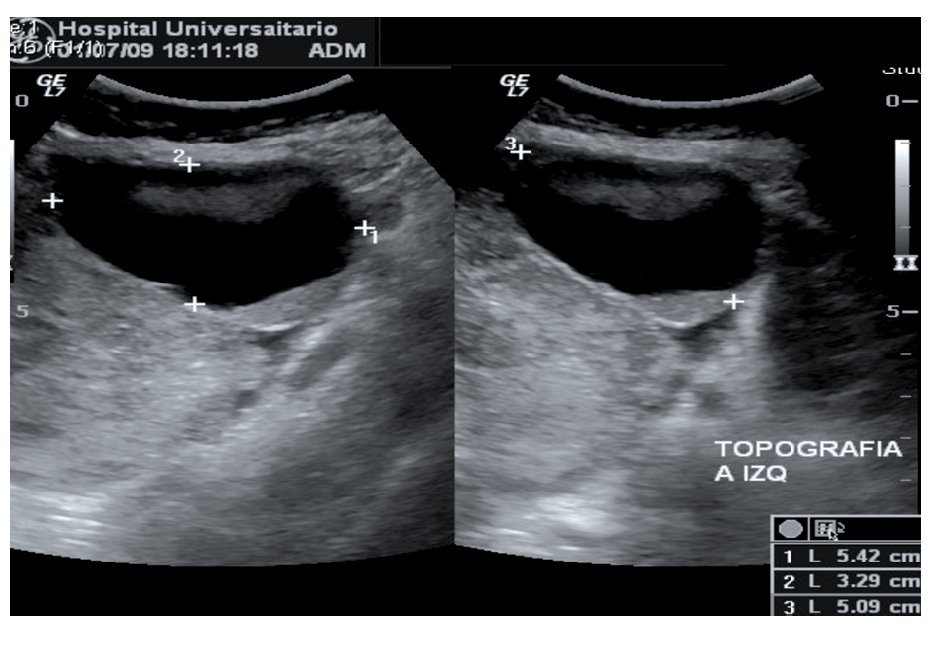
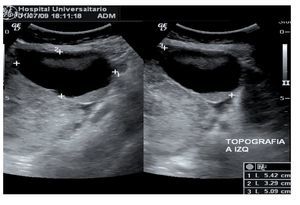
Mujer de 24 años de edad, residente de Laredo, Texas, sin antecedentes de importancia para su padecimiento. Unigesta, para uno; quien acudió al servicio de urgencias del Hospital Universitario Dr. José Eleuterio González por dolor abdominal tipo cólico, distensión abdominal, pérdida de peso de seis kg de dos meses de evolución. A la exploración física se valoró la presencia de distensión abdominal secundaria a ascitis. En la exploración pélvica bimanual se palpó tumoración en anexo izquierdo no dolorosa a la movilización. Los estudios de imagen realizados fueron tomografía de tórax y abdomen, encontrando los siguientes hallazgos: derrame pleural derecho loculado, crecimiento ganglionar pretraqueal, ascitis, nódulos linfáticos con centros de baja densidad, nodularidad y aumento en la densidad a nivel del epiplón mayor y peritoneo. Dichos hallazgos son compatibles con carcinomatosis peritoneal. También se encontró la presencia de masa pélvica de 5.4 cm por 3.2 cm por 5 cm, irregular, quística, con elementos sólidos y septos en su interior en topografía de anexo izquierdo (Figura 1).
Figura 1. Ultrasonido: masa pélvica de 5.4 X 3.2 x 5 cm irregular quística con elementos sólidos y septos en su interior.
Se solicitaron los siguientes marcadores tumorales: gonadotropina coriónica humana (beta-hCG), deshidrogenasa láctica, alfa fetoproteína (AFP), antígeno carcinoembrionario (CEA), los cuales fueron normales excepto, CA 125 en 179 UI/mL (normal < 35 UI/mL). El estudio citoquímico de líquido pleural reportó la presencia de linfocitos, células mesoteliales reactivas y ausencia de células neoplásicas.
Se realizó una laparotomía exploradora por sospecha de cáncer de ovario observándose ascitis, plastrón en epiplón mayor y adherencias laxas. Así como la presencia de múltiples nódulos blanquecinos de aproximadamente 5 mm en pared abdominal, peritoneo parietal, en asas intestinales y una masa en anexo izquierdo.
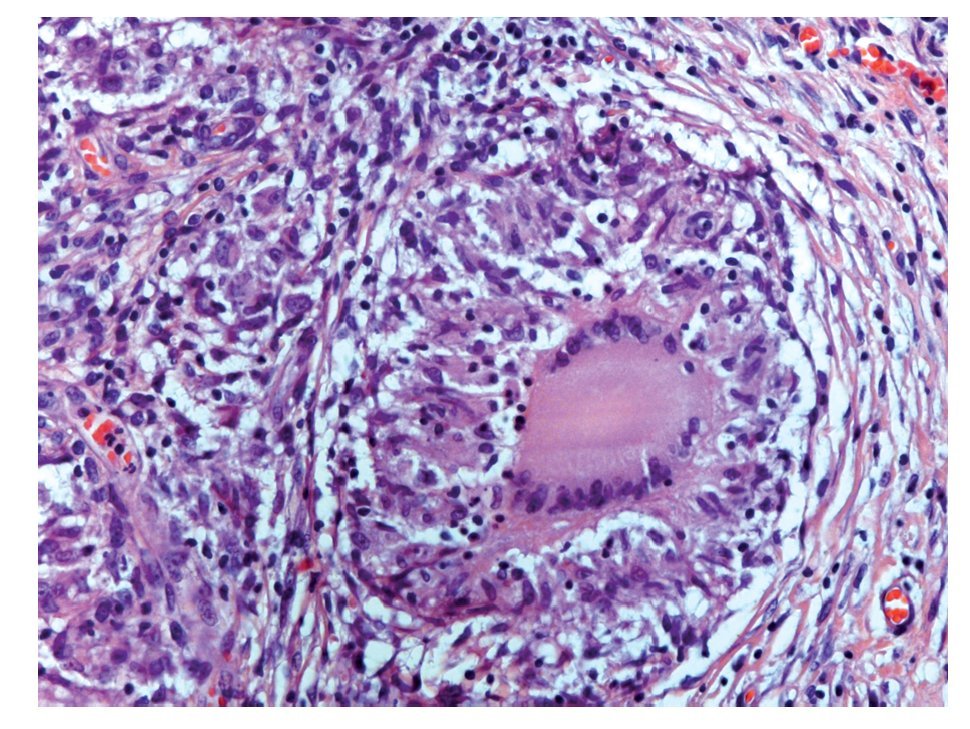
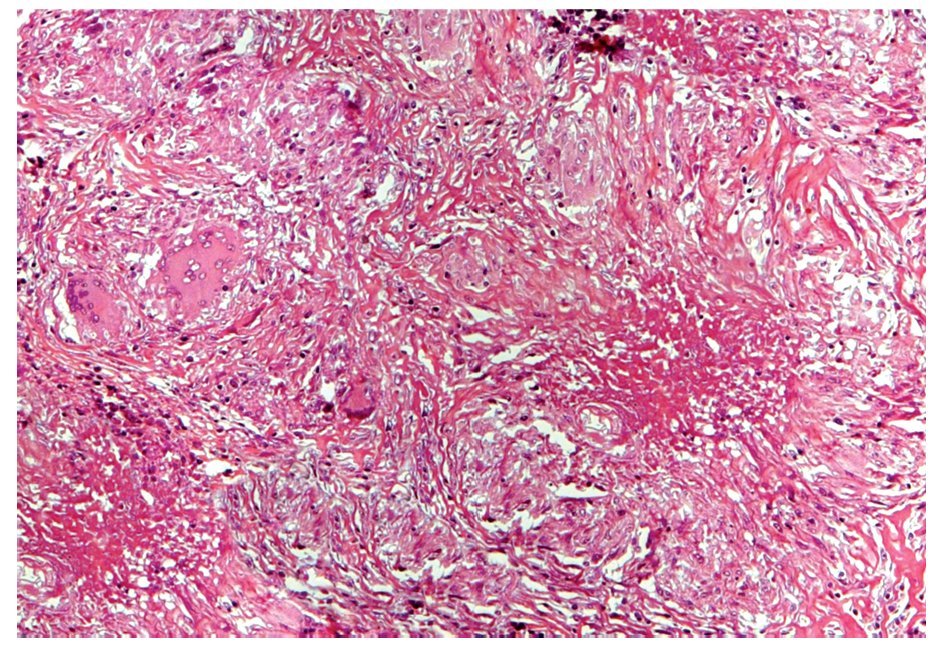
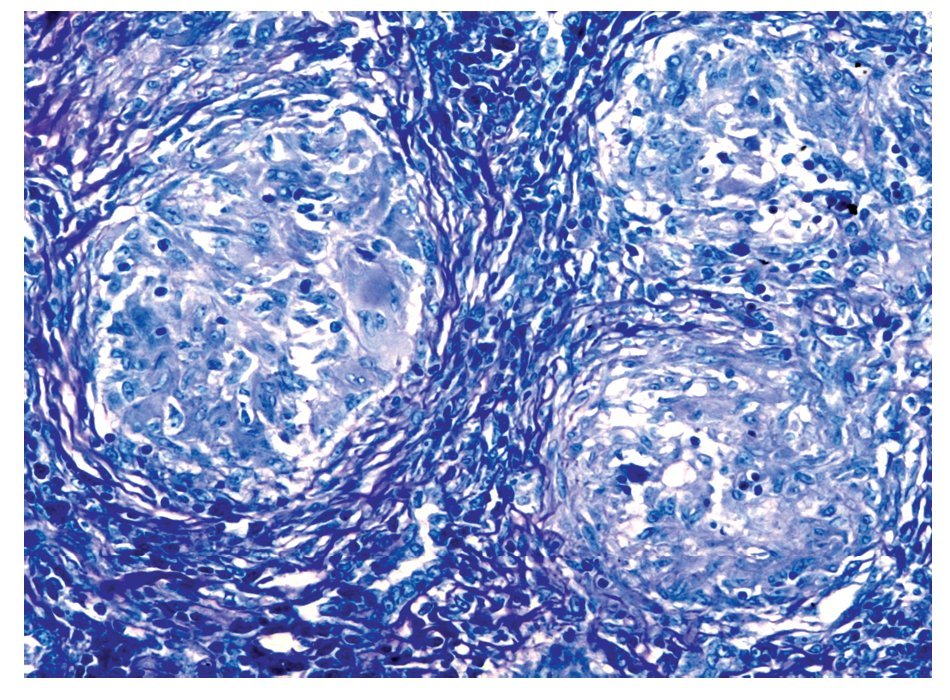
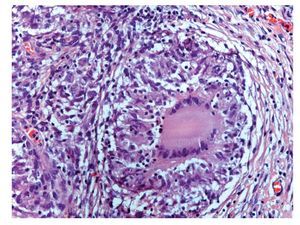
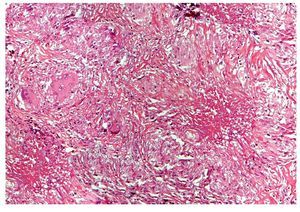
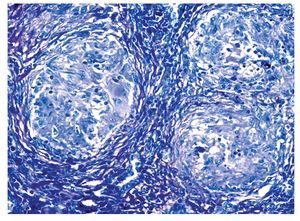
Se realizó biopsia transoperatoria de epiplón y anexo izquierdo reportando la presencia de granulomas y necrosis caseosa compatible con tuberculosis (Figuras 2 y 3). La tinción con Ziehl Neelsen resultó negativa (Figura 4).
Figura 2. Hematoxilina y eosina; 200 aumentos. Microfotografía del peritoneo en donde pueden apreciarse abundantes células inflamatorias, así como un granuloma (al centro) de tipo proliferativo, formado por histiocitos epitelioides dispuestos en empalizada y con linfocitos en la periferia. Además se observa una célula gigante tipo Langhans, con núcleos "en herradura".
Figura 3. Hematoxilina y eosina; 200 aumentos. Vista panorámica del tejido peritoneal en donde se observan múltiples granulomas, el mayor (lado derecho) con un centro de necrosis caseosa (material acidófilo, amorfo y acelular) e histiocitos epitelioides en la periferia. Otros granulomas muestran células gigantes multinucleadas de tipo Langhans (lado izquierdo).
Figura 4. Coloración de Histoquímica de Ziehl Neelsen (para búsqueda de bacilos acido alcohol resistentes). 200 aumentos. En esta microfotografía se observan granulomas proliferativos, sin embargo no fue posible demostrar la presencia de bacilos.
En el postoperatorio un estudio de VIH resultó negativo; además se aplicaron intradermorreacciones (PPD, coccidioidina y candidina). El PPD resultó positivo, por lo que ante la sospecha diagnóstica de tuberculosis peritoneal, se inició tratamiento con antifímicos: rifampicina, isoniacida, pirazinamida y etambutol, siendo egresada asintomática al quinto día de posoperatorio. El diagnóstico definitivo se obtuvo con el cultivo de las muestras tomadas por biopsia. Se realizó seguimiento por los servicios de Infectología y Ginecología del Hospital Universitario Dr. José Eleuterio González, efectuando pruebas de funcionamiento hepático, radiografía de tórax y tomografía de abdomen. A los seis meses de iniciado el tratamiento, los niveles de CA 125 disminuyeron a 37 UI/ mL.
Discusión
La tuberculosis peritoneal es una entidad secundaria a otra lesión tuberculosa ya sea a través de diseminación hematógena, linfática de un foco distante o por extensión local. Se han descrito numerosos factores de riesgo para el desarrollo de esta enfermedad, como infección por VIH, cirrosis hepática, diálisis peritoneal, alcoholismo, diabetes, uso de corticoides sistémicos, pero se ha descrito que hasta en 20% de los casos no se presenta un factor identificable, como ocurrió en nuestro caso.5,9,10
Usualmente dicha patología muestra una expresividad clínica inespecífica, siendo los síntomas más importantes la ascitis en 93% de los pacientes, dolor abdominal en 73%, pérdida de peso en 40% a 90% y 58% presenta fiebre. La radiografía de tórax evidencia compromiso pulmonar en 25% de los casos. Por esta razón la ausencia de hallazgos radiológicos no descarta una posible infección extrapulmonar.11,12 Esto hace que el diagnóstico diferencial con otros procesos abdominales sea difícil.5,13 La tomografía computada puede mostrar cambios morfológicos similares a los encontrados en un cáncer de ovario, tales como carcinomatosis, engrosamiento peritoneal, nódulos linfáticos con centros de baja densidad y linfadenopatía. 5,11 El típico dato macroscópico es la presencia de nódulos blanquecinos que semejan "granos de mijo" de aproximadamente 5 mm de diámetro esparcidos sobre el peritoneo y las vísceras, como los observados durante la laparotomía exploradora.
Los hallazgos histopatológicos más concluyentes son la presencia de células gigantes de Langhans y granulomas caseosos. Tinciones especiales, como la de Ziehl Neelsen, pueden identificar la presencia del bacilo tuberculoso, pero este hallazgo es poco común.11,13
En los casos de tuberculosis peritoneal se ha documentado un incremento del CA 125, el cual es un determinante antigénico expresado en el epitelio de las trompas de Falopio, endometrio, endocérvix, peritoneo, pleura y pericardio. Este se ha encontrado elevado hasta en 82% de los casos de cáncer de ovario epitelial. Sin embargo no es un marcador de malignidad ya que se puede encontrar aumentado en casos de inflamación peritoneal,8,10 esto lo hace más difícil diferenciar entre ambas patologías. En estas pacientes las determinaciones séricas seriadas del CA 125 pueden considerarse como marcador de la actividad y de la respuesta al tratamiento antifímico.6,11,13
En el presente caso es de gran importancia resaltar el antecedente de derrame pleural, para sospechar durante el diagnóstico diferencial sobre estas dos entidades. Tanto los hallazgos radiográficos como la elevación del Ca 125 llevaron a pensar en un cáncer de ovario, pero lo observado durante la laparotomía exploradora, los hallazgos anatomopatológicos de granulomas caseosos y células gigantes tipo Langhans, y aunque no fue posible la identificación del bacilo con la tinción de Ziehl-Neelsen y la prueba de tuberculina (la cual se encuentra positiva en 70% a 86% de los pacientes) apoyaron el diagnóstico clínico de esta entidad. 12,14
El análisis del líquido de ascitis (LA), puede orientar el diagnóstico. Suele tratarse de un exudado, la cuenta leucocitaria varía de 150 a 4000 mm3, con predominio linfocítico, con un gradiente albúmina del suero/LA menor a 1.1 g/dL. Con un contenido de proteínas de 2.5 a 3 g/dL. La adenosindesaminasa (ADA) se encuentra aumentada en el líquido de ascitis de origen tuberculoso, el cual se ha propuesto como un marcador útil, con una sensibilidad 100% y especificidad 97%, utilizando valores de corte 36 a 40 UI/L, siendo el óptimo 39 UI/L. Sin embargo, cifras elevadas de ADA, por sí solas, no sustituyen al diagnóstico microbiológico o histológico.5,11 Los nuevos métodos de diagnóstico rápido se han centrado en la detección mediante reacción en cadena de la polimerasa (PCR) en muestra directa del genoma de Mycobacterium tuberculosiscomplex. Algunos otros procedimientos, como el análisis de inmunoabsorción ligado a enzimas (ELISA) en suero, han demostrado una sensibilidad de 80% a 84% y especificidad de 85% a 95%.11,12,14
El diagnóstico concluyente de infección fímica sólo lo establece la demostración microbiológica de la micobacteria, en cultivo de líquido ascítico o en las muestras obtenidas por biopsia. Si bien debido a la demora que supone (cuatro a seis semanas), con frecuencia se recurre a otros métodos más rápidos o se inicia tratamiento de forma empírica, ya que la mortalidad de esta entidad varía entre 8% a 50%.4,5,12
En nuestro caso no se realizó análisis del líquido ascítico, PCR o ELISA, y el diagnóstico se obtuvo de las biopsias enviadas a cultivo. Se inició tratamiento empírico como el recomendado por el Centro de Control y Prevención de Enfermedades de los E.E.U.U. (CDC, siglas en inglés) con cuatro fármacos: isoniazida, rifampicina, pirazinamida y etambutol, presentando una respuesta adecuada.
Correspondencia: Dra. Clara del Carmen Flores Acosta.
Avenida Francisco I. Madero y Avenida Gonzalitos s/n. Colonia Mitras Centro, CP 64460, Monterrey, Nuevo León, México.
Teléfono: (+52 81) 8346 3443.
Correo electrónico:claracaflores@hotmail.com
Recibido: Enero 2010.
Aceptado: Junio 2010