En México, la medicina tradicional emplea extractos de hojas o de la planta completa de «siempre viva» (Kalanchoe pinnata [K. pinnata] Lam.) para tratar la alferecía amarilla cuando presenta convulsiones. La actividad anticonvulsivante del tallo o de la raíz sigue sin explorarse.
MétodosEl extracto metanólico de la raíz (EMR) y el del tallo (EMT) de K. pinnata Lam., fueron evaluados con el modelo de inducción de convulsiones con pentilentetrazol en ratones de la cepa Balb/C, comparado con diazepam. Las fracciones del EMT fueron subsecuentemente evaluadas.
ResultadosEl EMR incrementó la latencia a las crisis clónico-tónicas de forma inversamente proporcional a la dosis, observándose el mismo patrón sobre los efectos letales del pentilentetrazol. Todas las dosis evaluadas del EMT aumentaron la latencia a las mioclonías y a las crisis clónicas de forma dosis-dependiente e incrementaron la latencia a las crisis clónico-tónicas de manera semejante al diazepam con una protección del 100% contra los efectos letales del pentilentetrazol. El fraccionamiento del EMT redujo su eficacia. Al mezclar las fracciones de cloroformo y acetato de etilo, se recuperó la actividad anticonvulsivante y la protección contra los efectos letales. El análisis fitoquímico preliminar identificó alcaloides y esteroles en el EMR; esteroles y terpenos en el EMT
ConclusiónLa actividad anticonvulsivante de EMR de K. pinnata Lam. disminuye aumentando la dosis y en el EMT se presenta de forma dosis-dependiente, conservándose en la mezcla de cloroformo y acetato de etilo. Se sugiere que los metabolitos responsables de estos efectos son esteroles en el EMR; esteroles y terpenos presentes en el EMT.
In ancient and current traditional medicine in México, extracts from the leaves or whole plant of ‘life leaf’ (Kalanchoe pinnata [K. pinnata]Lam) have been used to treat an entity known locally as ‘yellow epilepsy’ (alferecía amarilla) when it is accompanied by seizures. However, the anticonvulsive activity of its stems and roots remains unexplored
MethodsThe anticonvulsant activity of the methanolic root extract (MER) or stem (MES) of K. pinnata Lam. was evaluated in a pentylenetetrazol-induced seizure model in Balb/C mice, and effects were compared to those of diazepam. The stem extract fractions that produced anticonvulsant activity were subsequently evaluated using the pentylenetetrazol -induced seizure model.
ResultsWe observed increased latency of tonic-clonic seizures that was inversely proportional to the dose of MRE, with a similar impact on the lethal effects of pentylenetetrazol. Different doses of the MSE showed a dose-dependent increase in latency to myoclonus, clonus, and tonic-clonic seizures, acting similarly to diazepam and offering 100% protection against the lethal effects of pentylenetetrazol. Fractioning MSE decreased its effectiveness, but when fractions were mixed with fractions of chloroform and ethyl acetate, anticonvulsive activity was restored. The preliminary phytochemical analysis identified alkaloids and sterols in MRE, and sterols and terpenes in MSE
ConclusionsThe anticonvulsant activity of K. pinnata Lam. decreases with increased doses of MRE, whereas the effect of MSE is dose-dependent and preserved in the mixture chloroform and ethyl acetate. We suggest that the metabolites responsible for these effects are sterols in MRE, and sterols and terpenes in MSE
Kalanchoe pinnata (K. pinnata)Lam (sin. Bryophyllum pinnatum) es una planta endémica de Madagascar perteneciente a la familia de las Crassulaceae y actualmente distribuida por todo el mundo1,2. En México, es popularmente conocida como «siempre viva» y se encuentra entre los 20-2.600m sobre el nivel del mar3.
En algunas regiones del estado de Veracruz, México, la planta completa es empleada en la medicina tradicional en forma de infusión para tratar la «alferecía amarilla» cuando se presentan convulsiones4. Algunos estudios demostraron que el extracto acuoso de las hojas de K. pinnata Lam. (50-200mg/kg) ejerce actividad anticonvulsivante y sedante, presentando mayor eficacia frente a los efectos de la picrotoxina que frente a los de la estricnina5. El modelo del pentilentetrazol (PTZ) es el método más usado para la búsqueda de sustancias con potenciales efectos anticonvulsivantes6,7, incluyendo los extractos de plantas8. Este modelo permite identificar el desarrollo de las convulsiones inducidas por PTZ (75-90mg/kg, ip, 6-7) identificando 5 niveles: 0 (no convulsiones), 1 (disminución progresiva de la actividad motora), 2 (mioclonías, movimiento localizados), 3 (convulsiones clónicas, pérdida de la postura erguida), 4 (fase clónico-tónicas) y 5 (muerte)6,9,10. El mecanismo por el cual el PTZ induce convulsiones aún no ha sido completamente establecido. Sin embargo, se ha sugerido que actúa sobre el sitio de reconocimiento de la picrotoxina en el receptor GABAA6–11. Diversos agonistas del receptor GABAA, como el diazepam (DZP), protegen contra las convulsiones inducidas por el PTZ12,13.
En el presente estudio, el potencial efecto anticonvulsivante de diversas dosis del extracto metanólico de raíz (EMR) y del de tallo (EMT) de K. pinnata Lam., fueron evaluadas empleando el modelo inducción de convulsiones con PTZ en ratones de la cepa Balb/C, comparando los efectos producidos con el DZP un fármaco anticonvulsivante clínicamente efectivo.
Material y métodosMaterial vegetalK. pinnata Lam. fue colectada en la ciudad de Xalapa, Veracruz, México, y autentificada por especialistas del herbario del Centro de Investigaciones Biológicas de la Universidad Veracruzana (CIB-UV), donde se quedó bajo su resguardo un espécimen con número referencia (CIB 9091, 9092).
Preparación de los extractos de Kalanchoe pinnata LamEl tallo (598,06g) y la raíz (495g) de K. pinnata Lam. fueron secados durante 7 días a 50°C, obteniéndose 88,11g de tallo y 56,04g de raíz, que fueron separados y picados. El material vegetal fue sometido a maceración con metanol (MeOH) de 5-7 días y concentrado empleando un rotoevaporador (Buchi, Flawil, Suiza) a 65°C, obteniendo un rendimiento de 32,60g del EMT y 5,90g del EMR, los cuales fueron evaluados en el modelo de PTZ, para determinar su potencial anticonvulsivante. Con base a esos resultados se decidió solo fraccionar el EMT. Se sometió 1g del EMT a cromatografía en columna. La columna fue empacada con silicagel (70-230 mesh, Merck). La elución se realizó empleando los disolventes cloroformo (CHCl3), acetato de etilo (AcOEt) y MeOH. Fueron obtenidas 4 fracciones: CHCl3 (8,2%), AcOEt (8,3%), MeOH (35,2%) y una sal inorgánica (SI; 48,3%).
AnimalesSe emplearon 114 ratones jóvenes ambos sexos de la cepa Balb/C13, con peso de entre 22-25g al inicio de los experimentos. Los ratones se obtuvieron del Bioterio del Instituto de Biotecnología de la UNAM-Cuernavaca (IBTUNAM), Cuernavaca, Morelos, México. Se mantuvieron en cajas acrílicas bajo condiciones controladas de luz/oscuridad (ciclo de 12h/12h) y temperatura (25±1°C), con acceso ad libitum a agua purificada y alimento (Harlan México, S.A. de C.V.). Todos los animales se manejaron de acuerdo a las normas éticas establecidas en la Guía con respecto al Uso, Manejo y Cuidado de Animales de Laboratorio (National Research Council, 1996,14) y a la Norma Oficial Mexicana (NOM-062-ZOO-1999).
Fármacos y reactivosPTZ, propilenglicol y Tween 80 fueron adquiridos de Sigma (St. Louis, MO, EE. UU.). DZP fue obtenido del Laboratorios Cryopharma (Cryopharma S.A. de C.V., México). Los disolventes CHCl3, AcOEt, y MeOH fueron obtenidos de PFQ (PFQ S.A. de C.V., México) y purificados a través de destilación fraccionada y por columnas de rectificación.
Pruebas fitoquímicas preliminaresLas pruebas preliminares se realizaron mediante el empleo de los siguientes métodos cualitativos: presencia de alcaloides (reactivos de Dragendorff y Wagner), esteroles y terpenos (reacción de Lieberman Burchardand y Salkowski) y flavonoides (técnica de Shinoda). El perfil químico de la SI se obtuvo mediante el ensayo a la flama y el reactivo de Griess, para determinar nitratos (NO3), y AgNO3 para determinar cloruros (Cl−)15,16.
Series experimentalesActividad anticonvulsivante del extracto metanólico de talloTreinta seis ratones jóvenes fueron asignados a 6 grupos independientes (n=6 por grupo). El primer grupo (VEH) recibió por vía oral 10ml/kg de vehículo (cosolvente, integrado por propilenglicol, Tween 80, y solución salina, 4:1:5, v:v:v)17. Al segundo grupo se le administró DZP (5mg/kg; ip) como fármaco de referencia13. Los 4 grupos restantes recibieron dosis de 100, 200, 400 y 800mg/kg, vía oral de EMT respectivamente. Todos los tratamientos se administraron 30min antes del agente convulsivante PTZ (75mg/kg, ip). Después de la administración, los sujetos experimentales fueron colocados individualmente en cajas de acrílico (11×11×11cm) para su observación.
Se emplearon 2 fases de observación. En la primera fase, durante 30min se evaluaron las latencias a: a) las mioclonías, b) las crisis clónicas y c) las crisis clónico-tónicas. Se consideró como tiempo cero el momento en que se administró el agente convulsivante PTZ. En la segunda fase, se evaluó la variable protección contra los efectos letales, considerando una protección total cuando el sujeto experimental sobrevivió 24h después de administrado el PTZ.
Actividad anticonvulsivante del extracto metanólico de raízEn otros treinta y seis ratones, se evaluó el efecto del EMR, distribuidos a 6 grupos independientes (n=6 por grupo): vehículo (VEH, 10ml/kg vo), DZP (5mg/kg, ip) y los 4 grupos restantes recibieron las dosis del EMR (100, 200, 400 y 800mg/kg, vo) respectivamente. Se utilizó el mismo esquema experimental del EMT.
Actividad anticonvulsivante de las fracciones del extracto metanólico de talloCuarenta y dos ratones fueron asignados a 7 grupos independientes (n=6 por grupo): vehículo (10ml/kg vo), DZP (5mg/kg, ip), los 5 grupos restantes recibieron vo (100mg/kg) las fracciones del EMT: CHCl3, AcOEt, MeOH, CHCl3:AcOEt (mezcla 1:1 de CHCl3 y AcOEt), y la SI. El efecto de los tratamientos se evaluó como se describió en los protocolos anteriores.
Todas las sesiones experimentales fueron videograbadas con una videocámara (Sony, DCR-DVD 101, lente Carl Zeiss) para ser analizadas posteriormente.
Análisis estadísticoLos datos obtenidos fueron analizados mediante el ANOVA de una vía para grupos independientes. Cuando los valores fueron de p≤0,05, se aplicó la prueba de Student-Newman-Keuls como post hoc. Los resultados se expresaron como media±error estándar.
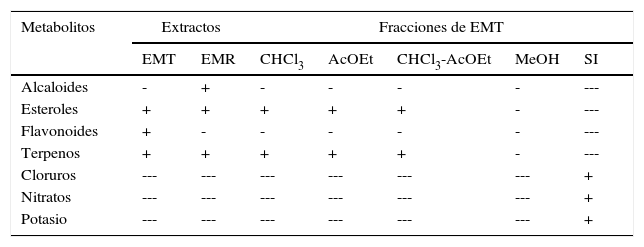
ResultadosAnálisis fitoquímico preliminarLos resultados del análisis fitoquímico preliminar del extracto de K. pinnata Lam. se presentan en la tabla 1. Los alcaloides y esteroles fueron identificados en el EMR. Terpenos y esteroles fueron detectados en el EMT, en las fracciones de CHCl3, AcOEt, y en la mezcla de CHCl3:AcOEt. Flavonoides fueron detectados en el EMT, no así en sus fracciones. En la SI obtenida del EMT se identificaron cloruros, nitratos y potasio.
Análisis fitoquímico preliminar
| Metabolitos | Extractos | Fracciones de EMT | |||||
|---|---|---|---|---|---|---|---|
| EMT | EMR | CHCl3 | AcOEt | CHCl3-AcOEt | MeOH | SI | |
| Alcaloides | - | + | - | - | - | - | --- |
| Esteroles | + | + | + | + | + | - | --- |
| Flavonoides | + | - | - | - | - | - | --- |
| Terpenos | + | + | + | + | + | - | --- |
| Cloruros | --- | --- | --- | --- | --- | --- | + |
| Nitratos | --- | --- | --- | --- | --- | --- | + |
| Potasio | --- | --- | --- | --- | --- | --- | + |
AcOEt: acetato de etilo; CHCl3: cloroformo; CHCl3-AcOEt: cloroformo-acetato de etilo; EMR, extracto metanólico de raíz; EMT: extracto metanólico de tallo; MeOH: metanol; SI: sal inorgánica;+: presencia; ---: ausencia.
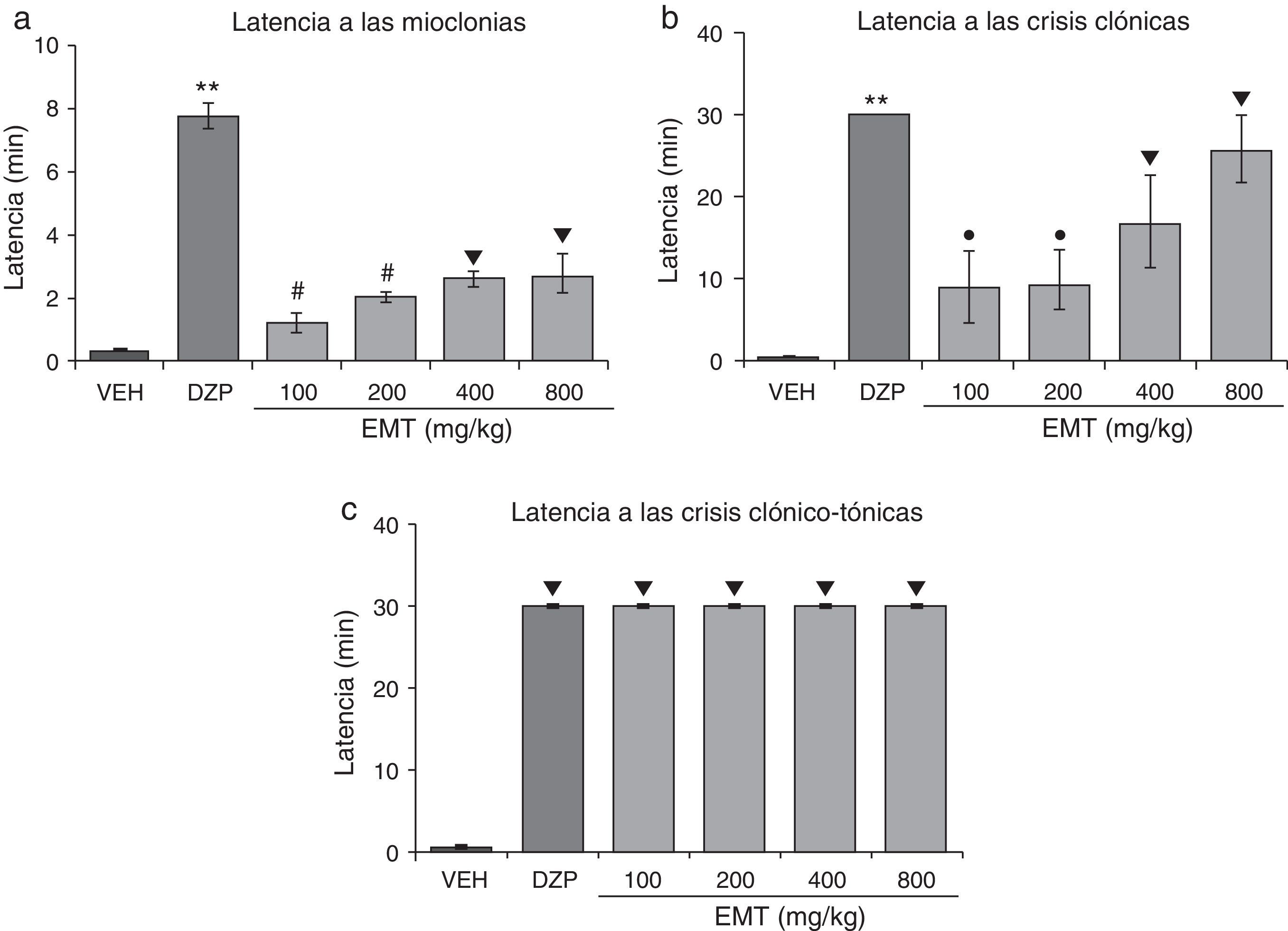
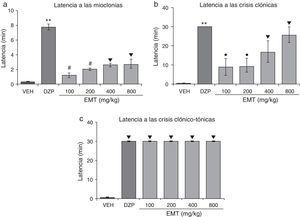
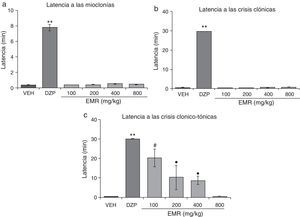
El análisis estadístico demostró diferencias significativas (F5,30=48,02; p<0,001) en la latencia a las mioclonías. La prueba post hoc mostró que esta variable se incrementó con todas las dosis evaluadas del EMT comparadas con el vehículo, aunque con menor eficacia que el DZP y la dosis de 100mg/kg y 200mg/kg con menor eficacia que las de 400mg/kg y 800mg/kg (fig. 1a). Asimismo, se observaron diferencias significativas (F5,30=8,19; p<0,001) en la latencia a las crisis clónicas. Esta variable se incrementó de forma dosis-dependiente en menor eficacia que el DZP y la dosis de 100mg/kg y 200mg/kg con menor eficacia que las de 400mg/kg y 800mg/kg (fig. 1b). La latencia a las crisis clónico-tónicas fue significativamente diferente (F5,30=62765,40; p<0,001) entre los tratamientos. La prueba post hoc mostró que todas las dosis evaluadas incrementaron significativamente esta variable con respecto al vehículo con la misma eficacia que el DZP (fig. 1c).
Modelo de inducción de convulsiones con PTZ. El EMT presenta actividad anticonvulsivante de manera semejante al DZP. a)**p<0,001, vs. todos los grupos; #p<0,001 vs. VEH, EMT 400, EMT 800; ▾p<0,001 vs. VEH. b)**p<0,001 vs. todos los grupos; ●p<0,001 vs. VEH y EMT 800; ▾p<0,001 vs. VEH. c)▾p<0,001 vs. VEH. DZP: grupo diazepam; EMT: grupo extracto metanólico de tallo; PTZ: pentilentetrazol; VEH: grupo vehículo.
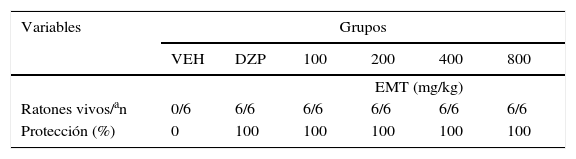
Finalmente, todas las dosis del EMT y el DZP producen una protección del 100% contra los efectos letales del PTZ (tabla 2).
Protección del extracto metanólico de tallo contra los efectos letales del PTZ
| Variables | Grupos | |||||
|---|---|---|---|---|---|---|
| VEH | DZP | 100 | 200 | 400 | 800 | |
| EMT (mg/kg) | ||||||
| Ratones vivos/an | 0/6 | 6/6 | 6/6 | 6/6 | 6/6 | 6/6 |
| Protección (%) | 0 | 100 | 100 | 100 | 100 | 100 |
DZP: diazepam; EMT: extracto metanólico de tallo; PTZ: pentilentetrazol; VEH: vehículo.
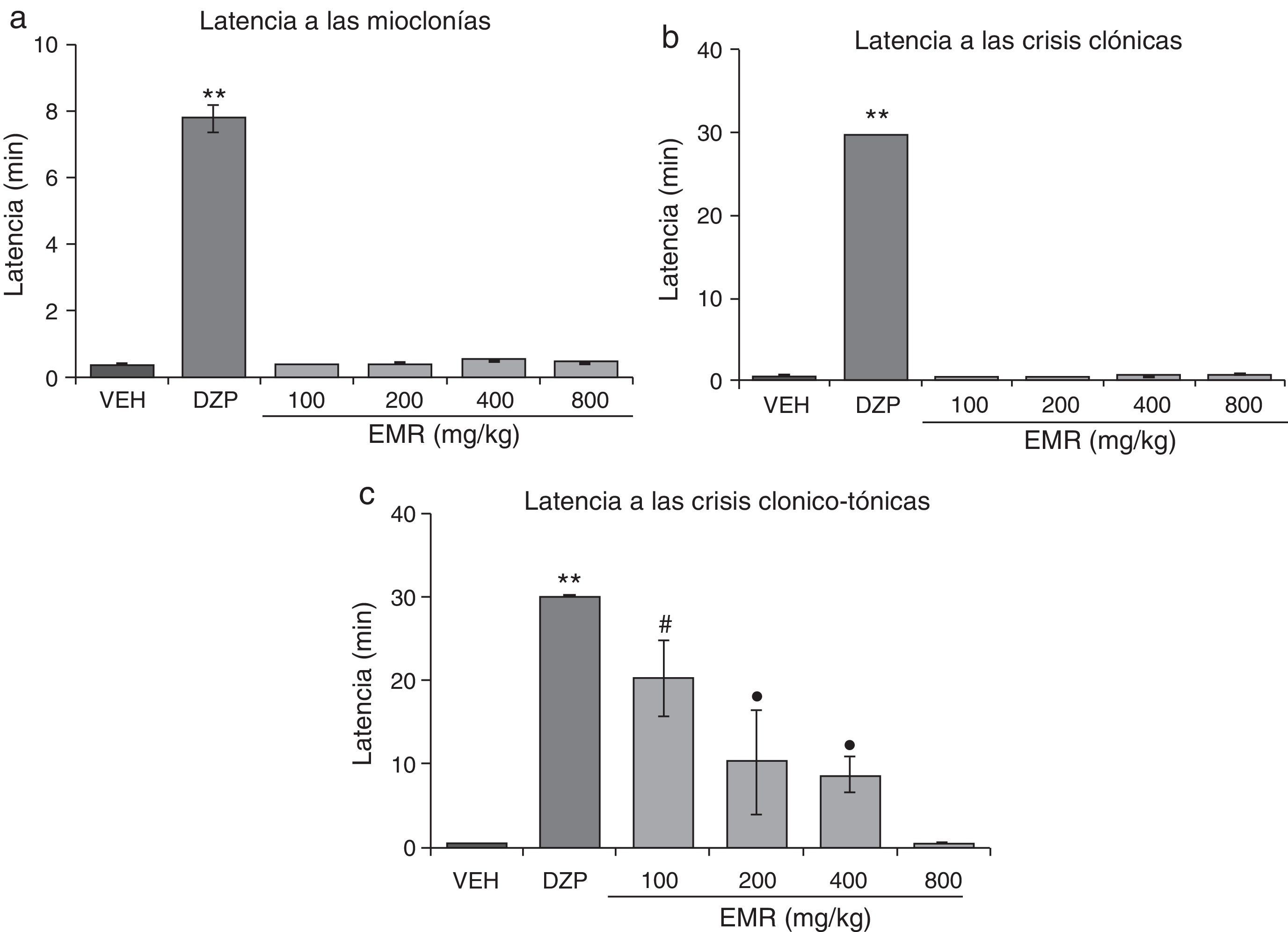
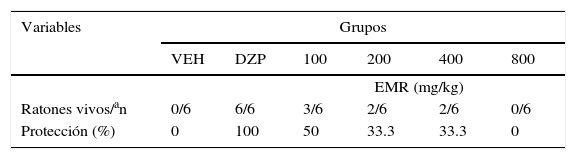
El análisis estadístico demostró diferencias significativas (F5,30=298,64; p<0,001; fig. 2a) en la latencia a las mioclonías y en la latencia a las crisis clónicas (F5,30=20147,09; p<0,001; fig. 2b); la post hoc demostró que solo el DZP incrementó dichas latencias en comparación a todos los grupos. SE encontraron diferencias significativas (F5,30=12,41,p<0,001) en la latencia a las crisis clónico-tónicas. EL análisis post hoc mostró que los grupos tratados con el EMR (100-400mg/kg) exhiben un incremento en la latencia a las crisis clónico-tónicas comparado con el vehículo, no así con la dosis de 800mg/kg, aunque con menor eficacia que el DZP (fig. 2c). Un efecto similar fue detectado en la variable protección contra los efectos letales del PTZ (tabla 3).
Modelo de inducción de convulsiones con PTZ. El EMR no modifica la latencia a las mioclonías ni a las crisis clónicas. Sin embargo, incrementa de manera inversamente proporcional a la dosis la latencia a las crisis clónico-tónicas. DZP produce efectos anticonvulsivantes. a)**p<0,001 vs. todos los grupos. b)**p<0,001 vs. todos los grupos. c)**p<0,001 vs. todos los grupos; #p<0,001 vs. VEH, EMR 400, EMR 800; ●p<0.001, vs VEH, EMR 800. DZP: grupo diazepam; EMR: grupo extracto metanólico de raíz; PTZ: pentilentetrazol; VEH: grupo vehículo.
Protección del extracto (EMR) contra los efectos letales del PTZ
| Variables | Grupos | |||||
|---|---|---|---|---|---|---|
| VEH | DZP | 100 | 200 | 400 | 800 | |
| EMR (mg/kg) | ||||||
| Ratones vivos/an | 0/6 | 6/6 | 3/6 | 2/6 | 2/6 | 0/6 |
| Protección (%) | 0 | 100 | 50 | 33.3 | 33.3 | 0 |
DZP: diazepam; EMR: extracto metanólico de raíz; PTZ: pentilentetrazol; VEH: vehículo.
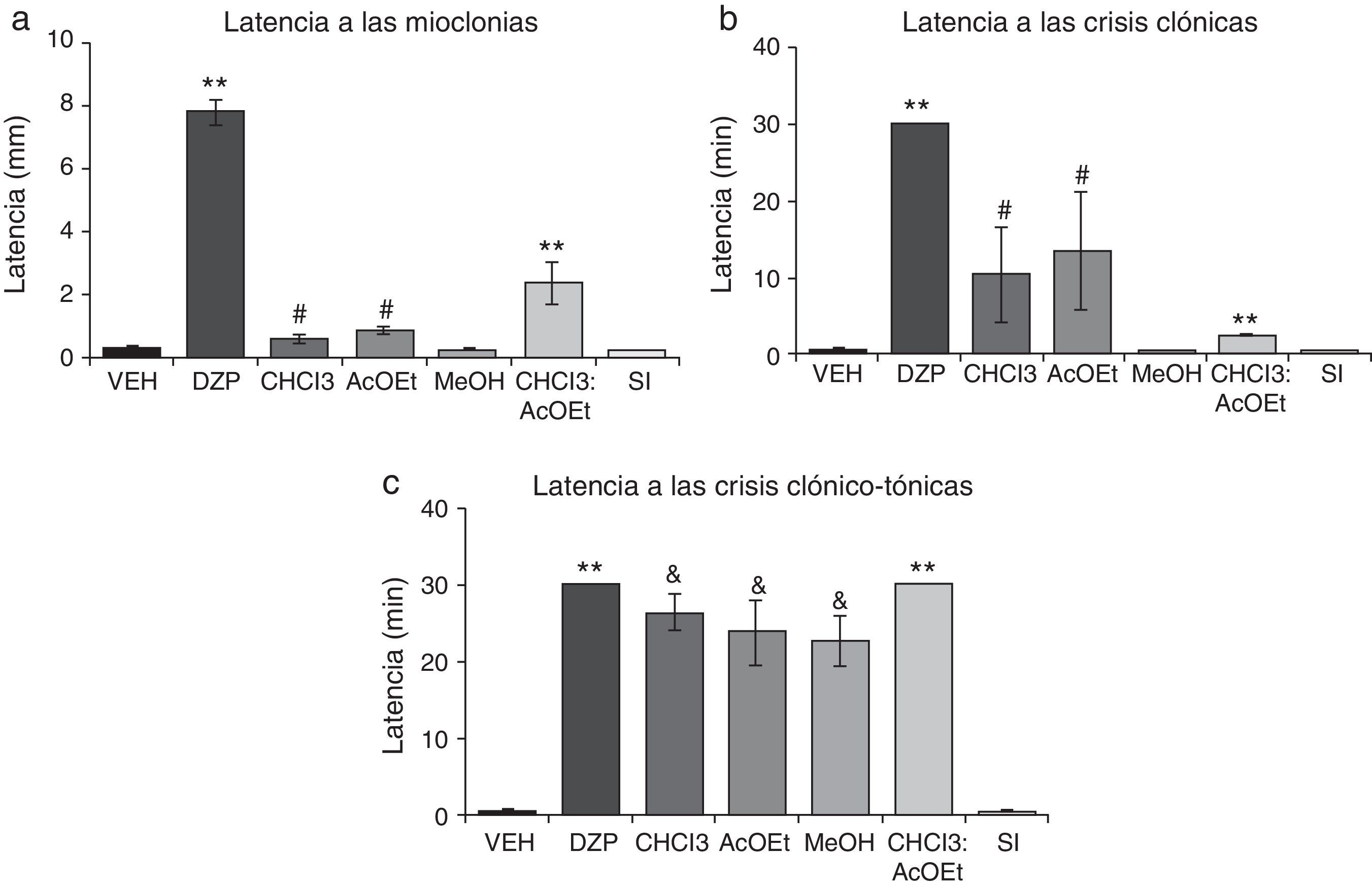
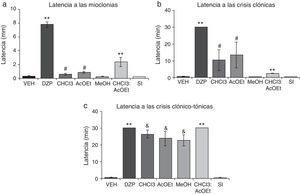
La latencia a las mioclonías presentó diferencias significativas entre los tratamientos (F6,35=80,66; p<0,001), así como la latencia a las crisis clónicas (F6,35=8,71; p<0,001). La prueba post hoc mostró que las fracciones de CHCl3 y AcOEt aumentaron significativamente la latencia comparadas con el VEH, MeOH y SI; mientras que DZP y CHCl3:AcOEt la incrementaron con respecto a todos los grupos (fig. 3a, 3b). La latencia a las crisis clónico-tónicas presentó diferencias significativas (F6,35=38,42; p<0,001). La prueba post hoc mostró que CHCl3, AcOEt y MeOH incrementaron esta variable en comparación con el grupo VEH y la SI, mientras que DZP y CHCl3:AcOEt con respecto a todos los grupos (fig. 3c).
Modelo de inducción de convulsiones con PTZ. Las fracciones CHCl3, AcOEt, CHCl3:AcOEt y DZP presentan efectos anticonvulsivantes. a)**p<0,001 vs. todos los grupos; #p<0,001 vs. VEH, MeOH, y SI. b)**p<0,001 vs- todos los grupos; #p<0,001 vs.VEH, MeOH y SI. c)**p<0,001 vs. todos los grupos; &p<0,001, comparado con VEH, SI. AcOEt: grupo acetato de etilo; CHCl3: grupo cloroformo; CHCl3:AcOEt: grupo cloroformo:acetato de etilo, DZP: grupo diazepam; MeOH: grupo metanol; PTZ, pentilentetrazol; SI: grupo sal inorgánica; VEH, grupo vehículo.
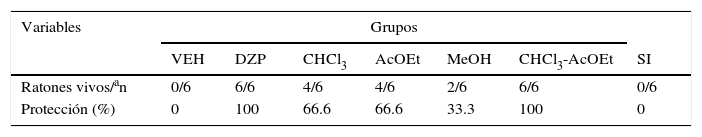
Finalmente, las fracciones del EMT presentan una menor protección sobre los efectos letales del PTZ. Sin embargo, la mezcla de fracciones CHCl3:AcOEt muestra una protección total, similar a la producida por el EMT y el DZP. La fracción de SI no presenta actividad alguna en esta variable (tabla 4).
Protección de las fracciones del EMT contra los efectos letales del PTZ
| Variables | Grupos | ||||||
|---|---|---|---|---|---|---|---|
| VEH | DZP | CHCl3 | AcOEt | MeOH | CHCl3-AcOEt | SI | |
| Ratones vivos/an | 0/6 | 6/6 | 4/6 | 4/6 | 2/6 | 6/6 | 0/6 |
| Protección (%) | 0 | 100 | 66.6 | 66.6 | 33.3 | 100 | 0 |
AcOEt: acetato de etilo; CHCl3: cloroformo; CHCl3-AcOEt: cloroformo-acetato de etilo; DZP: diazepam; EMT: extracto metanólico de tallo; MeOH: metanol; PTZ: pentilentetrazol; SI: sal inorgánica; VEH: vehículo.
En el presente trabajo se exploró la actividad anticonvulsivante del EMR y EMT de K. pinnata en ratones de la cepa Balb/C sometidos al modelo de inducción de convulsiones con PTZ. Estudios preclínicos demuestran que fármacos anticonvulsivantes clínicamente efectivos (valproato, DZP y carbamazepina), aminoran la severidad de las convulsiones inducidas por el PTZ7,18. El EMR incrementó la latencia a las crisis clónico-tónicas de manera inversamente proporcional a la dosis, presentando el mismo comportamiento sobre los efectos letales del PTZ, y observándose la mejor eficacia con la dosis de 100mg/kg, aunque menor que con el DZP. Mientras que el EMT incrementó de manera dosis-dependiente la latencia a las mioclonías y a las crisis clónicas con respecto del vehículo, con menor eficacia que el DZP; todas las dosis evaluadas incrementaron la latencia a las crisis clónico-tónicas y presentaron una protección del 100% frente a los efectos letales del PTZ con la misma eficacia que el DZP. De acuerdo al análisis fitoquímico preliminar, los efectos sobre las crisis clónico-tónicas por el EMT y el EMR se pueden asociar a la presencia de esteroles en ambos extractos, ya que esteroles como β-sitosterol y estigmasterol han sido identificados en el extracto de hoja de K. pinnata Lam.19,20. Estos compuestos tienen una cadena base de ciclopentanoperhidrofenantreno, al igual que esteroides neuroactivos como progesterona y alopregnanolona que poseen actividad anticonvulsivante, mediante la activación del receptor GABAA21,22.
Por otra parte, los efectos producidos por el EMT sobre la latencia a las mioclonías y a las crisis clónicas podrían ser atribuidos a la presencia de los terpenos como la α-amirina y β-amirina, que ya se han identificado en K. pinnata Lam.1; dichos terpenos han demostrado tener efectos sobre el sistema nervioso central, al producir efectos anticonvulsivantes en el modelo de PTZ23 y efectos ansiolíticos en el laberinto de brazos elevados, de manera semejante al DZP, lo que podría indicar que el mecanismo de acción es compartido24. Adicionalmente, se ha relacionado la interacción del sistema noradrenérgico con el efecto anticonvulsivante de la β-amirina, ya que su administración incrementa la liberación de noradrenalina cerebral en ratas25.
También se observó que la actividad anticonvulsivante se conserva en las fracciones CHCl3 y AcOEt del EMT, no con la misma eficacia que el extracto completo o el DZP; probablemente debido a la disminución de las concentraciones de esteroles y terpenos, identificados también en estas fracciones al fraccionar el EMT. En tanto que al combinar las fracciones CHCl3 y AcOEt, se recupera la eficacia anticonvulsivante, así como la protección contra los efectos letales del PTZ con la misma eficacia que el DZP.
Una limitante del presente estudio fue que no se logró identificar cuál o cuáles de los esteroles o terpenos son responsables del efecto anticonvulsivante de la planta y/o si existe una interacción entre ellos, una posibilidad que se mantiene para ser explorada en estudios posteriores.
ConclusiónEl EMR y el EMT de K. pinnata Lam. ejercen actividad anticonvulsivante en el modelo de inducción de convulsiones con PTZ. Adicionalmente el EMT produce una protección total contra los efectos letales del PTZ con la misma eficacia que el DZP. Los metabolitos responsables de la actividad en tallo se encuentran contenidos en la mezcla de las fracciones de CHCl3 y AcOEt, y se sugiere que son esteroles y terpenos. Mientras que la actividad en el EMR podría ser atribuida a la presencia de esteroles.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El primer autor recibió beca por parte del CONACyT (Reg.229628), para sus estudios de doctorado en Neuroetología.