El ictus isquémico puede ser una complicación grave en los pacientes con infección por SARS-CoV-2.
Estudiar y caracterizar los diferentes subtipos etiológicos, las características clínicas y el pronóstico funcional podrá resultar útil en la selección de pacientes para un manejo y tratamiento óptimos.
MétodosLa recogida de variables se hizo de forma retrospectiva en pacientes consecutivos con infección por SARS-CoV-2 que desarrollaron un episodio de isquemia cerebral focal (entre el 1 de marzo del 2020 y el 19 de abril del 2020). Se llevó a cabo en un hospital universitario de tercer nivel en la Comunidad de Madrid (España).
ResultadosDurante el período de estudio 1.594 pacientes fueron diagnosticados de infección por SARS-CoV-2. Identificamos a 22 pacientes con ictus isquémico (1,38%); de estos, no cumplieron los criterios de inclusión 6. Un total de 16 pacientes con isquemia cerebral focal constituyeron la serie del estudio (15 con ictus isquémico y uno con accidente isquémico transitorio).
En la valoración basal en el National Institutes of Health Stroke Scale la mediana fue de 9 (rango intercuartil: 16), la edad media ± desviación estándar fue de 73 ± 12,8 años; 12 pacientes fueron varones (75%). El tiempo desde los síntomas de COVID-19 hasta el ictus fue de 13 días. Se encontró oclusión de gran vaso en 12 pacientes (75%).
El dímero-D estuvo elevado en el 87,5% y la proteína C reactiva en el 81,2% de los casos. La etiología más frecuente del ictus isquémico fue la aterotrombosis (9 pacientes, 56,3%) con un subtipo predominante que fue el trombo endoluminal sobre placa de ateroma (5 pacientes, 31,2%), 4 de ellos en la arteria carótida interna y uno de ellos en el arco aórtico. La mortalidad en nuestra serie fue del 44% (7 de 16 pacientes).
ConclusionesEn los pacientes con ictus y COVID-19 la etiología más frecuente fue la aterotrombótica, con una elevada frecuencia de trombo endoluminal sobre placa de ateroma (31,2% de los pacientes). Nuestros hallazgos clínicos y de laboratorio apoyan la coagulopatía asociada a COVID-19 como un mecanismo etiopatogénico relevante en el ictus isquémico en este contexto.
Ischaemic stroke may be a major complication of SARS-CoV-2 infection. Studying and characterising the different aetiological subtypes, clinical characteristics, and functional outcomes may be valuable in guiding patient selection for optimal management and treatment.
MethodsData were collected retrospectively on consecutive patients with SARS-CoV-2 infection who developed acute focal brain ischaemia (between 1 March and 19 April 2020) at a tertiary university hospital in Madrid (Spain).
ResultsDuring the study period, 1594 patients were diagnosed with COVID-19. We found 22 patients with ischaemic stroke (1.38%), 6 of whom did not meet the inclusion criteria. The remaining 16 patients were included in the study (15 cases of ischaemic stroke and one case of transient ischaemic attack).
Median baseline National Institutes of Health Stroke Scale score was 9 (interquartile range: 16), and mean (standard deviation) age was 73 years (12.8). Twelve patients (75%) were men. Mean time from COVID-19 symptom onset to stroke onset was 13 days. Large vessel occlusion was identified in 12 patients (75%).
We detected elevated levels of D-dimer in 87.5% of patients and C-reactive protein in 81.2%. The main aetiology was atherothrombotic stroke (9 patients, 56.3%), with the predominant subtype being endoluminal thrombus (5 patients, 31.2%), involving the internal carotid artery in 4 cases and the aortic arch in one. The mortality rate in our series was 44% (7 of 16 patients).
ConclusionsIn patients with COVID-19, the most frequent stroke aetiology was atherothrombosis, with a high proportion of endoluminal thrombus (31.2% of patients). Our clinical and laboratory data support COVID-19–associated coagulopathy as a relevant pathophysiological mechanism for ischaemic stroke in these patients.
La pandemia por el SARS-CoV-2 (enfermedad por coronavirus 2019; COVID-19) ha supuesto un reto importante para los neurólogos en la atención al ictus; se ha propuesto una relación entre el ictus isquémico y la infección por SARS-CoV-21-5.
La comprensión de la fisiopatología del ictus isquémico relacionado con dicha infección es difícil debido a la ausencia de estudios anatomo-clínicos y de estudios aleatorizados. Por ello, es necesario documentar de forma sistemática las características clínicas y los hallazgos de laboratorio y radiológicos de estos pacientes.
El objetivo de este trabajo es analizar en una serie consecutiva de pacientes con ictus isquémico y COVID-19:
- 1.
Las variables demográficas, clínicas, de laboratorio, radiológicas y de pronóstico funcional.
- 2.
Los subtipos etiológicos de ictus isquémico.
Este es un estudio observacional retrospectivo, desarrollado en un hospital universitario de tercer nivel ubicado en la Comunidad de Madrid, España. El presente estudio fue aprobado por el Comité de Ética e Investigación del Hospital Universitario Puerta de Hierro de Majadahonda. Se seleccionó a pacientes que acudieron de forma consecutiva a nuestro centro entre el 1 de marzo y el 19 de abril del 2020. Los criterios de inclusión fueron los siguientes: 1) ictus isquémico con confirmación radiológica o accidente isquémico transitorio (AIT) con una puntuación> 3 en la escala ABCD26; 2) aparición de síntomas de COVID-19 antes del inicio del ictus, y 3) infección por SARS-CoV-2 confirmada a través de prueba de reacción en cadena de la polimerasa (transcriptasa-reversa), obtenida a partir de hisopo nasofaríngeo.
Durante la pandemia se estableció una estructura de atención al ictus adaptada para pacientes con COVID-19. Los pacientes admitidos fueron evaluados de acuerdo con los protocolos usuales de la Unidad de Ictus, realizando: neuroimagen cerebral, estudio de imagen vascular intra y extracraneal, ecocardiograma transtorácico y monitorización continua con electrocardiograma y telemetría.
Fueron revisadas las historias clínicas de 1.594 pacientes admitidos en nuestro centro por neumonía asociada a COVID-19 para determinar la frecuencia del ictus isquémico en esta población.
En las historias clínicas se seleccionó la información necesaria para el estudio de las variables previamente definidas. Se obtuvieron variables demográficas, clínicas, de laboratorio, de atención hospitalaria y de pronóstico funcional (se presentan en las tablas 1-3).
Datos demográficos, clínicos y radiológicos
| Edad (media en años±DE) | 73±12,8 |
| 40-50 | 2 (12,5%) |
| 51-60 | 1 (6,3%) |
| 61-70 | 1 (6,3%) |
| 71-80 | 7 (43,7%) |
| 81-90 | 5 (31,2%) |
| Sexo | |
| Masculino | 12 (75%) |
| Antecedentes/historia médica | |
| Consumo de alcohol | 2 (12,5%) |
| Tabaquismo | 3 (18,7%) |
| Hipertensión arterial | 14 (87,5%) |
| Diabetes mellitus | 4 (25%) |
| Dislipidemia | 9 (56,2%) |
| Enfermedad arterial periférica | 1 (6,2%) |
| Fibrilación auricular | 1 (6,2%) |
| Insuficiencia cardiaca | 1 (6,2%) |
| Prótesis valvular mitral | 1 (6,2%) |
| Enfermedad cerebrovascular previa (total) | 2 (12,5%) |
| Accidente isquémico transitorio | 1 (6,2%) |
| Ictus isquémico | 1 (6,2%) |
| Cáncer (total) | 2 (12,5%) |
| Activo (cáncer de mama) | 1 (6,2%) |
| En remisión | 1 (6,2%) |
| Enfermedad pulmonar obstructiva crónica | 3 (18,7%) |
| Enfermedad autoinmune | 2 (12,5%) |
| Síntomas de COVID-19 | |
| Cefalea | 4 (25%) |
| Fiebre | 14 (87,5%) |
| Astenia | 6 (37,5%) |
| Dolor de garganta | 2 (12,5%) |
| Síntomas gastrointestinales | 2 (12,5%) |
| Mialgia | 2 (12,5%) |
| Disnea | 6 (37,5%) |
| Tos seca | 12 (75%) |
| Hallazgos radiológicos | |
| Evaluación cualitativa-radiografía de tórax | |
| Normal | 3 (18,8%) |
| Infiltrados unilaterales | 1 (6,2%) |
| Infiltrados bilaterales | 7 (43,7%) |
| Neumonía bilateral | 3 (18,8%) |
| No disponible | 2 (12,5%) |
| Radiografía de tórax-clasificación radiológica | |
| Normal | 3 (18,8%) |
| Leve (< 25% de compromiso pulmonar) | 1 (6,2%) |
| Moderado (25-50% de compromiso pulmonar) | 2 (12,5%) |
| Grave (> 50% de compromiso pulmonar) | 8 (50%) |
| No disponible | 2 (12,5%) |
| Hallazgos TC de tórax | |
| Normal | 1 (16,7%) |
| Patrón intersticial | 1 (16,7%) |
| Infiltrados difusos | 1 (16,7%) |
| Opacidad en vidrio deslustrado | 3 (50%) |
| Escala de severidad respiratoria Brescia-COVID | |
| Leve (Brescia 0-1) | 9 (56,3%) |
| Moderado (Brescia 2) | 5 (31,2%) |
| Grave (Brescia 3) | 2 (12,5%) |
COVID-19: enfermedad por coronavirus 2019; DE: desviación estándar; TC: tomografía computarizada.
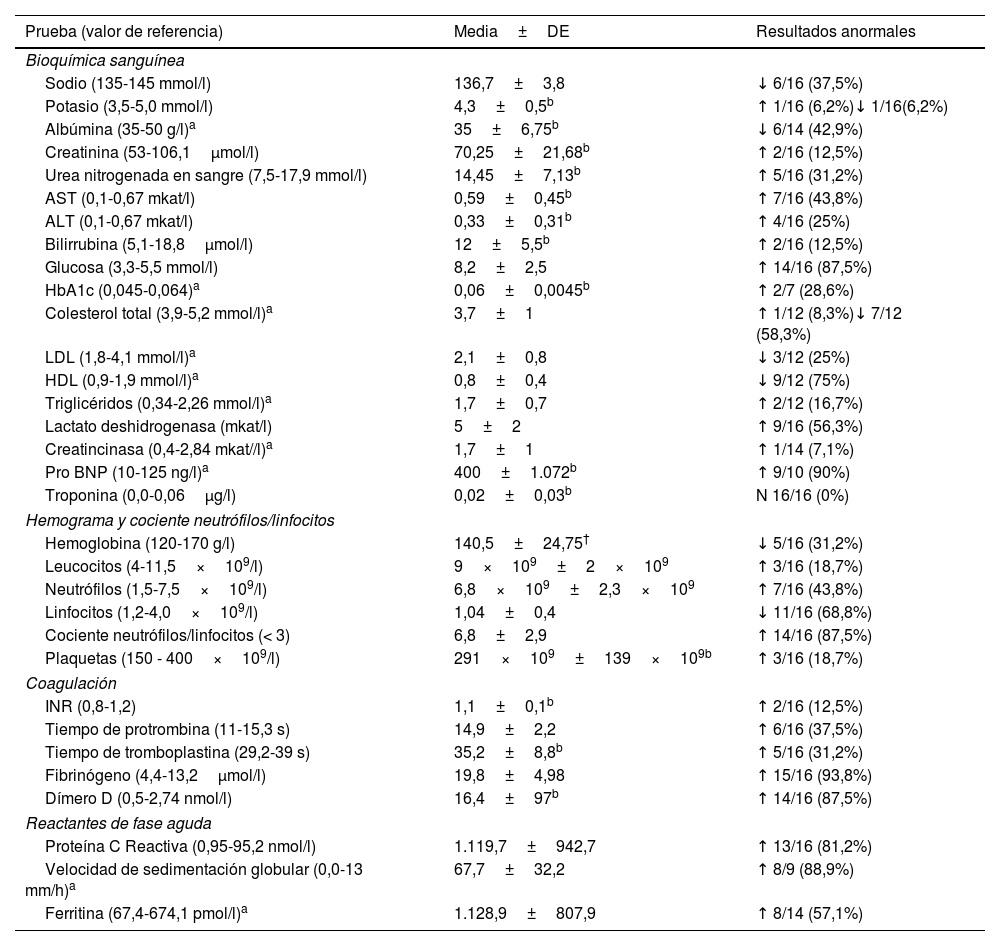
Hallazgos de laboratorio
| Prueba (valor de referencia) | Media±DE | Resultados anormales |
|---|---|---|
| Bioquímica sanguínea | ||
| Sodio (135-145 mmol/l) | 136,7±3,8 | ↓ 6/16 (37,5%) |
| Potasio (3,5-5,0 mmol/l) | 4,3±0,5b | ↑ 1/16 (6,2%)↓ 1/16(6,2%) |
| Albúmina (35-50 g/l)a | 35±6,75b | ↓ 6/14 (42,9%) |
| Creatinina (53-106,1μmol/l) | 70,25±21,68b | ↑ 2/16 (12,5%) |
| Urea nitrogenada en sangre (7,5-17,9 mmol/l) | 14,45±7,13b | ↑ 5/16 (31,2%) |
| AST (0,1-0,67 mkat/l) | 0,59±0,45b | ↑ 7/16 (43,8%) |
| ALT (0,1-0,67 mkat/l) | 0,33±0,31b | ↑ 4/16 (25%) |
| Bilirrubina (5,1-18,8μmol/l) | 12±5,5b | ↑ 2/16 (12,5%) |
| Glucosa (3,3-5,5 mmol/l) | 8,2±2,5 | ↑ 14/16 (87,5%) |
| HbA1c (0,045-0,064)a | 0,06±0,0045b | ↑ 2/7 (28,6%) |
| Colesterol total (3,9-5,2 mmol/l)a | 3,7±1 | ↑ 1/12 (8,3%)↓ 7/12 (58,3%) |
| LDL (1,8-4,1 mmol/l)a | 2,1±0,8 | ↓ 3/12 (25%) |
| HDL (0,9-1,9 mmol/l)a | 0,8±0,4 | ↓ 9/12 (75%) |
| Triglicéridos (0,34-2,26 mmol/l)a | 1,7±0,7 | ↑ 2/12 (16,7%) |
| Lactato deshidrogenasa (mkat/l) | 5±2 | ↑ 9/16 (56,3%) |
| Creatincinasa (0,4-2,84 mkat//l)a | 1,7±1 | ↑ 1/14 (7,1%) |
| Pro BNP (10-125 ng/l)a | 400±1.072b | ↑ 9/10 (90%) |
| Troponina (0,0-0,06μg/l) | 0,02±0,03b | N 16/16 (0%) |
| Hemograma y cociente neutrófilos/linfocitos | ||
| Hemoglobina (120-170 g/l) | 140,5±24,75† | ↓ 5/16 (31,2%) |
| Leucocitos (4-11,5×109/l) | 9×109±2×109 | ↑ 3/16 (18,7%) |
| Neutrófilos (1,5-7,5×109/l) | 6,8×109±2,3×109 | ↑ 7/16 (43,8%) |
| Linfocitos (1,2-4,0×109/l) | 1,04±0,4 | ↓ 11/16 (68,8%) |
| Cociente neutrófilos/linfocitos (< 3) | 6,8±2,9 | ↑ 14/16 (87,5%) |
| Plaquetas (150 - 400×109/l) | 291×109±139×109b | ↑ 3/16 (18,7%) |
| Coagulación | ||
| INR (0,8-1,2) | 1,1±0,1b | ↑ 2/16 (12,5%) |
| Tiempo de protrombina (11-15,3 s) | 14,9±2,2 | ↑ 6/16 (37,5%) |
| Tiempo de tromboplastina (29,2-39 s) | 35,2±8,8b | ↑ 5/16 (31,2%) |
| Fibrinógeno (4,4-13,2μmol/l) | 19,8±4,98 | ↑ 15/16 (93,8%) |
| Dímero D (0,5-2,74 nmol/l) | 16,4±97b | ↑ 14/16 (87,5%) |
| Reactantes de fase aguda | ||
| Proteína C Reactiva (0,95-95,2 nmol/l) | 1.119,7±942,7 | ↑ 13/16 (81,2%) |
| Velocidad de sedimentación globular (0,0-13 mm/h)a | 67,7±32,2 | ↑ 8/9 (88,9%) |
| Ferritina (67,4-674,1 pmol/l)a | 1.128,9±807,9 | ↑ 8/14 (57,1%) |
ALT: alanino aminotransferasa; AST: aspartato aminotransferasa; BNP: Brain Natriuretic Peptide/péptido natriurético auricular; HbA1c: hemoglobina glucosilada; HDL: High Density Lipoprotein/lipoproteína de alta densidad; INR: International Normalized Ratio/razón internacional normalizada; LDL: Low Density Lipoprotein/lipoproteína de alta densidad; N: normal.
Características de los pacientes con ictus isquémico y COVID-19
| Características Demográficas | Variables relacionadas con COVID | Laboratorio | Neurológico | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Paciente | Edad (años) | Sexo/raza | Antecedentes personales | Días desde inicio de COVID al ictus | RX tórax/TC | Gravedad(Brescia) | COVID tratamiento | LDH (mkat/j) | Linfocitos (×109/l)/N/L | PCR/VSG(nmol/l) (mm/h) | DD (nmol/l) | Fibrinógeno (μmol/l) | Ferritina (pmol/l) | NIHSS basal | Territorio arterial | Etiología TOAST/ASCOD | Complicaciones | Tratamiento de reperfusión | Hospitalización (días) | Pronóstico (Rankin) |
| 1 | 88 | F/Caucasiano | HTN, HLPD, cáncer mama, ICC, valvulopatía mitral | 4 | Normal | 2 | H+L/R+INF | 5 | 1,1/3,9 | 566,7/49 | 2,2 | 16 | 526 | 10 | ACM derecha | Cardioembólico. A9S3C1O0D0 | No | No | 7 | Fallecimiento (R6) |
| 2 | 67 | M/Caucasiano | HTN, HLPD, FA, EPOC | 12 | Neumonía bilateral | 3 | H+L/R+INF+CC | 3,7 | 1,6/3,5 | 1.148,6/124 | 161 | 25,4 | 1.489,8 | 21 | ACM izquierda. Oclusión en tándem | Aterotrombosis de gran arteria. Trombo endoluminal en carótidaA1S0C1O0D0 | Edema cerebral. ARDS | Fibrinólisis intravenosa | 5 | Fallecimiento (R6) |
| 3 | 76 | M/Caucasiano | HTN | 3 | Neumonía bilateral | 3 | H+AZ+CC | 9,2 | 0,8/10,1 | 1.217,2/NA | 23,2 | 19,7 | 1.002,1 | 17 | ACM derecha | Etiología indeterminada. A3S0C0O0D0 | Edema cerebral. ARDS | Fibrinólisis intravenosa+trombectomía mecánica | 5 | Fallecimiento (R6) |
| 4 | 81 | M/Caucasiano | HTN, DM, HLPD, ictus, EPOC | 13 | Neumonía bilateral | 2 | H+INF+CC | 4,6 | 0,9/10,5 | 2.381/NA | 92,5 | 28,8 | NA | 23 | ACM izquierda | Etiología indeterminada. A9S3C0O3D9 | Edema cerebral. ARDS | No | 2 | Fallecimiento (R6) |
| 5 | 77 | M/Caucasiano | HTN, alcohol, HLPD, neoplasia hematológica | 13 | Infiltrado intersticial pulmonar bilateral | 2 | H+AZ | 5,7 | 0,7/9,1 | 1.094,3/NA | 3.701,7 | 17,8 | 2.154,9 | 15 | ACM derecha. Oclusión en tándem | Aterotrombosis de gran arteriaA1S0C0O0D0 | No | Fibrinólisisintravenosa | 16 | Discapacidad moderada alta a centro de rehabilitación(R4) |
| 6 | 55 | F/Caucasiano | HLPD, fumador, asma | 16 | Infiltrado intersticial pulmonar bilateral | 2 | H+L/R | 4,1 | 1,1/9,5 | 1.066,7/NA | 130,9 | 22,1 | NA | 20 | ACM Derecha oclusión en tándem | Aterotrombosis de gran arteria. Trombo endoluminal en carótidaA1S0C0O3D0 | Edema cerebral | Fibrinólisis intravenosa | 2 | Fallecimiento (R6) |
| 7 | 86 | M/Caucasiano | HTN, fumador, alcohol, EPOC | 24 | Infiltrado intersticial pulmonar bilateral | 1 | H+AZ | 3,2 | 0,5/8,8 | 1.171,5/81 | 14,2 | 18,7 | 132,6 | 18 | ACM derecha | Etiología indeterminada. A9S3C0O3D9 | No | No | 3 | Fallecimiento (R6) |
| 8 | 74 | M/Caucasiano | HTN, DM, HLPD | 16 | Infiltrado intersticial pulmonar bilateral | 1 | H+A+L/R | 8,5 | 0,6/5,8 | 1.455,3/NA | 9,3 | 22,3 | 1.707,7 | 2 | ACI izquierda | Aterotrombosis de gran arteria. Trombo Endoluminal en carótidaA1S3C0O0D0 | No | No | 13 | Asintomático (R0) |
| 9 | 89 | M/Caucasiano | HTN | 1 | Infiltrado intersticial pulmonar unilateral | 0 | H+AZ | 3,3 | 1,8/2,5 | 82,9/48 | 3,8 | 13,9 | 305,6 | 3 | ACP derecha | Etiología indeterminada. A3S3C0O0D0 | No | No | 4 | Discapacidad leve (R2) |
| 10 | 71 | M/Caucasiano | Ninguno | 18 | Infiltrado intersticial pulmonar bilateral | 0 | H | 3,6 | 1,9/2,8 | 361,9/57 | 7,6 | 20,6 | 1.101 | 1 | ACM derecha | Aterotrombosis de gran arteria. Trombo endoluminal en carótidaA1S0C0O0D0 | No | No | 4 | Asintomático (R0) |
| 11 | 49 | F/Latino | HTN, lupus | 29 | Normal | 0 | Ninguno | 2,6 | 0,8/4,8 | 93,3/85 | 5,5 | 15,9 | 260,7 | 6 | Arteria coroidea anterior izquierda | Lupus eritematoso sistémicoA3S0C0 O1D0 | No | No | 30 | Discapacidad leve (R2) |
| 12 | 70 | M/Caucasiano | HTN, HLPD, fumadorFPI en tratamiento con AZA | 10 | Infiltrado intersticial pulmonar bilateral | 1 | H+AZ | 6,4 | 0,9/6,8 | 981/NA | 21,4 | 22,6 | 2.795,3 | 9 | ACM derecha | Aterotrombosis de gran arteria A1S0C3O3D0 | No | No | 12 | Discapacidad moderada alta a centro de rehabilitación (R4) |
| 13 | 75 | M/Caucasiano | HTN, DM, HLPDAsma | 18 | Infiltrado intersticial pulmonar bilateral | 2 | H+L/R+INF+tocilizumab+CC | 6 | 0,8/10,8 | 2.381/80 | 3,8 | 26,8 | 548,3 | 1 | ACM izquierda | Aterotrombosis de gran arteria. Trombo endoluminal en arco aórticoA1S0C0O0D0 | ARDS | No | 15 | Asintomático (R0) |
| 14 | 79 | M/Caucasiano | HTN, DM, HLPD | 9 | Infiltrado intersticial pulmonar bilateral | 1 | H+AZ+L/R+INF+INF | 6,9 | 0,5/9 | 3.434,4/80 | 18,6 | 20,9 | 2.485,2 | 9 | ACM derecha | Aterotrombosis de gran arteria A1S0C0O0D0 | ARDS | No | 3 | Fallecimiento (R6) |
| 15 | 49 | M/Caucasiano | HTN. Arteriopatía periférica | 13 | Normal | 0 | Ninguno | 2 | 1,4/3,2 | 33,3/10 | 0,5 | 10,1 | 1.119 | 1 | ACP izquierda | Aterotrombosis de gran arteria A1S0C3O0D0 | Elevación de enzimas hepáticas | No | 6 | Discapacidad leve(R1) |
| 16 | 85 | F/Caucasiano | HTN, ictus | 15 | NA | 1 | H+AZ+CC | 5,3 | 1,4/7 | 445,7/NA | 8,2468,6 | 14,7 | 435,9 | 2 | ACM izquierda | Etiología indeterminada. A3S3C0O0D0 | Tromboembolia pulmonar | No | 7 | Discapacidad leve (R1) |
ACI: arteria carótida interna; ACM: arteria cerebral media; ACP: arteria cerebral posterior; ARDS: síndrome de distrés respiratorio del adulto; AZ: azitromicina;
AZA: azatioprina; CC: corticoides; criterios ASCOD (A: aterotrombosis, S: enfermedad de pequeño vaso, C: cardioembolia, O: otras etiologías y D: disección); DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; F: femenino; FA: fibrilación auricular; FPI: fibrosis pulmonar idiopática; H: hidroxicloroquina; HLPD: hiperlipidemia; HTN: hipertensión arterial; ICC: insuficiencia cardíaca congestiva; IFN: interferón; L/R: lopinavir/ritonavir; LDH: lactato deshidrogenasa; M: masculino; N/L: linfocito/neutrófilo ratio; NA: no disponible; NIHSS: National Institute of Health Stroke Scale; PCR/VSG: proteína C reactiva/velocidad de sedimentación; R: Modified Rankin Scale; RX/TC: radiografía/tomografía computarizada.
La etiología del ictus fue clasificada de acuerdo con la clasificación TOAST (Trial of ORG 10172 in Acute Stroke Treatment classification)7 y también de acuerdo con los criterios ASCOD8. El estado funcional basal (previo al ictus) y la discapacidad al alta por el ictus fueron determinadas utilizando la escala de Rankin modificada (mRS)9. La gravedad de la enfermedad por COVID-19 fue categorizada utilizando la escala de gravedad respiratoria COVID de Brescia (Brescia-COVID Respiratory Severity Scale)10.
Se realizó un análisis descriptivo (los datos se muestran según las variables previamente mencionadas; tablas 1-3). Las medidas de dispersión y tendencia central fueron establecidas a partir de pruebas de normalidad según el tipo de variable. Varios valores fueron clasificados de forma dicotómica como normal o anormal (alterado).
ResultadosEn la revisión de 1.594 pacientes con neumonía asociada a COVID-19, se encontraron 22 pacientes con ictus isquémico. La frecuencia de presentación del ictus isquémico fue del 1,38% (22 de 1.594). De estos 22, 6pacientes no cumplieron los criterios de inclusión del presente estudio. Un total de 16 pacientes con isquemia cerebral focal aguda fueron incluidos en la serie (15 ictus isquémicos y un AIT).
Los pacientes acudieron al servicio de Urgencias utilizando diferentes circuitos. Cuatro pacientes (4/16; 25%) fueron traídos directamente por el Servicio de Urgencias Médicas de Madrid (SUMMA), 3pacientes (3/16; 18,7%) fueron derivados desde otros hospitales, 4pacientes (4/16; 25%) fueron ictus intrahospitalarios (previamente admitidos por COVID-19) y 5(5/16; 31,2%) acudieron por sus propios medios.
El tiempo medio desde el inicio del déficit neurológico hasta el ingreso hospitalario fue de 326,5 min (con un rango de 4.320 a 192 min). Los datos demográficos, clínicos y radiológicos se presentan en la tabla 1 y los de laboratorio en la tabla 2.
Datos neurológicos, atención hospitalaria y desenlacesEl tiempo medio ± desviación estándar desde el comienzo de los síntomas COVID-19 hasta el ictus fue de 13 ±7,5 días, con un rango de 1 a 29 días. La frecuencia más alta de ictus isquémico ocurrió durante la segunda semana tras el inicio de síntomas. La distribución fue la siguiente: primera semana 18,7% (3/16) de los casos, segunda semana 43,8% (7/16), tercera semana 25% (4/16) y cuarta semana 12,5% (2/16). La mediana de la puntuación National Institute of Health Stroke Scale (NIHSS) basal en la primera exploración fue de 9 (rango intercuartil: 16). La mayoría de las puntuaciones estuvieron entre 0 y 10 (10/16; 62,5%), pero el porcentaje de pacientes entre 11 y 30 puntos también fue relevante (4/16 [25%] entre 11 y 20 puntos y 2/16 [12,5%] entre 21 y 30 puntos). Un 75% de los pacientes (12/16) presentó oclusión de gran vaso, siendo más frecuente en la arteria cerebral media (12/15; 80%).
El tratamiento de revascularización se llevó a cabo en 4pacientes (4/16; 25%). Se administró trombólisis IV en 3de los casos tratados (3/16; 18.8%) y se realizó trombólisis IV combinada con trombectomía mecánica en el otro caso (1/16; 6,3%).
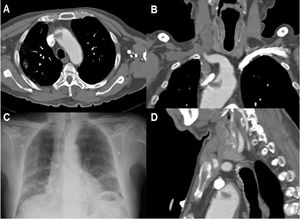
En cuanto a los subtipos etiológicos de ictus, de acuerdo con los criterios ASCOD, la mayoría de los casos fueron ictus aterotrombóticos con fenotipo A1 (9/16; 56,3%). Dentro de esta categoría, 5casos (5/16; 31,3%) se relacionaron con trombos endoluminales sobre placa de ateroma (un caso en el arco aórtico y el resto en la arteria carótida interna). Estos macrotrombos endoluminales sobre placa de ateroma correspondieron a los subtipos A1 (2): estenosis arterioesclerótica<50% en una arteria intra o extracraneal con un trombo endoluminal alojado en el vaso que suple el territorio vascular isquémico, y A1 (3): trombo móvil sobre placa de ateroma en el arco aórtico. En 3de estos pacientes se realizó angio-TC después de un mes de tratamiento con doble antiagregación plaquetaria y profilaxis antitrombótica con heparina de bajo peso molecular; en estos casos el trombo endoluminal se resolvió por completo (fig. 1).
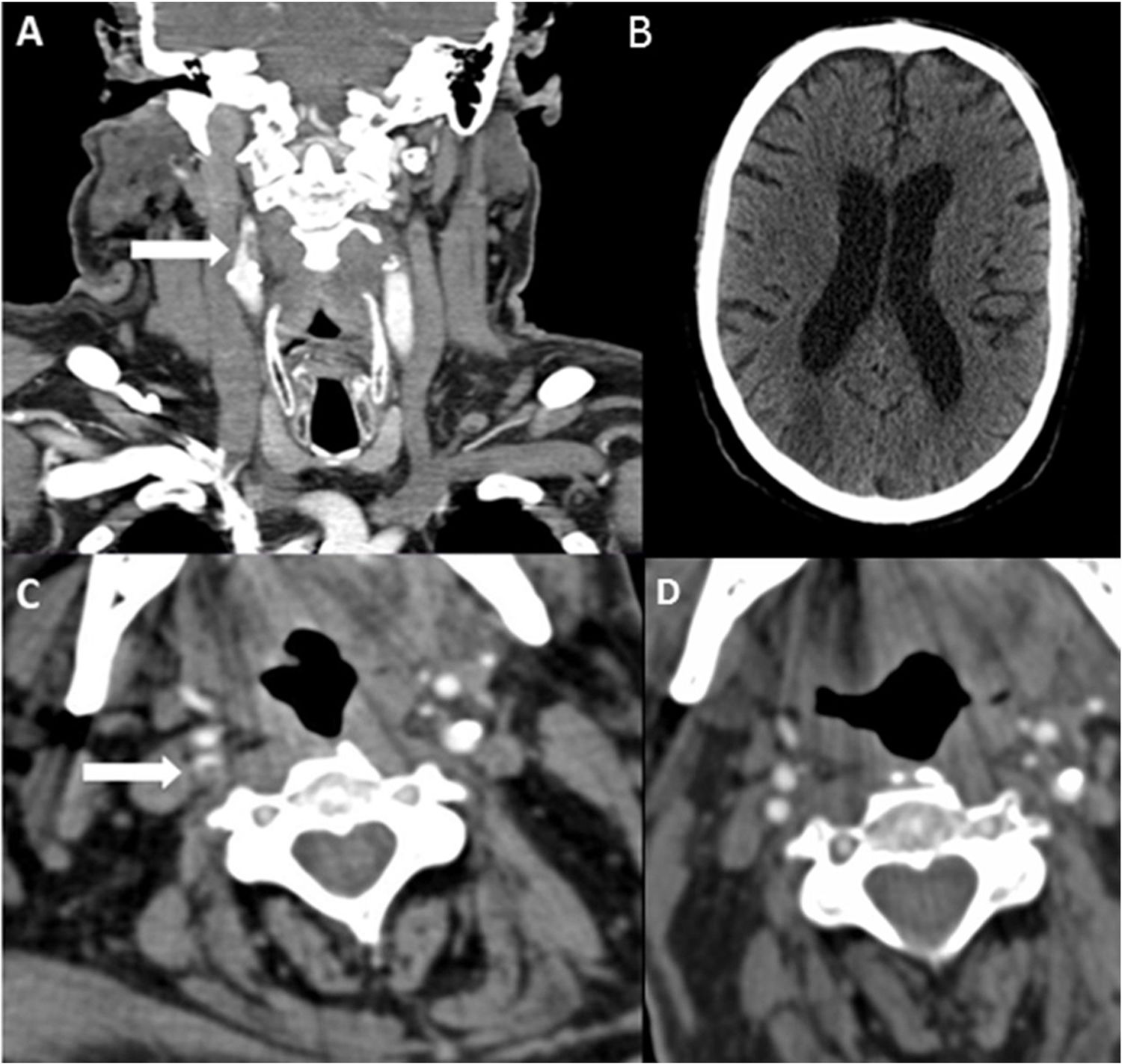
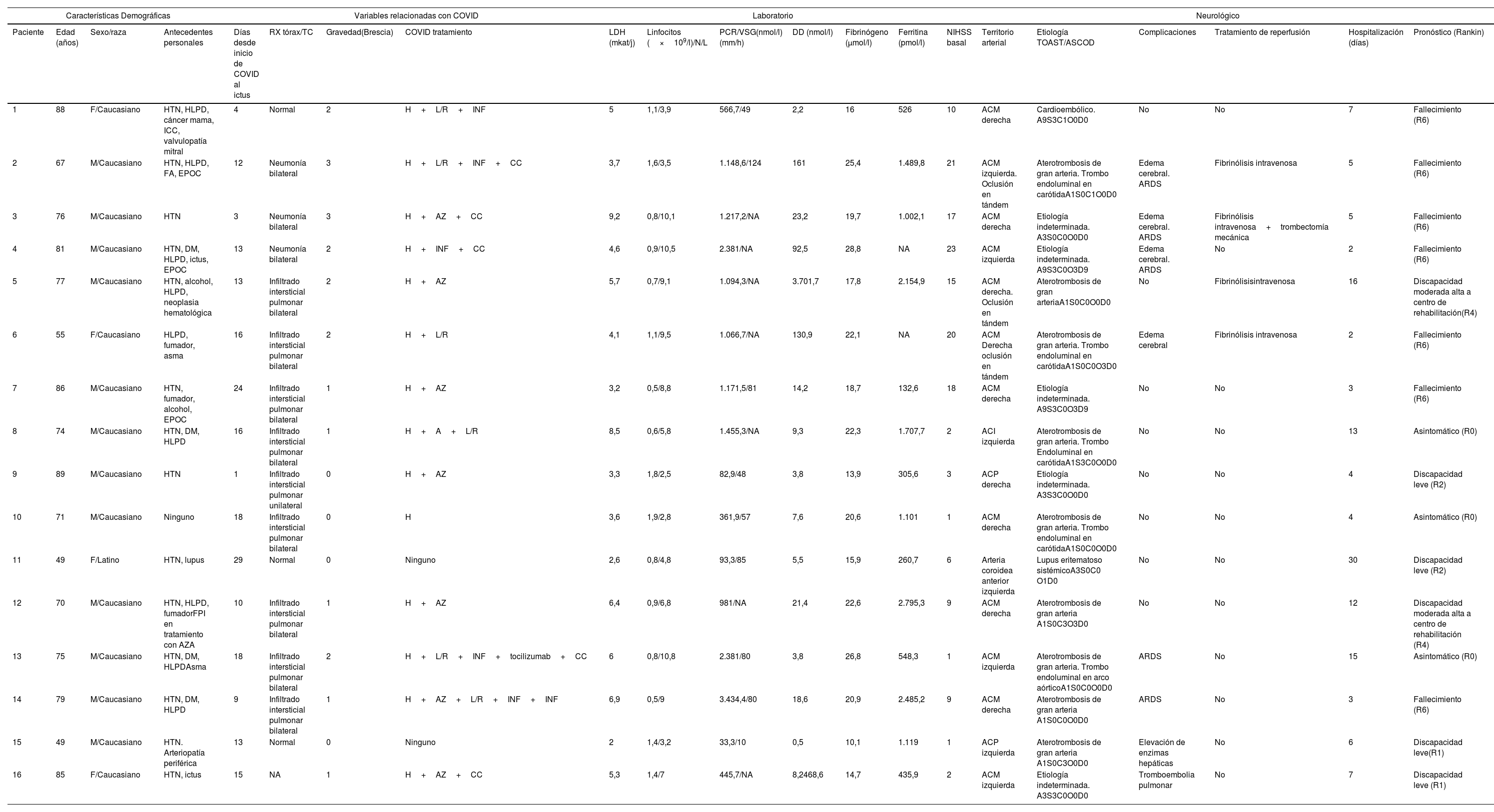
Paciente 6. A) Angio-TC axial, trombo endoluminal sobre placa de ateroma en la arteria carótida interna derecha (ACI).B) Reconstrucción coronal de angio-TC, placa de ateroma calcificada y trombo endoluminal sobre placa C) Radiografía de tórax,infiltración difusa bilateral por COVID-19. D) TC de cráneo sin contraste, con signos de infarto cerebral en el territorio de la ACMderecha.
Solo un caso fue diagnosticado de posible ictus cardioembólico (1/16; 6,3%). En este paciente no se llegó a realizar el estudio de imagen vascular con angio-TC por la mala situación basal respiratoria y el pronóstico infausto en el corto plazo. En ese sentido, no fue posible excluir la coexistencia de 2causas mayores. Otro caso se asoció con lupus eritematoso sistémico.
Tres casos correspondieron a etiología indeterminada por estudio negativo (3/16; 18,8%) y 2a indeterminada por estudio incompleto (2/16; 12,5%). No hubo casos asociados a enfermedad de pequeño vaso.
En cuanto a desenlaces y datos de atención hospitalaria, la estancia media hospitalaria (días) fue de 8±7 días. El pronóstico y desenlace fue: mRS 0-2 (asintomático-discapacidad leve): 7 casos (7/16; 43,8%); mRS 3-5 (discapacidad moderada a grave): 2pacientes (2/16; 12,5%) y mRS 6 (muerte): 7 pacientes (7/16; 43,8%).
En cuanto al destino al alta, 7 pacientes fueron derivados a su domicilio (7/16; 43,8%) y 2(2/16; 12,5%) a centros de rehabilitación.
Los datos individualizados de cada paciente se presentan en la tabla 3. Las figuras 2-3 ilustran 3de los casos de trombos endoluminales mencionados previamente.
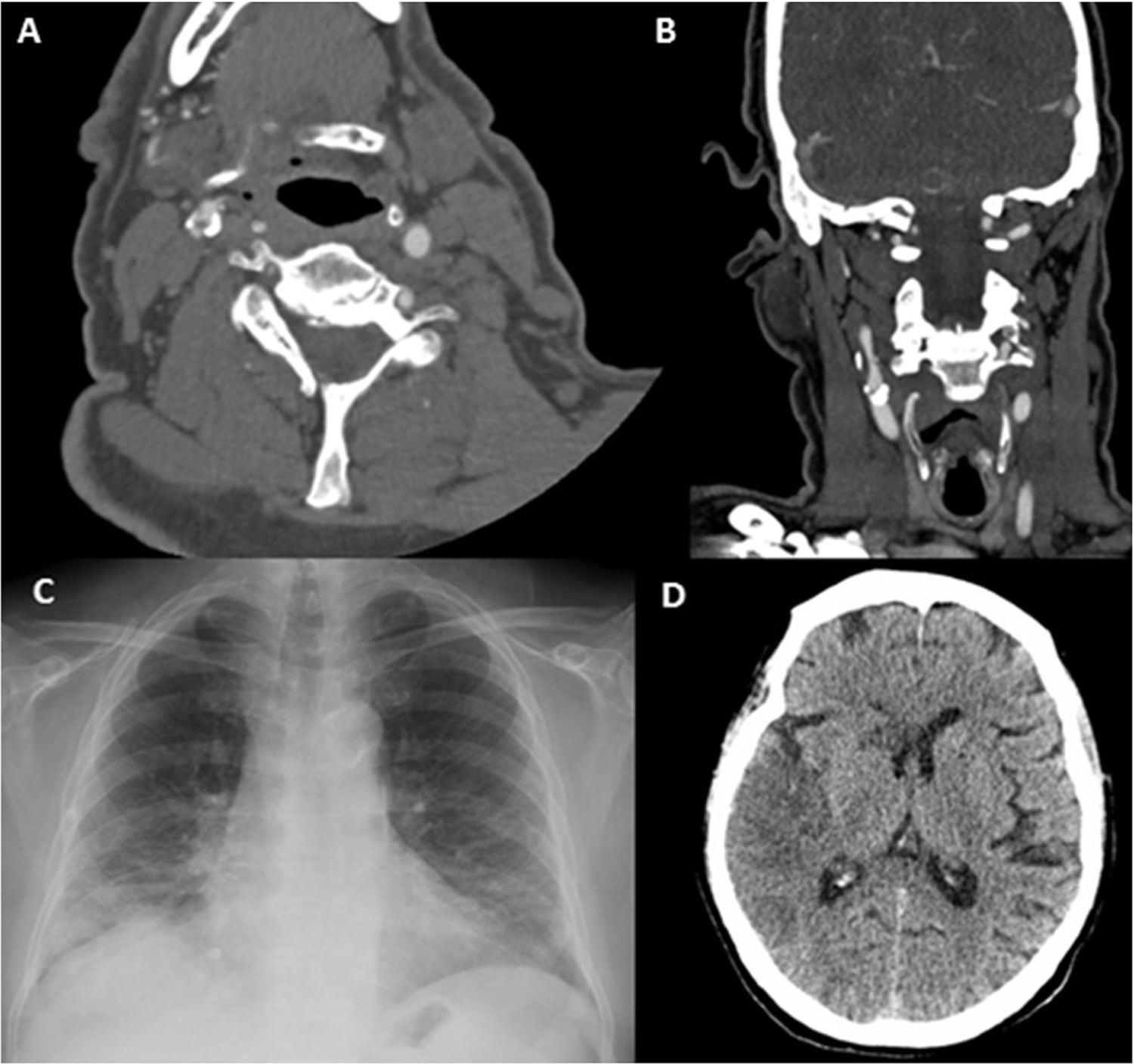
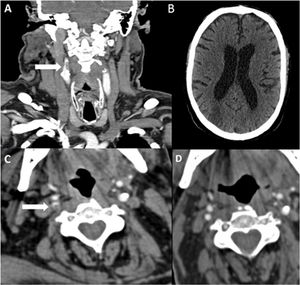
Paciente 8. A. Reconstrucción coronal de angio-TC, con un trombo endoluminal sobre placa de ateroma (flecha blanca) en la Arteria Carótida Interna Derecha (ACI). B. TAC de cráneo sin contraste, con signos de infarto cerebral en el territorio de la ACM derecha. C. angio-TC axial, trombosis aguda en ACI Derecha (flecha blanca). D. Estudio de control pasadas 4 semanas: Angio-TC axial, signos de resolución del trombo endoluminal, la placa de ateroma subyacente determinaba una estenosis residual del 30%.
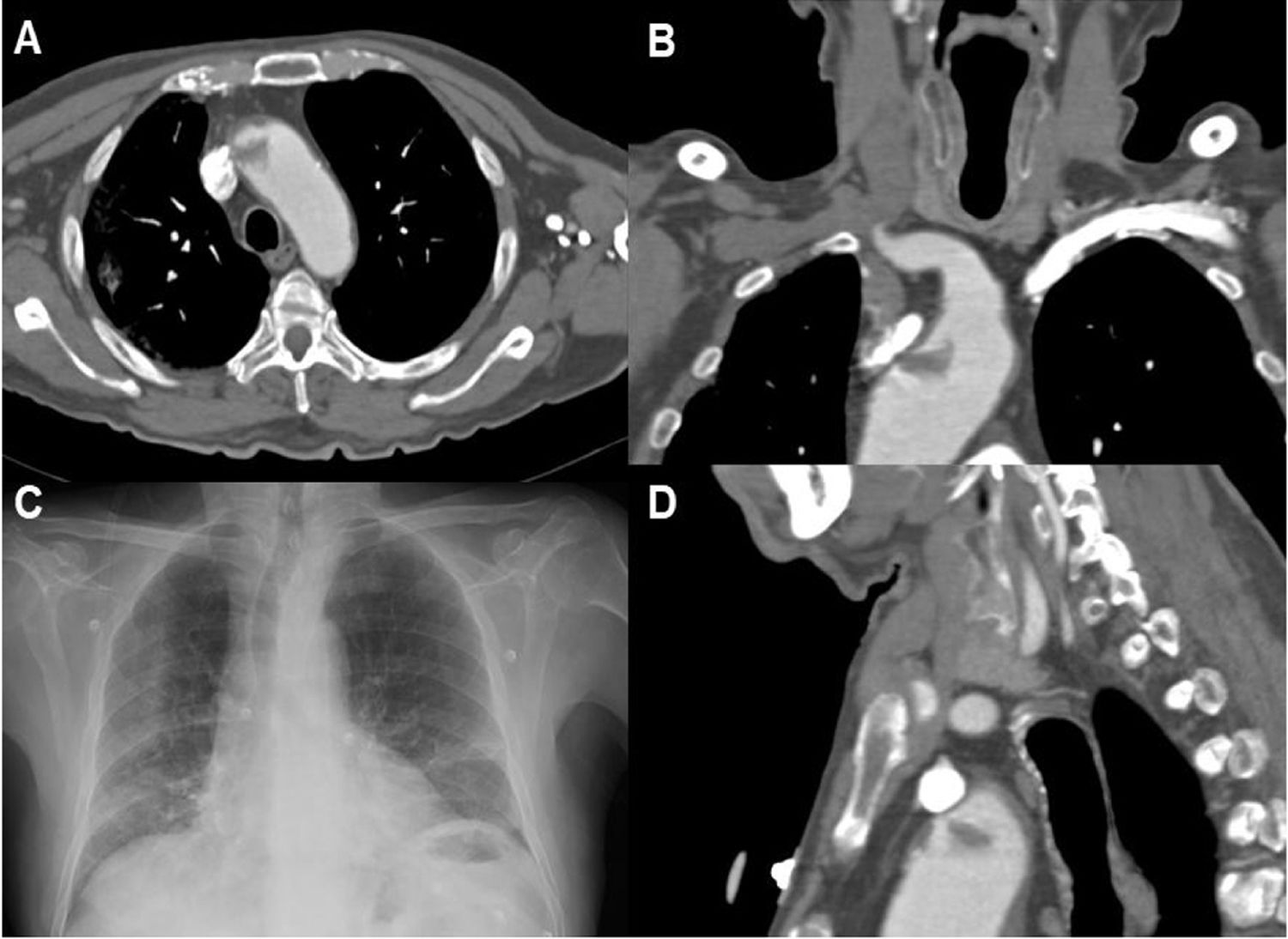
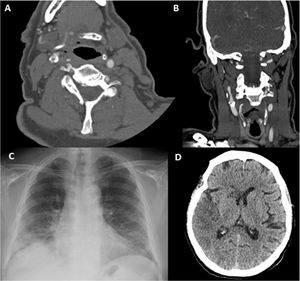
Paciente 13. A) Angio-TC axial, trombosis endoluminal sobre placa de ateroma en el arco aórtico ascendente. B) Reconstrucción coronal angio-TC. C) Radiografía de tórax, infiltrado bilateral difuso en lóbulos pulmonares inferiores y atelectasias laminares en el lóbulo inferior. D) Reconstrucción sagital de angio-TC de la trombosis endoluminal sobre placa de ateroma en el arco aórtico.
El SARS-CoV-2 es un coronavirus RNA monocatenario, que entra en la célula humana a través de la enzima conversora de la angiotensina 2 (ACE2)11; esta tiene una expresión muy alta en las células alveolares, en el endotelio vascular y en el sistema nervioso central en las células gliales y las neuronas12. La ACE2 desempeña un papel esencial en el sistema renina angiotensina, tiene un efecto antiinflamatorio y vasodilatador, contrarresta el efecto de la ACE1, la angiotensina i y angiotensina ii, que están relacionados con la vasoconstricción y tienen un efecto proinflamatorio y procoagulante13. El SARS-CoV-2 disminuye los niveles de la ACE2, aumentando el efecto de la ACE1 y de la angiotensina ii, que predisponen a la «tormenta» de citocinas y al estado de hipercoagulabilidad que determina la formación de trombos3.
De hecho, los estudios de anatomía patológica de que disponemos muestran trombos de fibrina en las arteriolas y las pequeñas arterias pulmonares, así como edema en el endotelio y megacariocitos en los capilares pulmonares, apuntando a una activación de la cascada de la coagulación14.
Desde el inicio de la pandemia por COVID-19, varios trabajos han descrito las posibles manifestaciones neurológicas de esta infección1,2,15,16. Un estudio retrospectivo observacional, de serie de casos de 214 pacientes con COVID-19 en Wuhan (China), describió una incidencia de manifestaciones neurológicas del 36,4%; de estas, la enfermedad cerebrovascular representó el 2,8% y fue más frecuente en pacientes con infecciones graves comparados con aquellos con infecciones leves (5,7% vs. 0,8%, respectivamente)15.
La frecuencia de presentación de ictus isquémico en el contexto de la infección SARS-CoV-2 de nuestra serie es similar a la descrita en el New York healthcare system (0,9%)4 e inferior a la de los estudios de China (el 2,7 y el 2,8%)5,15.
Los trabajos que describen a los pacientes con ictus e infección por SARS-CoV-2 muestran una alta prevalencia de factores de riesgo vascular y enfermedad cerebrovascular previa2,4,5. En nuestra serie también describimos antecedentes relevantes de hipertensión, diabetes mellitus y dislipidemia (tabla 1).
Con relación a los síntomas de la infección, la fiebre fue el más prevalente, seguido por mialgias y disnea. La mitad de nuestros pacientes tuvieron hallazgos de gravedad en la radiografía de tórax (> 50% de afectación pulmonar). En el contexto de la pandemia es esencial investigar la presencia de estos síntomas y signos. La radiografía de tórax o la TC de tórax nos pueden ayudar a identificar a los pacientes con ictus y COVID-19.
Acerca de los hallazgos de laboratorio, hay estudios epidemiológicos que han identificado marcadores de inflamación, como el número de leucocitos, el nivel de fibrinógeno, la proteína C reactiva (PCR) y la interleucina-6 (IL-6) como factores de riesgo independientes de ictus isquémico17,18.
En los resultados de los análisis de sangre en nuestros pacientes hemos demostrado una elevación de la PCR en la mayoría de los mismos. La PCR tiene propiedades trombogénicas al inducir el factor tisular de los monocitos, que es un potente activador de la cascada extrínseca de la coagulación, que puede actuar como mediador de la trombogénesis relacionada con la arteriosclerosis19. La PCR se ha relacionado también con la progresión de la aterotrombosis carotídea, el riesgo de desarrollar un primer ictus isquémico20 y con el número de células inflamatorias en la placa de ateroma inestable21.
El nivel de fibrinógeno y de dímero-D en pacientes con ictus isquémico y COVID-19 fueron superiores a los niveles de pacientes con ictus isquémico sin esta infección4,5. En este sentido todos nuestros pacientes tuvieron niveles de fibrinógeno> 88,4μmol/l (100mg/dl); esta elevación puede estar relacionada con eventos tromboembólicos y puede reflejar el estado protrombótico sistémico en la infección por SARS-CoV-2 y relacionarse con un peor pronóstico22.
Se han publicado varios artículos sobre la relación entre trombogénesis y COVID-193,23. La «tormenta» de citocinas lleva a una activación de la cascada de la coagulación conocida como coagulopatía asociada a COVID-19. Esta se caracteriza por una elevación en los marcadores de hipercoagulabilidad (dímero-D, fibrina, fibrinógeno), un incremento asociado en los marcadores inflamatorios periféricos (PCR, IL-6) y una discreta trombocitopenia3.
Nuestros resultados muestran un porcentaje muy alto de ictus aterotrombótico con trombo endoluminal sobre placa de ateroma (5 de 16 pacientes, 31%) en los pacientes con infección por SARS-CoV-2. Este subtipo etiológico de trombo endoluminal es una causa de ictus poco frecuente, con una prevalencia del 3,2% (10 veces inferior a la de nuestros resultados)24. El estado protrombótico y la inflamación grave causada por la infección por SARS-CoV-2 puede facilitar la formación de este macrotrombo endoluminal sobre la placa de ateroma25,26.
Las infecciones virales y bacterianas han sido relacionadas también con el riesgo de ictus. El riesgo fue mayor después de la infección (en particular durante el primer mes) y disminuyó a lo largo del tiempo27.
Estos datos son congruentes con nuestros resultados en los que la mayoría de los pacientes presentan el ictus en las 3primeras semanas tras el inicio de los síntomas por COVID-19. Este período sugiere la relación con la respuesta sistémica inflamatoria del paciente más que con el efecto de una invasión directa del virus25.
Así debemos considerar la infección por SARS-CoV-2 como un desencadenante de ictus a través de una reacción inflamatoria y procoagulante en pacientes con factores de riesgo vascular. En algunos pacientes se darán las condiciones para la rotura y la complicación de una placa de ateroma y la formación de un macrotrombo endoluminal25,26.
La alta proporción de pacientes con ictus de etiología indeterminada puede estar relacionada con una menor accesibilidad a las pruebas complementarias y el mal pronóstico a corto plazo que impide completar un estudio integral.
Otro hallazgo significativo es que no encontramos a pacientes con el subtipo etiológico de enfermedad de pequeño vaso, hallazgo similar a la serie del New York healthcare system4. Son precisos otros estudios para confirmar este hallazgo.
Con relación al pronóstico, la mortalidad de nuestros pacientes (44%) es inferior a la descrita en la serie de New York healthcare system (63,6%)4, lo que pudiera estar en relación con una menor gravedad en los cuadros respiratorios de nuestros pacientes. La mortalidad de la serie es alta cuando se compara con los pacientes con ictus sin COVID-1928. Los pacientes con ictus e infección por SARS-CoV-2 tienen razones para tener un peor pronóstico: Los daños mediados por la hipoxia, por la invasión directa de la barrera hematoencefálica y el inmunológicamente mediado cerebral pudieran desempeñar un papel importante29. No obstante, este peor pronóstico de los pacientes ingresados se puede deber a que pacientes con síntomas menores no acudan al hospital por la situación de pandemia o que tengan un mayor tiempo de demora en su llegada al hospital debido al distanciamiento social o a las medidas de confinamiento.
En cuanto al tratamiento médico, no hay evidencias que permitan realizar recomendaciones precisas. En nuestra serie, 3 de los 4 pacientes con tratamiento de reperfusión en fase aguda fallecieron. En lo que respecta a la prevención secundaria, 3pacientes con trombo endoluminal fueron tratados con doble antiagregación y profilaxis con heparina de bajo peso molecular, con resolución del trombo en el estudio de control realizado en un mes. Hay estudios en marcha que nos permitirán aclarar este aspecto.
La atención al ictus en el contexto de la pandemia está dificultada por una menor disponibilidad de servicios de urgencia, la necesidad de distanciamiento, las medidas de aislamiento de los pacientes infectados y una menor disponibilidad de acceso a los estudios diagnósticos. Necesitamos estrategias para adaptar la atención al ictus en pacientes con COVID-1930.
Fortalezas y limitacionesEste estudio se lleva a cabo en un hospital de tercer nivel universitario en el contexto de una estructura organizativa de Unidad de Ictus, con una atención al ictus con COVID-19 adaptada a las recomendaciones30.
Trabajamos con una historia clínica digitalizada que permite el acceso a toda la información clínica, de laboratorio y radiológica que permite un estudio sistemático y detallado. Hemos incluido a pacientes que presentan el ictus con posterioridad a la infección por COVID-19 para excluir a pacientes infectados tras el ictus y que pudieran añadir confusión.
Las limitaciones de nuestro trabajo son, en primer lugar, el haberse realizado en un solo centro, habrá que esperar otras series para poder extrapolar nuestros resultados. En segundo lugar, que el estudio diagnóstico se ha visto afectado de forma inevitable por las circunstancias críticas de la pandemia que han limitado la disponibilidad de algunas técnicas diagnósticas.
ConclusionesEn los pacientes con ictus y COVID-19 la etiología más frecuente es la aterotrombótica (56%), con una alta frecuencia de trombosis endoluminal sobre placa de ateroma (31%). Nuestros datos apuntan a que la coagulopatía asociada a la COVID-19 es un mecanismo etiopatogénico relevante para el ictus isquémico.
FinanciaciónSin fuentes de financiación.
Conflicto de interesesLos autores no tienen conflictos de interés.
Los autores quieren expresar su más alta gratitud al Dr. Juan-Antonio Zabala-Goiburú, por su sabio consejo y apoyo incondicional a nuestro trabajo. También mostrar su agradecimiento a Kathy Fitch, por la edición y traducción de la versión en inglés.