Analizar la supervivencia en el grupo de pacientes con gliomas de alto grado tratados de forma consecutiva en un mismo centro a lo largo de 10años. Establecer la relevancia de los factores asociados y el papel de la cirugía de rescate en el momento de la progresión.
MétodosFueron analizados de forma retrospectiva los pacientes con gliomas grado III y IV de la Organización Mundial de la Salud (OMS) diagnosticados en el Hospital Gregorio Marañón desde el 1 de enero de 2008 hasta el 31 de diciembre de 2017. Se obtuvieron de la historia clínica los datos clínicos, radiológicos y anatomopatológicos.
ResultadosSe completó el seguimiento en 233 pacientes con diagnóstico de glioma de alto grado (III o IV de la OMS). La edad media fue de 62,2 años. La mediana de supervivencia se situó en 15,4 meses. De los 133 pacientes (59,6%) que habían sido intervenidos mediante cirugía resectiva en el momento del diagnóstico, en 43 (32,3%) se efectuó cirugía de rescate en el momento de la progresión. La supervivencia global, así como la supervivencia tras la progresión, resultó mayor en este subgrupo de pacientes. Otras variables relacionadas con una mayor supervivencia fueron la puntuación en la escala de Karnofsky, el grado de resección quirúrgica y el diagnóstico inicial de grado III de la OMS.
ConclusionesAlrededor de una tercera parte de los pacientes con gliomas de alto grado pueden ser candidatos a una cirugía de rescate en el momento de la progresión. Ello está asociado a una mayor supervivencia.
This study addresses the survival of consecutive patients with high-grade gliomas treated at the same institution over a period of 10 years. We analyse the importance of associated factors and the role of salvage surgery at the time of progression.
MethodsWe retrospectively analysed a series of patients with World Health Organization (WHO) grade III/IV gliomas treated between 2008 and 2017 at Hospital Gregorio Marañón (Madrid, Spain). Clinical, radiological, and anatomical pathology data were obtained from patient clinical histories.
ResultsFollow-up was completed in 233 patients with HGG. Mean age was 62.2 years. The median survival time was 15.4 months. Of 133 patients (59.6%) who had undergone surgery at the time of diagnosis, 43 (32.3%) underwent salvage surgery at the time of progression. This subgroup presented longer overall survival and survival after progression. Higher Karnofsky Performance Status score at diagnosis, a greater extent of surgical resection, and initial diagnosis of WHO grade III glioma were also associated with longer survival.
ConclusionsAbout one-third of patients with HGG may be eligible for salvage surgery at the time of progression. Salvage surgery in this subgroup of patients was significantly associated with longer survival.
El tratamiento de los pacientes con gliomas de alto grado continúa representando uno de los campos más decepcionantes en la práctica habitual de la neurocirugía. Pese a la aparición en los últimos años de nuevas herramientas terapéuticas, el beneficio en la calidad de vida y supervivencia ha resultado modesto en términos generales. Años atrás, de hecho, debido a la gran agresividad y rápida progresión de esta enfermedad, los esfuerzos terapéuticos orientados a tratar de detenerla llegaron a ser muy cuestionados por su falta de efectividad1.
Si bien en la actualidad hay un consenso acerca de cómo actuar ante el diagnóstico de novo, no existe tal acuerdo en cómo proceder en el momento de la progresión tras una primera línea de tratamiento2. Dicho momento habrá de presentarse de forma inevitable, dado el comportamiento biológico de estos tumores. La heterogeneidad de los pacientes con recidivas de gliomas de alto grado en relación con el estado general que presentan en el momento de la recidiva, el grado de extirpación inicial y la región anatómica implicada representan un obstáculo importante a la hora de interpretar los resultados de los trabajos centrados en este escenario2. Se estima, no obstante, que alrededor del 20-30% de los pacientes con glioblastoma recurrente podrían beneficiarse de una cirugía de rescate3.
Determinar la pertinencia o futilidad de llevar a cabo en estos pacientes esfuerzos terapéuticos de intensidad similar a los empleados en el momento del diagnóstico de novo así como identificar el perfil de paciente que en mayor medida pudiera beneficiarse de ello constituyen a día de hoy puntos de gran interés1,4.
MétodosSe llevó a cabo un estudio retrospectivo en el que se incluyó a los pacientes adultos con tumores gliales de estirpe astrocitaria, localización supratentorial y grado histológico III y IV en la clasificación de la Organización Mundial de la Salud (OMS), diagnosticados en el Hospital General Universitario Gregorio Marañón en un período de 10años, entre enero de 2008 y diciembre de 2017. Se efectuó un muestreo consecutivo no probabilístico, de manera que los pacientes fueron incluidos en el estudio según orden de intervención. La referencia se obtuvo del archivo del Comité de Neurooncología del Hospital Gregorio Marañón. Fueron excluidos los pacientes con histologías correspondientes a ependimomas, gangliogliomas, oligodendrogliomas y oligoastrocitomas anaplásicos, así como astroblastomas, gliomas cordoides del III ventrículo y gliomas angiocéntricos. También se excluyó a todos aquellos pacientes con edad de inicio menor de 18 años.
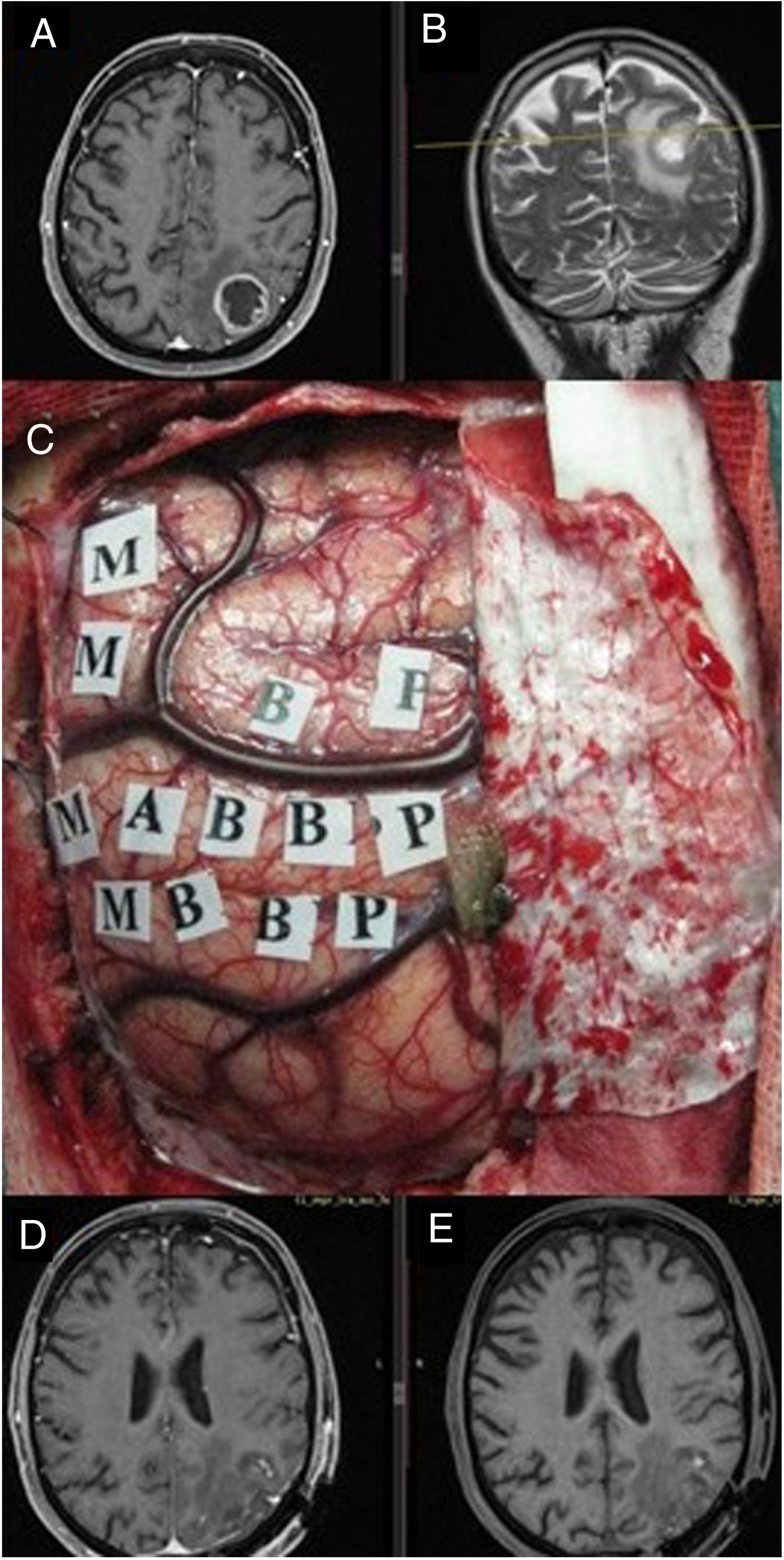
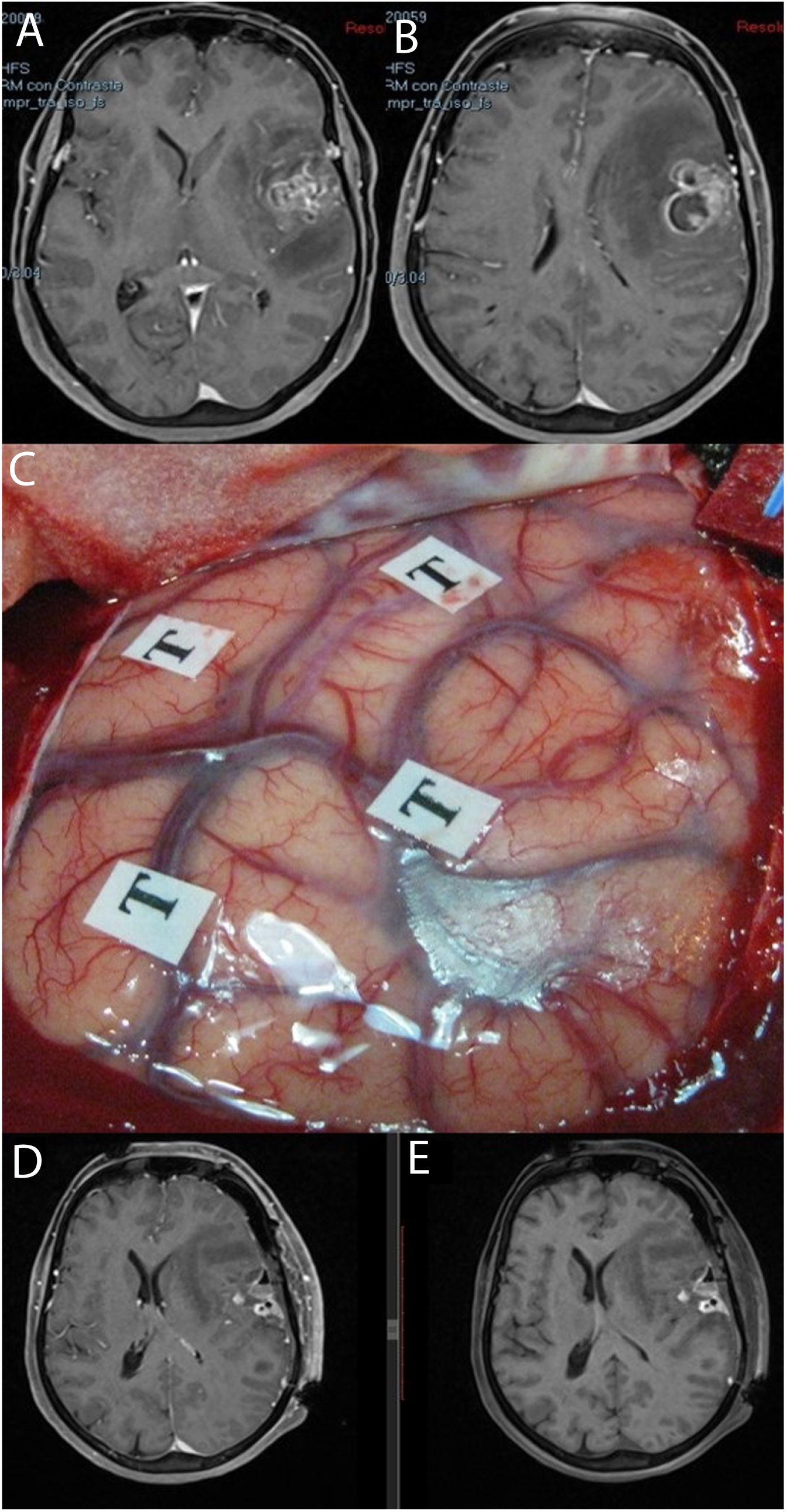
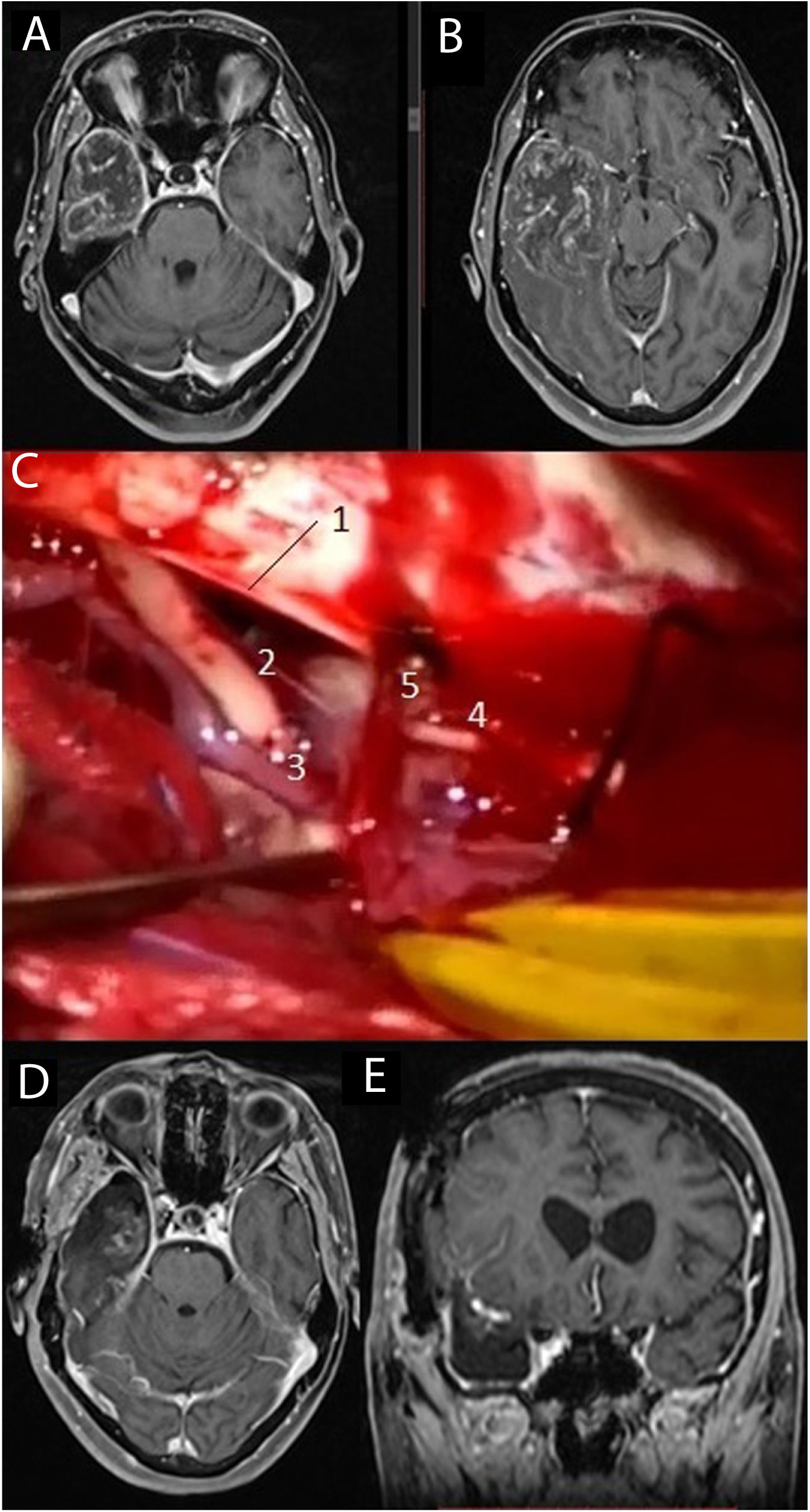
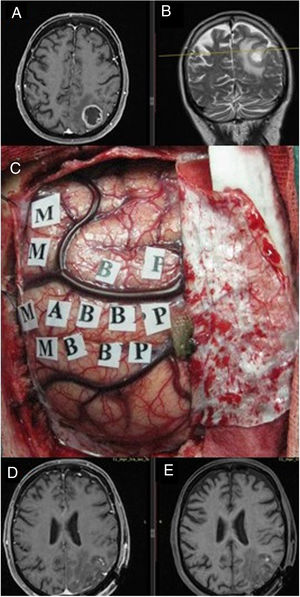
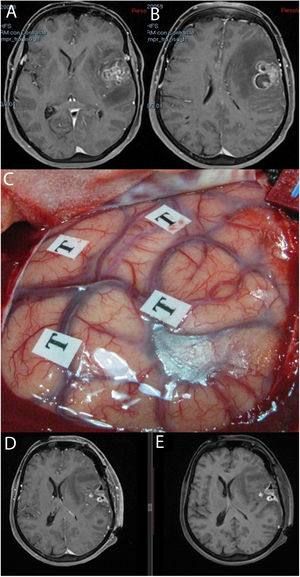
Se recogieron los datos pertenecientes a la edad, sexo, fecha de diagnóstico, Karnofsky Performance Status (KPS), enfoque terapéutico con o sin cirugía y modalidad de esta, intervalo libre de progresión desde la cirugía inicial, número de intervenciones, modalidad de tratamiento adyuvante y causa del fallecimiento. Del mismo modo, se obtuvieron de las imágenes e informes radiológicos los datos relacionados con la presencia de tumor en región elocuente, considerando como tal la extensión del tumor a la región tálamo-capsular, corona radiata o centro semioval, lóbulo central, áreas relacionadas con el lenguaje (opérculo frontal del hemisferio dominante, circunvolución supramarginal, lóbulo temporal dominante y transición entre dichas zonas). Para la extirpación de los tumores en dichas localizaciones se contó con la ayuda de monitorización neurofisiológica intraoperatoria (fig. 1) o cirugía con paciente despierto (fig. 2) con el fin de maximizar el grado de extirpación y limitar el riesgo de déficit neurológico postoperatorio (fig. 3).
Imágenes de resonancia magnética en secuencia T1 axial con contraste (A) y T2 coronal (B), que muestran una tumoración correspondiente a glioblastoma situado en el parietal izquierdo, en el margen posterior del lóbulo central. Se empleó cirugía con mapeo cerebral intraoperatorio para la identificación de córtex motor (C) gracias a lo cual se logró una extirpación completa como muestra la secuencia T1. Resonancia magnética postoperatoria con (D) y sin contraste intravenoso (E) en ausencia de déficit neurológico postoperatorio.
Imágenes de resonancia magnética en la secuencia T1 con contraste (A, B) que muestran una tumoración correspondiente a glioblastoma situada en la región opercular izquierda. Se empleó cirugía con mapeo cerebral intraoperatorio en paciente despierto (C). Las resonancias magnéticas postoperatorias con (D) y sin contraste intravenoso (E) muestran cambios posquirúrgicos, con restos hemáticos en ausencia de tumoración residual, todo ello sin que tuviera lugar un empeoramiento en el lenguaje.
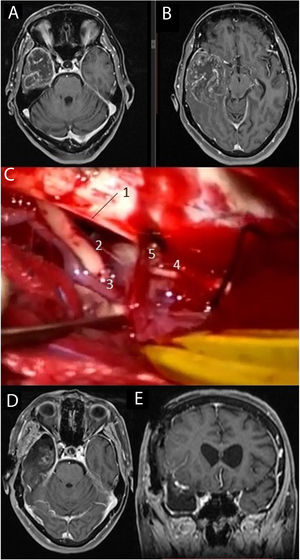
Imágenes de resonancia magnética en la secuencia T1 con contraste intravenoso (A, B) que muestran una voluminosa tumoración situada en el lóbulo temporal derecho, correspondiente a glioblastoma. Se practicó una lobectomía temporal (C), en la cual pueden diferenciarse el borde libre del tentorio (1), el III par craneal derecho (2), la arteria comunicante posterior derecha (3), el IV par craneal derecho (4) junto a una vena cortical que drena en el tentorio (5). Las imágenes D y E muestran respectivamente los cortes axial y coronal de la resonancia magnética postoperatoria.
El grado de resección (GR) efectuada en la cirugía inicial (GR1) fue determinado según los resultados de la resonancia magnética postoperatoria realizada en las primeras 72 h (figs. 1-3). De este modo fue clasificado el GR como resección subtotal y resección prácticamente completa, siguiendo el esquema propuesto por Bloch et al., en el que se consideró como resección prácticamente completa una extirpación mayor del 95% del volumen de la región hipercaptante, mientras que la extirpación menor o igual al 95% se consideró como resección subtotal5.
La caracterización histopatológica se basó en la clasificación de la OMS de 20076. Se obtuvo información correspondiente al grado del tumor según la OMS en el momento del diagnóstico, así como el grado de la OMS en el momento de la cirugía de rescate, en el caso de producirse.
El tratamiento adyuvante se basó en el protocolo descrito en el trabajo de Stupp del año 2005, consistente en la administración de 60Gy de radioterapia en 30 sesiones de 2Gy cada una repartidas durante 6 semanas, a razón de 5 sesiones semanales y acompañada de temozolomida concomitante 7 días a la semana desde el primero al último día de la radioterapia. Esto fue seguido por 6 ciclos de temozolomida, en cada uno de los cuales se administró el fármaco durante 5 días consecutivos, intercalando 2 días de descanso hasta alcanzar los 28 días por ciclo7.
El período de seguimiento se prolongó hasta el 31 de diciembre de 2018 y fue llevado a cabo por los departamentos tratantes, esto es, Neurocirugía, Oncología Médica y Oncología Radioterápica. Dicho seguimiento se apoyó en la programación de controles de imagen mediante resonancia magnética nuclear cerebral cada 3meses. El período de intervalo libre de progresión se definió desde el inicio del tratamiento hasta la documentación de una progresión de la enfermedad de acuerdo con los criterios Response assessment in neuro-oncology criteria8. Esto pudo objetivarse en la resonancia magnética nuclear rutinaria de control o bien en un estudio de imagen motivado por un empeoramiento neurológico.
La indicación de cirugía de rescate en el momento de la progresión se estableció de forma individualizada y consensuada en el Comité de Neurooncología. Dicho comité estuvo compuesto por médicos especialistas tratantes de la enfermedad: neurocirujanos, oncólogos médicos y oncólogos radioterápicos, así como por especialistas en radiodiagnóstico y anatomía patológica. Se incluyó también al personal administrativo encargado de registrar la decisión tomada en cada caso. De este modo, se discutió cada paciente de forma individualizada con el objetivo de, basándose en el rigor científico y en la situación particular de cada enfermo, alcanzar una decisión de tratamiento consensuada, a la vez que vinculante.
La indicación de cirugía de rescate en el momento de la progresión se basó en los siguientes criterios:
- -
KPS> 70.
- -
Progresión de la enfermedad en un período mayor a 6 meses tras el inicio del tratamiento.
- -
Localización del tumor favorable que posibilitara como mínimo una resección subtotal sin riesgo de déficit neurológico incapacitante.
Para el análisis de supervivencia se emplearon curvas de Kaplan-Meier. El impacto de cada variable en la supervivencia se estableció mediante la prueba log rank. La estratificación del riesgo de las variables con impacto significativo en la supervivencia fue calculada mediante el modelo de regresión de Cox. El grado de significación estadística se fijó en un valor de p < 0,05. El análisis estadístico se efectuó con el programa estadístico SPSS® versión 19.0 (IBM, Nueva York, Estados Unidos).
ResultadosEn el periodo de 10años comprendido entre enero de 2008 y diciembre de 2017 se identificó a un total de 328 pacientes, 185 varones (54,3%) y 143 mujeres (43,6%) con el diagnóstico de tumor glial grado III o IV de la OMS.
Se logró completar en 223 pacientes (68%) el seguimiento, cuya duración media fue 14,3 ± 10,9 meses. La edad media de los pacientes se situó en 62,21 ± 13,89 años. El KPS inicial era de 100 en 90 pacientes (40,3%), 90 en 49 pacientes (22%), 80 en 72 de los participantes (32,3%), 70 en 7 casos (3,1%) y de 60 o menor en 5 casos (2,2%).
El tumor se localizaba en una región cerebral no elocuente en 150 casos (67,3%) mientras que en 73 (32,7%) se localizaba en una zona elocuente. En 133 casos (59,6%) se efectuó una cirugía con finalidad resectiva en el momento del diagnóstico, en 70 (31,4%) la cirugía tuvo finalidad diagnóstica (biopsia escisional o bien guiada con navegación o estereotaxia) y en 20 casos (9%) se desestimó cualquier tratamiento quirúrgico. En cuanto al GR, fue posible una resección prácticamente completa en 89 casos (66,9%) mientras que en 44 casos (33,1%) tuvo lugar una resección subtotal. El grado histológico de la OMS fue III en 38 pacientes (18,7%) y IV en 165 casos (81,3%). La mediana del intervalo libre de progresión tras la primera intervención se situó en 10,9 meses (1,0-34,8).
En el momento de la progresión tras una primera línea de tratamiento, en 43 de los 133 pacientes (32,3%) en los que había tenido lugar una cirugía resectiva inicial, se abordó una cirugía de rescate con el fin de reducir al máximo posible la carga tumoral.
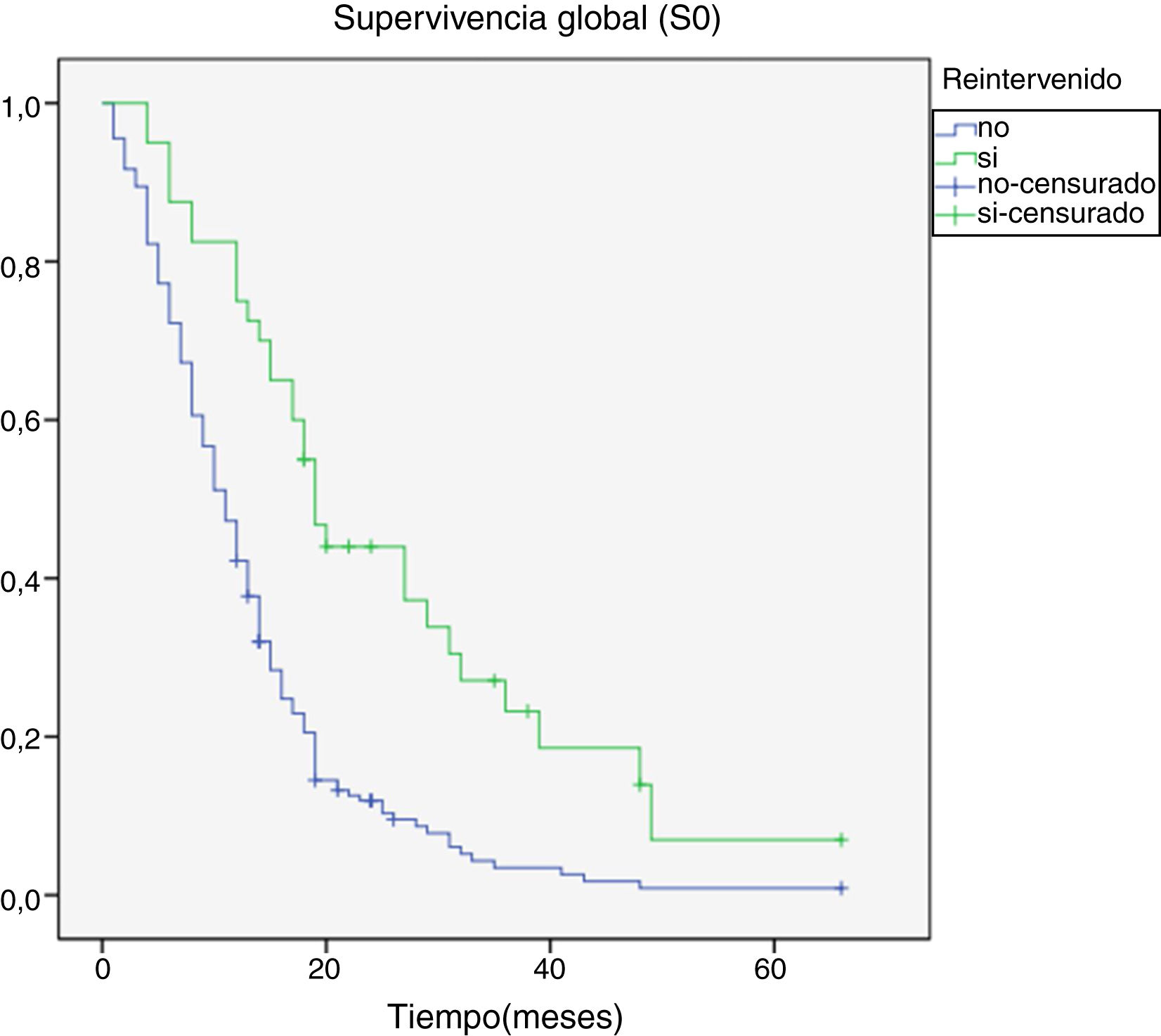
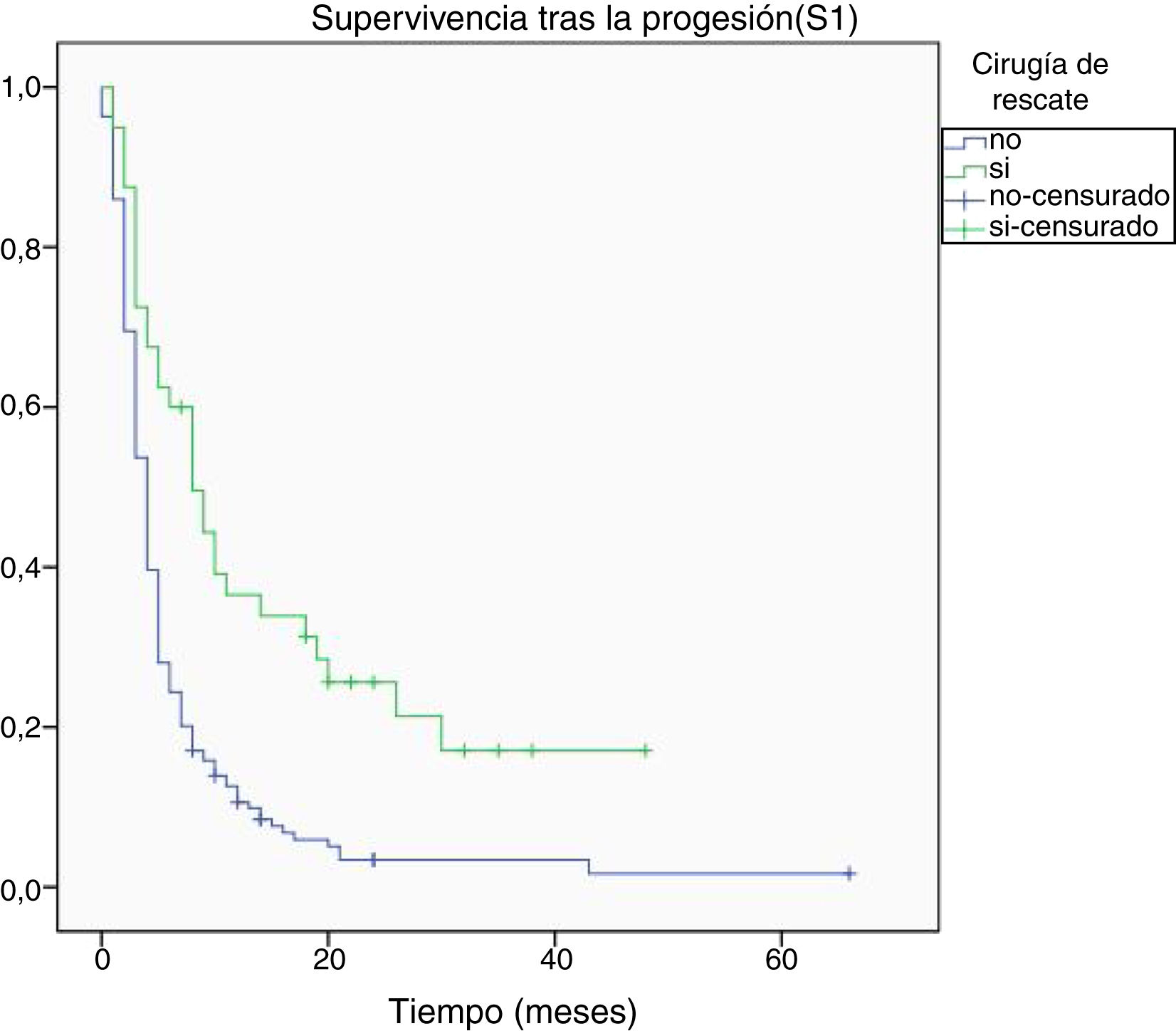
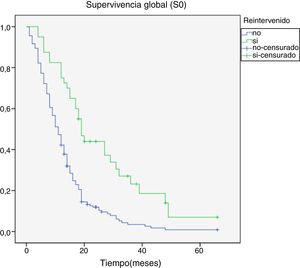
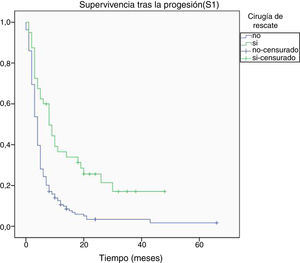
Al final del seguimiento fallecieron 200 pacientes (89,7%) mientras que 23 (10,3%) de ellos permanecían vivos. La progresión tumoral se identificó como causa directa del fallecimiento en 96 de los casos (48%). La mediana de supervivencia global (S0) determinada mediante la curva de Kaplan-Meier fue de 15,4 meses (0-66,3) (fig. 4). Por su parte, la mediana de supervivencia tras la progresión se situó en 7,8 meses (0-47,4) (fig. 5).
Se hallaron diferencias significativas en la S0 a favor de los pacientes menores de 50 años, con un mayor KPS al diagnóstico (p <0,05). El aumento de supervivencia también alcanzó significación estadística en los pacientes que fueron tratados mediante una primera cirugía con una resección prácticamente completa, presentaban una histológica correspondiente a grado III de la OMS y en aquellos en los que se efectuó una cirugía de rescate en el momento de la progresión (tabla 1). No se encontraron diferencias significativas en supervivencia según sexo y elocuencia o no de la región afectada.
Supervivencia global (S0) y su relación con diferentes variables
| Edad | ||
| <50 años | 19,0 ± 2,7 | p <0,001 |
| >50 años | 13,0 ± 1,6 | |
| Sexo | ||
| Mujer | 14,1 ± 2,8 | p = 0,107 |
| Varón | 16,7 ± 2,8 | |
| KPS | ||
| 100 | 15,9 ± 1,4 | |
| 90 | 14,2 ± 1,5 | p <0,001 |
| 80 | 7,2 ± 1,1 | |
| 70 | 5,1 ± 1,5 | |
| 60 | 4,8 ± 2,1 | |
| Región afectada | ||
| Elocuente | 16,3 ± 2,2 | p = 0,337 |
| No elocuente | 14,8 ± 2,9 | |
| Grado de resección | ||
| RPC | 19,3 ± 3,0 | p <0,001 |
| RST | 12,6 ± 2,1 | |
| Grado según OMS | ||
| Astrocitoma anaplásico (III) | 29,9 ± 7,2 | p <0,001 |
| Glioblastoma (IV) | 12,7 ± 1,4 | |
| Cirugía de rescate | ||
| Sí | 21,5 ± 4,2 | p <0,001 |
| No | 12,3 ± 1,7 | |
Datos de supervivencia en meses.
KPS: Karnofsky performance status; OMS: Organización Mundial de la Salud; RST: resección subtotal; RPC: resección prácticamente completa.
El análisis multivariante mostró la relación entre la mayor S0 y aquellos casos con mayor puntuación en el KPS al diagnóstico, una extirpación quirúrgica inicial próxima a la totalidad, el diagnóstico inicial de grado III de la OMS y la cirugía de rescate en el momento de la progresión (p <0,05) (tabla 2).
Modelo multivariante de Cox que muestra los riesgos relativos de las variables relacionadas con la supervivencia global (S0)
| Variable | Hazard ratio (IC 95%) | p |
|---|---|---|
| KPS | 0,92 (0,89-0,95) | <0,001 |
| GR | 0,95 (0,92-0,98) | <0,001 |
| Grado OMS | 1,67 (1,43-1,81) | <0,001 |
| Reintervención | 0,94 (0,91-0,97) | <0,001 |
GR: grado de resección; KPS: Karnofsky performance status; OMS: Organización Mundial de la Salud.
Respecto a la supervivencia tras la progresión (S1), se halló relación entre una mayor supervivencia y la edad menor a 50 años, una mayor extirpación tumoral inicial, el grado III de la OMS y la cirugía de rescate (tabla 3). El modelo de regresión de Cox confirmó la asociación de una mayor S1 con el grado III de la OMS y la cirugía de rescate (tabla 4).
Supervivencia tras el inicio de la progresión (S1) y su relación con diferentes variables
| Edad | ||
| <50 años | 13,8 ± 2,7 | p <0,001 |
| >50 años | 5,5 ± 1,7 | |
| Sexo | ||
| Mujer | 7,6 ± 3,4 | p = 0,458 |
| Varón | 7,9 ± 2,2 | |
| Región afectada | ||
| Elocuente | 7,9 ± 2,3 | p = 0,234 |
| No elocuente | 7,1 ± 1,7 | |
| Grado de resección | ||
| RPC | 8,9 ± 2,0 | p <0,001 |
| RST | 5,6+/1,3 | |
| Grado según OMS | ||
| III | 14,8 ± 4,6 | p <0,001 |
| IV | 5,5 ± 1,4 | |
| Cirugía de rescate | ||
| Sí | 12,5 ± 2,5 | p <0,001 |
| No | 4,9 ± 1,4 | |
Datos de supervivencia en meses.
OMS: Organización Mundial de la Salud; RPC: resección prácticamente completa; RST: resección subtotal.
La serie descrita muestra la experiencia acumulada en el tratamiento de gliomas de alto grado en los últimos 10años en una única institución, todo ello con posterioridad al reconocido trabajo de Stupp publicado en 20057. Dicho trabajo estandarizó el tratamiento de los gliomas de alto grado en el momento del diagnóstico.
Durante el período señalado de 10años fueron atendidos en nuestro centro un total de 328 pacientes con gliomas de alto grado, una media superior a 30 pacientes por año, lo que convierte a nuestra institución en un centro de alto volumen para el tratamiento de esta enfermedad9,10.
La S0 en nuestra experiencia se situó en 15,4 meses, cifra ligeramente superior a la establecida en la bibliografía actual, en torno a 14,6 meses7. Por su parte, la S1 en nuestro trabajo fue de 7,8 meses, dentro del rango de 6-10 meses establecido por la literatura actual11.
El análisis multivariante relacionó el aumento en la S0 con la mayor puntuación en el KPS inicial, un mayor grado de extirpación tumoral, el grado III de la OMS y la cirugía de rescate en el momento de la progresión tumoral (tabla 2). La asociación entre una mayor puntuación en la escala de Karnofsky en el momento inicial y una mayor supervivencia se encuentra ampliamente descrita en la literatura relacionada con los gliomas de alto grado12-15.
En cuanto al grado de resección tumoral, la tendencia en los últimos años ha venido a mostrar lo que hemos observado en nuestro trabajo: una extirpación amplia, próxima a la totalidad, está asociada a una mayor supervivencia. Este axioma, que resulta una constante en la gran mayoría de los tumores de órganos sólidos, ha sido cuestionado en los gliomas de alto grado debido a su compleja fisiopatología y enorme agresividad. De hecho, existen trabajos recientes centrados en pacientes con varias cirugías resectivas separadas por líneas de tratamiento adyuvante en los que no se observa un beneficio en la supervivencia derivado de un GR1 más amplio, mientras que sí existe tal beneficio al efectuar sucesivas resecciones próximas a la totalidad5.
Dejando a un margen observaciones como esta, nuestros resultados respecto al grado de extirpación tumoral se sitúan en la línea de la literatura actual. Esto viene a reforzar la importancia de herramientas como la monitorización neurofisiológica intraoperatoria, el mapeo cerebral y la cirugía con paciente despierto, capaces de permitir un mayor grado de extirpación quirúrgica dentro de los márgenes de seguridad3. De hecho, ha sido recientemente descrito el beneficio de coste efectividad y coste utilidad del mapeo motor gracias a su capacidad para aumentar el grado de extirpación de una forma controlada16. En el otro extremo, se ha comprobado la relación entre el deficit neurológico incapacitante postoperatorio y una menor supervivencia17.
Nuestra experiencia confirma, además, que un menor grado histológico en la escala de la OMS ha de asociar por definición una mayor supervivencia18.
Según nuestros datos, la cirugía de rescate en pacientes seleccionadas en el momento de la recidiva está relacionada con una mayor supervivencia3,5,19-21. En nuestra serie, casi un tercio (32%) de los pacientes con gliomas de alto grado en progresión fueron seleccionados para cirugía de rescate en el momento de la progresión tras una primera línea de tratamiento. La asociación entre la cirugía de rescate y el aumento de la supervivencia ha sido descrita en publicaciones previas2,3,15,20,21. Su papel se ha visto reforzado debido al escaso beneficio mostrado por la terapia antiangiogénica con bevacizumab en estos pacientes22. No obstante, a diferencia de lo que sucede con los gliomas de bajo grado, en los que está aceptada la validez de las cirugías repetidas de citorreducción20, el consenso a la hora de hacer lo propio en los gliomas de alto grado aún no es total23,24. De este modo, se han descrito experiencias favorables con otros tratamientos como la radiocirugía estereotáctica, la reirradiación25-30, la quimioterapia manteniendo temozolamida o bien introduciendo nitrosoureas u otros agentes alquilantes31,32, los campos eléctricos de baja intensidad (tumor treating fields)32 y los ensayos clínicos, generalmente con terapias biológicas31-34.
Buena parte de la dificultad a la hora de estandarizar el manejo de la progresión de esta enfermedad tras una primera línea de tratamiento viene dada por la heterogeneidad de los pacientes en el momento del diagnóstico de progresión1. Dicha heterogeneidad está definida, sobre todo, por la situación general del paciente, referida habitualmente mediante la escala KPS, lo que, en general, va a condicionar la indicación o no de iniciar un tratamiento activo35-41. La heterogeneidad viene también condicionada por el grado de agresividad empleado en la cirugía inical, a menudo diferente en cada paciente, la variedad de localizaciones anatómicas donde puede extenderse la progresión, que pueden condicionar su resecabilidad y, por último, las diferencias en las terapias adyuvantes recibidas, generalmente condicionadas por la tolerancia2. En este sentido, como ya han señalado diversos autores, es preciso tener en cuenta la existencia de un sesgo de selección en los pacientes beneficiados de una línea terapéutica en el momento de la progresión2,42-45. Dicho sesgo puede condicionar la obtención de un resultado favorable en el análisis de supervivencia de estos pacientes y conducirnos a sobrestimar el valor de cualquier tratamiento en este subgrupo.
De cara a reducir el impacto de dicho sesgo, llevamos a cabo un análisis de la supervivencia desde el momento de la progresión tras la primera línea de tratamiento (S1), en el cual se continúa apreciando un beneficio en la supervivencia asociado a la cirugía de rescate.
Las limitaciones de nuestro estudio vienen dadas sobre todo por su diseño retrospectivo. Dado el período en que tuvieron lugar las intervenciones, los diagnósticos histopatológicos pertenecen a la clasificación de la OMS de 2007, sin tener en cuenta la caracterización genética de la clasificación de 201646.
Consideramos, pues, que los resultados de nuestra experiencia y de la literatura muestran la importancia de llevar a cabo un tratamiento activo y radical en el momento de la progresión de esta enfermedad tras una primera línea de tratamiento en aquellos pacientes que cumplan con los criterios señalados. De este modo, creemos que, de la misma forma que ha sido abandonanda la visión nihilista de esta enfermedad en el momento del diagnóstico inicial1,3, debe extrapolarse esta actitud al momento del diagnóstico de la progresión. Para ello resulta esencial mantener un seguimiento estrecho de los pacientes por todos y cada uno de los departamentos tratantes: habitualmente Neurocirugía, Oncología Médica y Oncología Radoterápica. Este seguimiento ha de garantizar un control clínico-radiológico de cara a identificar la progresión en el momento adecuado para tratarla a tiempo. Asimismo, ha de permitir el control de los síntomas y de la medicación, fundamentalmente la corticoterapia, cuyo mantenimiento asocia peores resultados47. Todo ello ha de estar articulado con la creación de comités multidisciplinares de neurooncología, dotados de la capacidad para tomar decisiones vinculantes respecto al tratamiento de estos pacientes48.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
A la totalidad de los integrantes del Comité de Neurooncología del Hospital General Universitario Gregorio Marañón.