La miastenia gravis (MG) y la neuromielitis óptica (NMO) son trastornos inmunomediados con una baja prevalencia entre la población general. La NMO es un trastorno inflamatorio del sistema nervioso central con afectación de la médula espinal y del nervio óptico principalmente, asociado con la presencia de anticuerpos antiaquoporina 4 IgG (AQP4-Ab IgG) en el 60-80% de los pacientes1. Aquellos con AQP4-Ab negativo y cuadro clínico compatible se consideran dentro del espectro de la neuromielitis óptica (del inglés neuromyelitis optica spectrum disorders [NMOSD]), existiendo un subgrupo dentro de este con positividad para anticuerpos frente a la glicoproteína de la mielina de los oligodendrocitos (MOG)2. La MG es un trastorno neuromuscular en el que se producen anticuerpos frente a los receptores de acetilcolina (AChR). Su principal manifestación es la debilidad muscular, con frecuencia fluctuante3. Ambos afectan el sistema nervioso de una manera diferente, sin embargo, la asociación se ha descrito en la literatura4, por lo que es posible que compartan algún mecanismo patogénico. Presentamos dos casos de miastenia gravis que desarrollaron neuromielitis óptica.
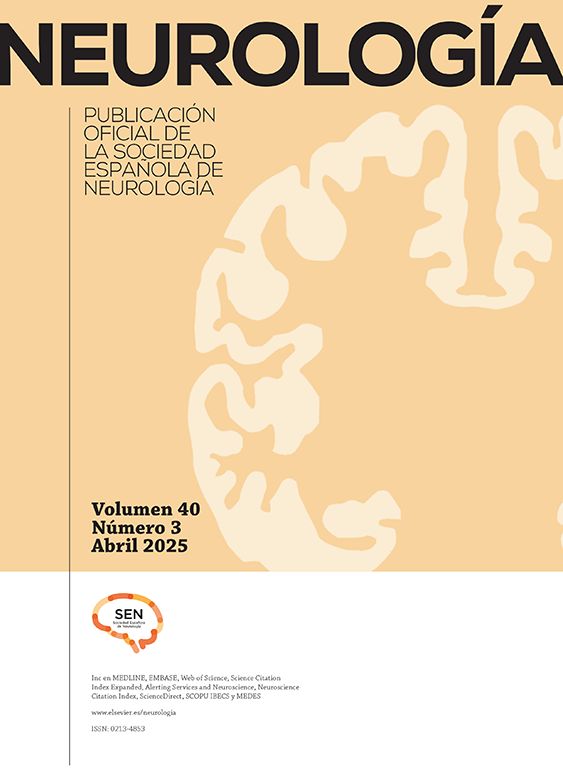
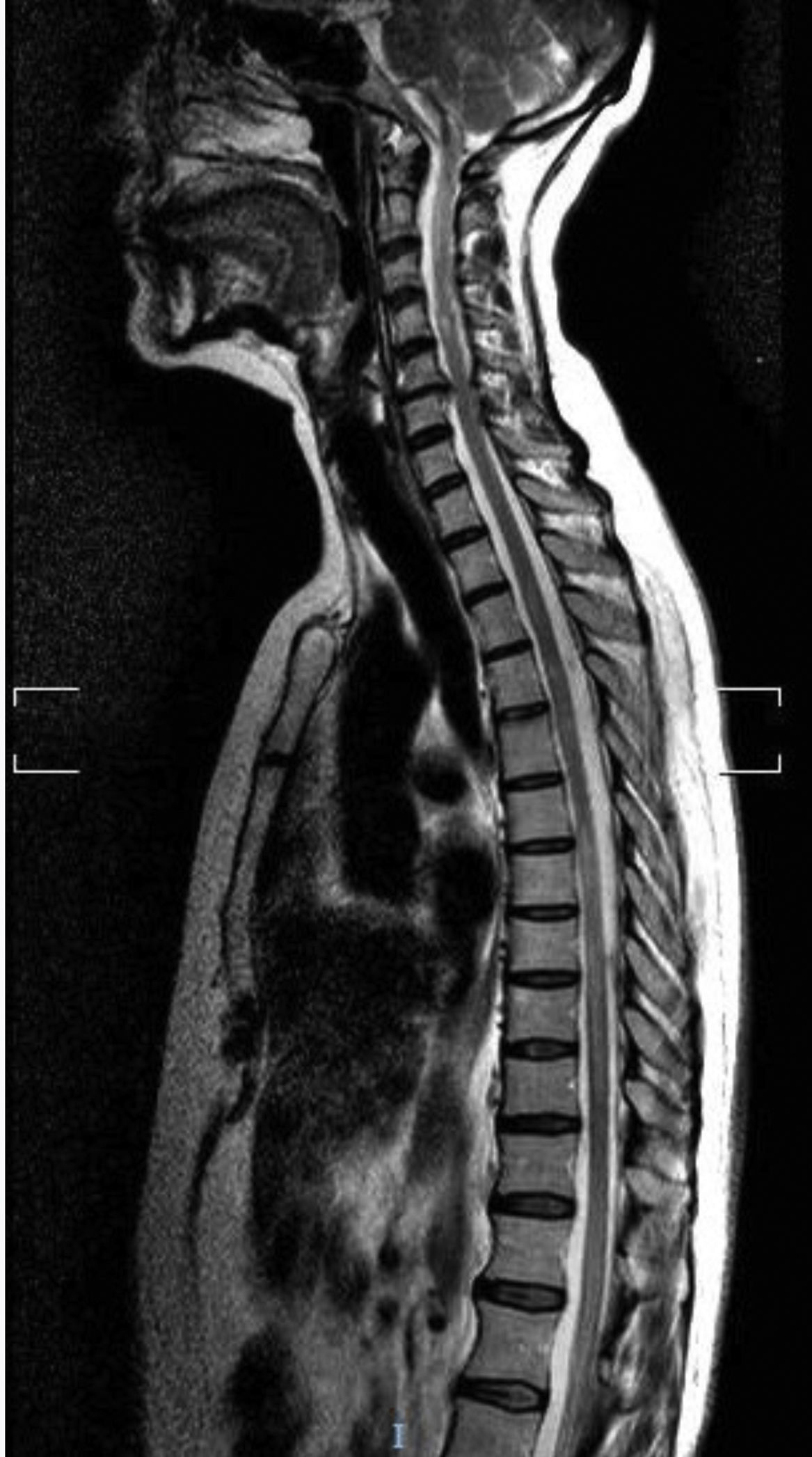
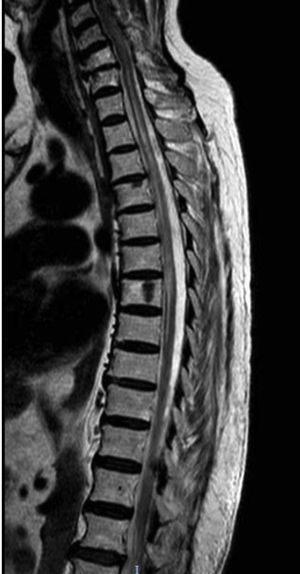
El primer caso es una mujer caucásica de 49 años con antecedentes personales de MG seropositiva no asociada a timoma diagnosticada 6 años antes, no timectomizada por buen control de los síntomas miasténicos con piridostigmina y dosis bajas de prednisona. Ingresa en Neurología por presentar debilidad subaguda, hipoestesia en la pierna derecha y dolor dorsal en cinturón. En la exploración neurológica se observó monoparesia en la pierna derecha e hipoestesia derecha con nivel sensorial en T7, hiperreflexia en miembros inferiores y reflejo plantar extensor derecho. Entre las pruebas diagnósticas realizadas destaca una resonancia magnética (RM) cerebral que mostró solo una lesión frontal inespecífica, mientras que la RM medular mostró en T2 una señal aumentada en C1-C3, T4 a T9 y T11-L2, mínimamente expansiva (fig. 1). El análisis del líquido cefalorraquídeo fue normal. Las bandas oligoclonales fueron negativas y los niveles serológicos de IgG anti-AQP4-Ab de 6,99 (rango normal inferior a 1). Fue tratada con bolos de metilprednisolona con pauta de prednisona descendente posterior y mejoría clínica, persistiendo únicamente banda de hipoestesia a nivel D7 y dificultad para la micción. Como tratamiento de fondo se asoció prednisona a dosis bajas con micofenolato de mofetilo.
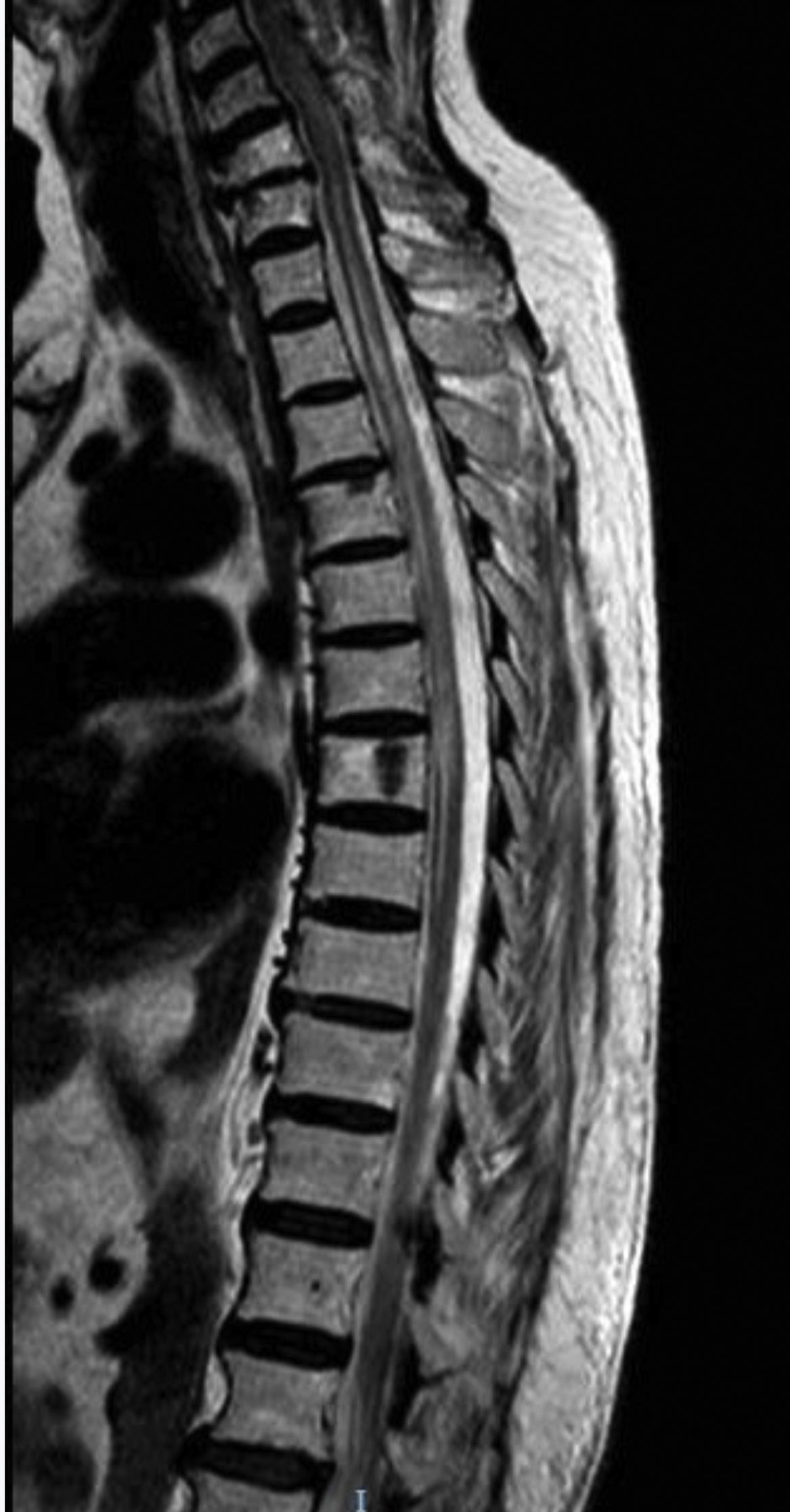
El segundo caso es una mujer caucásica de 76 años con diabetes mellitus tipo 2, hipotiroidismo autoinmune y síndrome de Sjögren. Entre sus antecedentes también destacaba MG ocular con Ac antiAchR positivo y buen control de los síntomas con piridostigmina. Acude a urgencias por dolor abdominal, debilidad y parestesias ascendentes en extremidades inferiores, asociando posteriormente incontinencia urinaria. En la exploración neurológica se apreció paraparesia con reflejos exaltados y área de hipoestesia suspendida entre D3 y L4. La RM reveló hiperintensidad T2 en segmento C7-D8 sin realce de gadolinio (fig. 2). El análisis de líquido cefalorraquídeo fue normal y las bandas oligoclonales fueron negativas. Los resultados analíticos mostraron positividad para AQP4-Ab IgG en LCR y suero en títulos de 1:10. El análisis de sangre también mostró ANA y ENA positivos, con el resto de autoinmunidad negativa. Fue tratada con bolo de metilprednisolona y prednisona con pauta descendente posterior y mejoría parcial, persistiendo leve paraparesia. Como tratamiento de fondo se inició micofenolato asociado a prednisona. A los 10 meses del primer episodio, presentó nueva mielitis, tratada con bolos de metilprednisolona y prednisona posterior. Se suspendió micofenolato y se instaura rituximab a dosis de 1g iv dos dosis separadas dos semanas, con dosis de 1g iv cada 6 meses, sin recurrencia por el momento de los síntomas.
La NMO es un trastorno inflamatorio asociado en una elevada proporción a la presencia de IgG AQP4-Ab1, autoanticuerpo altamente específico de esta entidad5. Se cree que puede ser patógeno mediante la unión de astrocitos y la activación del complemento. Por otro lado, en la MG existe positividad para los Ac anti-AChR (anti-AChR-Ab) de tipo IgG1 e IgG3 que también activan el complemento y conducen a la pérdida de la función normal de la placa motora6.
La concurrencia de ambos se publicó por primera vez en 1995 y desde entonces se han descrito varios casos. La mayoría son pacientes no caucásicos, mujeres y la MG fue diagnosticada previamente. La NMO se inició en el 72,9% de los pacientes después de la timectomía, a diferencia de nuestras pacientes. La positividad a antiAChR-Ab y AQP4-Ab se detectó en 97,7% y 90% respectivamente3 y en varias publicaciones indican que el curso de la miastenia gravis fue leve e incluso se produjo la remisión de la enfermedad en varios pacientes4,7. Los datos existentes sobre el tratamiento de estos pacientes es escaso. En fase aguda se han usado corticoides iv. y/o plasmaferesis1,4,7, y como tratamiento de fondo se han utilizado distintos inmunosupresores (corticoides, azatioprina, micofenolato, ciclofosfamida, rituximab, mitoxantrona) con evolución variable, en muchos casos desfavorable1,4,7.
La NMO y MG tienen baja prevalencia en la población general8,9. Podemos considerarlas como canalopatías autoinmunes que comparten ciertas similitudes: se desarrollan en sinergia entre los factores genéticos y los efectos ambientales, la preponderancia femenina o la coexistencia con otros trastornos autoinmunes sistémicos u órgano específicos10. El síndrome de Sjogren o el lupus eritematoso sistémico, así como otras patologías autoinmunes, ha sido ampliamente descrita en los pacientes con MG y NMO. En el caso de NMO parece que su presencia obedece a la coexistencia de entidades diferentes, siendo muy específica en estas la positividad de Ac antiNMO en pacientes con clínica de neuritis óptica o mielitis longitudinal extensa11. De hecho, diferentes estudios muestran que la asociación de NMO con otras enfermedades autoinmunes puede ser del 20-30%12 y, en un estudio de casos-controles en pacientes con NMO, el 2% tenía MG y en el 11% se detectó AchR-Ab13.
Dada la baja prevalencia de ambas entidades uno esperaría encontrar una proporción menor de pacientes con MG y NMO. No es tan extraño si tenemos en cuenta que el canal AQP4 se expresa no solo en el sistema nervioso central, sino también en músculo esquelético14 y células epiteliales en el timoma15. Es posible que la anomalía tímica en MG predisponga a la producción de AQP4-Ab, facilitada por la degeneración de la membrana postsináptica inducida por antiRAch-Ab16. Su patogenia puede estar relacionada con los linfocitos T reguladores CD4 +, involucrados en la autotolerancia y que podrían reducirse o alterarse en ambas entidades4,7. Tampoco se conoce la razón por la que es más frecuente en pacientes sometidos a timectomía, aunque parece estar en conexión con el papel del timo en la autotolerancia durante la vida adulta.
Para concluir, es importante tener en cuenta que la MG y la NMO pueden estar asociadas, ya que un diagnóstico adecuado puede tener importancia pronóstica e implicar una modificación de la actitud terapéutica.