Muchos procesos encefálicos que causan la muerte de los pacientes que los presentan están mediados por hipertensión intracraneal (HIC). La historia natural de la misma conduce inexorablemente a esta muerte encefálica. El objetivo de este trabajo estriba en realizar una revisión de la fisiopatología cerebral y de la monitorización de la presión intracraneal (PIC).
DesarrolloEl estudio de las ondas de PIC, su monitorización y el registro de las mismas nos informan sobre la existencia de procesos que tienen como común denominador la HIC.
ConclusionesEl correcto registro de la PIC es fundamental para diagnosticar la HIC y, lo que resulta aún más importante, poder instaurar un tratamiento adecuado a tiempo.
Many brain processes that cause death are mediated by intracranial hypertension (ICH). The natural course of this condition inevitably leads to brain death. The objective of this study is to carry out a systematic review of cerebral pathophysiology and intracranial pressure (ICP) monitoring.
DevelopmentStudying, monitoring, and recording ICP waves provide data about the presence of different processes that develop with ICH.
ConclusionsCorrect monitoring of ICP is fundamental for diagnosing ICH, and even more importantly, providing appropriate treatment in a timely manner.
El común denominador o vía final por el que se produce la muerte encefálica en muchos pacientes afectados de enfermedades neurológicas es el edema cerebral y su consecuencia directa, la hipertensión intracraneal (HIC). La historia natural de la misma conduce inexorablemente a esta muerte encefálica. El estudio de las ondas de presión intracraneal (PIC), su monitorización y el registro de las mismas nos informan sobre la existencia de procesos que tienen como común denominador esta HIC. Entre estos procesos se encuentran, principalmente, el traumatismo craneoencefálico grave, la enfermedad vascular cerebral (hematoma intraparenquimatoso, hemorragia subaracnoidea espontánea, infarto maligno de la arteria cerebral media, malformación vascular) y la enfermedad tumoral intracraneal.
Hace poco más de medio siglo que Guillaume y Janny describieron las primeras experiencias en la monitorización de la PIC1. En el trabajo que aquí presentamos, se revisan la fisiología cerebral, la fisiopatología de la PIC y los aspectos relacionados con la monitorización de la misma. Además, se exponen algunas consideraciones terapéuticas frente a la HIC.
DesarrolloFisiología cerebralConsideraciones generalesEl cráneo, tras el cierre de las suturas y las fontanelas, se convierte en una estructura inextensible y, por tanto, mantiene un volumen constante independientemente de su contenido. En condiciones normales, este contenido se puede dividir en 3 compartimentos (teoría de Monro-Kellie): parénquima cerebral (80%), líquido cefalorraquídeo (LCR) (10%) y sangre (10%). Cuando aumenta el volumen de alguno de los 3 componentes, aumenta también la presión que ejerce dicho compartimento sobre los otros 2.
En condiciones normales, estas variaciones se compensan de forma aguda a través del desplazamiento del LCR hacia la cisterna lumbar. De forma más tardía, existe una disminución del flujo cerebral. Solo en situaciones crónicas, el parénquima es capaz de deformarse, a expensas de perder parte del agua extracelular, e incluso neuronas y glía.
Sin embargo, cuando estos mecanismos tampón fallan, el aumento de la PIC puede suponer una disminución en el aporte sanguíneo y secundariamente una reducción de la presión de perfusión cerebral (PPC), con lo que aumenta la probabilidad de lesiones isquémicas, pues la PPC depende tanto de la presión arterial media (PAM) como de la PIC2. En esta relación se distinguen 3 situaciones: en una primera fase, el aumento del volumen intracraneal (VI) no repercute en la PIC pues el desplazamiento del LCR y del volumen sanguíneo cerebral lo compensa. En la segunda fase, el sistema de regulación se encuentra en el límite y no consigue amortiguar el aumento de presión secundario al aumento de volumen. Por último, en la tercera fase, el sistema de autorregulación ha desaparecido y pequeños cambios de volumen suponen elevaciones muy llamativas de la PIC2-6.
Flujo sanguíneo cerebralEntre el 15 y el 25% del gasto cardíaco está dirigido al cerebro, con un flujo sanguíneo cerebral (FSC) de 40-50ml/100g de tejido cerebral/min. El FSC está determinado por el consumo metabólico de oxígeno cerebral (CMRO2), vía autorregulación mediante la resistencia vascular cerebral (RVC), y por la PPC, que es la diferencia entre la PAM y la PIC2,3.
El CMRO2 corresponde, en un 40%, al gasto energético basal (en su mayor parte para mantener el potencial de membrana, por lo que no es modificable por fármacos pero sí termosensible) y en un 60% al gasto energético funcional (no termosensible pero sí modificable por fármacos). El 90% de este CMRO2 corresponde al tejido neuronal y solo un 10% al tejido de sostén o glía (el cual supone más del 50% del volumen encefálico). El CMRO2 se encuentra entre 4-6ml/100g de tejido cerebral/min. Así, situaciones patológicas como la anemia o la hipoxia reducirán el contenido arterial de oxígeno, pudiendo determinar una entrega cerebral de oxígeno inadecuada.
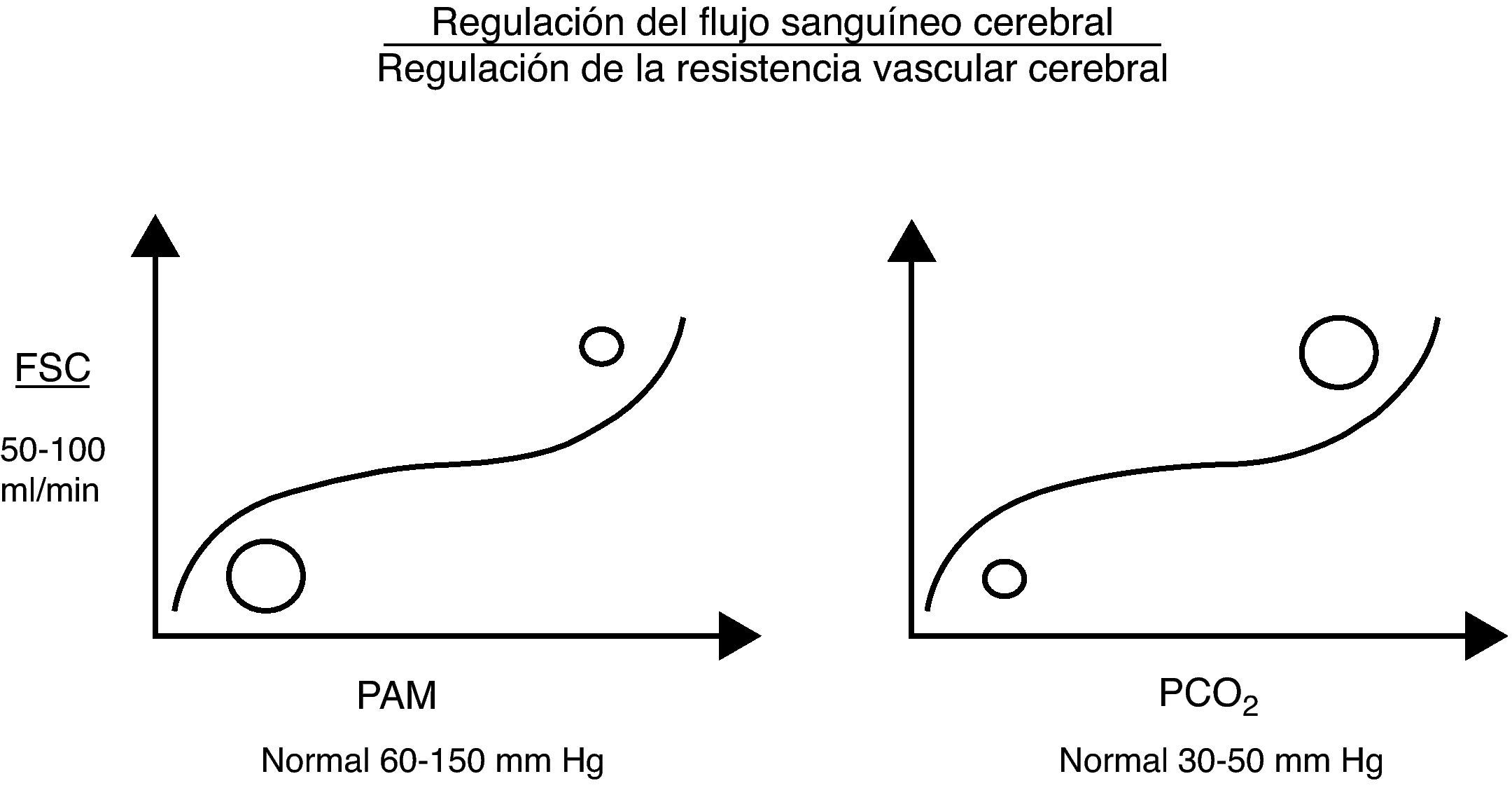
La autorregulación cerebral se basa en la modificación de la RVC (vasodilatación o vasoconstricción) con el fin de mantener un FSC acorde a las necesidades metabólicas cerebrales de O2 de cada momento. Está determinada en gran parte por la presión parcial arterial de dióxido de carbono (PaCO2), por la PAM y, en menor medida, por la presión parcial arterial de oxígeno, la adenosina, el pH, etc. Así, cuando la PaCO2 cerebral es alta (mayor trabajo metabólico), la RVC cae (vasodilatación), aumentando el FSC y la entrega cerebral de oxígeno (CDO2). Lo contrario ocurre cuando la PaCO2 disminuye (menor trabajo metabólico; vasoconstricción). Se estima que el FSC varía en un 4% por cada mmHg de CO2, en normotensión. Con la PAM ocurre algo similar, regulándose el FSC para proteger al tejido cerebral de caídas o alzas bruscas de presión que pudiesen comprometer la CDO2. Sin embargo, estas autorregulaciones tienen límites por encima o por debajo de los cuales el FSC se torna absolutamente dependiente de la PAM (fig. 1)7.
Presión de perfusión cerebralLa PPC se define como la presión necesaria para perfundir el tejido nervioso para un buen funcionamiento metabólico. Una PPC menor de 50mmHg implica una disminución severa del FSC, con el riesgo de isquemia cerebral. Por contra, valores sobre 60-70mmHg han sido determinados como seguros en adultos (en niños aún no ha sido bien establecido, si bien se sabe que los cerebros inmaduros como los de los recién nacidos toleran mejor cifras de PPC más bajas)2,3,8,9.
Fisiopatología de la presión intracranealLa PIC se define como la presión que existe dentro de la bóveda craneal. Se ha establecido que el funcionamiento cerebral es adecuado con valores de PIC entre 10 y 20mmHg en adultos, de 3 a 7mmHg en niños y de 1,5 a 6mmHg en recién nacidos2.
La PIC es la consecuencia de la interacción entre cerebro, LCR y sangre cerebral. Como hemos señalado anteriormente, corresponde al parénquima cerebral el 80% del contenido intracraneal. Este parénquima cerebral está compuesto en un 75-80% de agua, la cual se reparte entre el espacio intracelular (sustancia blanca y sustancia gris) y el extracelular (espacio intersticial).
Por otra parte, el LCR corresponde aproximadamente al 10% del VI. Es producido principalmente por los plexos coroideos a un ritmo de 0,3 a 0,35ml/min y esta producción se ve alterada en diversas circunstancias, como son la inflamación de las vellosidades aracnoideas o el propio incremento de la PIC (situaciones de edema cerebral difuso o presencia de masas intracraneales como hemorragias o tumores).
La sangre cerebral está compuesta por el volumen sanguíneo cerebral (VSC) y por el FSC. El VSC, volumen de sangre constante en el cerebro, corresponde aproximadamente a un 10% del VI. Este VSC contribuye en forma directa a la PIC, mientras que el FSC puede hacerlo indirectamente mediante la autorregulación cerebral.
La PIC varía con la posición (bipedestación frente a decúbito) y oscila con la presión arterial sistémica y con la respiración2. Las maniobras que incrementan la presión intratorácica o intraabdominal, tales como la tos, el llanto o la defecación, incrementan la presión de las venas yugulares y/o del plexo venoso epidural. Dado que las venas cerebrales no tienen válvulas, este incremento de la presión venosa se transmite al espacio intracraneal y así aumenta la PIC. Los diferentes mecanismos que controlan la PIC están en equilibrio en situaciones normales y su registro gráfico es regular y estable. En condiciones no patológicas, los factores que controlan la PIC son los siguientes:
- 1.
El volumen de producción de LCR.
- 2.
La resistencia del sistema a la reabsorción de LCR.
- 3.
La presión venosa del espacio intracraneal, representada por la presión en el seno longitudinal superior.
Los 3 componentes de la cavidad intracraneal son básicamente incompresibles y el VI total es constante. En situaciones patológicas, si se produce un aumento de uno de ellos o aparece un cuarto espacio (una lesión con efecto de masa, como una contusión, un hematoma o un tumor), para que no aumente la PIC, uno o más de los otros componentes tienen que disminuir.
El compartimento parenquimatoso tiene una función compensadora en el caso de lesiones cerebrales de crecimiento lento, pues pueden producir deformación o remodelación del tejido cerebral adyacente a expensas de una disminución del agua extracelular y, en algunos casos, mediante la pérdida de neuronas y células gliales, aunque estos procesos son poco conocidos. En pacientes de edad avanzada, en los que existe un gran componente de atrofia cerebral, el crecimiento de una lesión con efecto de masa se tolera mejor que en jóvenes con mayor volumen cerebral.
Si el aumento del VI se realiza de forma aguda, el componente parenquimatoso no tiene capacidad compensadora y son tanto el LCR como el VSC los que absorben el incremento de volumen. El LCR es el principal sistema compensador, pues su conexión con el espacio subaracnoideo perimedular expansible permite que se desplace rápidamente el LCR a esta localización en respuesta a un incremento del VI. Esto sucede hasta que el incremento de la PIC produce un desplazamiento de las estructuras cerebrales que acaban bloqueando la circulación del LCR2.
La disminución del compartimento vascular es más tardía. La mayor parte del VSC se sitúa en el sistema venoso, de baja presión y de alta capacidad. Por tanto, cuando aumenta el VI, se desplaza sangre intracraneal por las venas yugulares fuera del cráneo.
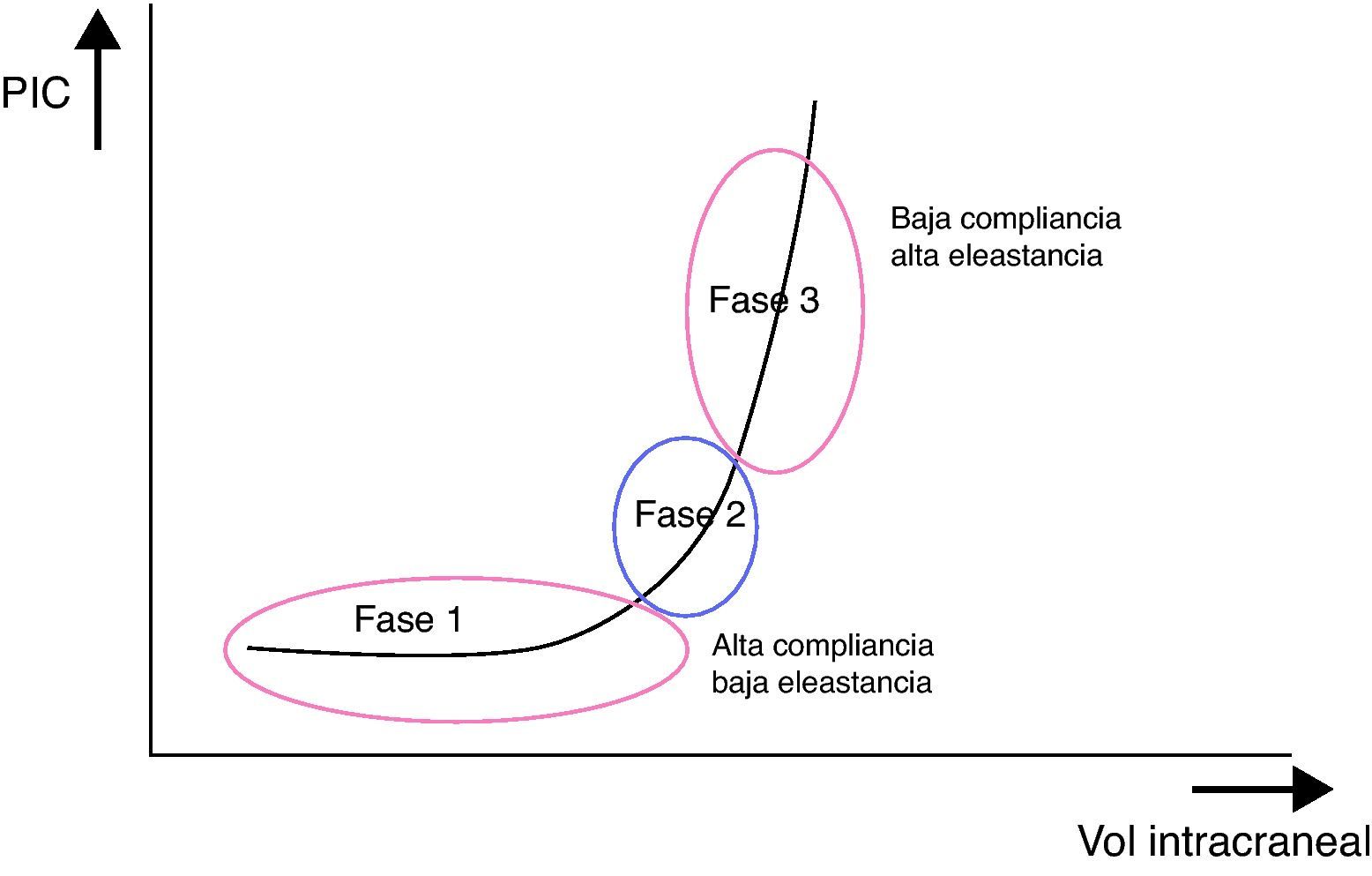
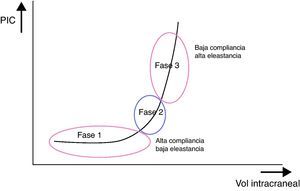
Relación entre el volumen cerebral y la presión intracranealAl cociente entre el diferencial de volumen (dV) y el diferencial de presión intracraneal (dP), es decir, al volumen necesario para obtener un cambio conocido de presión, se le conoce como «compliancia cerebral». Alude a la capacidad adaptativa de la cavidad craneal para tolerar un incremento de su volumen en función de la reserva de sus mecanismos de compensación. A su inverso, es decir, al dP/dV (presión resultante a un cambio conocido de volumen), se le denomina «elastancia cerebral», y se interpreta como la resistencia que se opone a la expansión del VI.
El efecto del LCR y del componente vascular como mecanismos compensatorios o sistemas tampón de la PIC no es infinito, como queda claramente reflejado en la curva de presión-volumen intracraneal que resume la relación entre los cambios del VI y los de la PIC. Dicha curva consta de 3 fases (fig. 2):
- –
Fase inicial: correspondiente a la fase de alta compliancia y baja PIC, en la que a pesar del incremento del volumen, no hay prácticamente ningún incremento de la PIC, pues el LCR y el VSC absorben el aumento de volumen.
- –
Fase de transición: de compliancia baja y PIC baja, en la que la PIC es aún baja pero progresivamente empieza a aumentar.
- –
Fase ascendente: fase de baja o nula compliancia o de descompensación y PIC alta, en la que los mecanismos compensatorios se han agotado y pequeños cambios de volumen condicionan grandes aumentos de presión.
El comportamiento sigmoideo de la curva PIC-VI explica que bastarán leves aumentos del VI para producir grandes cambios de presión. La distensibilidad y la capacidad de taponamiento cerebrales frente a los cambios de volumen varían con el valor numérico de la PIC en un factor de 10, estableciéndose así el índice de presión-volumen intracraneal (IPV). Así, un IPV>18ml conllevaría un bajo riesgo de HIC, mientras que un IPV<13ml implicaría una PIC prácticamente inmanejable. En la práctica clínica, se considera que incrementos de volumen que producen aumentos de la PIC superiores a 25mmHg hacen que la cavidad craneal se sitúe en la fase de descompensación. El problema es determinar clínicamente si un paciente con PIC normal se encuentra en la fase inicial (con alta compliancia) o en la fase ascendente (baja compliancia). Con este fin se han desarrollado varios métodos de estudio de la compliancia cerebral, incluido el análisis de la morfología de la curva de PIC2,10.
Otro aspecto que se debe considerar es que la curva presión-volumen corresponde al eje cráneo-espinal cuando existe una libre comunicación entre ambos espacios. Si hay un bloqueo de la circulación del LCR entre ambos compartimentos, como por ejemplo en el caso de una herniación transtentorial o transforaminal, la curva se desplaza hacia la izquierda (curva craneal), con la consiguiente menor compliancia.
Métodos de monitorizaciónEl método de monitorización estándar de la PIC es la colocación de un catéter en el interior del sistema ventricular. Este sistema permite, además, tratar el aumento de aquella drenando LCR. Sin embargo, existen en el mercado múltiples dispositivos, dependiendo de su ubicación intracraneal y del tipo de transductor de presión que utilicen (acoplados a fluidos o no acoplados, como la fibra óptica)4,5,10-14.
Localización de la monitorización- 1.
Intraventricular: es el patrón oro, ya que permite tratar la HIC y es el método más sencillo y más barato. Se coloca a través de un trépano precoronal preferentemente en el hemisferio con más lesiones radiológicas, pues puede existir un gradiente de presiones interhemisférico. Su principal problema es la infección, especialmente en aquellos catéteres que se mantiene más de 5 días (2-22%), por lo que es conveniente tunelizarlo lo más alejado posible de la incisión para minimizar este riesgo15. Actualmente, no se recomienda la profilaxis antibiótica en su colocación, por lo que se resulta fundamental una estricta asepsia en dicho procedimiento. Otros problemas derivados de este sistema son la hemorragia en el trayecto (1-6%) y la obstrucción del mismo, principalmente si existe hemorragia intraventricular asociada. En algunas ocasiones, debido a colapso o desplazamiento ventricular, puede resultar imposible su colocación necesitando recurrir a otra localización diferente.
- 2.
Intraparenquimatoso: puede colocarse a la cabecera del paciente en la propia Unidad de Críticos, a diferencia del resto de los sistemas. Además, algunos de estos dispositivos pueden ofrecer más datos que la PIC, como la temperatura cerebral. Su inserción es muy similar al intraventricular y, aunque tiene menores complicaciones que este, no permite drenar LCR y una vez implantado conviene recalibrarlo las menos veces posibles para evitar daño en su fibra óptica16.
- 3.
Subaracnoideo: reduce el riesgo de sangrado al no penetrar en el parénquima pero presenta muchos artefactos en las lecturas que ofrece, por lo que actualmente se ha abandonado su uso.
- 4.
Subdural: generalmente, se coloca tras la evacuación quirúrgica de las lesiones con efecto masa, incluso dentro del propio lecho quirúrgico para control postoperatorio. Tiende a infravalorar la PIC real.
- 5.
Epidural: es muy poco invasivo pero suele sobreestimar los valores absolutos de la PIC, por lo que puede llevarnos a iatrogenia al tratar situaciones de HIC falsas17.
- 6.
Lumbar: de colocación sencilla a través de una punción lumbar. Deben emplearse dispositivos que eviten la pérdida asociada de LCR. En aquellas situaciones en las que el flujo de LCR se encuentra interrumpido entre los ventrículos laterales y la cisterna lumbar, no es fiable su registro.
La indicación más clara de monitorización de la PIC la encontramos en el traumatismo craneoencefálico (TCE) grave («escala de coma de Glasgow» ≤8). Según las guías de manejo de esta entidad, los pacientes que se beneficiarían del control de la PIC son aquellos con riesgo de presentar una HIC3-5,18, y por tanto:
- 1.
Pacientes con tomografía computarizada (TC) craneal patológica, excepto en sujetos con lesión axonal difusa ya que el riesgo de HIC en ellos es muy bajo.
- 2.
Cuando se cumplan al menos 2 de los siguientes supuestos:
- –
Edad>40 años.
- –
Descerebración unilateral o bilateral.
- –
Anomalías pupilares.
- –
Solo el 13% de los pacientes con TCE grave y una TC craneal inicial sin lesión presentará elevaciones de la PIC que precisen tratamiento. Casi siempre serán aquellos pacientes en los que la TC fue precoz (en las primeras 2 o 3h tras el traumatismo), en los que de hecho está indicado repetir la prueba de imagen dentro de las 8h siguientes.
Aquellos individuos que por razones extracraneales deban permanecer sedados o presenten situaciones potencialmente causantes de HIC (trauma abdominal cerrado que comporte hipertensión abdominal, «distrés» respiratorio grave que precise presión espiratoria final positiva (PEEP) muy elevada,…) pueden beneficiarse también de la monitorización de la PIC.
Estudio de las ondas de presión intracranealAl recoger la PIC, además del valor absoluto podemos observar su morfología y ver cómo cambios en la misma pueden alertarnos del fallo de la autorregulación. De esta manera, podemos planificar el tratamiento de la HIC antes de la aparición de lesiones irreversibles.
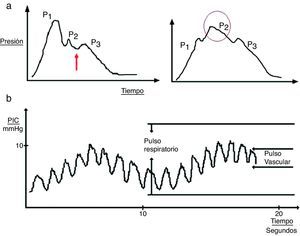
En el registro de una onda aislada de la PIC pueden distinguirse varias improntas19:
- 1.
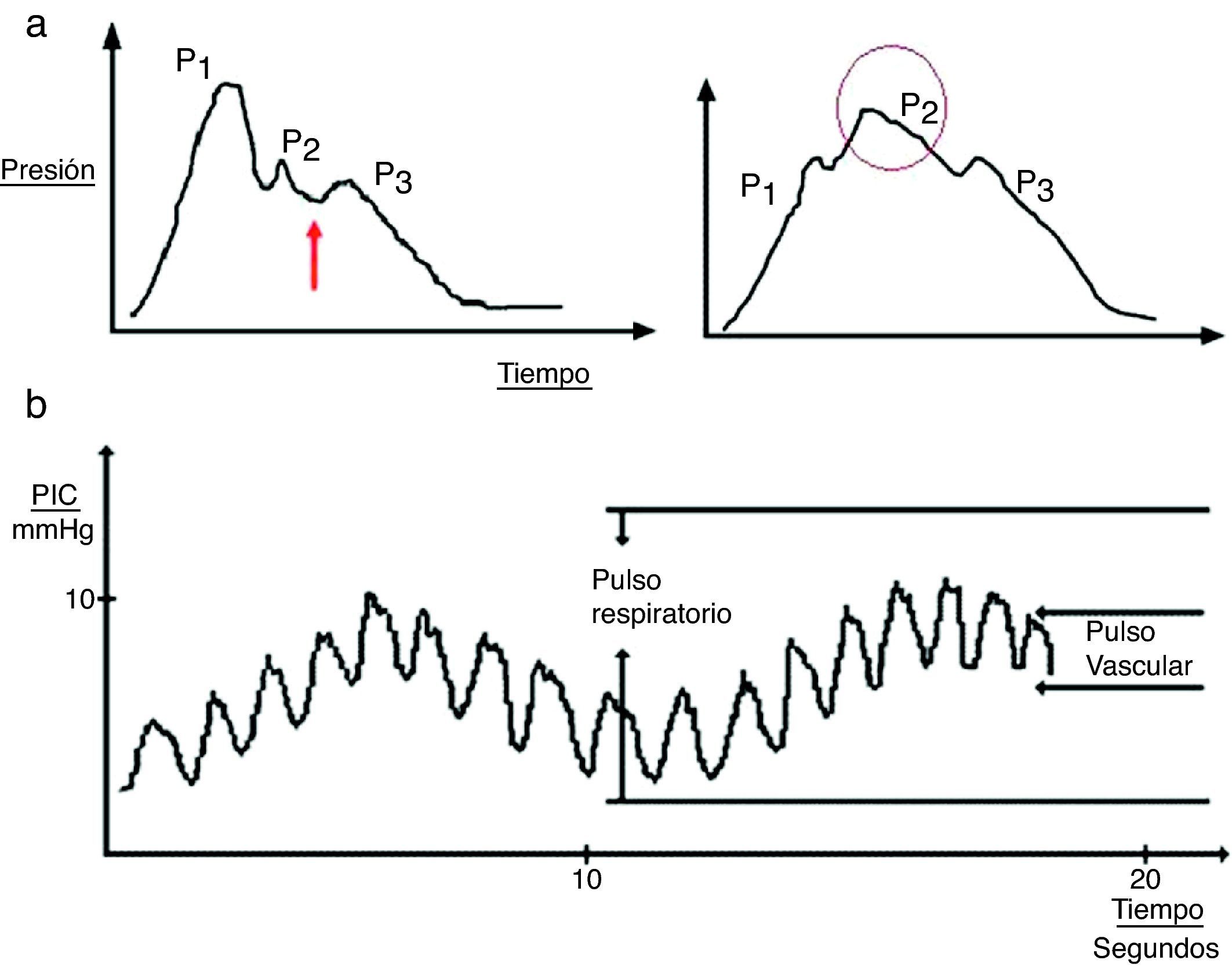
Ondas cardíacas: originadas por la transmisión del latido de los vasos cerebrales con una morfología similar a la onda del pulso arterial y tres improntas: P1 (onda de percusión), P2 (onda de Tidal) y P3 (onda dícrota). Aunque el origen exacto de las mismas no está aclarado todavía, se presupone que P1 se debe al pulso arterial sobre los plexos coroideos y refleja el flujo cerebral, mientras que P2 y P3 se deben al latido venoso retrógrado de las venas yugulares sobre las venas corticales; entre ellas se sitúa la hendidura dícrota del pulso. El cambio en la morfología de la segunda onda (P2) puede predecir el fracaso de los sistemas de autorregulación cerebral y ser, por tanto, un indicador precoz de HIC (fig. 3a).
Figura 3.a) Detalle de la onda cardíaca de la presión intracraneal (PIC). En la gráfica de la izquierda se puede observar un registro no patológico; la flecha indica la hendidura dícrota. En la gráfica de la derecha destaca cómo la onda P2 se acentúa en situaciones de baja distensibilidad. b) Patrón ondulatorio de la onda de PIC.
(0.16MB). - 2.
Ondas respiratorias: confieren el modelo sinusoidal al registro (fig. 3b).
Lundberg fue el primero en describir el cambio en la morfología del registro de PIC en su conjunto. Así, observó 3 patrones distintos20,21:
- 1.
Ondas A o en «plateau»: elevaciones de PIC mantenidas en el tiempo (5-20min) de gran amplitud (50-100mmHg). Aunque se pueden observar en el sujeto sano asintomático, su aparición en el registro de forma mantenida compromete la PPC y provoca isquemia global hasta la muerte encefálica. Suelen acompañarse de signos clínicos de sufrimiento a la exploración.
- 2.
Ondas B: de amplitud entre 20-50mmHg y 1-2min de duración. Pueden progresar a ondas A y se relacionan con las variaciones del FSC fisiológico o patológico.
- 3.
Ondas C: no son ondas patológicas. Con una amplitud menor de 20mmHg y duración inferior a 5min. Son consecuencia de la transmisión de las ondas de la presión arterial.
Los valores absolutos de la PIC, para un paciente adulto, oscilan entre los 5 y los 15mmHg, con una presión media de 12mmHg. Cuando los valores superan los 20mmHg se considera HIC. No ha de olvidarse que existen situaciones fisiológicas de HIC, como la fase de sueño REM o cualquier maniobra de Valsalva (toser, estornudar, defecar…). En los pacientes intubados también podemos encontrar causas extracraneales de aumento de la PIC: fiebre, compresión venosa (en la región yugular por la postura de la cabeza, en el tórax por PEEP elevadas o neumotórax, en el abdomen por un síndrome compartimental), retención de CO2 y otras.
El objetivo del manejo del paciente con HIC-edema cerebral es asegurar una PIC inferior a 20mmHg y una PPC por encima de 60mmHg. Por debajo de estas cifras de PPC aumentan los fenómenos isquémicos y por encima se favorece el edema cerebral al incrementarse la presión hidrostática3-5. Para luchar contra la HIC, distinguimos desde un punto de vista terapéutico, medidas de primer y de segundo nivel22:
Medidas de primer nivel- 1.
Favorecer el retorno venoso yugular:
- –
Posición neutra de la cabeza, con el cabecero elevado 30°. Si es una mujer embarazada, la postura correcta es en decúbito lateral izquierdo.
- –
Disminuir la presión abdominal mediante relajantes musculares, laxantes o descompresión si se sospecha hipertensión abdominal.
- –
Disminuir la presión intratorácica, sobre todo en aquellos pacientes que precisen una PEEP elevada.
- –
- 2.
Disminuir el consumo metabólico cerebral:
- –
Sedación.
- –
Analgesia.
- –
Normotermia.
- –
- 3.
Mejorar la oxigenación cerebral:
- –
Hiperventilación moderada con presión de dióxido de carbono (pCO2) entre 25-30mmHg y teniendo en cuenta que la hiperventilación intensa (pCO2≤25mmHg) está contraindicada en las primeras 24h.
- –
Saturación de oxígeno mayor del 90% y presión de oxígeno mayor de 80mmHg.
- –
Normoperfusión: presión arterial sistólica mayor de 90mmHg, hematocrito entre 30-33% y hemoglobina entre 8-10g/dl.
- –
- 4.
Disminuir el edema cerebral:
- –
Monitorización de la PIC a través de un drenaje ventricular externo, si es posible, pues el drenaje de LCR es eficaz para disminuir la PIC.
- –
Osmoterapia: bien con manitol al 20% o con suero salino hipertónico (al 3%, al 7,2%, al 20% o al 23,4%). Deben administrarse en bolos intermitentes de 20 min de duración, cada 4h, con un máximo de un litro al día y ha de mantenerse la osmolalidad plasmática por debajo de 320 mOsm/kg y la concentración de Na+ plasmático inferior a 155 mEq/l.
- –
- 5.
Profilaxis anticonvulsiva:
- –
Es recomendable, pues durante las crisis existe un aumento de la PIC y de la demanda de oxígeno tisular. Además, muchas de ellas son subclínicas.
- –
- 6.
Repetir la TC craneal:
- –
Para descartar aumento y/o aparición de nuevas lesiones intracraneales que precisen evacuación quirúrgica, así como la aparición de edema cerebral masivo («swelling» cerebral).
- –
Cuando la PIC es refractaria a los tratamientos anteriores y persisten cifras superiores a 20mmHg, deben aplicarse las medidas de segundo nivel: hiperventilación intensa, hipotermia moderada, coma barbitúrico o craniectomía descompresiva.
Limitaciones del registro de la presión intracranealEn los estudios realizados por Sahuquillo et al.23 se demuestra la existencia de gradientes de PIC entre los hemisferios cerebrales, aunque los análisis de la PPC no demostraron diferencias estadísticamente significativas. Por ello, es recomendable monitorizar la PIC en el hemisferio ipsolateral a la lesión o al conjunto de lesiones de mayor volumen24.
Las lesiones temporales, sobre todo aquellas situaciones de estallido del lóbulo temporal (contusión cerebral con hemorragia subaracnoidea y/o hematoma subdural asociado), necesitan seguimiento con pruebas diarias de imagen, pues puede desarrollarse una herniación uncal sin elevación previa de la PIC.
Por otro lado, las lesiones en la fosa posterior no pueden monitorizarse con un registro de PIC y, además, el sobredrenaje de LCR a través de un catéter intraventricular en estos casos puede desembocar en una herniación transtentorial invertida.
En pacientes en los que se sospecha una hemorragia cerebral por aneurisma o malformación arteriovenosa, está contraindicado mantener la PIC extremadamente baja pues lo que conseguiríamos es favorecer un hipotético resangrado de la lesión vascular, aunque esta circunstancia no puede considerarse una limitación per se del registro de la PIC.
Finalmente, cabe decir que la información obtenida de los registros de la PIC proporciona una visión global de la situación intracraneal que ha de completarse con información específica sobre la oxigenación cerebral y la situación metabólica, tanto en territorios sanos como patológicos.
Ayudas a la monitorización de la presión intracranealOtro parámetro que complementa la monitorización de la PIC y nos ayuda a optimizar el tratamiento de estos pacientes es la presión tisular de oxígeno (ptiO2). Es una medida local que nos orienta sobre la hipoxia tisular en una región determinada del cerebro. Los valores normales de la ptiO2 en la sustancia blanca cerebral oscilan entre 20-30mmHg. Por encima de 30mmHg consideramos que existe hiperemia. Por el contrario, valores entre 15 y 10mmHg indican hipoxia tisular moderada y por debajo de 10mmHg, hipoxia tisular grave y necesidad de actuación25. Estos valores son solo significativos si se mantienen en el tiempo, habitualmente durante más de 30 min. La ptiO2 está sustituyendo a la saturación yugular de oxígeno a la hora de valorar la hipoxia cerebral pues al tratarse esta última de una medida global, a diferencia de la ptiO2, puede llevarnos a interpretaciones erróneas.
El sensor de ptiO2 debemos colocarlo en la sustancia blanca cerebral, bien en el área penumbra (región perilesional con isquemia secundaria pero potencialmente recuperable si se resuelve la situación de isquemia) o en el parénquima aparentemente normal, pues debido a que esta medida es puramente local, debemos elegir cuál es nuestra región cerebral a monitorizar y cerciorarnos con una TC craneal posterior de la ubicación del dispositivo.
La información que proporciona el sensor de ptiO2 es fiable a partir de los 30-40 min de su colocación, pero debe acompañarse del dato de la temperatura tisular, pues aumentos de 1°C provocan un aumento de la extracción de oxígeno del 8 al 12%26.
ConclusionesEl tratamiento de la HIC requiere de un conocimiento profundo de la fisiopatología cerebral y de la monitorización de la PIC. Errores en la medición de la misma pueden llevar a consecuencias indeseables de causa iatrogénica. El adecuado registro de la PIC es fundamental para diagnosticar esta HIC y, lo que resulta aún más importante, poder instaurar un tratamiento adecuado a tiempo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.