La enfermedad de Parkinson (EP) se caracteriza por una serie de deficiencias motoras que son tratadas comúnmente con L-DOPA; sin embargo, tras un uso crónico se desarrollan disquinesias inducidas por L-DOPA (DIL). Por otra parte, el origen de las DIL no está del todo claro, pero se asocia con alteración en receptores dopaminérgicos, donde los receptores D2 (RD2) han sido poco estudiados. El presente trabajo buscó: 1)desarrollar y estandarizar un modelo experimental de disquinesia con L-DOPA en ratas hemiparkinsonizadas, y 2)evaluar la correlación entre la expresión del RD2 y la manifestación de movimientos involuntarios anormales (MIA). Se utilizaron 21 ratas Wistar macho asignadas a 3 grupos: control intacto, lesionados (con la neurotoxina 6-OHDA) y lesionados disquinéticos (inyectados con L-DOPA durante 19días). Los reactivos biológicos se sometieron a pruebas comportamentales para evaluar el deterioro sensoriomotor. Los animales del grupo disquinético desarrollaron de forma gradual MIA durante el tratamiento, siendo mayores los MIA de miembro anterior y menores los de tipo locomotor (p<0,05). Todos los MIA fueron significativamente evidentes a partir del día 5 y se mantuvieron hasta el último día de inyección. Además, se pudo evidenciar incremento en la densidad del RD2 en el estriado y el cerebro anterior medial en los grupos lesionados con respecto al control, así como también una posible asociación entre la expresión del RD2 y MIA de tipo locomotor. Por lo que concluimos que el RD2 está implicado en el fenómeno disquinético generado con la L-DOPA.
Parkinson's disease (PD) is characterised by motor alterations, which are commonly treated with L-DOPA. However, long-term L-DOPA use may cause dyskinesia. Although the pathogenic mechanism of L-DOPA-induced dyskinesia is unclear, the condition has been associated with alterations in dopamine receptors, among which D2 receptors (D2R) have received little attention. This study aims to: (i)develop and standardise an experimental model of L-DOPA-induced dyskinesia in rats with hemiparkinsonism; and (ii)evaluate the correlation between D2R expression and presence of abnormal involuntary movements (AIM). We allocated 21 male Wistar rats into 3 groups: intact controls, lesioned rats (with neurotoxin 6-OHDA), and dyskinetic rats (injected with L-DOPA for 19 days). Sensorimotor impairment was assessed with behavioural tests. Dyskinetic rats gradually developed AIMs during the treatment period; front leg AIMs were more severe and locomotor AIMs less severe (P<.05). All AIMs were significantly evident from day 5 and persisted until the last day of injection. D2R density was greater in the striatum and the medial anterior brain of the lesioned and dyskinetic rats than in those of controls. Our results suggest an association between D2R expression and locomotor AIMs. We conclude that RD2 is involved in L-DOPA-induced dyskinesia.
La enfermedad de Parkinson (EP) es la segunda enfermedad neurodegenerativa más frecuente1. La levodopa constituye el tratamiento sintomático más eficaz, aunque con un uso prolongado de este medicamento se suelen presentar movimientos involuntarios anormales conocidos como disquinesias inducidas por L-DOPA (DIL)2. Ahora bien, para el estudio de las DIL se hace necesaria la construcción de modelos experimentales. En el caso de la DIL en EP, los modelos requieren la pérdida de dopamina nigroestriatal, la cual es obtenida usando neurotoxinas específicas como la 6-hidroxidopamina (6-OHDA) y la 1-methyl-4-phenyl-1,2,3,6-tetrahidropiridina (MPTP; éstas han sido comúnmente usadas en roedores3 y primates no humanos, respectivamente. Las DIL son inducidas mediante la administración de L-DOPA mimetizando la situación en humanos4-6.
Con respecto al origen de las DIL, se ha postulado que tras la EP se presenta sensibilización en los receptores dopaminérgicos D1 y D2; no obstante, las DIL han sido más asociadas con los receptores dopaminérgicos D1, en tanto que poco se conoce de la participación de los receptores D2 (RD2)7. A este respecto, Silvan8 plantea que solo la coactivación de ambos receptores puede producir el movimiento normal. También se ha sugerido que los RD2, al poseer localización presináptica, estarían implicados en mecanismos más complejos, que ciertamente condicionarían las intervenciones antidisquinéticas9,10. Por lo tanto, si se mejora la señalización de los D2R, teóricamente las DIL disminuirán11.
Por todo lo anterior, y puesto que el RD2 ha sido poco estudiado en relación con el tratamiento con L-DOPA, resulta necesario darle un enfoque mayor a este tipo de receptores por su posible asociación con el fenómeno disquinético. En este orden de ideas, evaluamos el papel de la L-DOPA en la expresión de RD2 en animales disquinéticos y la correlación entre la densidad de DR2 con la manifestación de movimientos involuntarios anormales (MIA).
Materiales y métodosAnimalesSe utilizaron 21 ratas Wistar macho con un peso corporal de 250 a 350g y de 12 a 16semanas de edad. Los animales se mantuvieron en el Bioterio de Experimentación Animal de la Universidad del Tolima. Los experimentos fueron aprobados por el Comité de Ética de la Universidad del Tolima y cumplieron con las normas dictadas por el National Institute of Health Guide for the Care and Use of Laboratory Animals (NIH Publications No. 80-23)
Diseño experimentalLos animales fueron divididos de forma aleatoria en tres grupos experimentales de 7 animales cada uno: control intacto, lesionados con 6-OHDA y disquinéticos (lesionados con 6-OHDA y posterior tratamiento de L-DOPA/benserazida) (Sigma-Aldrich®). La lesión unilateral con 6-OHDA se realizó en el hemisferio derecho sobre la substancia nigra pars compacta (SNpc). Un mes después de realizada la lesión, los animales recibieron una inyección subcutánea (0,5mg/kg) de apomorfina (Sigma-Aldrich®).
Posteriormente, los animales del grupo disquinético fueron tratados con un conjugado de L-DOPA (Sigma-Aldrich®) y el inhibidor periferal de la L-DOPA descarboxilasa benserazida12 (Sigma-Aldrich®) (6 y 12mg/kg. respectivamente, por vía intraperitoneal [i.p.]). Ambos medicamentos fueron disueltos en solución salina fisiológica e inyectados diariamente i.p. Todos los procedimientos de tipo comportamental fueron llevados a cabo en horas de la mañana (9:00-11:00h). El equipo de investigación se dividió en tres grupos. El primer grupo realizó las cirugías y asignó el número a cada unidad experimental de forma aleatoria. El segundo grupo realizó las pruebas comportamentales y el tercer grupo las pruebas morfológicas. El análisis final se realizó de acuerdo con la información suministrada por el primer grupo, de la distribución a las unidades experimentales.
Procedimientos quirúrgicosLas ratas fueron anestesiadas con un coctel de ketamina (90mg/kg) y xilacina (10mg/kg i.p) y se colocaron en un aparato estereotáxico, en el que recibieron mediante jeringuilla Hamilton 3μl de 6-OHDA por cada animal a razón de 1μl/min. La lesión se realizó en las coordenadas: AP≥−4,4; ML≥1,2; DV=−7,813.
Evaluaciones conductualesConducta de rotación inducida por apomorfina.La prueba de rotación inducida por agonistas dopaminérgicos es una prueba decisiva para evaluar la eficacia de la lesión que pocos modelos de enfermedades neurodegenerativas tienen14. Un mes después de la lesión con 6-OHDA se midió la actividad rotatoria inducida por apomorfina para determinar el grado de la lesión. Las ratas fueron colocadas en baldes circulares después de la inyección de la apomorfina durante 20min, tiempo en el que se contabilizó el número de vueltas contralaterales a la lesión. Los animales debían rotar 140 vueltas contralaterales a la lesión durante los 20min, rotación que se corresponde con una pérdida neuronal del 80% en el hemisferio lesionado demostrado en estudios previos15.
Test neurológico y Pole testSe evaluaron alteraciones sensoriomotoras tras la lesión con la 6-OHDA durante el procedimiento de estereotaxia, evaluando reflejos de corrección de postura, reflejo de flexión-retracción de extremidades, reacción de apoyo y localización visual, así como la prueba de Pole test, para evaluar corrección de postura, uso de extremidades y tiempo de descenso de un tubo de 60cm de largo por 3cm16. Todas las pruebas se ajustaron a una escala cuantitativa para su análisis.
Evaluación de los movimientos involuntarios anormalesLa disquinesia fue evaluada mediante la escala de MIA propuesta por Cenci et al.4. Los animales fueron grabados durante una hora en una caja de acrílico circular transparente de 50×30cm. Para el estudio se tuvieron en cuenta: a)disquinesias orofaciales: movimientos en el eje vertical de la mandíbula (apertura y cierre) con ligera desviación hacia el lado contralateral a la lesión, movimientos masticatorios vacíos y protrusión de la lengua; b)disquinesias de extremidades anteriores: movimientos de la extremidad contralateral al lado lesionado de naturaleza coreica o bálica, en sacudidas; c)disquinesias axiales: desviación lateral de la cabeza, cuello y tronco hacia al lado contralateral a la lesión, postura torcida mantenida del tronco y extremidades, y d)disquinesias locomotoras: conducta locomotora circular en dirección al lado contralateral a la lesión7. La severidad de los 4 subtipos de MIA se evaluó mediante las puntuaciones de 0 a 4, siendo: 0 ausente; 1 ocasional: presente menos de 50% del tiempo; 2 frecuente: más de 50% del tiempo; 3 continua, pero interrumpido por un fuerte estímulo sensorial; y 4 continuo, no interrumpido por fuertes estímulos sensoriales17-19.
Preparación del tejido cerebral e inmunofluorescenciaAl concluir los tratamientos y evaluaciones comportamentales las ratas fueron anestesiadas con una sobredosis de pentobarbital (50mg/kg, i.p) y perfundidas mediante el método de gravedad utilizando solución salina 0,9% y paraformaldehído al 4%. Los cerebros recibieron un tratamiento de deshidratación con sacarosa y cortados a 50μm de grosor en los bregmas −0,96; −1,8; −3,72 y −4,6813 utilizando micrótomo de congelación KEDGE 33-58.
Los cortes se analizaron en estriado, cerebro anterior medial (CAM) y SNpc para observar diferencias de inmunorreactividad en los distintos grupos. Los procedimientos de inmunofluorescencia fueron realizados en placa, colocando 4 cortes por placa, correspondientes a cada animal y a cada bregma, con dos réplicas por animal. El procedimiento de inmunofluorescencia se realizó utilizando anticuerpos primarios para tirosina hidroxilasa (1:500; Sigma-Aldrich, EE.UU) y receptor dopaminérgico D2 (1:800; Abcam, 2015), posteriormente se realizó incubación con anticuerpos secundarios Alexa fluor 488 anti rabbit policlonal (1:500; Invitrogen, 2015) y Alexa fluor 594 anti mouse (1:500; Invitrogen, 2015), respectivamente; posteriormente a esto se incubó con DAPI (1:2000; Invitrogen, 2014) y se aplicó una gota de Fluoromount® en las placas para su posterior visualización en el Floid Cell Imaging Station del Laboratorio de Biotecnología Aplicada de la Universidad del Tolima. El conteo celular se realizó mediante el programa Fiji-ImajeJ (versión 2017).
Análisis estadísticoSe evaluaron la distribución normal y la homogeneidad de varianzas de los datos por medio de las pruebas de Kolmogorov-Smirnov y de Bartlett, respectivamente. Para la evaluación de la rotación inducida por agonista dopaminérgico y la densidad de neuronas TH+ o D2+, así como la prueba de Pole test, se realizó un análisis de varianza de ANOVA y prueba post hoc de Tukey para identificar las diferencias significativas específicas entre los grupos. Sin embargo, el análisis de los MIA se realizó mediante prueba de varianza no paramétrica de Kruskal Wallis. La correlación entre los MIA según su distribución topográfica y el D2R fue realizada mediante correlación lineal y coeficiente de correlación de Pearson. Se trabajó con un nivel de significación de 0,05, y para el análisis de los datos se empleó el software InfoStat versión 2015. Los datos son presentados como X±EEM.
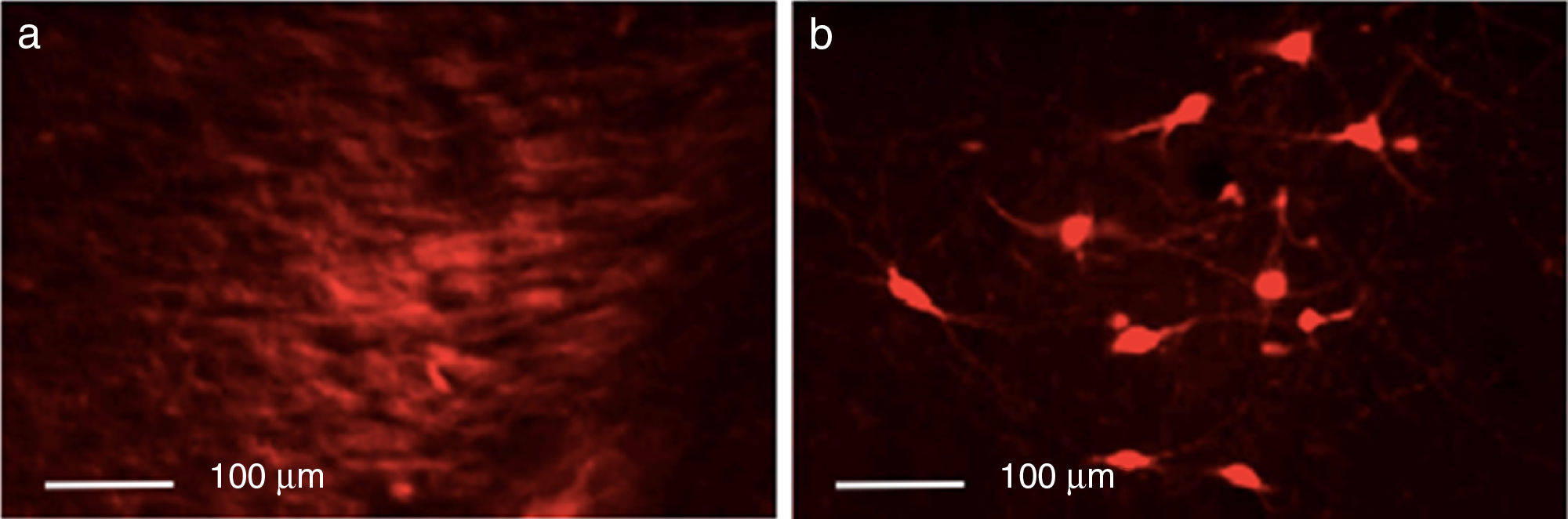
ResultadosEficacia de la lesión dopaminérgica con 6-OHDALa inyección de la neutoroxina 6-OHDA en la SNpc indujo la pérdida drástica de neuronas dopaminérgicas en el hemisferio lesionado, como se pudo evidenciar mediante inmunorreactividad al TH. El control presentó el mayor número de células inmunorreactivas a TH, x=133,25 en todas las zonas analizadas comparado con los otros grupos (p<0,05). Cabe destacar que para la SNpc la diferencia de inmunorreactividad fue importante, con medias para el control de 133,25 neuronas TH+, lesionados 29,25 y disquinéticos 23,25 (fig. 1).
Pruebas comportamentalesEvaluación de la conducta de giro inducida con apomorfinaLa prueba de ANOVA demostró una rotación de más de 7 vueltas/min en todos los animales lesionados, F=7,69 (p<0,05), aunque el análisis post hoc demostró diferencias significativas entre los animales lesionados y los animales disquinéticos, p<0,05. Mientras los animales lesionados dieron 7,57 vueltas/min, los animales disquinéticos ejecutaron 16,46 vueltas/min, respectivamente.
Test neurológico y Pole testEn estas pruebas se pudo evidenciar alteración sensoriomotora con mayor tendencia en los reflejos del lado contralateral a la lesión y tren posterior, El grupo disquinético presentó fallas más acentuadas en los miembros contralaterales a la lesión. Por otra parte, en la prueba Pole test tanto el grupo lesionado como el disquinético presentaron latencias de descenso superiores comparadas con el grupo control, siendo más caóticas en el grupo disquinético (p<0,05). De la misma forma, el grupo disquinético fue el que presentó el mayor número de errores (p<0,05), F=14,33, por mal uso/no uso de las extremidades y la cola.
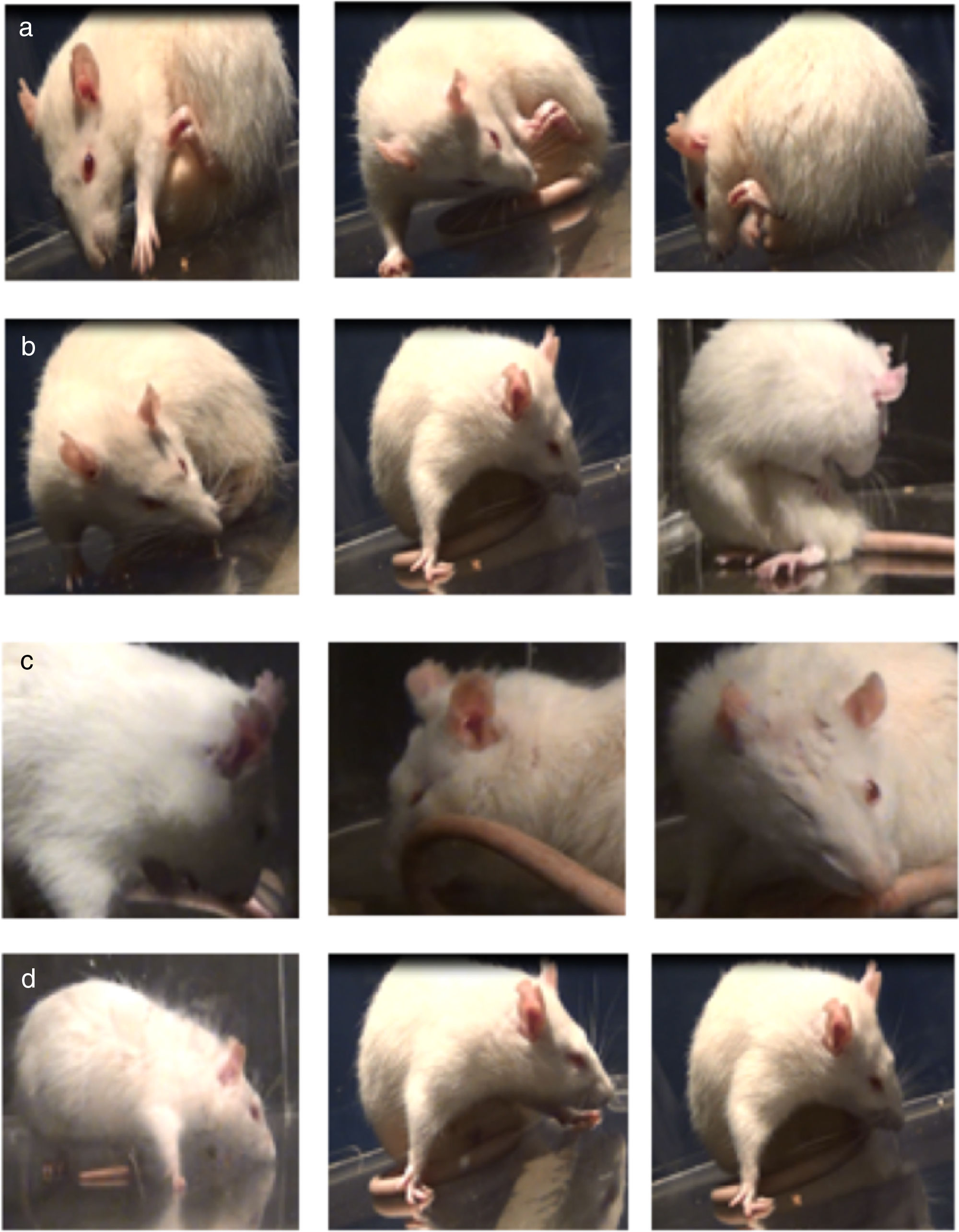
Prueba de movimientos involuntarios anormalesEl tratamiento crónico con L-DOPA indujo gradualmente el desarrollo de MIA en las ratas lesionadas. Todos los animales que desarrollaron disquinesias presentaron los 4 tipos de MIA, aunque con gran variabilidad en la severidad. En la figura 2 se pueden observar los MIA según la distribución topográfica.
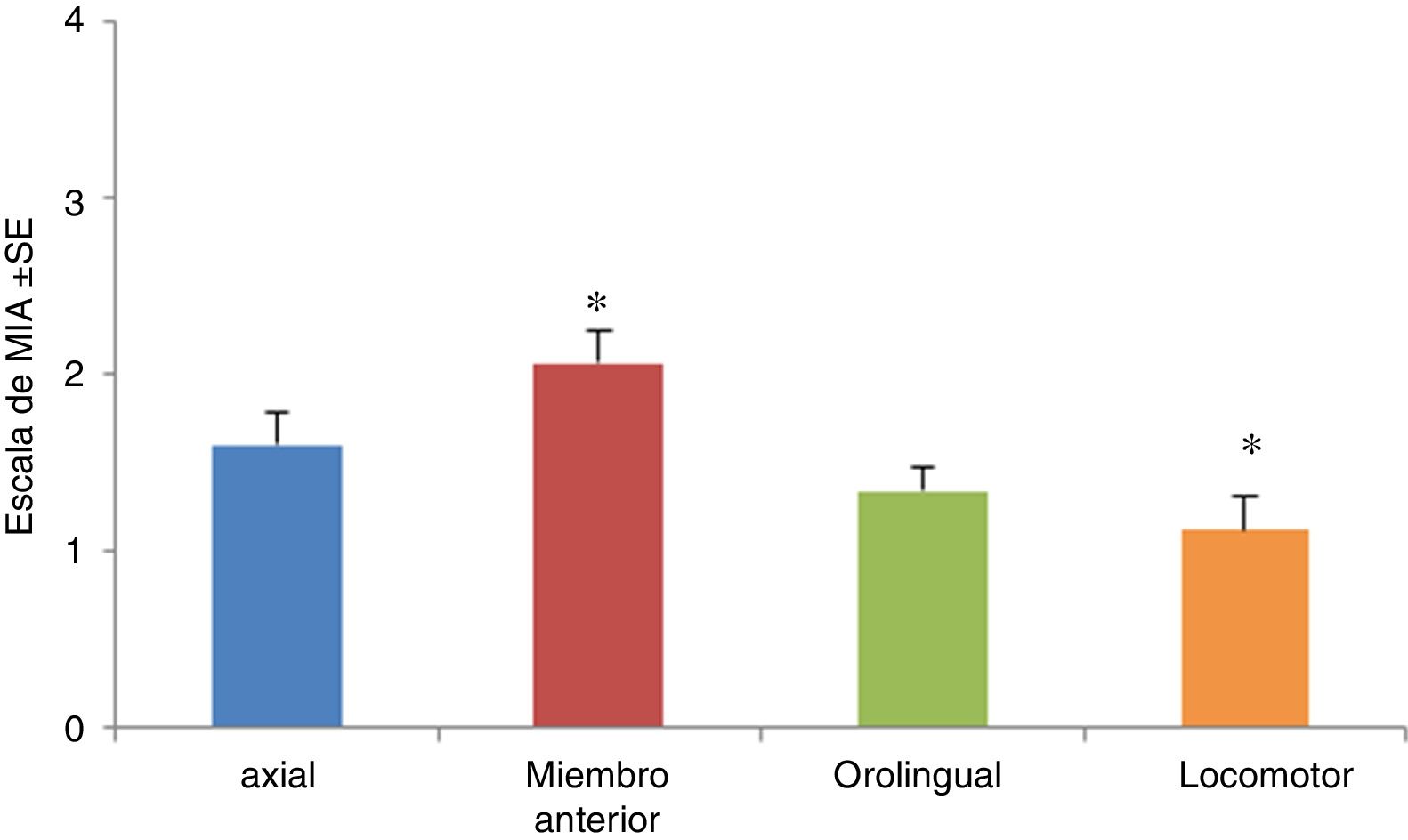
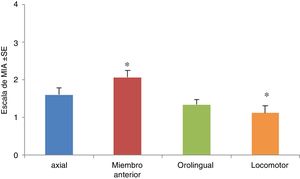
La manifestación de MIA fue máxima entre los 20 y 60min después de inyectada la L-DOPA. Todos los MIA fueron significativamente evidentes a partir del día5 y se estabilizaron alrededor del día11. Cabe destacar que una vez aparecieron los MIA, la severidad de los mismos fue mantenida hasta el último día de inyección. Cuando se analizaron los MIA, la prueba no paramétrica de Kruskal-Wallis, H=23,82, se observó solo diferencia significativa en los MIA de tipo locomotor y miembros anteriores, p=0,0001, obteniéndose una x=1,12 en los MIA de tipo locomotor y una mayor frecuencia en los MIA miembro anterior (x=2,06). Por su parte, los MIA de tipo orolingual y axial presentaron frecuencias igualmente altas, pero sin diferencia significativa con los otros grupos (medias 1,43 y 1,60, respectivamente) (fig. 3).
Movimientos involuntarios anormales (MIA) durante los días de tratamiento. Se muestran todos los MIA topográficos (axiales, miembro anterior, orolingual y locomotor) durante todos los días de inyección. Solo fueron significativas las diferencias entre los MIA de tipo locomotor y miembro anterior (p<0,05), H=23,82, siendo menos frecuentes los MIA de tipo locomotor, en tanto que los de miembro anterior presentaron la mayor frecuencia.
Fuente: autor.
El grupo control presentó el mayor número de neuronas TH+ en todas las zonas (p<0,05). En cuanto al estriado, todos los grupos se comportaron de manera diferente (p<0,05, F=39,18); la media mayor fue para el control, con 55,25 neuronas TH+, comparadas con 7,75 para el lesionado y 24,00 para el grupo disquinético. En el CAM y en la SNpc solamente el control presentó diferencias significativas con los otros grupos (p<0,05, F=71,82 y F=143,11, respectivamente). En el CAM el control presentó la mayor media, con 62,50 neuronas TH+, en tanto que el lesionado presentó 11,75 y el grupo disquinético, 20,00. Por su parte, la SNpc fue la que presentó el mayor número de neuronas TH+ en todos los grupos; el control presentó el mayor número de neuronas TH+, con 133,25 neuronas; el lesionado, 23,25, y el grupo disquinético, 29,25 (fig. 4).
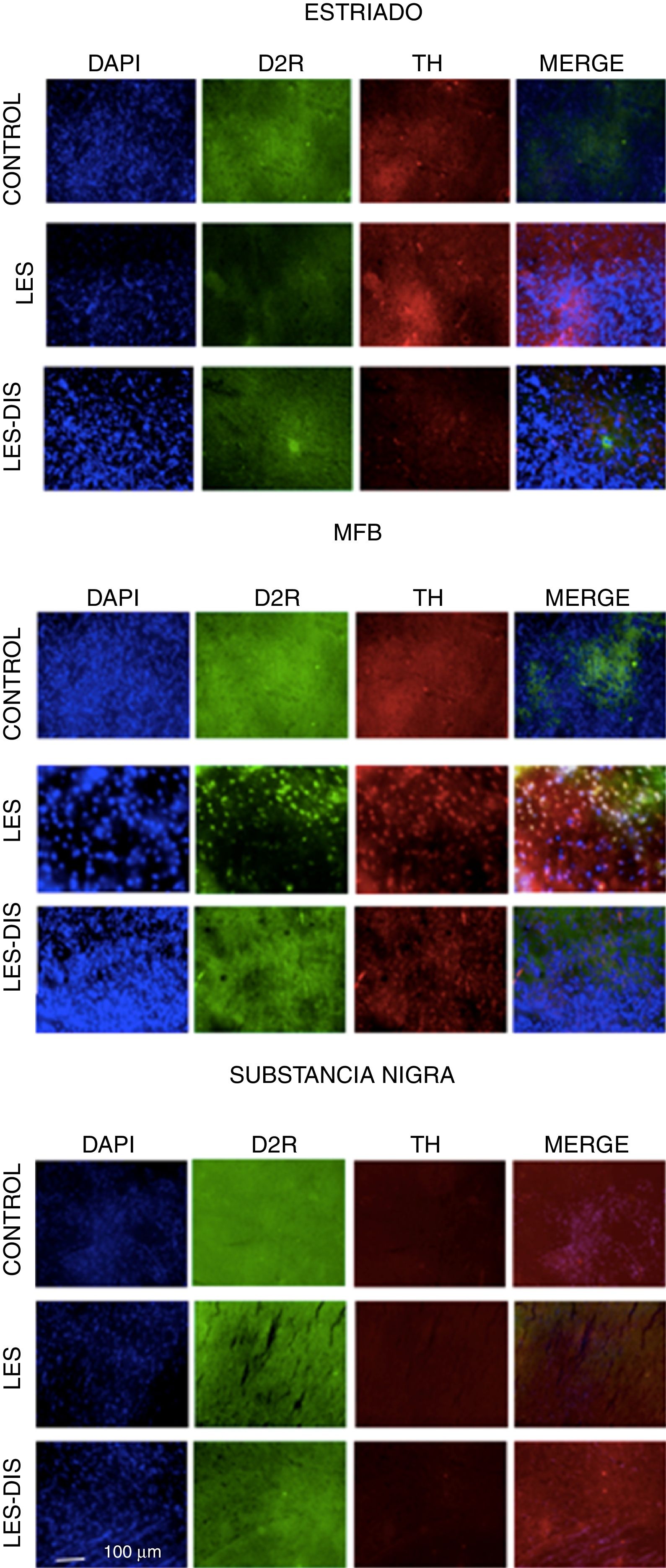
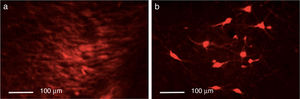
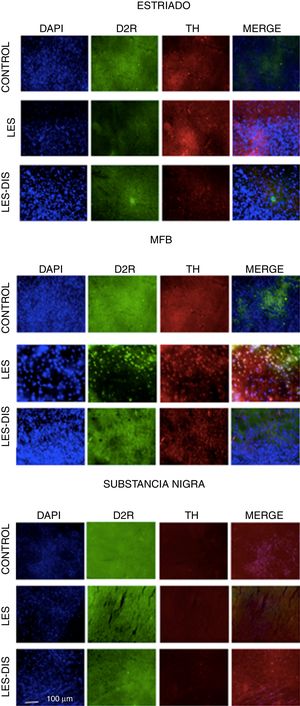
Inmunofluorescencia de triple marcaje para DAPI, TH y receptor dopaminérgico D2 en a) estriado, b) MFB y c) substancia nigra en los grupos tratados. Se puede evidenciar la mayor densidad celular en el estriado y MFB. Las flechas blancas indican la reactividad a los tres marcajes (DAPI+, TH+ D2+). Las fotos fueron tomadas a una escala de 1:100μm.
Fuente: autor.
En el estriado y en el CAM todos los grupos se comportaron de manera distinta. En la prueba de Tukey se demostró una diferencia significativa entre los tres grupos; en cuanto a la distribución del RD2 en el estriado, el grupo control presentó menor cantidad de RD2, x=110, seguido del grupo lesionado, x=139, y presentando el grupo disquinético la mayor cantidad de RD2, x=241. Con respecto al CAM, las medias fueron de 269, 116 y 128, respectivamente, revelando solo una diferencia significativa del grupo disquinético con el resto de los grupos. Al analizar SNpc se denotó que la densidad de RD2 está disminuida con respecto a las otras áreas de estudio, y en este caso el grupo control se destacó por su mayor inmunorreactividad a RD2, x=48,5, seguido por el grupo disquinético, x=34,5, y en último lugar el grupo lesionado, x=21,5. No obstante, en esta zona no se presentaron diferencias entre los grupos (p>0,05) (fig. 4).
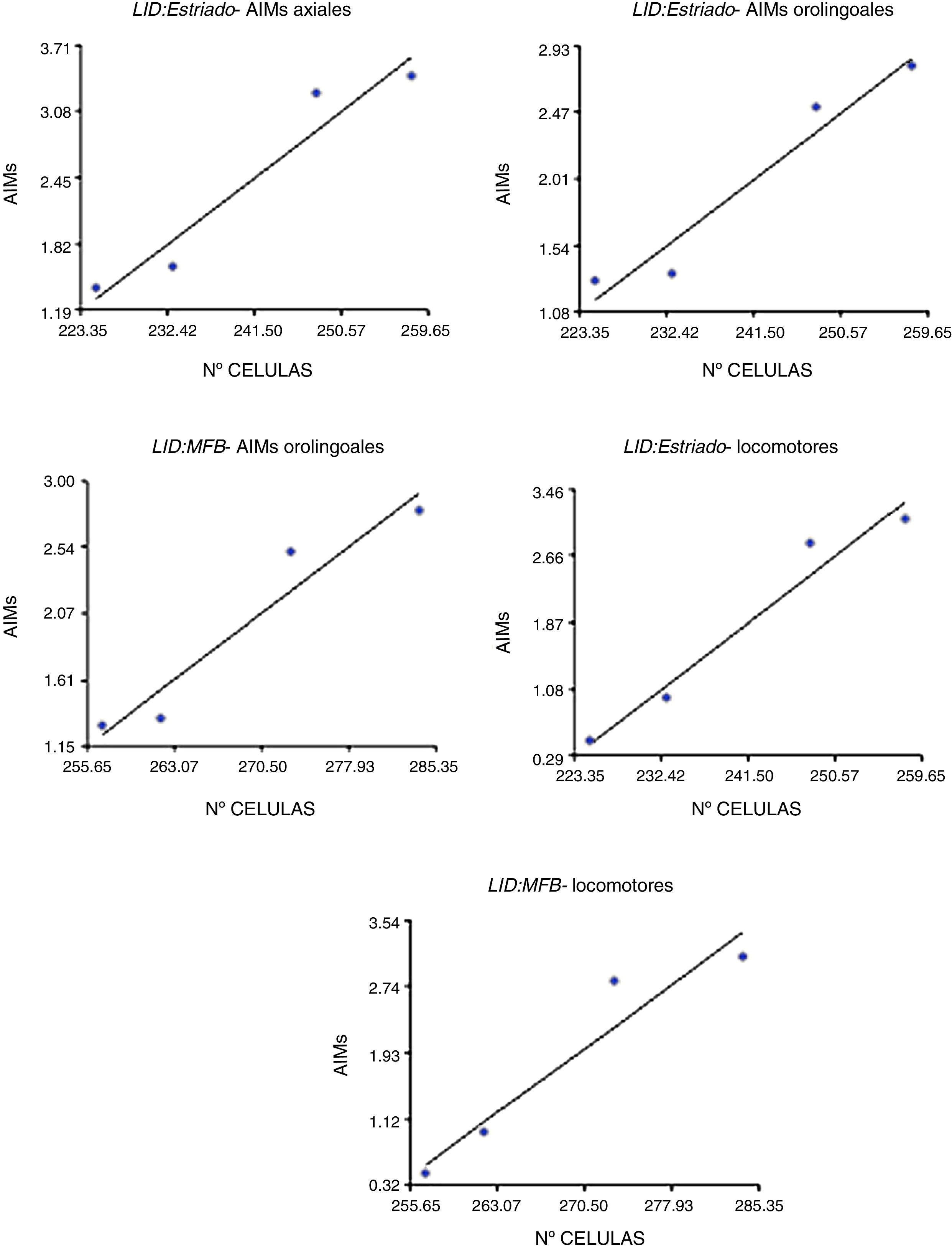
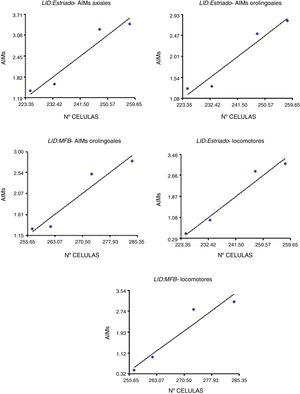
Correlación entre la expresión del receptor dopaminérgico D2 y manifestación de movimientos involuntarios anormalesLa correlación entre la expresión del RD2 y los MIA se dieron en las zonas de estriado y CAM, no siendo así en la SNpc (p<0,05) (fig. 5). Adicionalmente fueron más notorias para los MIA de tipo orolingual (R2=0,95, F=34,42 en el cuerpo estriado y R2=0,93, F=25,10 en el CAM) y locomotor (R2=0,96, F=49,04 en el cuerpo estriado y R2=0,92, F=22,36 en el CAM), en tanto que los MIA axiales se correlacionaron solamente en el cuerpo estriado (R2=0,93, F=27,70). Por su parte, los MIA de miembro anterior no presentaron ningún tipo de correlación en las zonas de estudio (p>0,05, F=16,83).
DiscusiónLa EP es un trastorno neurodegenerativo con amplio espectro de características clínicas que se presenta debido a la degeneración de las neuronas dopaminérgicas localizadas en la SNpc, lo que conduce a una serie de deficiencias motoras. La levodopa es el más efectivo tratamiento para la enfermedad actualmente disponible y mejora notablemente los síntomas; sin embargo, tras 5años de tratamiento aproximadamente el 40% de los pacientes desarrollan fluctuaciones motoras conocidas como disquinesias inducidas por L-DOPA (DIL)20. En este punto es importante recalcar que no es bien conocido el papel que tiene la L-DOPA en la generación de disquinesias, para lo cual se hace indispensable la construcción de modelos experimentales que reproduzcan las características principales de la enfermedad y las DIL21. Para esta instancia se generó un modelo con 6-OHDA y tratamiento crónico con L-DOPA en ratas. La lesión dopaminérgica fue comprobada mediante la actividad rotatoria inducida por apomorfina. Se utilizó la apomorfina por considerarse un mejor predictor de lesiones producidas con 6-OHDA, y estudios previos han demostrado que es necesaria una pérdida de por lo menos el 90% de las neuronas dopaminérgicas para que el animal rote con apomorfina; la habilidad de la apomorfina de predecir una lesión de más del 90% es del 100%14,22. Dentro de los grupos evaluados, se evidenció un mayor número de giros en los animales del grupo disquinético con respecto al grupo de solo lesionados, lo que puede atribuirse a cambios en la intensidad de la respuesta motora generados por la L-DOPA, puesto que esta hace que aumente después de un tratamiento crónico. Esta variación en la respuesta a la administración crónica de levodopa se conoce como sensibilización7, la cual implica un cambio ante la exposición exógena del neurotransmisor, puesto que se induce un estado no fisiológico23.
Por otra parte, y teniendo en cuenta que las pruebas que evalúan la conducta de giro con apomorfina no resultan suficientes para medir el grado de déficit motor en animales lesionados24, en las pruebas de test neurológico y Pole test se pudo evidenciar la disminución de habilidades motoras, siendo peor el desempeño de los grupos lesionados y disquinéticos con respecto al control; los errores se resumieron en mala integración de los movimientos necesarios para la realización de la actividad, desde la posición de la cabeza y la dirección de la mirada hasta la simetría corporal y utilización de extremidades y cola16, actividad que depende de áreas de asociación en la corteza motora2. Cabe destacar que el desacierto en la ejecución de las pruebas fue sobre todo en los miembros contralaterales a la lesión y tren posterior; posiblemente el suministro de L-DOPA acentúa la sensibilización de receptores en este sitio25. De esta forma se puede concluir que tanto la lesión como el tratamiento disminuyen la probabilidad de establecer un plan de ejecución motora que requiera grandes niveles de planificación y control26.
Además de la afectación sensoriomotora que genera el tratamiento con L-DOPA, la consecuencia posiblemente más notable tiene que ver con la manifestación de MIA27. Nuestros resultados muestran que la administración repetida de L-DOPA induce la aparición gradual de una serie de movimientos que afectan la cabeza, el tronco y las extremidades. En este modelo, las disquinesias se manifestaron como movimientos que aparecieron en el momento de máxima efectividad del tratamiento (pico de dosis)28, movimientos que se desarrollaron hasta aparecer en todos los animales tratados, aunque con variabilidad en cuanto a la severidad y duración.
Resulta evidente entonces que el tratamiento crónico con L-DOPA genera una serie de cambios funcionales expresados en MIA. No obstante, aun cuando podemos comprobar las consecuencias del tratamiento crónico con L-DOPA, no se conoce el mecanismo preciso que permita explicar el origen de las DIL, pero sí existe un amplio consenso acerca de que están relacionadas con estimulación no fisiológica de receptores dopaminérgicos crónicamente denervados29. Inicialmente se habían asociado más a los receptores de tipo D1 con el fenómeno disquinético, y de hecho parece ser que tras la pérdida de dopamina en la EP los primeros receptores que se afectan son los D1, en tanto que los D2 presentan una afectación posterior que trae como consecuencia dificultades en la ejecución de movimientos orientados a objetivos como hábitos30. En este sentido, y aun cuando se desconoce mucho de la función de los RD2, ya existen evidencias que involucran a dicho receptor en alteraciones del movimiento. Fabbrini et al.10 plantean que agonistas selectivos de los RD2 causan menos DIL, puesto que los RD2 ayudan a mantener un tono dopaminérgico adecuado. Sin embargo, tras una degeneración progresiva el número de terminales dopaminérgicos residuales son insuficientes para mantener niveles de dopamina adecuados; por lo tanto, la disquinesia podría ocurrir por fallas en la activación de los RD2, lo que ha sido previamente demostrado31.
Lo anterior concuerda con lo reportado por Gay y Pilar32, quienes han generado ratones knock-out para el RD2 en los que han evidenciado una actividad locomotora superior a los controles. Los ratones sin autorreceptor D2 liberan más dopamina, por síntesis alterada del neurotransmisor33. Esto sugiere que posiblemente en el modelo de estudio se generó una destrucción masiva de autorreceptores D2 tras la inyección estereotáxica de 6-OHDA en la SNpc, donde el RD2 tiene localización presináptica abundante, densidad que fue significativamente mayor en el grupo intacto con respecto a los grupos lesionado y disquinético. Es probable que la destrucción masiva en la SNpc genere una mayor liberación de dopamina estriatal por parte de las neuronas sobrevivientes, dopamina que se incrementaría con la exposición a dopamina exógena como lo es el tratamiento con L-DOPA, lo que contribuiría a la manifestación de MIA en los animales tratados. Ello permite inferir que la estimulación de los autorreceptores D2 sería la responsable de la disminución de la actividad locomotora, probablemente mediante la reducción de disparo de las neuronas dopaminérgicas y la liberación de dopamina, o posiblemente, como plantea Kehr et al.34, el RD2 modularía la síntesis de dopamina mediante su acción sobre la tirosina hidroxilasa. Debido a todo lo anterior, actualmente la investigación está dirigida a encontrar un tratamiento para la EP basado en la modulación de la transmisión dopaminérgica mediante una acción indirecta que actúe sobre el RD235.
En este estudio evaluamos la expresión del receptor en áreas de proyección de la vía nigroestriatal, y pudimos evidenciar un importante incremento en la densidad del RD2 a nivel del cuerpo estriado y CAM en los grupos lesionados y lesionados disquinéticos. Es importante mencionar que en dichas regiones el RD2 es altamente expresado36. Ahora bien, el aumento en la densidad de los receptores podría explicarse por sensibilización ante la dopamina generada tras la degeneración de la vía nigroestriatal, por lo que las neuronas aferentes del estriado se sensibilizan ante la falta de dopamina y aumentan la exteriorización de sus receptores dopaminérgicos. En consecuencia, cuanto más alta sea la concentración del RD2 mayor es la manifestación de MIA. Lo anterior da cuenta de la mayor cantidad de receptores en el estriado y CAM para el grupo disquinético con respecto a los otros dos grupos, que fue estadísticamente significativo en el cuerpo estriado pero no en el CAM.
En cuanto a la manifestación de los MIA según la distribución topográfica y su relación con la expresión del D2R, nuestros resultados concuerdan en parte a lo reportado por Pavón et al.7 respecto a que la expresión de este receptor parece estar implicada en movimientos de tipo orofacial. Según dichos autores, ratones knock-out D2 presentan alteraciones en los MIA de tipo orofacial, pero no así en los locomotores, axiales y de miembro anterior. Posiblemente este tipo de receptor permite la movilidad normal de la región oral, aunque los resultados obtenidos en el presente estudio demostraron que los MIA de tipo locomotor también presentan una correlación positiva con la expresión del receptor.
Los resultados obtenidos nos llevan a reflexionar sobre el papel y la participación de los RD2 en el desarrollo de la disquinesia, por lo que deben realizarse más investigaciones enfocadas al estudio de dicho receptor.
ConclusionesEs posible modelar en ratas hemiparkinsonizadas la disquinesia mediante tratamiento continuo con L-DOPA, tal como sucede en el humano. Este modelo resulta adecuado para el estudio de los mecanismos fisiopatológicos que subyacen en complicaciones motoras. Por otra parte, resulta evidente que la L-DOPA genera sensibilización conductual en los animales tratados, manifestado en aumento de la locomoción hacia el lado contralateral a la lesión tras la administración de apomorfina.
Así mismo, el tratamiento crónico con L-DOPA modifica la expresión del RD2, que resultó relacionarse más con MIA de tipo orofacial y locomotor, sugiriendo un importante rol de estos receptores en el control de dichos movimientos, por lo que concluimos que el RD2 está implicado en el fenómeno disquinético, tanto en la génesis como en la fisiopatología, por lo que el estudio de los receptores de dopamina es altamente importante para entender una gran cantidad de anomalías funcionales a nivel de los GB que permitan crear nuevas dianas terapéuticas.
FinanciaciónEl presente trabajo fue financiado por la Oficina de Investigaciones y Desarrollo de la Universidad del Tolima, Proyecto de código 250113.
Conflicto de interesesLos autores señalan que no tienen conflicto de intereses.
A la Universidad del Tolima y su Oficina de Investigaciones y Desarrollo científico y al Grupo de Modelos Experimentales paras las Ciencias Zoohumanas por permitir el desarrollo del presente proyecto de investigación.