Un síntoma principal de la enfermedad de Parkinson es la alta incidencia en caídas y deterioro en el equilibrio, tanto estático como dinámico. El objetivo de este estudio es determinar el efecto de un programa de entrenamiento de Ai Chi acuático sobre la prevención de caídas en pacientes con Parkinson, mejorando su autonomía funcional y su percepción del dolor físico.
MétodoQuince pacientes diagnosticados de Parkinson (Hoehn y Yahr, rango: 1-3) participaron en un programa de intervención de Ai Chi acuático de 10 semanas de duración, con sesiones 2 veces por semana. Se emplearon las escalas EVA de dolor, Tinetti de equilibrio y marcha y el test Get up and Go.
ResultadosLos resultados se obtuvieron aplicando la prueba de Friedman para 3 muestras relacionadas, en los pacientes antes de la terapia, después de la terapia y al mes de la terapia. Los datos obtenidos mostraron una mejoría significativa (p<0,001) al comparar los resultados mostrados en las 3 mediciones, donde los valores de percepción de dolor, equilibrio y funcionalidad en marcha han disminuido significativamente, incluso al mes de finalizar las mismas los pacientes seguían mostrando mejoría y mantenimiento en sus resultados.
ConclusiónUn programa de Ai Chi en el agua parece ser un tratamiento factible para los pacientes diagnosticados con EP en un grado leve y moderado en el tratamiento del dolor, equilibrio y capacidad funcional.
One of the main symptoms of Parkinson's disease is the high incidence of falls occurring due to the decline of both static and dynamic balance. The aim of this study is to determine the effect of an Ai Chi programme designed to prevent falls in patients with Parkinson's disease by improving both functional independence and perception of physical pain.
MethodsFifteen patients diagnosed with Parkinson's disease (Hoehn and Yahr stages 1-3) participated in a 10-week Ai Chi programme consisting of 30 to 45-minute aquatic exercise sessions twice a week. The assessment measures used in this study were the pain visual analogue scale (VAS), the Tinetti gait and balance assessment tool, and the Timed Get up and Go test.
ResultsThe results were calculated by applying the Friedman test to 3 related measurements: patients at baseline, at post-treatment (at the end of the 10 week programme) and after one month of follow-up. The data obtained showed a significant improvement (p <.001) in scores for pain perception, balance, and gait function after the treatment programme. Furthermore, patients continued to show significant improvements and the benefits remained at the one-month follow-up visit.
ConclusionAi Chi is a promising and feasible aquatic treatment for improving pain perception, balance, and functional capacity in patients diagnosed with mild or moderate Parkinson's disease.
La enfermedad de Parkinson (EP) es la segunda enfermedad neurodegenerativa en frecuencia. En España, cerca de 120.000 personas padecen la EP. Se presenta en ambos sexos de forma similar, con un discreto predominio en varones. Su prevalencia es de 150-200 casos por 100.000 habitantes y aumenta de forma exponencial entre los 65 y los 90 años. Un 10% de los pacientes inician sus síntomas de manera prematura (antes de los 40 años)1. Los trastornos de la marcha suponen uno de los principales desafíos terapéuticos en la EP2, pues implican un riesgo de caídas, discapacidad y declive físico3. Los avances en el tratamiento de las alteraciones de la marcha, especialmente a través de la farmacoterapia, han mejorado, mientras que las técnicas quirúrgicas es otra opción terapéutica indicada, pero no solucionan de manera definitiva los problemas de la marcha y del equilibrio4,5.
Otro síntoma incapacitante en la EP es el dolor, y con mucha frecuencia pasa desapercibido en la práctica clínica6. Se ha descrito que en los estadios precoces de la enfermedad hay dolor de espalda y de cuello, que puede resultar de la rigidez en la cintura escapular, y dolor en las piernas, producto del síndrome de piernas inquietas o de distonías. En los estadios avanzados, el dolor puede ser causado por discinesia, acatisia, distonía del periodo «off» (40%) y dolor de tipo músculo-esquelético, articular o radicular (20%)7. Otro tipo de dolor complejo que describen incluye dolores quemantes, profundos, con hormigueo o picazón, en regiones corporales no bien definidas, generalmente en el lado de mayor compromiso motor, con sensación difusa de tensión y malestar, y que responden pobremente al tratamiento dopaminérgico. Se considera que dicho dolor es primario, neuropático central, y al parecer, una consecuencia directa de la enfermedad y no el resultado de alteraciones músculo- esqueléticas. Los mecanismos fisiológicos de este dolor neuropático en pacientes con EP no han sido establecidos y se ha sugerido que puede ser debido a una disfunción del sistema nervioso central en el procesamiento nociceptivo, como lo sugiere la disminución del umbral para el dolor producido por estímulos de calor en algunos de estos pacientes, o a una alteración de la modulación del dolor, por el déficit dopaminérgico en los circuitos gangliobasales-tálamo-corticales6.
El ejercicio se ha recomendado para los pacientes con EP, independientemente de su estado de salud o el curso de su enfermedad8. Varios tipos de actividad física han sido probados, y los resultados han demostrado los beneficios del ejercicio en relación con la no intervención con deporte9. Algunos investigadores han sugerido que los efectos neuroprotectores del ejercicio podrían contribuir a una disminución en el riesgo de desarrollar EP, o podrían ralentizar la progresión de la neurodegeneración10,11. A pesar de la creciente atención que se ha dado al ejercicio como terapia para la EP, solo unas pocas directrices prácticas se han desarrollado para la aplicación en clínica12. Están siendo recomendados varios tipos de ejercicios, incluyendo el Tai Chi, Yoga y Pilates, entre otros8,13.
La hidroterapia es una técnica de fisioterapia que se aplica como terapia complementaria en el tratamiento de múltiples patologías neuro-músculo- esqueléticas, tanto en población adulta como en población infantil. A este respecto se ha confirmado la efectividad de distintos programas de rehabilitación de la marcha en la EP14,15, si bien se dispone de poca información sobre el efecto del ejercicio físico en el agua16,17. Sin embargo, la evidencia científica aportada por estas investigaciones presenta ciertas limitaciones metodológicas, y destaca el escaso empleo de técnicas de valoración objetivas18. Una de las terapias posibles es el Ai Chi, siendo creado por Jun Konno en Japón en 1996, a partir de la combinación de conceptos de Tai-Chi y Qi Qong. En el desarrollo de esta técnica, el fisioterapeuta enseña verbal y visualmente una combinación de movimientos de miembros superiores, inferiores y tronco con un ritmo lento y coordinado que la persona debe realizar en bipedestación dentro de la piscina19,20.
Por ello, el objetivo de este estudio es evaluar los efectos que puede producir el Ai Chi en sesiones de 10 semanas de duración en el dolor, equilibrio y capacidad funcional en pacientes diagnosticados de EP.
Pacientes y métodosEl proyecto tuvo una duración de 10 semanas y fue llevado a cabo en un centro acuático donde los pacientes realizan sus terapias en este medio.
Se pudo contar con una muestra de 15 pacientes, pertenecientes a la asociación de enfermos de Parkinson de la localidad. Todos los participantes del estudio cumplieron los criterios de inclusión: paciente diagnosticado de EP en estadios 1-3 (Hoehn and Yahr Scale)- evaluados por el servicio de salud de su localidad- y que haya superado los 6 meses desde el diagnóstico de la enfermedad, mayor de 40 años, no presentar demencia, capacidad de deambulación de manera independiente, no alteración de los reflejos posturales, firmar el consentimiento informado, no presentar ninguna contraindicación médica al respecto, permanecer con medicación estable anti-Parkinson durante el desarrollo del programa y aceptación de las normas del estudio (asistencia regular y participación activa). Los criterios de exclusión fueron los siguientes: falta de compromiso en la asistencia a las sesiones, enfermedad neurológica que suponga la no comprensión de órdenes verbales u otra que influya en el resultado obtenido, patología cardiaca, ginecológica, dermatológica, incontinencia (vesical o anal), y lesiones articulares y/o musculares de miembros inferiores que afectasen a la marcha autónoma.
Este estudio fue aprobado por el Comité Ético de Investigación Humana de la institución origen del investigador principal, y todos los sujetos dieron su consentimiento informado por escrito de acuerdo con la Declaración de Helsinki, antes de iniciar las evaluaciones iniciales.
MetodologíaEstudio clínico con intención de tratar, por lo que no se cuenta con grupo control. Habiendo asistido a la reunión preliminar, los pacientes fueron citados para realizar la valoración inicial en seco durante 30-45 minutos. Fueron evaluadas por un fisioterapeuta externo al estudio. Se pautaron normas de horario y vestimenta apropiada a la actividad a realizar. Hubo una evaluación antes de iniciar la terapia, al finalizar todas las sesiones y al mes siguiente. Todos los participantes fueron evaluados en fase «on» (60-90 minutos tras haberse administrado la medicación antiparkinsoniana).
MedidasEscala analógica visual (EVA) del dolor21: la valoración del dolor fue llevada a cabo, en un primer momento, a partir de la puntuación que el sujeto asignaba a su dolor a través de la EVA («ahora me gustaría que le diera una puntuación a su dolor en una escala de 0-10, siendo 0 que no tiene dolor y 10 el peor dolor posible haciendo una media entre los días que más y menos le ha dolido»). Posteriormente se valoraban otras variables relacionadas con el dolor oscilando el rango de respuesta de 1-5 puntos de una escala de Likert y donde las variables de valoración fueron seleccionadas a partir de preguntas abiertas realizadas a los pacientes sobre qué aspectos de su dolor consideraban relevantes18,19.
La escala de Tinetti es una herramienta muy valiosa en el momento de detectar alteraciones en la marcha y equilibrio del adulto mayor, a mayor puntaje, es mayor el riesgo de caídas o de sospecha de alguna patología claudicante. Es utilizada frecuentemente en el proceso de valoración funcional, valorando el equilibrio y la marcha como un método de observación directa utilizando calificadores numéricos de acuerdo con la capacidad de ejecución de acciones específicas que componen la actividad funcional probada22,23.
Test Get up and Go: se cronometró el tiempo que tardaba el sujeto en levantarse de una silla, caminar a su velocidad preferida una distancia de 3 m, girar, volver a la silla y sentarse de nuevo24. Ha sido desarrollado para evaluar la movilidad funcional básica y la capacidad locomotora (equilibrio dinámico) de ancianos. Es considerado un test de movilidad física muy útil en la práctica clínica, por haber demostrado es un test simple, rápido y fácil de administrar y que no requiere ningún equipamiento especial.
Terapia acuática: los 15 pacientes del estudio recibieron 20 sesiones en total, 2 veces por semana, durante 10 semanas que duró el estudio. Estas 20 sesiones consistieron en sesiones grupales con una duración de 45 minutos. Fueron realizadas por un fisioterapeuta especializado en terapia acuática y externo al estudio.
Las sesiones se impartieron en una piscina de 20×6 m, con profundidad de 110cm. La temperatura del agua era de 30o (variación inferior a 0,5o) y la temperatura ambiental de 27,5o (variación inferior a 1o). El programa de tratamiento se llevó a cabo en su totalidad en una piscina adaptada para tratamientos colectivos.
Las sesiones fueron programadas previamente con una progresión en dificultad. En la parte inicial de la sesión se practicó una actividad lúdica de calentamiento y en la parte final se realizó una actividad de vuelta a la calma. Se destinó 30 minutos a la práctica del programa de Ai Chi. Los ejercicios se realizaron en un orden determinado, hasta completar los 19 posibles.
Los aspectos de seguridad fueron los propios de la realización de una actividad en un medio acuático.
Además de los efectos terapéuticos en el ámbito de la mejora en el equilibrio y la reducción del riesgo de caídas, como efectos secundarios también podemos encontrar efectos relajantes y analgésicos ante su práctica, indicada también para la población en general.
El presente estudio demostró variable Ai Chi como variable independiente y como variables dependientes serán la intensidad del dolor, calidad de vida y grado de dependencia, que se dividen como cualitativa categórica.
El estudio estadístico fue realizado por una persona ajena al estudio. Se calcularon las medias y desviaciones típicas para definir las características de la muestra objeto de estudio. Se comprobó la normalidad de la muestra a través de la prueba de Kolmogorov-Smirnov. Con el fin de identificar los efectos del programa acuático sobre las variables, se llevó a cabo la prueba t de Student para muestras relacionadas. El análisis estadístico se efectuó mediante el programa estadístico SPSS v. 19. Todos los datos cumplieron el criterio de normalidad, por lo que el análisis se desarrolló a través de estadísticos paramétricos. Un valor p<0,05 se consideró estadísticamente significativo, usando la prueba exacta de Fisher.
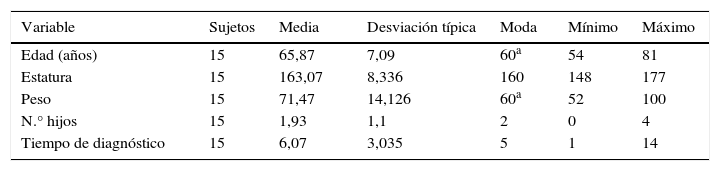
ResultadosNuestra muestra estaba compuesta por 15 pacientes, de los cuales 6 sujetos eran varones (40%), mientras que 9 eran mujeres (60%). En la tabla 1 se muestran las características socio-demográficas de la población estudiada.
Características socio-demográficas de la población estudiada
| Variable | Sujetos | Media | Desviación típica | Moda | Mínimo | Máximo |
|---|---|---|---|---|---|---|
| Edad (años) | 15 | 65,87 | 7,09 | 60a | 54 | 81 |
| Estatura | 15 | 163,07 | 8,336 | 160 | 148 | 177 |
| Peso | 15 | 71,47 | 14,126 | 60a | 52 | 100 |
| N.° hijos | 15 | 1,93 | 1,1 | 2 | 0 | 4 |
| Tiempo de diagnóstico | 15 | 6,07 | 3,035 | 5 | 1 | 14 |
a Existen varias modas. Se mostrará el menor de los valores.
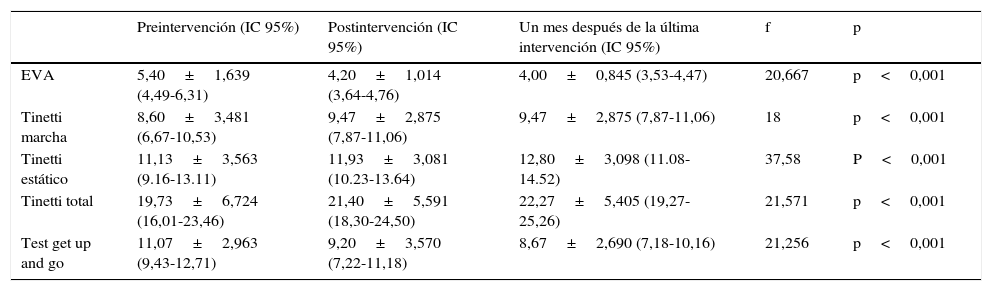
Todos los pacientes finalizaron el tratamiento, cumpliendo plenamente la adhesión al programa propuesto. No presentó el estudio ninguna incidencia que supusiera algún efecto no deseado en los pacientes. Los resultados obtenidos, una vez finalizada la intervención, indican la existencia de una serie de cambios en las variables que se han estudiado (tabla 2).
Resultados obtenidos en el estudio
| Preintervención (IC 95%) | Postintervención (IC 95%) | Un mes después de la última intervención (IC 95%) | f | p | |
|---|---|---|---|---|---|
| EVA | 5,40±1,639 (4,49-6,31) | 4,20±1,014 (3,64-4,76) | 4,00±0,845 (3,53-4,47) | 20,667 | p<0,001 |
| Tinetti marcha | 8,60±3,481 (6,67-10,53) | 9,47±2,875 (7,87-11,06) | 9,47±2,875 (7,87-11,06) | 18 | p<0,001 |
| Tinetti estático | 11,13±3,563 (9.16-13.11) | 11,93±3,081 (10.23-13.64) | 12,80±3,098 (11.08-14.52) | 37,58 | P<0,001 |
| Tinetti total | 19,73±6,724 (16,01-23,46) | 21,40±5,591 (18,30-24,50) | 22,27±5,405 (19,27-25,26) | 21,571 | p<0,001 |
| Test get up and go | 11,07±2,963 (9,43-12,71) | 9,20±3,570 (7,22-11,18) | 8,67±2,690 (7,18-10,16) | 21,256 | p<0,001 |
Se ilustran los resultados que se obtuvieron aplicando la prueba de Friedman para 3 muestras relacionadas, en los pacientes antes de la terapia, después de la terapia y al mes de la terapia, se detecta que las distribuciones antes, después y al mes de la terapia no son las mismas, con un nivel de significación del 5%.
DiscusiónEste estudio tuvo como objetivo comprobar los efectos de un programa de ejercicios realizado en el medio acuático en una población formada por pacientes diagnosticados con la EP en un grado leve a moderado (escala de 1-3 en la escala de Hoehn y Yahr). Una vez finalizada la intervención, los pacientes mostraron una mejoría evidente en su movilidad funcional y dolor, de acuerdo con los resultados mostrados en las distintas esferas evaluadas.
El dolor es un síntoma muy frecuente de la EP, que se asocia a la depresión, y predice una peor calidad de vida y autonomía por parte del paciente. Sin embargo, y a pesar de ser un síntoma importante en estos pacientes y de que cada vez hay más trabajos dirigidos hacia el diagnóstico y manejo del dolor de la EP25-33, este sigue siendo un síntoma infravalorado, infradiagnosticado e infratratado32,33.
El dolor crónico podría actuar como un distractor, que interferiría la actividad cognitiva necesaria para prevenir caídas. Tinetti et al.34 y Stubbs et al.35 señalan una asociación entre el dolor y las caídas. Micke et al.36 descubrieron que la prevalencia de dolor de pies era significativamente mayor en las personas mayores que sufren un mayor índice de caídas, resultados similares que mostró el meta-análisis de Stubbs35 y Mickle36, donde los pies y el dolor crónico son 2 factores de riesgo muy importantes y necesarios tener en cuenta en una buena valoración realizada por los profesionales.
Igualmente, es evidente que la sintomatología depresiva coexiste con el dolor en pacientes con EP28,37,38 y estudios previos han demostrado que esta predice una mayor puntuación en las escalas de cuantificación del dolor38-40.
El tener una puntuación más baja en la EVA del cuestionario EuroQol-5D tiene importancia, ya que está relacionado con un menor riesgo de sufrir caídas40. Esto concuerda con la puntuación media de la EVA obtenida por los sujetos de nuestra muestra, que es una puntuación sensiblemente inferior a la media de la población general de los estudios realizados en España41. Existen diferencias significativas, en concreto entre antes-después (f=−1,000, p=0,006) y antes-al mes (f=−1,200, p=0,001). Se han obtenido mejores resultados al mes de finalizar las sesiones, pero hay 4 casos a los que la terapia ha dejado indiferente y los resultados de la terapia al mes, después de terminarla no han sido significativos. Se ha visto que la puntuación ha ido disminuyendo conforme avanzaba el tiempo, considerando adecuado este método como control del dolor, con efecto inmediato y prolongado en el tiempo. Pero importante señalar que la diferencia entre la valoración inicial y final es de 1,2 puntos de diferencia, como media. Esta diferencia no es tan evidente como en otros estudios afirman, que es necesario que para que el efecto clínico sea relevante necesita un cambio de 2-3 puntos. No se puede afirmar que este descenso se deba a la disminución del dolor en miembros inferiores o el dolor en otras localizaciones.
Respecto al equilibrio, aplicando el ANOVA de 2 factores, siendo uno de los factores los 15 pacientes y el otro la toma de puntuaciones (antes, después y al mes), se comprueba que en los valores de la escala de Tinetti estático existen diferencias significativas entre los 15 pacientes, es decir la terapia ha influido de manera diferente en cada paciente (f=37,58; p<0,001). También existen diferencias significativas entre las tomas de las puntuaciones, es decir, la terapia ha influido de manera positiva en el cambio de las puntuaciones (f=12,98; p<0,001).
La puntuación en la escala de equilibrio y marcha de Tinetti debe ser tenida muy en cuenta en la evaluación de las habilidades motoras de las personas mayores, ya que valora el equilibrio y la marcha en las maniobras motoras que se usan en las actividades de la vida diaria. La pérdida de la capacidad de realizar dichas maniobras motoras puede conducir a la pérdida de autonomía y a la dependencia42,43. La extensión de este problema, su gravedad (calidad de vida, tasa de letalidad, comorbilidad…), su vulnerabilidad primaria, su repercusión social y económica y su evolución en el tiempo determinan la importancia de la investigación e intervención en este tema. Por lo que es necesario realizar estudios al respecto.
Hartley44 describió un caso de un paciente PD donde los valores pasaron de 10-17. Debido a diversas comorbilidades y la falta de descripción de la etapa H & Y, el caso no proporciona información relevante. Park45 utilizó Tinetti en pacientes con accidente cerebrovascular crónico y encontró cambios comparables en el total Tinetti. Su programa incluyó ejercicios de equilibrio que eran en parte comparable con Ai Chi. Pero en nuestros pacientes se han obtenido diferencias significativas, lo que se podría afirmar que el empleo de esta terapia para el equilibrio es una técnica válida y que muestra eficacia, pudiéndose realizar estudios aleatorizados y con grupos control.
Marinho-Buzelli et al.46 concluyeron en su revisión sistemática sobre la influencia de la terapia acuática en la movilidad de las personas con enfermedades neurológicas, incluyendo el Parkinson, que era evidente la mejora que aporta el uso de la terapia acuática para mejorar el equilibrio dinámico y velocidad de marcha en adultos. Otros estudios47,48 mostraron mejoras en la estabilidad postural, que fue significativamente mayor tras un programa de intervención acuática, y menor número de caídas que muestran los pacientes neurológicos que realizan sus terapia en tierra48.
Según Sai et al.49, el Timed Get Up and Go Test es el mejor test de equilibrio para predecir caídas recurrentes. Según Witney et al.50, las personas mayores que tardan más de 15 segundos en ejecutar el Timed Get Up and Go Test tienen un alto riesgo de sufrir caídas. Igualmente, una pobre ejecución en el Timed Up and Go Test se correlaciona significativamente con la baja velocidad de marcha. Estudios51,52 confirman que el paciente con EP, en comparación con la población sana, presenta una menor velocidad de desplazamiento y una menor longitud de zancada, así como un menor rango de movilidad articular en sus miembros inferiores.
Nuestros pacientes mostraron diferencias significativas en el test, en concreto entre antes-después (f=1,033, p=0,005) y antes-al mes (f=1,367, p<0,001), pero hay 2 casos, a los que la terapia ha dejado indiferente y los resultados de la terapia después-al mes de terminarla no han sido tan relevantes. Por este motivo podemos afirmar que esta terapia es válida para prevenir y retrasar los síntomas motores que presentan nuestros pacientes que sufren alteraciones del equilibrio. Por ello, una puntuación baja en este test indica mejora de velocidad y menor posibilidad de sufrir caídas.
El punto de corte para definir un riesgo alto de caída es de 14 segundos en poder realizar la prueba. En nuestros pacientes muestran valores más rápidos que este valor, y la diferencia entre el pre y post es de 3,05, cambio mínimo detectable. La terapia Ai Chi no incluye ejercicios de marcha y, por tanto, grandes cambios en el TUG no son de esperar. Sin embargo, los cambios de nuestro estudio son parecidos a los descritos por Volpe48, y difieren en el estudio de Vivas47, que no encontró cambios significativos ni clínica relevante en el TUG después de su programa.
Por otro lado, hay que tener en cuenta la posible influencia de 2 factores determinantes en los efectos que los programas de ejercicio físico tienen sobre la marcha en pacientes con EP. Estos son el empleo de señales rítmicas y la estimulación del metabolismo aeróbico53. En el primer caso, es conocido su efecto positivo sobre la fluidez del movimiento en la persona afectada de EP, lo que favorece de forma significativa su patrón de marcha. Del mismo modo, se ha comentado que la estimulación metabólica aeróbica puede traducirse en ganancias tanto en la longitud del paso como en la velocidad de desplazamiento54. En relación con esto, parece oportuno comentar que el programa de ejercicio acuático aplicado en este estudio incluía demostraciones rítmicas de los movimientos que servían de patrón y guía básica para su correcta ejecución. Además, aunque no se valoró objetivamente la intensidad de las sesiones, a juzgar por su duración y la intervención de grandes grupos musculares en la realización de gran parte de las tareas propuestas, no se descarta la existencia de un estímulo aeróbico de magnitud suficiente como para tener el efecto anteriormente mencionado. Conviene señalar que un protocolo fisioterápico desarrollado en el medio acuático con pacientes con EP no encontró cambios significativos en la cinemática de la marcha47, y mostró diferencias en cuanto a los contenidos del programa de ejercicio y menor duración de este.
Sobre la base de lo anterior, los resultados muestran indicios de que el ejercicio físico desarrollado en el agua tiene efectos positivos sobre algunas de las características necesarias para un buen y correcto patrón biomecánico de la marcha de pacientes con EP. Esta puede ser una opción rehabilitadora que se debe considerar por el neurólogo siempre que existan los recursos necesarios para su puesta en práctica. Futuros estudios aleatorizados y controlados, y con una mayor potencia muestral son necesarios para confirmar los hallazgos que aquí se describen47.
La evolución positiva de los síntomas motores después del ejercicio en agua se ha relacionado con el desarrollo de tareas que necesitan un patrón rítmico y un ajuste postural constante y que podría implicar un efecto de aprendizaje. En este sentido, las ventajas del ejercicio físico en el agua (mayor variedad de movimientos, ejercicios fáciles y de bajo impacto- debido a la presión hidrostática y la flotación-, y un ambiente recreativo y agradable) y la posibilidad de trabajar en grupo, puede haber tenido un efecto positivo en la motivación de los pacientes para el cumplimiento del programa.
Además, el agua caliente pudo haber tenido un efecto terapéutico en algunos de los síntomas motores, tales como la rigidez e inestabilidad postural, como ya se ha observado por otros investigadores46.
Finalmente, el programa de ejercicio físico en agua aquí presentado demostró tener un efecto positivo en cuanto a la adhesión al mismo, en comparación con otros programas de ejercicio físico desarrollados para este colectivo, según lo estudiado por Ellis et al.55.
Así mismo, ciertas limitaciones relacionadas con el diseño de este estudio, principalmente el reducido tamaño de la muestra y la ausencia de un grupo control, debilitan, en cierto modo, la magnitud de los efectos del programa de ejercicio acuático anteriormente comentados. Dichos efectos solo son extensibles a pacientes de similares características a los de la muestra, necesitando realizar más estudios relacionados.
Como conclusión, los resultados de este estudio indican que un programa de Ai Chi en el agua parece ser un tratamiento factible para los pacientes diagnosticados con EP en un grado leve y moderado. Por lo tanto, se podría afirmar que los participantes mejoraron su equilibrio y calidad de movimiento gracias al programa de ejercicio realizado en el medio acuático, que facilitó la propuesta de tareas y acciones motrices que sirvieron de estímulo para desarrollar la fuerza muscular, la amplitud de movimiento y la agilidad de los mismos, y que están directamente involucradas en la acción motora.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.