La epilepsia afecta más frecuentemente a niños y personas ancianas. La edad media de la población está aumentando, al igual que la prevalencia de la epilepsia. El tipo de epilepsia y su manejo cambian con la edad.
MétodoPresentamos un estudio observacional retrospectivo en el que comparamos pacientes epilépticos mayores de 65 años con diagnóstico de epilepsia, antes y después de los 65 años. Estudiamos las características de la epilepsia de estos pacientes y las comorbilidades.
ResultadosIncluimos a 123 pacientes; 61 fueron diagnosticados de epilepsia antes de los 65 años (grupo A) y 62 después de los 65 (grupo B). La distribución en cuanto al género fue similar en ambos grupos: en el A fueron hombres el 62,9%(N=39) y el 60,7% (N=37) en el B. La edad media fue 69,97±5,6 años en el A y 77,29±6,73 en el B. La etiología más prevalente fue desconocida en el A (44,3%; N=27) y estructural en el B (74,2%; N=46). Se hallaron antecedentes de ictus en el 19,7% (N=12) en el A y 51,6% (N=32) en el B. La dosis de fármacos antiepilépticos fue menor en el grupo B. Se encontraron diferencias estadísticamente significativas entre los grupos respecto al antecedente de ictus isquémico, deterioro cognitivo, enfermedades psiquiátricas, diabetes mellitus, grado de dependencia y número de fármacos antiepilépticos.
ConclusiónLa epilepsia que se inicia después de los 65 años tiene una estrecha relación con factores de riesgo cardiovascular, precisa para su control un menor número de fármacos y dosis más bajas, aunque en algunos casos puede iniciarse con estatus epiléptico.
Epilepsy is most frequent in children and elderly people. Today's population is ageing and epilepsy prevalence is increasing. The type of epilepsy and its management change with age.
MethodsWe performed a retrospective, observational study comparing patients aged ≥ 65 years with epilepsy diagnosed before and after the age of 65, and describing epilepsy characteristics and comorbidities in each group.
ResultsThe sample included 123 patients, of whom 61 were diagnosed at <65 years of age (group A), 62 at ≥ 65 of age (group B). Sex distribution was similar in both groups, with 39 men (62.9%) in group A and 37 (60.7%) in group B. Mean age was 69.97±5.6 years in group A and 77.29±6.73 in group B. The most common aetiology was unknown in group A (44.3%, n=27) and vascular in group B (74.2%, n=46). History of stroke was present in 12 patients from group A (19.7%) and 32 (51.6%) in group B. Antiepileptic drugs were prescribed at lower doses in group A. Statistically significant differences were found between groups for history of ischaemic stroke, cognitive impairment, psychiatric disorders, and diabetes mellitus; degree of dependence; and number of antiepileptic drugs.
ConclusionAge of onset ≥ 65 years is closely related to cardiovascular risk factors; these patients require fewer antiepileptic drugs and respond to lower doses. Some cases initially present as status epilepticus.
La epilepsia, descrita como la predisposición a sufrir crisis epilépticas, es una enfermedad neurológica común que afecta aproximadamente al 1% de la población1. Esta tendencia a desarrollar crisis se ha visto en todas las etapas de la vida, especialmente en la infancia y en los ancianos2,3, si bien la etiología en estos 2grupos es muy diferente. En niños son típicas las alteraciones del desarrollo cortical y las causas genéticas4. En cambio, en edades más avanzadas la epilepsia se asocia a causas degenerativas o estructurales como consecuencia de tumores, ictus o traumatismos5. Por el otro lado, la Real Academia Española define como persona anciana aquella de mucha edad6 y según la Organización Mundial de la Salud (OMS) se empieza a considerar anciano a los mayores de 60 años7. Esta edad puede parecer prematura, por lo que con el aumento de la esperanza de vida, se empieza a considerar anciano a aquel con 65 o más años de edad.
El estudio publicado por Simpää et al., sobre el registro finés de epilepsia entre los años 1986 y 2002, muestra un descenso en la incidencia de epilepsia de nuevo inicio en niños y un aumento significativo en el grupo de los ancianos8. En el estudio de Besocke et al9., se objetiva un incremento de la incidencia con la edad, siendo de 40 casos por cada 100.000 en el grupo de edad de 40-45 años, de 80 casos por cada 100.000 en el grupo de 60-65 y, en personas mayores de 80 años, de 140 casos por cada 100.000. Estos valores tienen mucha importancia considerando el envejecimiento poblacional, especialmente en Europa y en nuestro país. Según los datos demográficos a nivel nacional, se espera que el 70% de la población sea mayor de 64 años en los próximos 30 años10.
Otro hecho importante son las limitaciones que, en comparación con los pacientes más jóvenes, tienen los pacientes ancianos con epilepsia para el manejo de sus crisis, por sus comorbilidades y múltiples tratamientos concomitantes. También se han de considerar cambios fisiológicos que ocurren cuando se acumulan años, como disminución de las proteínas libres en sangre, peor funcionamiento renal o hepático y fallos de memoria, que pueden afectar a la óptima toma de la medicación11.
El conjunto de pacientes ancianos epilépticos se podría dividir en aquellos que desarrollaron la epilepsia en la edad senil y en aquellos que lo hicieron muchos años antes de llegar a la frontera de los 65 años. El objetivo de nuestro estudio es analizar el perfil del paciente epiléptico ≥ 65 años y determinar si existen diferencias en función del diagnóstico de epilepsia antes o después de los 65 años.
Pacientes y métodoEstudio retrospectivo observacional de todos aquellos pacientes valorados en la consulta monográfica de epilepsia en el Hospital Clínico Universitario Lozano Blesa durante el periodo comprendido entre junio del 2013 y diciembre del 2014. Fueron incluidos todos aquellos pacientes con diagnóstico confirmado de epilepsia según la definición de la International League Against Epilepsy (ILAE)12 y con una edad ≥ 65 años. Fueron excluidos aquellos pacientes que no cumplían los criterios de inclusión. El estudio siguió los principios éticos de la Declaración de Helsinki, aunque por el carácter retrospectivo observacional del estudio no se dispone de los consentimientos informados de los pacientes.
Se recogieron datos demográficos (edad y género), datos relacionados con la epilepsia (edad en el momento del diagnóstico de epilepsia, tipo de crisis epiléptica —focal, focal con afectación del nivel de conciencia, focal con generalización tónico-clónica, generalizada tónico-clónica—, frecuencia de crisis en los 3 últimos meses y etiología de la epilepsia), datos de las exploraciones complementarias realizadas (tomografía computarizada craneal, resonancia magnética cerebral y electroencefalograma) y fármacos antiepilépticos (FAE) utilizados (principio activo, dosis, duración del tratamiento).
Los pacientes fueron divididos en 2grupos: grupo A, en el que se incluyeron todos los pacientes que desarrollaron la epilepsia antes de los 65 años y grupo B, formado por aquellos que la iniciaron con edad ≥ 65 años.
Para el análisis estadístico se utilizó el paquete SPSS versión 22.0. En el estudio descriptivo los variables cuantitativas se expresaron como media y desviación estándar (DE); las variables cualitativas, como frecuencias y porcentajes.
Para el análisis de las variables cuantitativas en los 2grupos se usó la prueba de t de Student y la U de Mann-Whitney cuando la muestra no seguía una distribución normal. Para las variables cualitativas se usó chi cuadrado, y cuando el número de casos era inferior a 5, se usó el test de Fisher. Para minimizar el error α tipo 1 se aplicó el test post hoc de Bonferroni. Finalmente, se realizó un análisis multivariante a partir de un modelo de regresión logística. Se consideró estadísticamente significativo con valores de p <0,05.
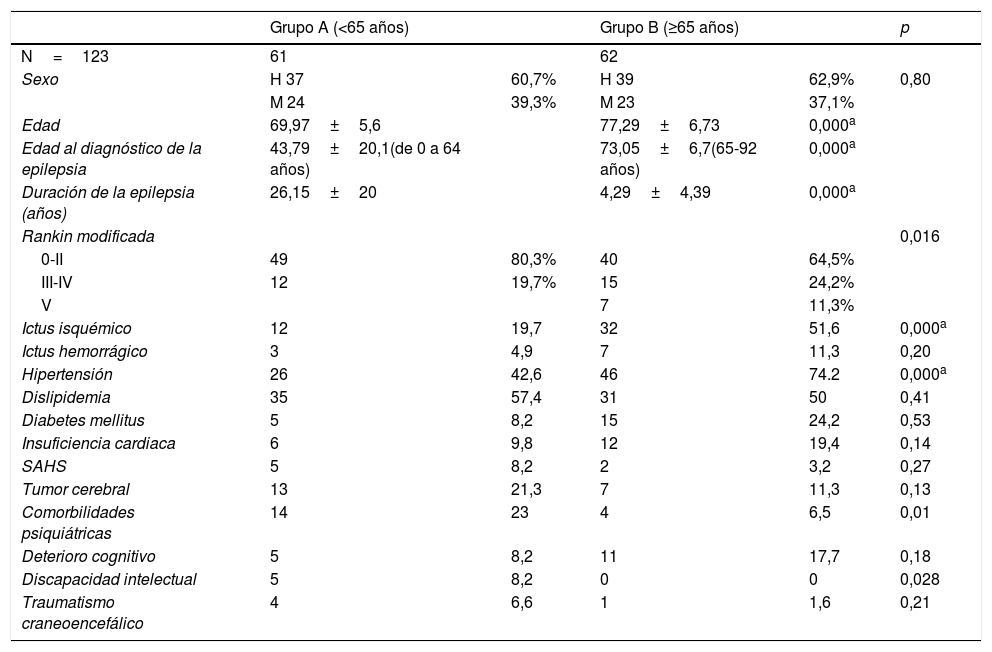
ResultadosUn total de 123 pacientes fueron incluidos, 61 pacientes en el grupo A (<65 años cuando desarrollaron epilepsia) y 62 en el grupo B (≥65 años cuando desarrollaron epilepsia). Ambos grupos tenían un número semejante de pacientes, con edades y géneros comparables, siendo el 60,7% (N=37) varones en el grupo A y 62,9% (N=39) en el grupo B. La media de edad en el grupo A, al igual que la edad al diagnóstico, fue inferior que en el grupo B, según lo esperado (ver tabla 1 con el resto de la información demográfica).
Información demográfica, escala Rankin modificada y factores de riesgo en cada uno de los grupos
| Grupo A (<65 años) | Grupo B (≥65 años) | p | |||
|---|---|---|---|---|---|
| N=123 | 61 | 62 | |||
| Sexo | H 37 | 60,7% | H 39 | 62,9% | 0,80 |
| M 24 | 39,3% | M 23 | 37,1% | ||
| Edad | 69,97±5,6 | 77,29±6,73 | 0,000a | ||
| Edad al diagnóstico de la epilepsia | 43,79±20,1(de 0 a 64 años) | 73,05±6,7(65-92 años) | 0,000a | ||
| Duración de la epilepsia (años) | 26,15±20 | 4,29±4,39 | 0,000a | ||
| Rankin modificada | 0,016 | ||||
| 0-II | 49 | 80,3% | 40 | 64,5% | |
| III-IV | 12 | 19,7% | 15 | 24,2% | |
| V | 7 | 11,3% | |||
| Ictus isquémico | 12 | 19,7 | 32 | 51,6 | 0,000a |
| Ictus hemorrágico | 3 | 4,9 | 7 | 11,3 | 0,20 |
| Hipertensión | 26 | 42,6 | 46 | 74.2 | 0,000a |
| Dislipidemia | 35 | 57,4 | 31 | 50 | 0,41 |
| Diabetes mellitus | 5 | 8,2 | 15 | 24,2 | 0,53 |
| Insuficiencia cardiaca | 6 | 9,8 | 12 | 19,4 | 0,14 |
| SAHS | 5 | 8,2 | 2 | 3,2 | 0,27 |
| Tumor cerebral | 13 | 21,3 | 7 | 11,3 | 0,13 |
| Comorbilidades psiquiátricas | 14 | 23 | 4 | 6,5 | 0,01 |
| Deterioro cognitivo | 5 | 8,2 | 11 | 17,7 | 0,18 |
| Discapacidad intelectual | 5 | 8,2 | 0 | 0 | 0,028 |
| Traumatismo craneoencefálico | 4 | 6,6 | 1 | 1,6 | 0,21 |
H: hombres; M: mujeres; SAHS: síndrome de apnea-hipoapnea del sueño.
En cuanto a los datos relacionados con su enfermedad, el tipo de crisis más frecuente en ambos grupos fue focal con afectación del nivel de conciencia (41% en el grupo A vs. 53% en el grupo B), sin que hubiera diferencia estadísticamente significativa.
Con relación a las pruebas de neuroimagen, se realizó tomografía computarizada craneal en el 96,7% (N=59 en el grupo A y N=60 en el B) y resonancia magnética cerebral en el 80,3% (N=49) del grupo A y 61,3% (N=38) en el grupo B. La resonancia magnética resultó normal en el 32,8% (N=16) en el grupo A y en el 11,3% (N=4) en el B. Las imágenes clasificadas como encefalomalacia secundaria a ictus u otras lesiones como traumatismos representaron el 24,6% (N=12) en el A y el 64,5% (N=25) en el B. Finalmente, cabe destacar la presencia de esclerosis mesial temporal en el grupo A (1,6%), sin ningún caso encontrado en el grupo B. Se encontró una significación estadística de p <0,001 en los resultados de neuroimagen. La afectación del lóbulo temporal estaba presente en el 25,6% (N=13) de los pacientes del grupo A y en el 18% (N=7) del B. Por otro lado, solo el 10,3% (N=5) del grupo A presentó afectación del lóbulo parietal, frente al 24% (N=9) del grupo B. En el 28,2% de los pacientes del grupo A y en el 38% del grupo B se objetivó un compromiso de los ganglios de la base. De nuevo se encontró una diferencia estadísticamente significativa entre los 2grupos (p=0,003).
El electroencefalograma de vigilia fue normal en el 27,9% (N=17) en el grupo A y en el 40,3% (N=25) en el B. Por otro lado, se encontraron anomalías generalizadas en el 8,2% (N=5) en el A y 6,5% (N=4) en el B. Hallazgos focales fueron identificados en el 26,2% (N=16) en el A y en el 14,5% (N=9) en el B, pero no se encontraron diferencias estadísticamente significativas.
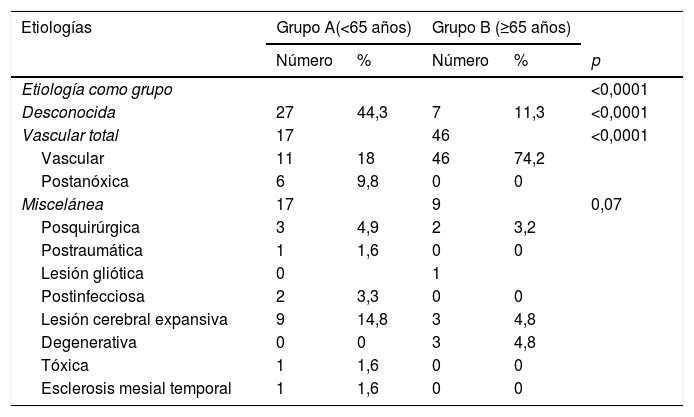
La etiología de la epilepsia fue desconocida en el 44,3% (N=27) en el grupo A y en el 11,3% (N=7) en el grupo B. La causa más frecuente en el grupo B fue la vascular, con un 74,2% (N=46) de los casos, frente al 18% (N=11) en el grupo A. Llama la atención en el grupo A tanto la etiología postanóxica (9,8%) como la secundaria a lesión sugestiva de tumor intraparenquimatoso (14,8%), escasamente representada en el grupo B, con 0% y 4,8%, respectivamente, con una diferencia estadísticamente significativa (p<0,001). Para más información sobre las etiologías, ver tablas 2 y 3.
Etiología y subclasificación de la epilepsia en los 2 grupos
| Etiologías | Grupo A(<65 años) | Grupo B (≥65 años) | |||
|---|---|---|---|---|---|
| Número | % | Número | % | p | |
| Etiología como grupo | <0,0001 | ||||
| Desconocida | 27 | 44,3 | 7 | 11,3 | <0,0001 |
| Vascular total | 17 | 46 | <0,0001 | ||
| Vascular | 11 | 18 | 46 | 74,2 | |
| Postanóxica | 6 | 9,8 | 0 | 0 | |
| Miscelánea | 17 | 9 | 0,07 | ||
| Posquirúrgica | 3 | 4,9 | 2 | 3,2 | |
| Postraumática | 1 | 1,6 | 0 | 0 | |
| Lesión gliótica | 0 | 1 | |||
| Postinfecciosa | 2 | 3,3 | 0 | 0 | |
| Lesión cerebral expansiva | 9 | 14,8 | 3 | 4,8 | |
| Degenerativa | 0 | 0 | 3 | 4,8 | |
| Tóxica | 1 | 1,6 | 0 | 0 | |
| Esclerosis mesial temporal | 1 | 1,6 | 0 | 0 | |
Multivariante análisis de los factores de riesgo seleccionados
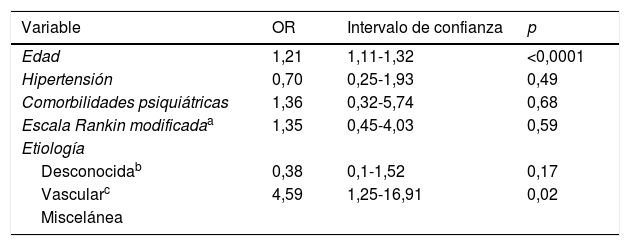
De las comorbilidades encontradas en los 2grupos destaca la hipertensión (42,6% en el A y 74,2% en el B), el antecedente de ictus isquémico (19,7% en el A y 51,6% en el B) y hemorrágico (4,9% en el A y 11,3% en el B), dislipidemia (57,4% en el A y 50% en el B), diabetes mellitus (8,2% en el A y 24,2% en el B), deterioro cognitivo (8,2% en el A y 17,7% en el B) y trastornos psiquiátricos (23% en el A y 6,5% en el B). El resto de los factores de riesgo registrados son recopilados en la tablas 1 y 3. Se encontró una significación estadística entre los 2grupos en ictus isquémico (p=0,003), deterioro cognitivo (p=0,045), trastornos psiquiátricos (p=0,027) y diabetes mellitus (p=0,016). Sin embargo, en el test post hoc de Bonferroni, solo la hipertensión, el ictus isquémico y la edad resultaron estadísticamente significativos (ver tabla 3).
Los pacientes de ambos grupos fueron clasificados según su nivel de dependencia valorado mediante la escala de Rankin modificada en 3grupos: 0-II (no discapacidad o mínima sin precisar ayuda para actividades diarias), III-IV (con incapacidad moderada a moderada-severa) y V (discapacidad severa), con una diferencia estadísticamente significativa (p=0,016), pero no significativa en el test post hoc. Los resultados se resumen en las tablas 1 y 3.
La frecuencia de crisis en los 3meses previos a la inclusión en el estudio fue igual a 0 en el 78,3% (N=47) en el A y en el 74,2% (N=46) en el B. El caso de haber tenido 2o menos crisis en ese periodo fue más frecuente en el B (93,5%, N=58) que en el A (90%, N=54), sin encontrar una diferencia estadísticamente significativa. Respecto a antecedentes de estatus epiléptico, fue mayor en el grupo A con 16,1% (N=10) que en el B 1,6% (N=1).
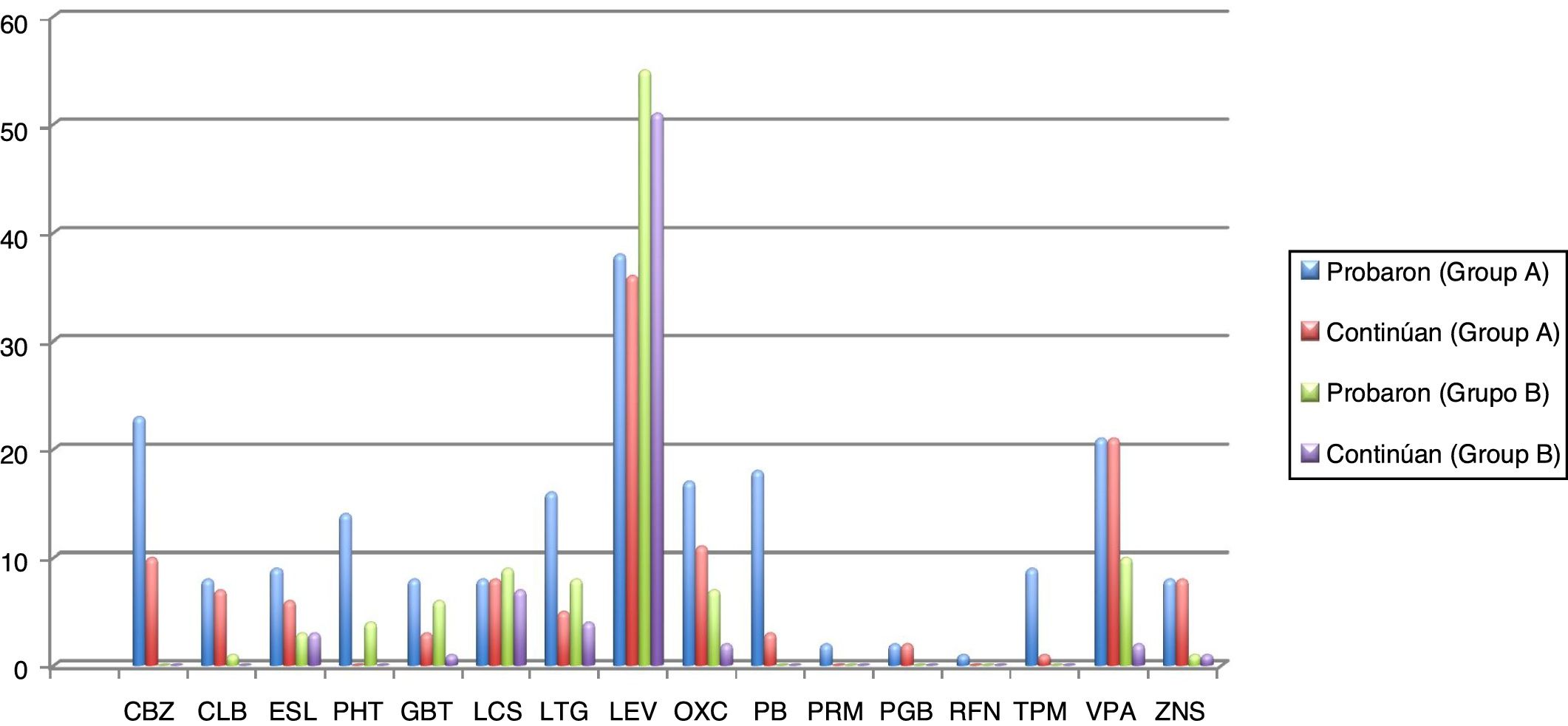
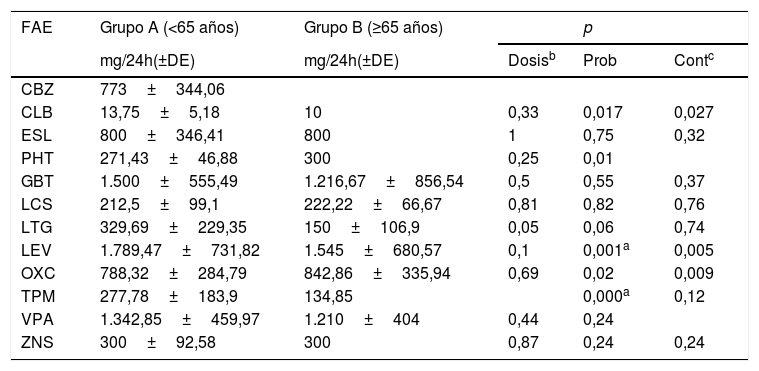
Revisando el tratamiento farmacológico de ambos grupos, el grupo B fue más fácilmente controlado con un solo fármaco (59,7%, N=37) que el grupo A (16,4%, N=10). De igual forma, el número de pacientes que necesitaron usar 3 FAE fue mayor en el A (18%, N=11) que en el B (16,1%, N=10), con significación estadística (p <0,001). Los fármacos más comúnmente utilizados en el grupo A fueron levetiracetam, oxcarbazepina, carbamazepina y ácido valproico, y los mejor tolerados fueron la lacosamida, levetiracetam, zonisamida y clobazam. En cambio, en el grupo B los fármacos más utilizados fueron levetiracetam, ácido valproico, lacosamida y lamotrigina, y la mejor tolerancia se obtuvo con eslicarbazepina, zonisamida, seguido de levetiracetam y lacosamida. En la figura 1 y en la tabla 4 se pueden observar los datos de los distintos fármacos en los 2grupos. En referencia a las dosis utilizadas en los 2grupos, estas fueron menores en el grupo B, sin diferencias significativas.
Número de pacientes del grupo A (<65 años) y del grupo B (≥65 años) que probaron los diferentes fármacos antiepilépticos, cuántos de ellos siguen tomándolos (continúan), ambos resultados expresados en número absoluto de pacientes. También se representa la dosis media (mg/24h), desviación estándar de la dosis media y rango (expresado en mg/24h).
CBZ: carbamazepina; CLB: clobazam; ESL: eslicarbazepina; GBT: gabapentina; LCS: lacosamida; LEV: levetiracetam; LTG: lamotrigina; OXC: oxcarbazepina; PB: fenobarbital; PGB: pregabalina; PHT: fenitoína; PRM: primidona; RFN: rufinamida; TPM: topiramato; VPA: ácido valproico; ZNS: zonisamida.
Fármacos antiepilépticos y dosis medias diaria (mg/24h) en ambos grupos
| FAE | Grupo A (<65 años) | Grupo B (≥65 años) | p | ||
|---|---|---|---|---|---|
| mg/24h(±DE) | mg/24h(±DE) | Dosisb | Prob | Contc | |
| CBZ | 773±344,06 | ||||
| CLB | 13,75±5,18 | 10 | 0,33 | 0,017 | 0,027 |
| ESL | 800±346,41 | 800 | 1 | 0,75 | 0,32 |
| PHT | 271,43±46,88 | 300 | 0,25 | 0,01 | |
| GBT | 1.500±555,49 | 1.216,67±856,54 | 0,5 | 0,55 | 0,37 |
| LCS | 212,5±99,1 | 222,22±66,67 | 0,81 | 0,82 | 0,76 |
| LTG | 329,69±229,35 | 150±106,9 | 0,05 | 0,06 | 0,74 |
| LEV | 1.789,47±731,82 | 1.545±680,57 | 0,1 | 0,001a | 0,005 |
| OXC | 788,32±284,79 | 842,86±335,94 | 0,69 | 0,02 | 0,009 |
| TPM | 277,78±183,9 | 134,85 | 0,000a | 0,12 | |
| VPA | 1.342,85±459,97 | 1.210±404 | 0,44 | 0,24 | |
| ZNS | 300±92,58 | 300 | 0,87 | 0,24 | 0,24 |
CBZ: carbamazepina; CLB: clobazam; Cont: continúan con el fármaco; ESL: eslicarbazepina; FAE: fármaco antiepiléptico; GBT: gabapentina; LCS: lacosamida; LEV: levetiracetam; LTG: lamotrigina; OXC: oxcarbazepina; PB: fenobarbital; PGB: pregabalina; PHT: fenitoína; PRM: primidona; Prob: probaron el fármaco; RFN: rufinamida; TPM: topiramato; VPA: ácido valproico; ZNS: zonisamida.
En referencia al uso de los fármacos antiepilépticos, considerando el número de variables analizadas, se aplicó el test post hoc de Bonferroni. Resultaron estadísticamente significativos los valores de la p igual o inferior a 0,0029.
La epilepsia es una enfermedad frecuente en el adulto, cuya incidencia se incrementa con la edad, y está relacionada con el aumento de otras enfermedades que pueden ser causa de epilepsia, especialmente tumores, ictus isquémicos o hemorrágicos, así como demencia13. Nuestros resultados muestran que la edad, por sí misma, es un factor que incrementa el riesgo para desarrollar epilepsia del anciano. En los pacientes que desarrollan la epilepsia a edades más tempranas (menos de 65 años), esta puede estar asociada a epilepsias idiopáticas generalizadas, malformaciones del desarrollo cortical, episodios postanóxicos intrauterinos o durante el parto así como esclerosis mesial temporal, entre otras etiologías.
En nuestro estudio se compararon 2grupos de pacientes epilépticos ancianos: aquellos que presentaron la epilepsia antes de los 65 años y aquellos que la presentaron después. El riesgo de estatus epiléptico en pacientes ancianos según el estudio publicado por Hesdorffer et al. es del 0,4% a la edad de 75 años14, y estudios posteriores muestran un riesgo de 86/100.000 en la población anciana, con una tendencia ascendente que alcanza los 100/100.000 entre los 70 y los 79 años15. En nuestro estudio, solo un paciente del grupo B tenía antecedentes de estatus epiléptico, mientras que en el grupo A hubo varios casos.
En el estudio publicado por Stephan et al.13, se estudiaron 3grupos, uno de inicio de la epilepsia después de los 50 y antes de los 65, otro de inicio y diagnóstico de epilepsia después de los 65 años y el tercero después de los 18 y antes de los 50. Respecto a los 2primeros grupos, se obtuvieron valores relativamente más elevados de crisis focales en ambos grupos, 26,9% y 21,5% respectivamente, comparado con un valor de 10% y 14% (grupos A y B) en nuestro estudio. Con relación a las crisis focales con afectación del nivel de conciencia, su prevalencia fue del 64,2% y del 48,1%, similares a las obtenidas en nuestro estudio (41 y 53%, respectivamente). Sin embargo, el porcentaje de crisis tónico-clónicas generalizadas en el grupo B fue inferior al del estudio Stephan (15% versus 46,8%). Este resultado fue más parecido al publicado por Hughes et al., en 199916. Consideramos importante la distinción de 2únicos grupos para valorar mejor el curso evolutivo de la enfermedad y las comorbilidades asociadas.
Como era esperado, un elevado porcentaje de pacientes en el grupo A tenían un estudio de neuroimagen normal en comparación con el otro grupo. Este resultado se asoció con una frecuencia superior de epilepsia de etiología idiopática en ese mismo grupo. También se encontraron más lesiones focales, especialmente por ictus y traumatismos, en el grupo B, que podían tener una relación causal directa con la etiología de la epilepsia.
Muy interesantes son los resultados obtenidos en cuanto a la frecuencia de comorbilidades en ambos grupos. Esa información es crucial para entender qué tipo de población estamos tratando y optimizar el tratamiento. Destacan los factores cardiovasculares, encabezados por la hipertensión, diabetes y dislipidemia; este último es el factor más frecuente de inicio temprano de epilepsia en la población. Esto podría ser consecuencia de los FAE utilizados para el manejo de la epilepsia en esta población, que podrían incrementar secundariamente el riesgo cardiovascular y, con ello, las lesiones cerebrales que se relacionan con epilepsia. En este sentido, el antecedente de ictus isquémico es mucho más prevalente que el hemorrágico en ambos grupos: ocurre en más del doble de veces en el grupo B que en el A, y representa la etiología más frecuente de crisis en la edad avanzada. Es importante también el elevado número de casos con deterioro cognitivo asociado a epilepsia de diagnóstico tardío. En contraposición, las comorbilidades psiquiátricas fueron más frecuentes en el grupo de pacientes con epilepsia de larga evolución. Una minoría de los pacientes, mayor en el grupo A que en el B, fue diagnosticada de síndrome de apnea-hipopnea del sueño.
Del mismo modo, es necesario un abordaje global del paciente teniendo en cuenta, además de su epilepsia y las comorbilidades asociadas, su rendimiento cognitivo y capacidad de autonomía. En estudios previos no se ha reportado un análisis de grado de dependencia. El grupo B tenía un nivel de dependencia mayor. En la bibliografía existen datos claros respecto del grado de dependencia en estos subgrupos de poblaciones. Optimizar al máximo el grado de dependencia y evitar nuevas crisis puede prevenir caídas, fracturas, al igual que hospitalizaciones e ingresos prematuros en residencias de ancianos17.
En lo referente al tratamiento de la epilepsia, se encontró una clara diferencia en el número de fármacos utilizados en los 2grupos: el 16,4% (N=10) en el grupo A se controlaron con un solo fármaco frente al 59,7% (N=37) del grupo B; del mismo modo, las dosis utilizadas fueron menores en el grupo B. Sin embargo, en el estudio de Tanaka et al. del año 2013, las dosis utilizadas en los pacientes ancianos fueron mucho menores que en nuestro estudio18. A diferencia del estudio de Phabphal et al., pero de forma similar al de Stephan et al., predomina el uso de FAE de más reciente incorporación en el mercado para intentar minimizar los efectos adversos19. Nos pareció relevante valorar no solamente los fármacos utilizados, sino también la tolerancia y cuáles tuvieron que ser interrumpidos. No existe una evidencia clara, pero nuestros datos indican que la nueva generación de FAE tiene mejor tolerancia, incluso a dosis relativamente altas, por la menor interacción con otros fármacos y mejor biofarmacocinética.
Por todo lo expuesto, se debe tener en cuenta a la hora de prescribir un FAE las comorbilidades que asocian los pacientes epilépticos. Un número significativo de ellos tiene factores de riesgo cardiovascular y el tratamiento con ciertos FAE puede incrementar de forma directa o indirecta la tendencia a eventos cardiovasculares20. Del mismo modo se debe evitar, en la medida de lo posible, la prescripción de FAE que puedan causar síntomas psiquiátricos, como depresión o psicosis en aquellos pacientes que padecen enfermedades mentales, para evitar el empeoramiento de sus propias enfermedades y garantizar una mejor adherencia al tratamiento antiepiléptico.
Contemplamos como limitaciones de nuestro estudio el hecho de que los pacientes incluidos fueron atendidos en la consulta monográfica de epilepsia de nuestro centro, por lo que puede existir un sesgo de selección de pacientes, probablemente más refractarios de lo esperado. Además, la obtención de datos fue retrospectiva, a partir de una revisión de historias clínicas. Futuros estudios con mayor volumen de pacientes son clave para obtener más información acerca de este subgrupo de pacientes cuya incidencia y presencia en la práctica clínica asistencial es cada vez mayor.
FinanciaciónLa presente investigación no ha recibido ninguna beca específica de agencias de los sectores público, comercial ni sin ánimo de lucro.
Conflicto de interesesEste proyecto no tiene ningún conflicto de intereses.