Los estados de hipercoagulabilidad se han estudiado como una de las posibles etiologías de la trombosis venosa cerebral y, desde hace unos años, también como factor predisponente de isquemia cerebral de origen arterial, especialmente en pacientes jóvenes. Esto podría tener implicaciones en el manejo terapéutico y la prevención secundaria, por lo que nos proponemos estudiar la frecuencia de anomalías protrombóticas en pacientes jóvenes con ictus isquémico, subgrupo en que otros factores de riesgo clásicos son menos habituales.
Material y métodosEstudio observacional con inclusión secuencial de los pacientes menores de 55 años con infarto cerebral o ataque isquémico transitorio ingresados en la unidad de ictus desde enero de 2005 hasta diciembre de 2007. Se analizaron datos demográficos, gravedad y subtipo de ictus, factores de riesgo, incluidos los estados de hipercoagulabilidad, y evolución.
ResultadosSe incluyó a 100 pacientes, de los que 65 eran varones, con una media ± desviación estándar de edad de 42,6±8,9 años. El 46% presentó estado de hipercoagulabilidad, sin diferencia por sexo. La hiperhomocisteinemia adquirida fue la alteración más frecuente (18%), seguida del déficit de proteína C o S (8%), la mutación para el factor V de Leiden (5%) y la mutación C677T del gen de la metiltetrahidrofolato reductasa (MTHFR) (5%). Otras alteraciones procoagulantes fueron síndrome antifosfolípido (3%), anticoagulante lúpico (2%), trombocitosis (3%) y mutación 20210A del gen de la protrombina (3%). No se encontró relación de estas alteraciones con otros factores de riesgo vascular, como tampoco se relacionó la hipercoagulabilidad con el ictus de mayor gravedad o peor evolución. Se observó una mayor presencia de estas alteraciones en los pacientes catalogados de ictus de origen aterotrombótico (p=0,04).
ConclusionesLos estados de hipercoagulabilidad son frecuentes en los pacientes menores de 55 años con ictus isquémico, encontrándose hasta en el 46% de ellos.
Hypercoagulable states have been reported as an established risk factor for cerebral venous thrombosis, but they have also been proposed as a predisposing factor for cerebral ischemia of arterial origin, especially among young patients. This may have implications on therapeutic management and secondary prevention. We have studied the frequency of prothrombotic abnormalities in young patients with ischaemic stroke, as other classic risk factors are less common in this group.
Materials and methodsObservational study with sequential inclusion of patients under 55 with stroke or transient ischaemic attack (TIA) admitted to the Stroke Unit from January 2005 through December 2007. We analysed demographic data, severity and subtype of stroke, risk factors, including the presence of hypercoagulable states, and outcome.
ResultsWe included 100 patients, of whom 65 were men. The mean age was 42.6±8.9 years, 46% with a hypercoagulable state, and no sex differences. Acquired hyperhomocysteinemia was the most common abnormality (18%), followed by protein C or S deficiency (8%), factor V Leiden mutation (5%) and methyl-tetrahydro-folate-reductase (MTHFR) C677T mutation (5%). Other findings included anticardiolipin antibodies (3%), presence of lupus anticoagulant (2%), thrombocytosis (3%) and G20210A prothrombin gene mutation (3%). No association was found between these states and the presence of other vascular risk factors, or more severe stroke or worse outcomes. There was an increased presence of these abnormalities in patients who were classified as atherothrombotic stroke (p=0.04).
ConclusionsThe hypercoagulable states are common in young patients with ischaemic stroke, being present in up to 46% of them.
Los estados de hipercoagulabilidad se han estudiado principalmente en relación con la trombosis venosa cerebral, en la que están hasta en un tercio de los casos1,2. Sin embargo, aunque menos estudiados, desde hace unos años cada vez parece más clara su implicación en la patogenia de la isquemia arterial, presentándose según diferentes series, hasta en un 5-10% en la población joven con ictus sin otros factores de riesgo concomitantes3,4. Hasta en un tercio de estos pacientes, el ictus es clasificado por su origen, indeterminado o criptogénico5, y el hallazgo de estos trastornos permitiría una orientación etiológica3 y, con ello, la posibilidad de implantar medidas de prevención secundaria adecuadas.
Aunque no existan estudios que recojan datos poblacionales de la frecuencia de las distintas alteraciones procoagulantes en la misma población adulta, análisis en población infantil y revisiones de series de casos en adultos destacan la alta frecuencia de los diferentes estados de hipercoagulabilidad en relación con el desarrollo de un infarto cerebral4,6.
Nos proponemos realizar un estudio descriptivo con el objeto de analizar la frecuencia de estos trastornos en pacientes jóvenes con infarto cerebral y ataque isquémico transitorio (AIT) ingresados en una unidad de ictus.
Pacientes y métodosEstudio observacional con inclusión secuencial de los pacientes ingresados en la unidad de ictus de nuestro servicio de neurología entre enero de 2005 y diciembre de 2007. Se seleccionó a los pacientes menores de 55 años con infarto cerebral o AIT. Los datos se obtuvieron de las historias clínicas de los pacientes y fueron incluidos de forma prospectiva en una base de datos de ictus.
Los parámetros analizados fueron: a) datos demográficos como edad y sexo; b) subtipo etiológico de infarto cerebral de acuerdo con la clasificación del Grupo de Estudio de Enfermedades Cerebrovasculares de la Sociedad Española de Neurología (GEECVSEN)7 (infarto cardioembólico, aterotrombótico, lacunar, de causa inhabitual y de origen indeterminado); c) factores de riesgo vascular previos: hipertensión arterial (HTA), diabetes mellitus (DM), hiperlipemia (hipercolesterolemia y/o hipertrigliceridemia); d) tabaquismo; e) abuso de alcohol; f) consumo de otras drogas; g) diagnóstico previo de migraña, definida según los criterios de la International Headache Society8, y h) foramen oval permeable objetivado mediante ecocardiograma transtorácico y/o transesofágico.
Se evaluó la gravedad del ictus medida por la Escala Canadiense de ictus (EC), tomando como valor de corte 6 puntos para diferenciar entre ictus graves (EC < 6) y leves. Se utilizó la Escala de Rankin modificada (ERm) para evaluar la situación funcional al alta, dicotomizando los valores según el grado de dependencia de los pacientes (los valores < 2 son indicativos de buena recuperación funcional e independencia).
Se realizó un análisis comparativo clasificando a los pacientes en dos grupos según presentaran o no alteraciones en el estudio de hipercoagulabilidad.
Durante la hospitalización, a todos los pacientes se les aplicó el programa de estudio y tratamiento de la unidad de ictus. Además de la monitorización de constantes vitales durante su estancia en la unidad, éste incluye al menos una prueba de imagen cerebral (tomografía computarizada y/o resonancia magnética), estudio hemático y bioquímico de laboratorio, radiografía de tórax, electrocardiograma, estudio Doppler/dúplex carotídeo, de sistema vertebrobasilar y transcraneal, monitorización con Doppler transcraneal para la detección de shunt derecha-izquierda y ecocardiograma transtorácico (ETT) con contraste. En los casos con sospecha de cortocircuito derecha-izquierda, se realizó un ecocardiograma trasesofágico para confirmar la presencia de foramen oval permeable.
A los pacientes menores de 55 años se les solicitó, durante el ingreso hospitalario, un estudio hemático completo para detectar alteraciones en la coagulación tanto genéticas como adquiridas, que incluía la determinación de la mutación G1691 del factor V Leiden, mutación G20210A del gen de la protrombina, mutación C677T del gen de la metiltetrahidrofolato reductasa (MTHFR), concentraciones de proteínas C y S, anticoagulante lúpico, anticuerpos anticardiolipina, resistencia a la proteína C activada, valores de homocisteína en plasma y recuento plaquetario.
Clasificamos los hallazgos hemáticos, según su grado de evidencia como factores relacionados etiológicamente con el ictus, en alteraciones “Mayores” (con fuerte evidencia de asociación) y “Menores” (con alguna evidencia), basándonos en la revisión propuesta por Levine4. A su vez, diferenciamos subgrupos según se tratara de estados de hipercoagulabilidad adquiridos o genéticos.
El estudio de factores de hipercoagulabilidad se repitió a los 3 meses con objeto de descartar falsos positivos por alteraciones debidas a la fase aguda del ictus3. Los datos que se incluyeron en el estudio son los definitivos a los 3 meses.
Para el análisis estadístico se utilizó el programa SPSS 15.0 para Windows. El análisis univariable se desarrolló con la prueba de la χ2 o el test exacto de Fisher para variables dicotómicas. Se consideraron significativos los valores de p<0,05. Los resultados se presentan con un intervalo de confianza (IC) del 95%.
ResultadosDe un total de 120 pacientes que cumplían los criterios de inclusión (diagnóstico de infarto cerebral o AIT en menores de 55 años), a 20 no se les realizó estudio de hematología para detección de anomalías de la coagulación, por lo que fueron excluidos del análisis, con un total de 100 pacientes analizados (70 con infarto cerebral y 30 con AIT).
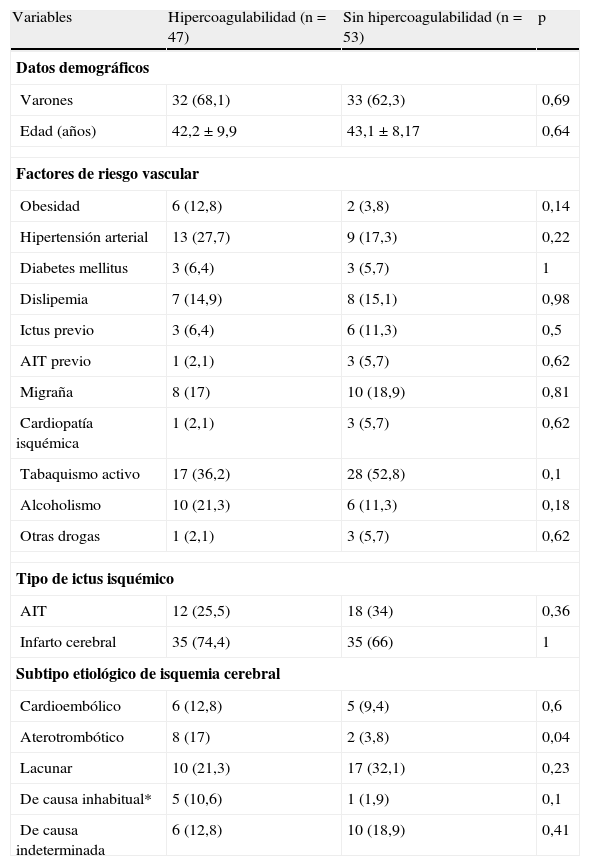
Las características de la muestra de pacientes incluidos se detallan en la tabla 1. No observamos diferencias significativas en la distribución de factores de riesgo vascular entre los grupos con o sin estados de hipercoagulabilidad asociados.
Datos demográficos, factores de riesgo vascular y subtipo de ictus según los estados de hipercoagulabilidad.
| Variables | Hipercoagulabilidad (n=47) | Sin hipercoagulabilidad (n=53) | p |
| Datos demográficos | |||
| Varones | 32 (68,1) | 33 (62,3) | 0,69 |
| Edad (años) | 42,2±9,9 | 43,1±8,17 | 0,64 |
| Factores de riesgo vascular | |||
| Obesidad | 6 (12,8) | 2 (3,8) | 0,14 |
| Hipertensión arterial | 13 (27,7) | 9 (17,3) | 0,22 |
| Diabetes mellitus | 3 (6,4) | 3 (5,7) | 1 |
| Dislipemia | 7 (14,9) | 8 (15,1) | 0,98 |
| Ictus previo | 3 (6,4) | 6 (11,3) | 0,5 |
| AIT previo | 1 (2,1) | 3 (5,7) | 0,62 |
| Migraña | 8 (17) | 10 (18,9) | 0,81 |
| Cardiopatía isquémica | 1 (2,1) | 3 (5,7) | 0,62 |
| Tabaquismo activo | 17 (36,2) | 28 (52,8) | 0,1 |
| Alcoholismo | 10 (21,3) | 6 (11,3) | 0,18 |
| Otras drogas | 1 (2,1) | 3 (5,7) | 0,62 |
| Tipo de ictus isquémico | |||
| AIT | 12 (25,5) | 18 (34) | 0,36 |
| Infarto cerebral | 35 (74,4) | 35 (66) | 1 |
| Subtipo etiológico de isquemia cerebral | |||
| Cardioembólico | 6 (12,8) | 5 (9,4) | 0,6 |
| Aterotrombótico | 8 (17) | 2 (3,8) | 0,04 |
| Lacunar | 10 (21,3) | 17 (32,1) | 0,23 |
| De causa inhabitual* | 5 (10,6) | 1 (1,9) | 0,1 |
| De causa indeterminada | 6 (12,8) | 10 (18,9) | 0,41 |
AIT: ataque isquémico transitorio.
*Infartos catalogados como causa inhabitual antes de completarse el estudio de hipercoagulabilidad.
Los datos expresan n (%) o media ± desviación estándar.
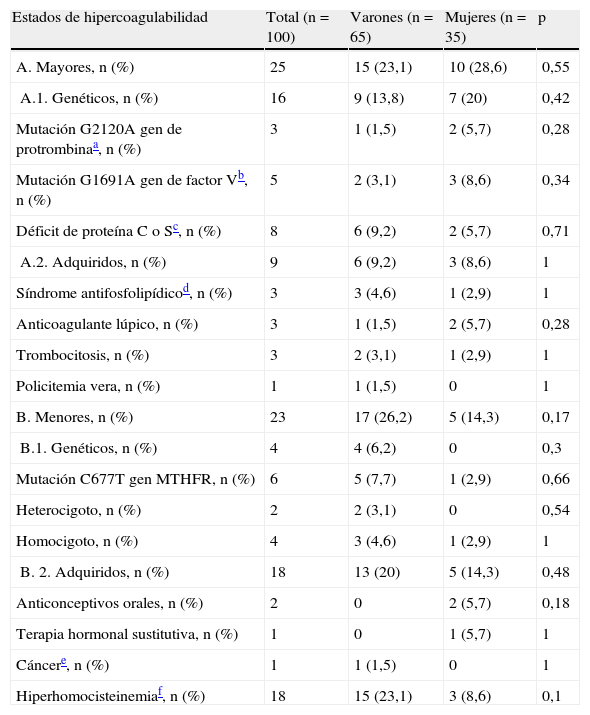
En el 46% de los pacientes se detectó un estado de hipercoagulabilidad; de base genética en el 20% y adquirido en el 27%. Un 2% presentaba combinación de ambas formas.
La distribución de los diferentes hallazgos en el estudio hemático se detallan en la tabla 2. La alteración más frecuentemente encontrada fue la hiperhomocisteinemia, adquirida (18%) o por mutación del gen de la MTHFR (5%); seguida de el déficit de proteína S o C (8%) y la mutación del factor V Leiden (5%).
Estados de hipercoagulabilidad según el sexo.
| Estados de hipercoagulabilidad | Total (n=100) | Varones (n=65) | Mujeres (n=35) | p |
| A. Mayores, n (%) | 25 | 15 (23,1) | 10 (28,6) | 0,55 |
| A.1. Genéticos, n (%) | 16 | 9 (13,8) | 7 (20) | 0,42 |
| Mutación G2120A gen de protrombinaa, n (%) | 3 | 1 (1,5) | 2 (5,7) | 0,28 |
| Mutación G1691A gen de factor Vb, n (%) | 5 | 2 (3,1) | 3 (8,6) | 0,34 |
| Déficit de proteína C o Sc, n (%) | 8 | 6 (9,2) | 2 (5,7) | 0,71 |
| A.2. Adquiridos, n (%) | 9 | 6 (9,2) | 3 (8,6) | 1 |
| Síndrome antifosfolipídicod, n (%) | 3 | 3 (4,6) | 1 (2,9) | 1 |
| Anticoagulante lúpico, n (%) | 3 | 1 (1,5) | 2 (5,7) | 0,28 |
| Trombocitosis, n (%) | 3 | 2 (3,1) | 1 (2,9) | 1 |
| Policitemia vera, n (%) | 1 | 1 (1,5) | 0 | 1 |
| B. Menores, n (%) | 23 | 17 (26,2) | 5 (14,3) | 0,17 |
| B.1. Genéticos, n (%) | 4 | 4 (6,2) | 0 | 0,3 |
| Mutación C677T gen MTHFR, n (%) | 6 | 5 (7,7) | 1 (2,9) | 0,66 |
| Heterocigoto, n (%) | 2 | 2 (3,1) | 0 | 0,54 |
| Homocigoto, n (%) | 4 | 3 (4,6) | 1 (2,9) | 1 |
| B. 2. Adquiridos, n (%) | 18 | 13 (20) | 5 (14,3) | 0,48 |
| Anticonceptivos orales, n (%) | 2 | 0 | 2 (5,7) | 0,18 |
| Terapia hormonal sustitutiva, n (%) | 1 | 0 | 1 (5,7) | 1 |
| Cáncere, n (%) | 1 | 1 (1,5) | 0 | 1 |
| Hiperhomocisteinemiaf, n (%) | 18 | 15 (23,1) | 3 (8,6) | 0,1 |
MTHFR: metiltetrahidrofolato reductasa.
Se observa también la combinación de más de una alteración procoagulante en un 7% de los pacientes; la hiperhomocisteinemia fue la alteración que más frecuentemente se asociaba a otras.
Hemos encontrado relación entre los estados de hipercoagulabilidad en general (p=0,04) y el ictus catalogado como aterotrombótico, que no se demostró para la presencia de hiperhomocisteinemia en solitario, a pesar de que se ha descrito que esta alteración se relaciona con la afección de grandes arterias y, en menor medida, con el infarto cerebral lacunar9. Esto no supone diferencias en las características de los pacientes, que no presentaban estenosis mayores en el estudio Doppler.
Tras la realización de una monitorización con Doppler transcraneal con inyección de suero agitado para la detección de un posible shunt derecha-izquierda, se realizaron estudios ecocardiográficos transtorácicos y/o transesofágicos a 51 pacientes con sospecha de FOP. Sólo 20 de ellos presentaron esta anomalía estructural, sin relación de la hipercoagulabilidad con el desarrollo de ictus (sólo el 35% de los pacientes con FOP presentaban alteraciones en el estudio hemático, sin diferencias significativas con el subgrupo sin ellas) (p=0,11).
Respecto a la gravedad del ictus al ingreso, los pacientes con factores de hipercoagulabilidad mostraron una tendencia a mayor frecuencia de ictus graves (EC<6) (el 14,9 frente al 9,4%; p=0,40). No se observaron diferencias en la evolución funcional, que fue buena en ambos grupos, según la ERm al alta, con el 90,6% de los pacientes sin alteraciones procoagulantes con una puntuación < 2 frente al 82,6% de los que tenían un estado de hipercoagulabilidad (p=0,24).
DiscusiónLos estados de hipercoagulabilidad en pacientes menores de 55 años con ictus isquémico son un hallazgo muy frecuente llegando a afectar al 46%, es decir, casi uno de cada 2 pacientes jóvenes con infarto cerebral.
La hiperhomocisteinemia, con o sin mutación concomitante, es la alteración más frecuente, seguida de la mutación del factor V Leiden, lo que parece corresponderse con hallazgos en la población general10,11 y otros estudios sobre pacientes con infarto cerebral3,6,12.
No encontramos relación entre trastornos hemáticos y otros factores de riesgo cerebrovascular (HTA, DM, DL) ni consumo de tóxicos.
En los pacientes cuyo ictus se catalogó de origen aterotrombótico, se observó mayor frecuencia de estados de hipercoagulabilidad (p=0,04) respecto a otros subtipos etiológicos, sin que esto supusiera una mayor frecuencia de estenosis extracraneales o intracraneales ni de hiperhomocisteinemia, como señalan estudios previos9.
Respecto a la presencia de migraña, FOP y estados de hipercoagulabilidad, en nuestro análisis no hemos podido demostrar asociación entre alteraciones protrombóticas y shunt por comunicación interauricular en el contexto del ictus; como tampoco hemos demostrado mayor prevalencia de migraña en el grupo de pacientes con hipercoagulabilidad, como señalan otros estudios13.
Aunque recomendado, la utilidad del estudio hemático en busca de alteraciones procoagulantes se ha debatido como test diagnóstico sistemático en infartos cerebrales en adultos sin antecedentes personales o familiares de estados de hipercoagulabilidad o trombosis venosa3,4,14–17. Esto se debe al bajo valor predictivo positivo de estas determinaciones11. Su importancia en el caso del estudio etiológico del infarto cerebral (y también en trombosis venosas) en niños parece más evidente, y forma parte de los estudios de laboratorio habituales en esta población6,15,18. Que la frecuencia encontrada en nuestra muestra sea más elevada que la descrita en trabajos anteriores3,4 podría deberse tanto al hecho de que se centra exclusivamente en pacientes menores de 55 años como a la extensa batería de tests diagnósticos de estados de hipercoagulabilidad utilizada. Sin embargo, parece útil, y de alta rentabilidad diagnóstica, la determinación de estados de hipercoagulabilidad en este grupo de pacientes, ya que se encuentran en aproximadamente uno de cada 2 pacientes jóvenes con infarto cerebral.
Los factores de riesgo y la etiología del ictus isquémico en población joven difieren notablemente de lo observado en pacientes de mayor edad, y hay factores predisponentes, que si bien no serían exclusivos de este grupo de edad, tendrían mayor valor en él por no haber en general otros factores de riesgo concomitantes. Esto supone un reto diagnóstico para los neurólogos5,19.
En el ictus de etiología indeterminada, cuya frecuencia varía según las series, pero puede suponer hasta un tercio de los casos en los jóvenes5, la búsqueda de estados protrombóticos tendría más valor si cabe, ya que el estudio hemático puede suponer la filiación de la causa de la isquemia cerebral, pasando a diagnosticarse un ictus de causa inhabitual7. En nuestro caso, 6 pacientes, en los que inicialmente no se encontró un mecanismo etiológico mediante las pruebas complementarias habituales, fueron diagnosticados de ictus de etiología inhabitual tras encontrarse alteraciones en el estudio hemático en busca de alteraciones procoagulantes.
No obstante, se requirirán más estudios para determinar el papel de los estados de hipercoagulabilidad en la fisiopatología de la isquemia cerebral, así como en el riesgo de recurrencia, tanto de manera aislada como en relación con otros factores.
Encontrar una causa potencial en estos pacientes conlleva un mejor manejo terapéutico10,20,21 y la posibilidad de disminuir el riesgo de recurrencias22,23 con medidas de prevención secundaria. Aunque en general se recomienda la antiagregación plaquetaria como fármaco eficaz en la prevención de nuevos eventos (clase IIa, nivel de evidencia C), hay circunstancias en las que la anticoagulación oral de estos pacientes está indicada (en casos con antecedentes de trombosis venosa profunda y trombofilia hereditaria, clase I, nivel de evidencia A, o en aquellos con síndrome antifosfolipídico que asocie trombosis arteriales o venosas, clase IIa, nivel de evidencia B). Otros tratamientos específicos propuestos, en el caso del déficit de proteína S, incluyen transfusiones sanguíneas repetidas (clase IIb, nivel de evidencia C).
Como conclusión, hasta un 46% de los pacientes menores de 55 años con infarto cerebral agudo presentaron un estado de hipercoagulabilidad. Por lo tanto, sería recomendable el estudio de hipercoagulabilidad en pacientes jóvenes con ictus isquémico, porque podría contribuir en el proceso trombótico. Futuros estudios deberían aclarar su influencia en la fisiopatología de la isquemia cerebral.
FinanciaciónNo se ha recibido financiación para la elaboración de este estudio.
PresentaciónPresentado en la LX Reunión de la Sociedad Española de Neurología en formato póster.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.