Aún no es posible estimar la proporción de pacientes con la COVID-19 que presentan síntomas y síndromes neurológicos clásicos diferenciables.
Nuestro objetivo es estimar la incidencia de síntomas sensitivos (hipoestesia, parestesias e hiperalgesia), en médicos que han sufrido la COVID-19 en el Hospital Universitario Fundación Alcorcón de Madrid; relacionar la clínica sensitiva con la presencia de otros síntomas o signos de la infección y estudiar la asociación con la gravedad de la COVID-19.
MétodosEstudio descriptivo, transversal, retrospectivo y de carácter observacional. La población del estudio incluyó a médicos del Hospital Universitario Fundación Alcorcón que presentaron infección por SARS-CoV-2 entre el 1 de marzo y el 25 de julio del 2020. Se hizo llegar a través del correo electrónico corporativo una encuesta voluntaria y anónima en la que se recogieron características sociodemográficas y clínicas de aquellos trabajadores con confirmación de la COVID-19 por PCR o serología.
ResultadosLa encuesta se envió a 801 médicos. Contestaron 89. La edad media fue de 38,28 años; el 17,98% presentó clínica sensitiva. Se encontró una relación significativa entre la presencia de parestesias y tos, fiebre, mialgias, astenia y disnea. Se observó una relación significativa entre las parestesias y la necesidad de recibir tratamientos e ingresar por la COVID-19. El 87,4% presentó la clínica sensitiva a partir del 5.° día de la enfermedad.
ConclusionesLa infección por SARS-CoV-2 se puede acompañar de clínica sensitiva que refleje cuadros más graves; aparece diferida en el tiempo, lo que podría corresponder con un probable origen parainfeccioso en el que quizá influya un trasfondo de autoinmunidad.
It is not yet possible to estimate the proportion of patients with COVID-19 who present distinguishable classical neurological symptoms and syndromes.
The objective of this study is to estimate the incidence of sensory symptoms (hypoaesthesia, paraesthesia, and hyperalgesia) in physicians who have presented the disease at Hospital Universitario Fundación Alcorcón (HUFA) in Madrid; to establish the relationship between sensory symptoms and the presence of other signs of infection; and to study their association with the severity of COVID-19.
MethodsWe conducted a descriptive, cross-sectional, retrospective, observational study. HUFA physicians who presented SARS-CoV-2 infection between 1 March and 25 July 2020 were included in the study. A voluntary, anonymous survey was distributed via corporate email. Sociodemographic and clinical characteristics were collected from professionals with PCR- or serology-confirmed COVID-19.
ResultsThe survey was sent to 801 physicians and we received 89 responses. The mean age of respondents was 38.28 years. A total of 17.98% presented sensory symptoms. A significant relationship was found between the presence of paraesthesia and cough, fever, myalgia, asthaenia, and dyspnoea. A significant relationship was also found between paraesthesia and the need for treatment and admission due to COVID-19. Sensory symptoms were present from the fifth day of illness in 87.4% of cases.
ConclusionsSARS-CoV-2 infection can be associated with sensory symptoms, mostly in severe cases. Sensory symptoms often appear after a time interval, and may be caused by a parainfectious syndrome with an autoimmunity background.
Desde el 31 de diciembre de 2019 estamos viviendo una pandemia a nivel mundial iniciada en Wuhan (China), causada por un nuevo agente infeccioso conocido desde el 7 de enero de 2020 e identificado como un nuevo tipo de virus de la familia Coronaviridae, que se ha nombrado «nuevo coronavirus», 2019-nCoV. Posteriormente el virus se denominó SARS-CoV-2 y a la enfermedad se la denomina COVID-19. Se trata de un β-coronavirus y es el tercer coronavirus zoonótico identificado después del SARS y el MERS.
Todavía no es posible estimar la proporción de pacientes con la COVID-19 que presentan síntomas y síndromes neurológicos clásicos diferenciables. En general, los trabajos publicados hasta la fecha son series de pacientes en las que las complicaciones neurológicas son un objetivo secundario.
Si bien en la bibliografía consultada no se han encontrado descripciones de parestesias aisladas o hiperalgesia relacionadas con el curso leve de la infección de SARS-CoV-2, sí se han descrito diversas alteraciones neurológicas.
La manifestación neurológica asociada a la infección viral se ha visto en otros brotes de coronavirus. En el caso del SARS se han descrito casos de polineuropatía axonal a las 2-4 semanas del inicio de los síntomas víricos, y se ha postulado que las afectaciones en el sistema nervioso periférico podrían atribuirse a reacciones inmunes postinfecciosas, sin poder descartar afectación directa del virus en los nervios y ganglios1. Es posible que el SARS haya causado una disfunción inmune con la producción de varios mediadores proinflamatorios que no solo dañen el pulmón, sino también los nervios2,3. Se ha observado, además, que la infección aguda puede producir daño a las células por citólisis, pero también por un proceso inmunopatológico1.
La pérdida de gusto u olfato relacionada con la infección por SARS-CoV-2 se ha descrito como una de las manifestaciones neurológicas leves del virus4. También hay descritos casos de Guillain-Barré asociados a la COVID-195, lo que indica un patrón parainfeccioso6 así como un caso de una encefalitis vírica por este virus7.
En un estudio realizado en Wuhan (China) con una muestra de 214 pacientes confirmados para la COVID-19, se observó que el 36,4% (78 pacientes) presentó síntomas neurológicos, la mayoría de los cuales eran de origen central8. El 8,9% de los pacientes (n=19) tuvieron síntomas relacionados con el sistema nervioso periférico. De ellos, 12 pacientes cursaron con síntomas leves de la COVID-19, mientras que los 7 restantes cumplían criterios de gravedad de la infección.
En un estudio realizado en 2unidades de cuidados intensivos (UCI) de Estrasburgo (Francia), se observó clínica neurológica consistente en encefalopatía, agitación, confusión y síntomas corticoespinales en un 12% de los pacientes críticos ingresados en la UCI. Esta incidencia está probablemente infraestimada por las características de los pacientes (intubación, sedación, bloqueo neuromuscular). No es posible asegurar si dicha clínica era debida al propio estado crítico del paciente, si era secundaria a la tormenta de citocinas, si era derivada de la medicación usada o era efecto directo del virus9.
En el registro llevado a cabo por la Sociedad Española de Neurología, en el que 12 comunidades autónomas han notificado los casos de manifestaciones neurológicas en pacientes infectados por SARS-CoV-2 a fecha de 12 de abril de 2020, se han identificado 131 eventos neurológicos. La sintomatología más frecuente es la de síndrome confusional o encefalopatía leve-moderada (28,3%), seguida del infarto cerebral (22,8%) y 7 pacientes (7,6%) presentaron polirradiculoneuropatía. También se describe algún caso de afectación del sistema nervioso periférico en forma de neuropatía, radiculopatía y plexopatía. La PCR de SARS-CoV-2 en líquido cefalorraquídeo fue negativa en los 27 pacientes en los que se determinó10.
Los mecanismos patogénicos relacionados con las complicaciones neurológicas que presentan los pacientes con la COVID-19 son actualmente desconocidos. De manera similar a lo que ocurre con otras infecciones virales, podría haber una infección directa del sistema nervioso, una encefalopatía tóxica aguda por infección sistémica grave o lesiones desmielinizantes postinfecciosas. Se ha visto que existen niveles elevados de dímero D, trombocitopenia y datos patológicos de microangiopatía, por lo que podrían existir otros mecanismos precipitantes de ictus11. Además, el síndrome de respuesta inflamatoria sistémica podría ocasionar daño inmunológico neuronal12: la liberación masiva de citocinas puede alterar la permeabilidad vascular, producir coagulopatía y un efecto proinflamatorio13.
El objetivo de nuestro estudio es estimar la incidencia de síntomas sensitivos (hipoestesia, parestesias e hiperalgesia), en personal sanitario que ha presentado infección por SARS-CoV-2 en nuestro centro, el Hospital Universitario Fundación Alcorcón (HUFA) de Madrid.
Como objetivos secundarios, se intentó relacionar la clínica sensitiva con la presencia de otros síntomas o signos de enfermedad por COVID-19 y ver si existía una asociación entre estos y la gravedad por infección por SARS-CoV-2.
Dada la escasa bibliografía previa acerca de clínica sensitiva en la COVID-19, creemos que nuestro estudio es novedoso a la hora de intentar recopilar los casos que presentaron dicha sintomatología, conocer su incidencia e intentar establecer relación con alguna variable (sociodemográfica, clínica o terapéutica) que pudiera plantear nuevos estudios.
Material y métodosEstudio descriptivo, transversal, retrospectivo, de carácter observacional, que trata de relacionar los síntomas neurológicos sensitivos con la infección pasada o en evolución del SARS-CoV-2.
La población del estudio incluyó a médicos facultativos y residentes de todas las especialidades de nuestro hospital (HUFA), que presentaron infección por SARS-CoV-2 durante el periodo comprendido entre el 1 de marzo y el 25 de julio del 2020. El estudio fue aprobado de forma previa por el Comité de Ética de la Investigación del HUFA. Ninguno de los diseñadores del estudio presentó ningún conflicto de interés.
La infección por SARS-CoV-2 se estableció por pruebas de laboratorio que demostraran directamente la presencia de la infección (PCR viral en exudado nasofaríngeo) o de manera indirecta la enfermedad (serología positiva por el método ELISA) en la realización de un estudio de seroprevalencia llevado a cabo en el hospital a todo el personal sanitario. Como única excepción, se incluyó a una paciente sin PCR realizada y con serología negativa, que presentó clínica muy sugestiva de infección por SARS-CoV-2 (respiratoria y gastrointestinal) con ambiente epidemiológico positivo (convivientes con PCR positiva) en contexto de pandemia. Se interpretó la IgG negativa como una negativización (en algunos casos, el estudio serológico se demoró hasta meses después del cuadro clínico) y el resultado de la PCR como un falso negativo.
Se recogieron variables clínicas en relación con sintomatología compatible para la COVID-19 en contexto epidémico: fiebre con clínica respiratoria (tos, congestión nasal, estornudos, disnea, broncoespasmo) u otros síntomas también achacables a dicho virus (astenia, mialgias, lumbalgia, náuseas o vómitos, diarrea, anosmia, ageusia o cefalea). Por otra parte, se analizan variables sociodemográficas. También se incluyeron variables diagnósticas, en función de los resultados de laboratorio (PCR y serología); terapéuticas siguiendo los protocolos vigentes en el HUFA en ese momento y, por último, variables de evolución (días de duración de clínica de la COVID-19, días de duración de la clínica sensitiva y latencia entre la aparición de sintomatología de la COVID-19 y la clínica sensitiva).
Para la recogida de datos se hizo llegar, a través del correo electrónico corporativo de los médicos facultativos y residentes de todas las especialidades del HUFA, una encuesta para rellenar de forma voluntaria y anónima a través del programa Google Doc. La encuesta se adjunta en el anexo I. Se siguieron las normas CHERRIES para su validación. En total se envió a 801 personas, de las que contestaron 89.
En dicha encuesta se recogieron las características sociodemográficas y clínicas de aquellos trabajadores que tuvieron síntomas con confirmación de la COVID-19, bien mediante PCR o serología. En nuestra población hospitalaria, según el estudio serológico llevado a cabo en nuestro centro, la prevalencia fue de un 39,6% para la COVID-19 entre los médicos14.
Los datos se han descrito con frecuencias absolutas y relativas para las variables cualitativas y media y con desviación estándar o mediana y rango intercuartílico para variables cuantitativas. Como resultado principal se ha estimado la frecuencia de síntomas sensitivos, calculando el intervalo de confianza al 95% por el método de Wilson. Se estudiaron las diferencias entre los pacientes con y sin síntomas mediante un análisis univariante: la comparación entre variables cualitativas se realizó mediante el test de ?? o el test exacto de Fisher y para comparar la distribución de las variables cuantitativas se calculó la prueba t de Student para 2muestras independientes o la prueba no paramétrica U de Mann-Whitney, según la distribución de los datos. Se estudió la asociación entre la presencia de síntomas y la gravedad de la enfermedad. Como medida de asociación se estimó la odds ratio sin ajustar y ajustada por edad, sexo y comorbilidades, mediante modelos de regresión logística. Todos los test se consideraron bilaterales y como estadísticamente significativos aquellos p-valores menores de 0,05.
ResultadosNuestro trabajo contó con un tamaño muestral de 89 sanitarios de nuestro centro que presentaron infección por SARS-CoV-2 demostrada por PCR o serología. La edad media fue de 38,28 años±11,16 (DE). La distribución por sexos fue de 54 mujeres (60,7%) y 35 varones (39,3%).
De los encuestados, 86 (96,6%) tuvieron algún síntoma. Los principales síntomas y sus frecuencias se recogen en la tabla 1.
Datos clínicos de la población a estudio que presentó algún síntoma compatible con infección por SARS-CoV-2
| Variable | N pacientes | % pacientes |
|---|---|---|
| Síntoma | ||
| Febrícula o fiebre | 47 | 52,8 |
| Astenia | 51 | 57,3 |
| Mialgias | 48 | 53,9 |
| Lumbalgia | 24 | 27 |
| Tos | 41 | 46,1 |
| Congestión nasal | 23 | 25,8 |
| Estornudos | 15 | 16,9 |
| Disnea | 17 | 19,1 |
| Broncoespasmo | 8 | 9 |
| Nauseas o vómitos | 8 | 9 |
| Diarrea | 29 | 32,6 |
| Parestesias | 8 | 9 |
| Hipoestesia | 3 | 3,4 |
| Hiperalgesia | 4 | 4,5 |
| Anosmia | 46 | 51,7 |
| Ageusia | 40 | 44,9 |
| Cefalea | 9 | 10,1 |
| Respuestas | 89 | 100 |
| Localización de la clínica sensitiva | ||
| Miembro superior izquierdo | 1 | 6,25 |
| Miembro superior derecho | 2 | 12,5 |
| Ambos miembros superiores | 4 | 25 |
| Ambos miembros inferiores | 2 | 12,5 |
| 4 extremidades | 2 | 12,5 |
| Zona dorsal aislada | 3 | 18,75 |
| Lengua | 1 | 6,25 |
| No especificada | 2 | 12,5 |
| Pacientes con clínica sensitiva | 16 | 100 |
| Opciones PCR o serología | ||
| PCR +, IgG+ | 48 | 53,9 |
| PCR −, IgG+ | 10 | 11,2 |
| PCR no realizada, IgG+ | 30 | 33,7 |
| PCR no realizada, IgG − | 1 | 1,12 |
| Respuestas | 89 | 100 |
De los 89 pacientes, 16 individuos (un 17,98% del total) presentaron clínica sensitiva aislada o combinada con otros síntomas. De los 16 sujetos con clínica sensitiva, 8 experimentaron parestesias (50,0%), 3 pacientes hipoestesia (18,75%) y 4 pacientes hiperalgesia (25%). La localización de la afectación sensitiva se detalla en la tabla 1.
Al estudiar la asociación entre clínica sensitiva y otra clínica de la COVID-19, se vio que existe una relación estadísticamente significativa (p<0,05) entre la presencia de parestesias y tos (p = 0,014), disnea y parestesias (p = 0,001), disnea y clínica sensitiva incluyendo parestesias, hipoestesia e hiperalgesia (p = 0,014), astenia y clínica sensitiva (p = 0,001), fiebre y parestesias ((p = 0,042), fiebre y clínica sensitiva ((p = 0,033) y mialgias con clínica sensitiva ((p = 0,044).
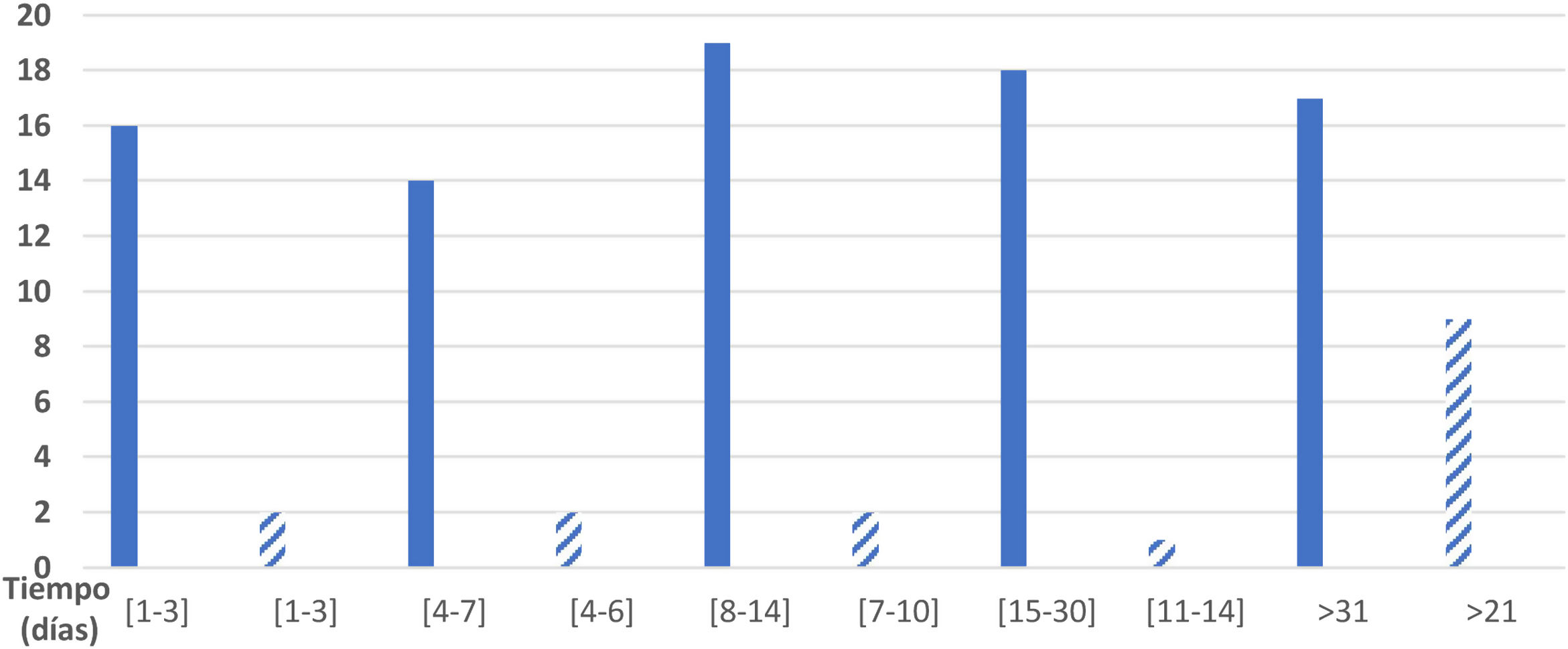
De los 89 encuestados, 84 especificaron el tiempo de duración de la sintomatología de la infección por SARS-CoV-2. La duración total de los síntomas fue de 1-3 días en el caso de 16 pacientes (19,0%); de 4-7 días en 14 pacientes (16,7%); de 8-14 días en 19 pacientes (22,6%); de 15-30 días en 18 pacientes (21,4%) y de más de un mes en el caso de 17 pacientes (20,2%); 5 de los encuestados no contestaron. En la figura 1 puede verse la distribución de pacientes por intervalo de tiempo de duración de la sintomatología sensitiva.
Se recogieron los días transcurridos desde el inicio clínico de la enfermedad hasta la aparición de los síntomas sensitivos: de 1 a 2 días, un paciente; de 3 a 4 días, un paciente; de 5 a 7 días, 4 pacientes; de 8 a 10 días, 4 pacientes; de 8 a 10 días, 4 pacientes; de 15 a 20 días, 2 pacientes; de 21 a 30 días, un paciente; más de 31 días, 3 pacientes.
En cuanto a la duración de la clínica sensitiva, 2 de los 16 pacientes (12,5%) mantuvieron la clínica durante un período de 1 a 3 días; 2 pacientes (12,5%) durante un período de 4 a 6 días; 2 pacientes (12,5%) durante un período de 7 a 10 días, un paciente (6,25%) en un periodo de 11 a 14 días y 9 pacientes (56,25%) de 21 días en adelante, por lo que no se pudo calcular una media de duración de los síntomas. Los datos vienen representados en la figura 1.
Con relación a los antecedentes de los encuestados, los datos se resumen en la tabla 2. Respecto a los antecedentes de enfermedad autoinmune: 3 pacientes tenían artritis psoriásica; un paciente, tiroiditis de Hashimoto y otro, enfermedad de Graves.
Distribución de pacientes en función de antecedentes personales y antecedentes familiares
| Antecedente personal o familiar | N encuestados que dieron una respuesta positiva | n de los cuales presentaron clínica sensitiva (hipoestesia, parestesias o hiperalgesia) | % |
|---|---|---|---|
| AP enfermedad autoinmune | 5 | 2 | 40 |
| AP infección zoster | 5 | 1 | 20 |
| AP clínica sensitiva previa | 2 | 0 | 0 |
| AF patología autoinmune | 6 | 1 | 16,7 |
AF: antecedente familiar; AP: antecedente personal.
Solo presentaron clínica sensitiva un paciente con antecedente de artritis psoriásica (parestesias e hipoestesia) y el paciente que padecía enfermedad de Graves (hipoestesia). Esto supone que 2 de los 16 pacientes que experimentaron clínica sensitiva (un 12,5%) tenían diagnosticada una enfermedad autoinmune previa.
No existía relación estadísticamente significativa entre presentar clínica sensitiva y tener antecedente de enfermedad autoinmune (p>0,05), pero presentar antecedente de enfermedad autoinmune sí que se relacionó con la aparición de hipoestesia durante la infección (2 de 5 pacientes, el 40%), lo que alcanzó la significación estadística (p=0,007). Ninguno de ellos había tenido clínica sensitiva previamente.
Por otro lado, un paciente con antecedentes familiares de enfermedad autoinmune (hipotiroidismo) presentó clínica sensitiva (parestesias); 5 pacientes tenían antecedente de infección por zóster cutáneo; 2 pacientes (sin diagnóstico de enfermedad autoinmune) describieron clínica sensitiva en el pasado y ninguno de ellos presentó clínica sensitiva durante la infección por SARS-CoV-2. En cuanto a historia de infección previa por zóster o clínica sensitiva en el pasado, los resultados vienen reflejados en la tabla 2.
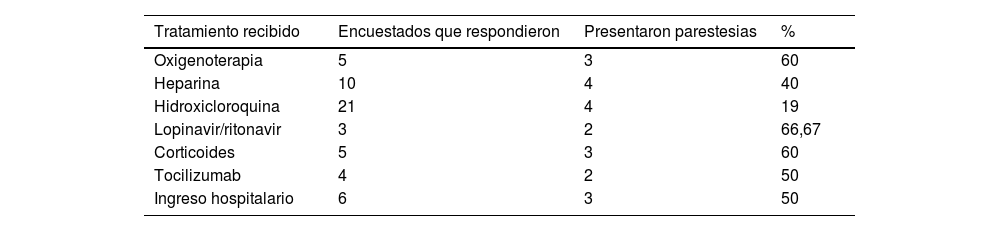
La distribución de los tratamientos utilizados y la necesidad de ingreso hospitalario se muestran en la tabla 3. Se observó una asociación entre la necesidad de tratamiento y de ingreso hospitalario con una p<0,05. En el análisis por subgrupos en función del tipo de sintomatología sensitiva (parestesias, hipoestesia o hiperalgesia), se vio que las parestesias se asociaban significativamente a la prescripción de heparina (p = 0,005), oxigenoterapia (p = 0,005), lopinavir/ritonavir (p = 0,02), corticoterapia (p = 0,005) y tocilizumab (p = 0,039). No se encontró relación que alcanzara la significación estadística entre las diferentes modalidades de tratamiento y el hecho de presentar hiperalgesia o hipoestesia.
Distribución de pacientes en función del tratamiento o tratamientos recibidos para la COVID-19
| Tratamiento recibido | Encuestados que respondieron | Presentaron parestesias | % |
|---|---|---|---|
| Oxigenoterapia | 5 | 3 | 60 |
| Heparina | 10 | 4 | 40 |
| Hidroxicloroquina | 21 | 4 | 19 |
| Lopinavir/ritonavir | 3 | 2 | 66,67 |
| Corticoides | 5 | 3 | 60 |
| Tocilizumab | 4 | 2 | 50 |
| Ingreso hospitalario | 6 | 3 | 50 |
La relación de resultados de PCR de SARS-CoV-2 y serología (IgG) de los pacientes encuestados se expone en la tabla 1. Solamente un encuestado no tenía PCR realizada y la IgG negativa, sin embargo, presentaba clínica compatible con dicha infección en contexto de pandemia y con un contacto estrecho (convivientes con PCR positiva), tal como la participante comunicó de forma voluntaria a los investigadores.
De los pacientes que presentaron clínica sensitiva, al momento de manifestarla, 5 no tenían PCR realizada (un 31,3%), 7 pacientes tenían PCR positiva (43,8%) y 4 pacientes tenían PCR negativa (25%).
DiscusiónSe envió la encuesta a 801 médicos facultativos y residentes de todas las especialidades del HUFA, entre los que la incidencia estimada de la COVID19 fue del 39,6% en el estudio de seroprevalencia (312 médicos)14. De ellos, contestaron a la encuesta 89.
De los 89 pacientes, 16 de los encuestados afirmaron haber presentado clínica sensitiva (17,98% del total). No hay estudios publicados hasta la fecha en los que se analice la incidencia de sintomatología sensitiva, por lo que no podemos comparar nuestros datos con ningún otro trabajo. En el Manual COVID-19 para el neurólogo general proporcionado por la Sociedad Española de Neurología, se ofrece la incidencia de enfermedad de nervio periférico con diagnóstico definido, por ejemplo, el síndrome de Guillain-Barré. Sin embargo, no se estima la incidencia de síntomas, como las parestesias, hipoestesia e hiperalgesia, que son las de interés en nuestro trabajo10.
En este estudio se encuentra una relación significativa entre la presencia de clínica sensitiva leve en forma de parestesias en diferentes partes de la anatomía y la presencia de otros síntomas de la enfermedad como tos, fiebre, mialgias, astenia y disnea, sugiriendo una relación entre la presencia de clínica sensitiva y cuadros floridos y sintomáticos de la enfermedad, incluyendo síntomas graves, como la disnea.
Es importante destacar que, de los 17 encuestados que respondieron haber tenido disnea durante la COVID-19, solo 5 pacientes recibieron oxigenoterapia. La disnea es un síntoma subjetivo y puede no traducir una hipoxemia, por lo que puede sesgar los datos al comparar la gravedad clínica de la COVID-19 y la sintomatología sensitiva. Sin embargo, de estos 17 pacientes con disnea, 5 necesitaron oxígeno, 4 manifestaron broncoespasmo y 6 precisaron ingreso; por lo que podríamos decir que, en este caso, la sensación subjetiva de disnea sí que es representativa de gravedad clínica. Además, se encuentra una relación significativa entre la presencia de parestesias y la necesidad de prescripción de tratamientos para la enfermedad y la necesidad de ingreso hospitalario, lo que hace pensar que la presencia de parestesias se asocia, de forma significativa, a cuadros más graves de la enfermedad. Por tanto, los pacientes considerados más graves por criterios clínicos (disnea) y datos objetivos, como la necesidad de requerir tratamientos específicos como oxigenoterapia, corticoides, lopinavir/ritonavir y tocilizumab, se relacionaron, de manera estadísticamente significativa, con la aparición de sintomatología sensitiva en la infección por SARS-CoV-2. Estos resultados van acordes con la bibliografía consultada, en la que se observa mayor incidencia de enfermedad neurológica en los cuadros más graves y en pacientes críticos, si bien no se describen síntomas sensitivos leves como parestesias, hipoestesia o hiperalgesia15.
De los pacientes que presentaron clínica sensitiva, el 50% tuvo una latencia de entre 5 a 10 días desde el inicio de los síntomas hasta la aparición de sintomatología sensitiva; solo un 12,6% tuvo una latencia de 1 a 4 días y el resto, el 37,4%, más de 11 días. La latencia entre el inicio de síntomas de la COVID-19 y la clínica sensitiva también se ha observado en otros estudios, con una media de 5 a 10 días15.
Se recogió el número de días que tardaban en aparecer los síntomas sensitivos desde el inicio clínico del resto de los síntomas de la COVID-19: de 1 a 2 días en un paciente; de 3 a 4 días en un paciente; de 5 a 7 días en 4 pacientes; de 8 a 10 días en 4 pacientes; de 15 a 20 días en 2 pacientes; de 21 a 30 días en un paciente; más de 31 días en 3 pacientes. De los pacientes que presentaron clínica sensitiva, el 50% tuvo una latencia de entre 5 a 10 días desde el inicio de los síntomas hasta la aparición de sintomatología sensitiva; solo un 12,6% tuvo una latencia de 1 a 4 días, y el resto, el 37,4% más de 11 días.
Con esto evidenciamos que es más común el inicio diferido de la clínica sensitiva que el resto de los síntomas (el 97% de los pacientes presentaron la clínica sensitiva después del 5.° día del inicio de la enfermedad, de ellos casi el 40% a partir de los 11 días del inicio), lo que podríamos relacionar con una respuesta inflamatoria propia del huésped más que con la acción directa del virus16, mecanismo fisiopatogénico que se teorizaba en la introducción.
En nuestro trabajo, se obtuvo una relación estadísticamente significativa (p = 0,007) entre padecer una enfermedad autoinmune y desarrollar hipoestesia, lo que indica que dicho antecedente predispone a presentar clínica sensitiva. Sin embargo, siendo la «n» tan pequeña (5 pacientes), no podemos extraer este tipo de conclusiones sin realizar otros estudios de mayor tamaño muestral.
Hipotetizando con la teoría parainfecciosa, esperaríamos encontrar que la mayoría de las PCR hubieran sido negativas en el momento del desarrollo de la clínica sensitiva, pensando en una fase en la que la carga viral es baja, o en una infección ya pasada. Sin embargo, solo un 25% presentaban PCR negativa (4 pacientes) y un 43,8%, PCR positiva (7 pacientes), si bien es cierto que no se ha podido recoger el tiempo desde el inicio de la clínica COVID-19 hasta la aparición de sintomatología sensitiva (una mayor latencia apoyaría esta etiología).
La alternativa sería pensar que una PCR positiva correspondería a la existencia de virus en el sistema nervioso central y que ese fuera el mecanismo de producción de la clínica sensitiva (afectación directa del virus) y no el parainfeccioso. Sin embargo, en la bibliografía consultada, no es común el hallazgo de virus en el líquido cefalorraquídeo. En un estudio realizado en el laboratorio de virología del Hospital Universitario de Lyon se analizó el líquido cefalorraquídeo de 555 pacientes en busca del virus; todas las muestras fueron negativas excepto 2, en las que no se encontró virus en el tejido cerebral en la necropsia, lo que indicaba una contaminación del líquido cefalorraquídeo. Este estudio orienta a un origen de la clínica sensitiva en la respuesta inmune del huésped y no en la afectación directa del virus. Esto apoyaría nuestra teoría de un proceso parainfeccioso, bien autoinmune o bien en el contexto de la respuesta inflamatoria del huésped17.
Ninguno de los sanitarios encuestados facilitó una explicación alternativa clara a la aparición de clínica sensitiva, ni se encontró relación significativa entre antecedentes de infección por herpes zóster y la presencia de clínica sensitiva durante la infección por SARS-CoV-2, por lo que se concluyó como principal sospecha de la clínica sensitiva el antecedente de infección.
Que la población encuestada fuera personal sanitario hace más fiable la autoevaluación e identificación de la clínica sensitiva y la búsqueda de causas alternativas.
Como limitaciones al estudio hay que destacar, por un lado, el sesgo de respuesta, dado que la recogida de datos se basa en la participación voluntaria de la población del estudio y en que la población afectada con clínica sensitiva podría haber estado más motivada a rellenar la encuesta que aquellos que no la presentaron. Por otro lado, el hecho de que los individuos de la muestra del estudio pertenezcan al medio sanitario, por lo que la aplicabilidad de los resultados podría no ser válida para el resto de la población (validez externa).
En conclusión, la muestra conseguida es pequeña para sacar conclusiones definitivas, lo que supone la necesidad de realizar más estudios en esta dirección para conseguir mayor potencia. Sin embargo, vemos una tendencia que nos permite concluir que la infección por SARS-CoV-2 se puede acompañar de clínica sensitiva y que esta puede reflejar cuadros más graves de la enfermedad. La presencia de la clínica sensitiva es diferida en el tiempo. Se desconoce por el momento el mecanismo por el cual aparece dicha sintomatología, pero los resultados nos orientan a pensar en un origen parainfeccioso, más que en una afectación directa del virus, en el que puede influir un trasfondo de autoinmunidad18.
Conflicto de interesesNo existen conflictos de interés.