Cuantificar el tipo de fármacos antiepilépticos (FAE) empleados en epilepsia, en consultas de neurología.
Material y métodoEstudio descriptivo observacional sobre una muestra de 559 pacientes mayores de 14 años con epilepsia y en tratamiento farmacológico, recogidos en consultas ambulatorias por 47 neurólogos en España en mayo del año 2016.
Para las clasificaciones clínicas de la epilepsia se utilizaron las de la Liga Internacional contra la Epilepsia (ILAE). Los FAE se clasificaron según el año de comercialización: clásicos (anteriores al 1990) y nuevos (los posteriores). Se realiza un análisis descriptivo de las variables cualitativas y cuantitativas.
ResultadosDemográficos: 54,6% mujeres; edad media 42,7 años; edad media de inicio de la epilepsia 22,4 años.
Clínicos: predominan las crisis parciales: 75,7%; sintomáticas: 51,5% y con epilepsia farmacorresistente: 32,4%. Pacientes libres de crisis en el último año: 35,6%. Comorbilidad asociada: 59,2%. Tratamiento: número de FAE empleados 1103; 64,6% FAE nuevos. El 85,4% de los pacientes tratados con FAE nuevos. La media y el rango de FAE empleados: 2 (1-5). El 59,6% recibía politerapia. Los FAE más utilizados: levetiracetam (LEV) 42,6%, ácido valproico (VPA) 25,4%, lamotrigina 19,5%, carbamacepina 17,9% y lacosamida 17,5%. Ningún FAE fue empleado exclusivamente en monoterapia. El más utilizado en crisis generalizadas fue el VPA (48,2%) y en parciales, el LEV (43,2%). El VPA fue menos utilizado en mujeres. Los pacientes sin control de sus crisis (48,7%) o con comorbilidad asociada (45,6%) recibían la combinación de ambos tipos de FAE, en mayor porcentaje, que de forma aislada.
ConclusionesLa mayoría de los pacientes toman FAE nuevos. La asociación de ambos tipos de FAE se emplea en mayor medida en los pacientes sin control de sus crisis o con comorbilidad asociada.
The study aims to quantify the types of antiepileptic drugs (AED) prescribed in neurology consultations.
Material and methodThis descriptive, observational study included a sample of 559 patients older than 14 years, diagnosed with epilepsy, and receiving pharmacological treatment. Data were collected at outpatient consultations by 47 Spanish neurologists in May 2016. Epilepsy was defined based on the International League Against Epilepsy classification. According to the year of marketing, AEDs were categorised as classic (before 1990) or new (after 1990). We performed a descriptive analysis of qualitative and quantitative variables.
ResultsFemale patients accounted for 54.6% of the sample. Mean age was 42.7 years; mean age of onset was 22.4. Regarding epilepsy type, 75.7% of patients experienced partial seizures, 51.5% were symptomatic,32.4% had refractory epilepsy, 35.6% had been seizure-free for the previous year, and 59.2% had associated comorbidities.A total of 1103 AED prescriptions were made; 64.6% of prescriptions were for new AEDs; 85.4% of patients received new AEDs. Patients received a mean of 2 AEDs (range, 1-5). A total of 59.6% of patients received polytherapy.The most frequently prescribed AEDs were levetiracetam (42.6%), valproic acid (25.4%), lamotrigine (19.5%), carbamazepine (17.9%), and lacosamide (17.5%). No AED was employed exclusively as monotherapy. The most frequently prescribed AEDs for generalised and partial seizures were valproic acid (48.2%) and levetiracetam (43.2%), respectively. Valproic acid was less frequently prescribed to female patients. Patients with refractory epilepsy or with associated comorbidities were more frequently prescribed a combination of new and classic AEDs (48.7% and 45.6%, respectively) than only one type of AED.
ConclusionsThe majority of patients received new AEDs. The combination of classic and new AEDs was more frequently prescribed to patients with refractory epilepsy or with associated comorbidities.
La epilepsia es una grave afectación neurológica asociada a estigma, comorbilidades y a un coste económico elevado.
La Organización Mundial de la Salud (OMS), en su medición de la carga global por enfermedades en el mundo, señala que la epilepsia es la segunda enfermedad neurológica en años de vida potencialmente perdidos o vividos con discapacidad1.
En Europa, afecta a unos 6millones de habitantes con 400.000 nuevos casos cada año. El 50% de los pacientes viven estigmatizados; su expectativa de vida está reducida entre 2 y 10 años, y su tasa de mortalidad es 2-3 veces mayor que la de la población general. El 60% de los pacientes asocian trastornos psiquiátricos, neurológicos o intelectuales. El coste total de la epilepsia en Europa es de 20 billones de euros por año2,3.
En España, en la población mayor de 18 años, la prevalencia de vida ajustada por edad y sexo es de 14,87 y 1.000 habitantes, y la prevalencia activa es de 5,79×1.000 habitantes4.
Se constata un aumento del empleo de fármacos antiepilépticos (FAE) en los estudios poblacionales y que varía según los países, aunque no todos ellos se emplean de forma exclusiva para el control de las crisis epilépticas, ya que tienen indicaciones terapéuticas para otras enfermedades: psiquiátrica, dolor crónico, migraña, trastornos alimentarios y adicciones. Se clasifican según el año de comercialización en FAE clásicos (anteriores a 1990): carbamacepina (CBZ), clobazam (CLB), clonazepam (CZP), etosuximida (ESM), fenobarbital (PB), fenitoína (PHT), primidona (PRM) y ácido valproico (VPA), y los posteriores como FAE nuevos: eslicarbacepina (ESL), felbamato (FBM), gabapentina (GBP), lacosamida (LCM), levetiracetam (LEV), lamotrigina (LTG), oxcarbazepina (OXC), perampanel (PMP), pregabalina (PGB), rufinamida (RFM), retigabina (RTG), tiagabina (TGB), topiramato (TPM), vigabatrina (VGB) y zonisamida (ZNS).
Un estudio europeo en 7 países entre 2001 y 2009 sobre el consumo de FAE para todas sus indicaciones muestra un incremento global, debido fundamentalmente al aumento de la prescripción de nuevos FAE. La prevalencia de prescripciones de FAE en el año 2001 entre los países del estudio oscilo entre 88 y 144×100.000 habitantes, con un incremento del 6-15% al final del periodo (2009)5.
El tratamiento crónico con FAE contribuye al coste directo (médico, farmacéutico) del tratamiento de la epilepsia. En los últimos 25 años, se ha producido un importante aumento de las opciones terapéuticas para tratar la epilepsia. Los nuevos FAE son más caros que los clásicos y su elección como primera opción puede tener un impacto económico en el tratamiento crónico6. En los últimos 20 años se han comercializado 17 nuevos FAE, pero su empleo no ha modificado el número de pacientes libres de crisis7,8.
No hay evidencias de calidad en los ensayos clínicos de coste-efectividad que indiquen el uso preferente de los nuevos FAE, tanto en monoterapia como en politerapia, sobre los FAE clásicos o del empleo de un nuevo FAE sobre otro del mismo grupo, por lo que las valoraciones económicas sobre su empleo señalan que los nuevos FAE son costo-efectivo en monoterapia cuando los FAE clásicos son ineficaces, mal tolerados o están contraindicados9.
El presente estudio es el primero que se realiza en España en todo el territorio nacional y su objetivo es analizar la prescripción de FAE según las características demográficas y clínicas de pacientes con epilepsia, con edad igual o mayor de 14 años, la práctica clínica habitual.
Material y métodosPoblación de estudioLa muestra está compuesta por 559 pacientes mayores de 14 años con epilepsia que reciben tratamiento con FAE, atendidos en consultas de neurología, que, previo consentimiento informado para su participación, aportaron 47 neurólogos repartidos por el territorio nacional y desarrollado durante los meses de abril y mayo del 2016.
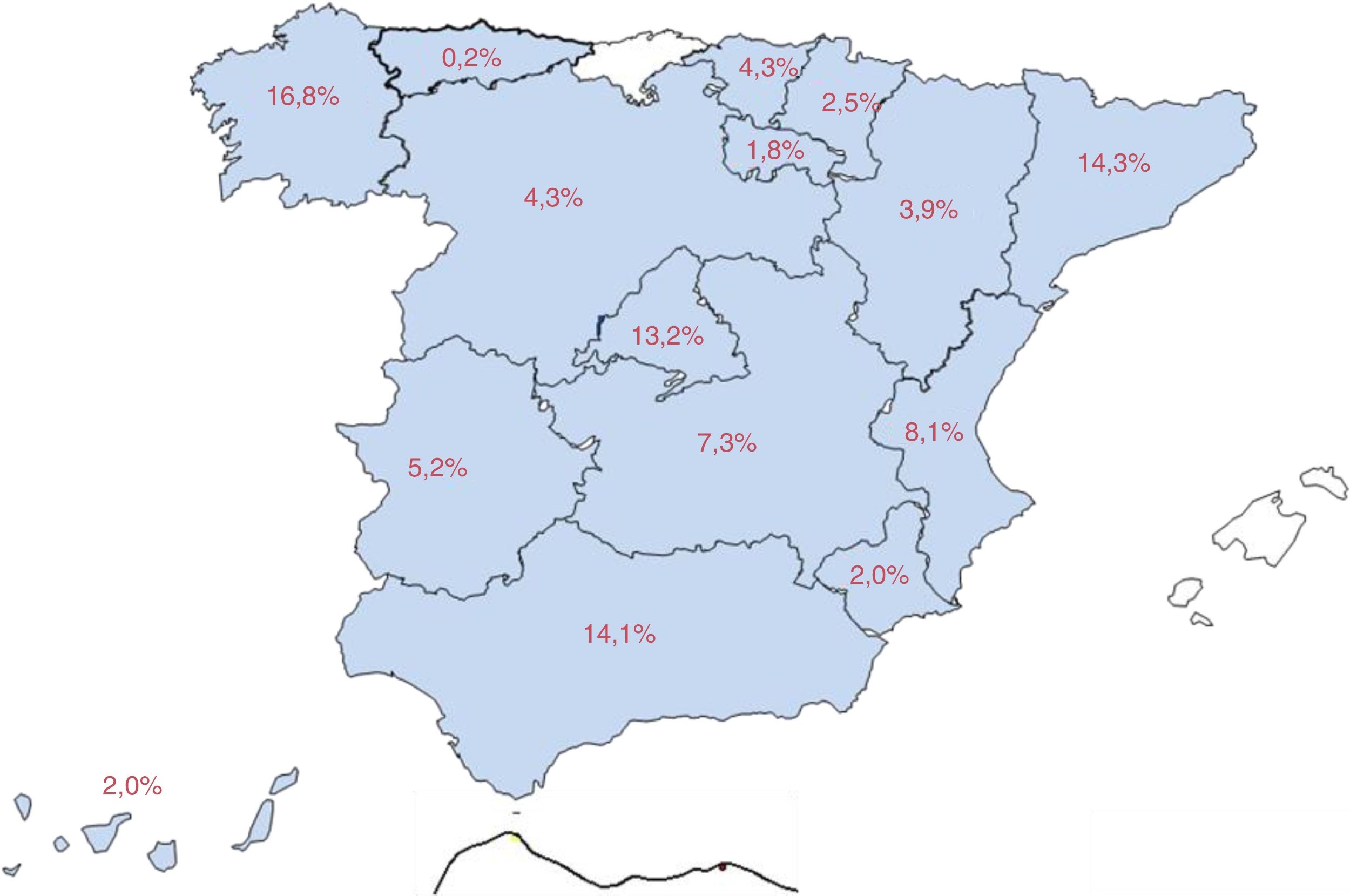
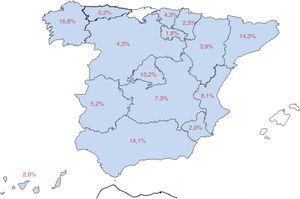
El 83% de los pacientes procedían de consultas dedicadas a epilepsia (58,7% consultas de primer nivel, 15,9% de epilepsia refractaria y 8,4% de consultas médico-quirúrgicas) y el 17% de consultas de neurología general. La figura 1 recoge el mapa de distribución nacional de la muestra.
MetodologíaTodos los pacientes del estudio se incluyeron de forma aleatorizada, en una base de datos previamente validada en 2015, con sus características demográficas, clínicas y de tratamiento antiepiléptico que recibían en este momento, y el previo si era conocido.
Los pacientes incluidos reunían los criterios de la ILAE para el diagnóstico de epilepsia (2005-2014)10,11 y se clasificaron las crisis y el diagnóstico etiológico según la clasificación de la ILAE (1989)12.
Las epilepsias sintomáticas se clasificaron según la propuesta de Shorvon de 2011 en: predominantemente genéticas o por trastornos del desarrollo y por causas adquiridas13.
Para el criterio de epilepsia farmacorresistente, se utilizó la propuesta por la ILAE de 201014.
Análisis estadísticoSe realizó un análisis descriptivo de las variables recogidas, tanto cualitativas como cuantitativas. Las variables cualitativas se analizaron mediante frecuencias absolutas y porcentajes, mientras que las variables cuantitativas se estudiaron a través de la media, la desviación estándar (DE), la mediana, el mínimo, el máximo, los intervalos de confianza (IC) (o P25-P75) y el número de casos válidos.
Las comparaciones entre grupos de variables cualitativas se realizaron mediante el test de la chi al cuadrado. Las comparaciones de variables cuantitativas se estudiaron mediante el test U de Mann-Whitney o el test de Kruskal-Wallis.
El nivel de significación se estableció en el 5%. En todos los análisis se utilizó el paquete estadístico SPSS 19.0.
ResultadosCaracterísticas demográficasDe los 559 pacientes, 254 (45,4%) eran hombres y 305 (54,6%) mujeres.
La edad media de la muestra es de 42,7 años (DE 16,8 años) y la mediana 41,0 años (13-91 años), IC deL 95%, 41,3; 44,1.
Características clínicasLa edad de inicio de la epilepsia en el total de la muestra es de 22,4 años (DE 19,1) y la mediana 17,0 años (mínimo 0 y máximo 90 años). P25 8 y P75 32,0. Es inferior en los farmacorresistentes respecto a los otros grupos (p < 0,001), con una media de 15,8 (DE 13,7) y una mediana 13,0 años (0-56 años).
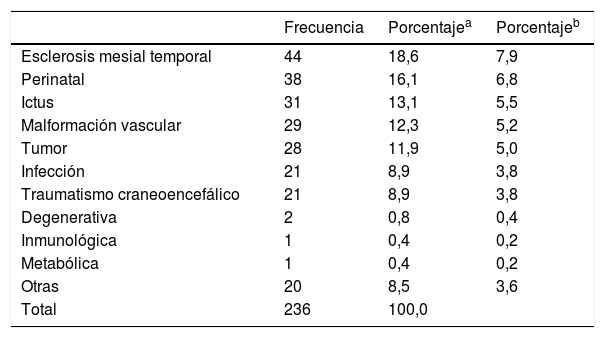
La mayoría de las etiologías eran sintomáticas 288 (51,5%) y en 171 (30,6%) criptogénicas y en 100 (17,9%) idiopáticas. La sintomática adquirida estaba presente en un 82,5% y la predominantemente genética o por trastorno del desarrollo en un 17,5% de los casos. Las causas sintomáticas adquiridas se muestran en la tabla 1.
Etiología sintomática adquirida
| Frecuencia | Porcentajea | Porcentajeb | |
|---|---|---|---|
| Esclerosis mesial temporal | 44 | 18,6 | 7,9 |
| Perinatal | 38 | 16,1 | 6,8 |
| Ictus | 31 | 13,1 | 5,5 |
| Malformación vascular | 29 | 12,3 | 5,2 |
| Tumor | 28 | 11,9 | 5,0 |
| Infección | 21 | 8,9 | 3,8 |
| Traumatismo craneoencefálico | 21 | 8,9 | 3,8 |
| Degenerativa | 2 | 0,8 | 0,4 |
| Inmunológica | 1 | 0,4 | 0,2 |
| Metabólica | 1 | 0,4 | 0,2 |
| Otras | 20 | 8,5 | 3,6 |
| Total | 236 | 100,0 |
Según el tipo de crisis de los pacientes, el 70,5% presentaba crisis parciales, el 26% crisis generalizadas y el 3,5% crisis indeterminadas en cuanto a su inicio (focal o generalizado).
Se clasificaron los pacientes en 5grupos clínicos:
- 1.
En remisión. No presentaron crisis en los últimos 2años. El 24% de los pacientes.
- 2.
Con epilepsia activa no farmacorresistente que requiere cambios terapéuticos probablemente eficaces a criterio del médico investigador. El 30,2% de los pacientes15.
- 3.
Con epilepsia farmacorresistente según definición por consenso de la ILAE. El 32,4% de pacientes14.
- 4.
De nuevo diagnóstico: menos de 6meses de diagnóstico o tratamiento. El 2,5% de pacientes.
- 5.
Sometidos a cirugía o técnicas no resectivas. El 10,9% de pacientes.
Estaba libres de cualquier tipo de crisis en el último año de seguimiento (exceptuando los pacientes de nuevo diagnóstico) un 35,6% de los pacientes.
Presentaban comorbilidad asociada el 59,2% de los pacientes de la muestra, distribuida según los siguientes grupos de enfermedades: médicas 30,6%, psiquiátricas 29,7% y neurológicas 28,4%. En un 4,1% se asociaba más de una patología. Los pacientes farmacorresistentes la presentaban en mayor medida (70,2%) que los otros grupos (54%), p < 0,001.
Tratamiento farmacológicoTodos los pacientes incluidos en la muestra recibían tratamiento con FAE, cumplieran o no criterios de epilepsia activa, según la definición de la ILAE, de 199316.
El 72,3% de los pacientes habían recibido tratamiento previo con FAE distintos de los de la visita de inclusión y en un 51% habían probado un número ≥ 2 FAE. Los motivos de retirada fueron: falta de eficacia 45,1%, intolerancia 16,5%, ambos 32,4% y desconocido 6%.
La media de años de tratamiento con FAE de la muestra era 17,9 (DE 15,0) y una mediana de 14 años (0-73 años). Es estadísticamente superior en los pacientes farmacorresistentes (p < 0,001) respecto a los otros grupos, con una media de 24,4 años (DE 15,0) y una mediana de 23 años (2-67 años).
En el total de la muestra se emplearon 1.103 FAE: 64,6% FAE nuevos (comercializados después de 1990) y el 35,4% FAE clásicos (comercializados antes de 1990). Su distribución entre los pacientes se muestra en la tabla 2.El 85,4% de los pacientes recibían FAE nuevos.
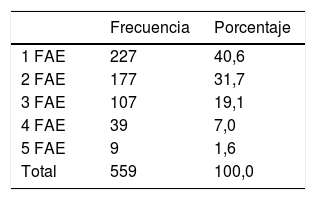
Recibía monoterapia el 40,6% y politerapia el 59,4% (2-5 FAE) de los pacientes (tabla 3).
Los fármacos actuales utilizados con mayor frecuencia por los pacientes, fueron: LEV (42,6%), VPA (25,4%), LTG (19,5%), CBZ (17,9%), LCM (17,5%) y ESL (12,7%).
Por tipo de crisis, los FAE más utilizados en crisis parciales por orden de frecuencia, eran: LEV (43,2%), LCM (22,1%), CBZ (21,4%), VPA (19,2%), LTG (17,3%) y ESL (15,4%). Y en crisis generalizadas: VPA (48,2%), LEV (41,1%), LTG (23,4%), ZNS (9,9%) y ESL (6,4%).
Según sexo de los pacientes, los varones, utilizaban por orden de frecuencia, LEV (46,1%), VPA (31,1%), CBZ (19,7%), LCM (18,1%), LTG (18,1%) y ESL (12,2%) y las mujeres: LEV (39,7%), VPA (20,7%), LTG (20,7%), LCM (17%), CBZ (16,4%) y ESL (13,1%).
El porcentaje pacientes que reciben VPA es estadísticamente superior en varones que en mujeres: 31,1% vs. 20,7%, respectivamente (p = 0,005) De las 63 mujeres tratadas con VPA, en 43 (68,3%) sus edades están comprendidas entre los 15 y los 45 años. No se encontraron diferencias estadísticas de empleo con el resto de FAE, entre sexos (tabla 4).
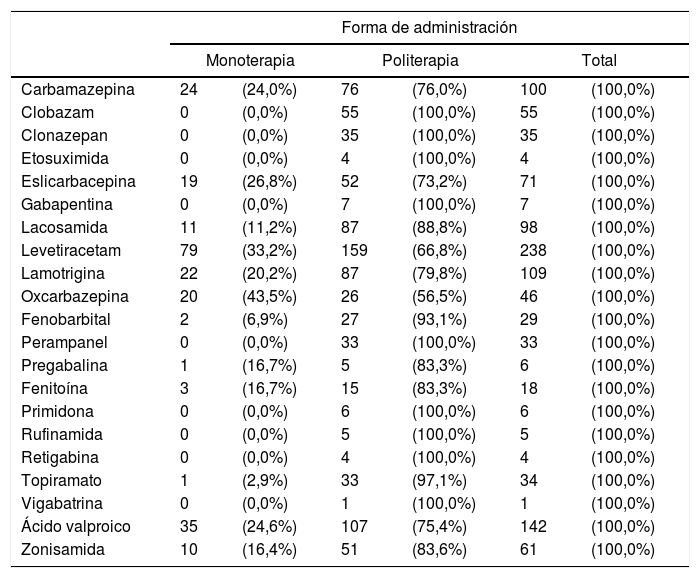
Ninguno de los FAE se emplea exclusivamente en monoterapia, pero algunos de ellos se emplean exclusivamente en politerapia: CLB, CZP, ESM, GPT, PMP, PRM, RFM, TGB y VGB. La tabla 5 recoge los FAE actuales y la forma de administración en el total de los pacientes.
Tipo de FAE actuales y forma de administración (sobre el total de cada FAE)
| Forma de administración | ||||||
|---|---|---|---|---|---|---|
| Monoterapia | Politerapia | Total | ||||
| Carbamazepina | 24 | (24,0%) | 76 | (76,0%) | 100 | (100,0%) |
| Clobazam | 0 | (0,0%) | 55 | (100,0%) | 55 | (100,0%) |
| Clonazepan | 0 | (0,0%) | 35 | (100,0%) | 35 | (100,0%) |
| Etosuximida | 0 | (0,0%) | 4 | (100,0%) | 4 | (100,0%) |
| Eslicarbacepina | 19 | (26,8%) | 52 | (73,2%) | 71 | (100,0%) |
| Gabapentina | 0 | (0,0%) | 7 | (100,0%) | 7 | (100,0%) |
| Lacosamida | 11 | (11,2%) | 87 | (88,8%) | 98 | (100,0%) |
| Levetiracetam | 79 | (33,2%) | 159 | (66,8%) | 238 | (100,0%) |
| Lamotrigina | 22 | (20,2%) | 87 | (79,8%) | 109 | (100,0%) |
| Oxcarbazepina | 20 | (43,5%) | 26 | (56,5%) | 46 | (100,0%) |
| Fenobarbital | 2 | (6,9%) | 27 | (93,1%) | 29 | (100,0%) |
| Perampanel | 0 | (0,0%) | 33 | (100,0%) | 33 | (100,0%) |
| Pregabalina | 1 | (16,7%) | 5 | (83,3%) | 6 | (100,0%) |
| Fenitoína | 3 | (16,7%) | 15 | (83,3%) | 18 | (100,0%) |
| Primidona | 0 | (0,0%) | 6 | (100,0%) | 6 | (100,0%) |
| Rufinamida | 0 | (0,0%) | 5 | (100,0%) | 5 | (100,0%) |
| Retigabina | 0 | (0,0%) | 4 | (100,0%) | 4 | (100,0%) |
| Topiramato | 1 | (2,9%) | 33 | (97,1%) | 34 | (100,0%) |
| Vigabatrina | 0 | (0,0%) | 1 | (100,0%) | 1 | (100,0%) |
| Ácido valproico | 35 | (24,6%) | 107 | (75,4%) | 142 | (100,0%) |
| Zonisamida | 10 | (16,4%) | 51 | (83,6%) | 61 | (100,0%) |
Las biterapias utilizadas por el 31,7% de pacientes más frecuentes fueron: LEV + VPA (9,6%), LEV + ESL (9%) y LEV + LCM (9%).
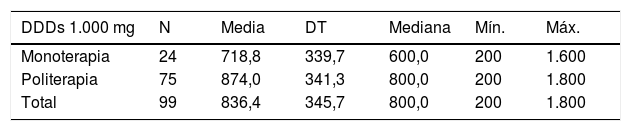
En cuanto a las dosis de los FAE, se observa que a los pacientes tratados con CBZ, ESL, LCM, LEV, OXC, VPA o ZNS en politerapia se les administran dosis superiores que a los pacientes tratados en monoterapia con estos mismos fármacos. La tabla 6 recoge las dosis diarias en monoterapia y politerapia de estos FAE, así como la dosis diaria definida por la OMS en monoterapia17.
Dosis diaria de carbamazepina (CBZ) (U = 621,0; p = 0,021; test U de Mann-Whitney)
| DDDs 1.000 mg | N | Media | DT | Mediana | Mín. | Máx. |
|---|---|---|---|---|---|---|
| Monoterapia | 24 | 718,8 | 339,7 | 600,0 | 200 | 1.600 |
| Politerapia | 75 | 874,0 | 341,3 | 800,0 | 200 | 1.800 |
| Total | 99 | 836,4 | 345,7 | 800,0 | 200 | 1.800 |
| Dosis diaria de eslicarbacepina (ESL) (U = 333,5; p = 0,023; test U de Mann-Whitney) | ||||||
|---|---|---|---|---|---|---|
| DDDs 800 mg | N | Media | DT | Mediana | Mín. | Máx. |
| Monoterapia | 19 | 842,1 | 226,9 | 800,0 | 400 | 1.200 |
| Politerapia | 52 | 1.042,3 | 346,0 | 1.000,0 | 400 | 2.000 |
| Total | 71 | 988,7 | 329,3 | 800,0 | 400 | 2.000 |
| Dosis diaria de lacosamida (LCM) (U = 169,5; p = 0,013; test U de Mann-Whitney) | ||||||
|---|---|---|---|---|---|---|
| DDDs 300 mg | N | Media | DT | Mediana | Mín. | Máx. |
| Monoterapia | 8 | 225,0 | 88,6 | 200,0 | 100 | 400 |
| Politerapia | 87 | 336,5 | 127,0 | 350,0 | 100 | 700 |
| Total | 95 | 327,1 | 127,7 | 300,0 | 100 | 700 |
| Dosis diaria de levetiracetam (LEV) (U = 3.792,5; p < 0,001; test U de Mann-Whitney) | ||||||
|---|---|---|---|---|---|---|
| DDDs 1.500 mg | N | Media | DT | Mediana | Mín. | Máx. |
| Monoterapia | 73 | 1.490,4 | 742,9 | 1.000,0 | 250 | 3.000 |
| Politerapia | 158 | 2.024,1 | 896,9 | 2.000,0 | 250 | 4.000 |
| Total | 231 | 1.855,4 | 885,3 | 2.000,0 | 250 | 4.000 |
| Dosis diaria de oxcarbazepina (OXC) (U= 155,0; p=0.015; test U de Mann-Whitney). | ||||||
|---|---|---|---|---|---|---|
| DDDs 1.000 mg | N | Media | DT | Mediana | Mín. | Máx. |
| Monoterapia | 20 | 1.006,5 | 407,7 | 990,0 | 300 | 1.800 |
| Politerapia | 26 | 1.336,5 | 474,9 | 1.200,0 | 600 | 2.400 |
| Total | 46 | 1.193,0 | 472,0 | 1.200,0 | 300 | 2.400 |
| Dosis diaria de ácido valproico (VPA) (U = 992,5; p < 0,001; test U de Mann-Whitney) | ||||||
|---|---|---|---|---|---|---|
| DDDs 1.500 mg | N | Media | DT | Mediana | Mín. | Máx. |
| Monoterapia | 32 | 993,8 | 380,9 | 1.000,0 | 500 | 2.100 |
| Politerapia | 107 | 1.355,6 | 503,8 | 1.500,0 | 300 | 2.500 |
| Total | 139 | 1.272,3 | 500,9 | 1.200,0 | 300 | 2.500 |
| Dosis diaria de zonisamida (ZNS) (U = 43,0; p < 0,001; test U de Mann-Whitney) | ||||||
|---|---|---|---|---|---|---|
| DDDs 200 mg | N | Media | DT | Mediana | Mín. | Máx. |
| Monoterapia | 10 | 160,0 | 69,9 | 150,0 | 100 | 300 |
| Politerapia | 51 | 358,8 | 118,2 | 400,0 | 100 | 600 |
| Total | 61 | 326,2 | 133,7 | 300,0 | 100 | 600 |
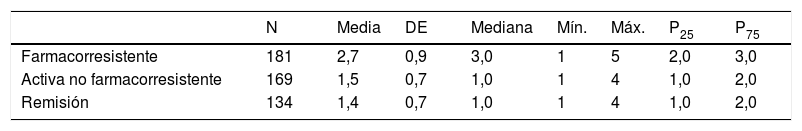
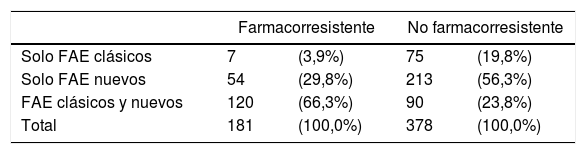
El grupo clínico de pacientes farmacorresistentes recibía un mayor número de FAE, respecto a los grupos clínicos no farmacorresistentes o en remisión, con una media de 2,7 (DE 0,9) y una mediana de 3 (1-5) (tabla 7). Los pacientes farmacorresistentes son tratados en mayor medida (66,3%) con la combinación de FAE clásicos y nuevos, y los pacientes no farmacorresistentes solo con FAES clásicos (20%) o solo con FAE nuevos (56%) (tabla 8).
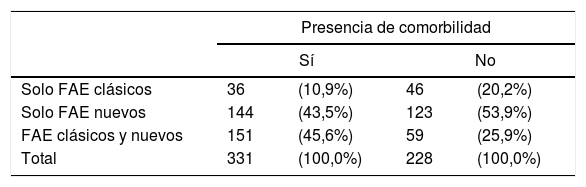
Los pacientes con comorbilidad asociada recibían en mayor cuantía la asociación de ambos tipos de FAE (45,6%) respecto a los que no la presentaban (25,9%) (tabla 9).
Los FAE iniciales que se emplean en los pacientes de nuevo diagnóstico por orden de frecuencia fueron: LEV (50%), VPA (21,4%), LCM (21,4%) y CBZ (7,1%). En un 64% se emplearon solo FAE nuevos y en un 22% solo FAE clásicos, y en un 14% combinaciones de ambos.
DiscusiónLa clasificación clínica de las crisis depende de la certeza de los datos semiológicos obtenidos, la disponibilidad de test diagnósticos, fundamentalmente de neuroimagen, y de la clasificación utilizada. En los estudios poblacionales, las crisis parciales oscilan entre el 20 y el 66%, y las crisis sintomáticas entre 14 y el 39%18. Un estudio de Cockerell et al., en Reino Unido (1984-1997), sobre una muestra amplia de pacientes de nuevo diagnóstico, basado en registros de médicos de cabecera, un 52% presentaba crisis parciales y en un 59% la etiología era desconocida19. Serrano Castro et al., en un estudio poblacional nacional en 2013 sobre pacientes con epilepsia activa, reflejan un predominio de las crisis parciales en el 59% de la muestra y en la mitad de los casos la etiología era sintomática4.
En los estudios de base hospitalaria estas cifras son más altas por una mayor cualificación profesional y disponibilidad tecnológica. En nuestra muestra, las crisis parciales alcanzaban el 75% y la etiología sintomática era del 51,5%, concordante con los datos de algunos estudios tanto a nivel nacional como internacional. En el estudio de Luengo et al., en Madrid en 2000, el 63% de sus casos presentaban crisis parciales y en un 45% la etiología era sintomática20. García Martin et al., en Málaga en 2010, recogían crisis parciales en el 75,5% y con etiología sintomática conocida en el 47,6% de los pacientes de su muestra21. Las mismas tendencias se observan en otros estudios internacionales; Kim et al., en Corea en 2014, basado en registros clínicos, observaron en la muestra que el 78% de las crisis eran parciales y en el 65% la etiología era sintomática22.
Entre las causas sintomáticas, las más frecuentes recogidas en la mayoría de los estudios epidemiológicos son, por orden de frecuencia: vasculares, traumáticas y congénitas4,20,22,23. En nuestra muestra, la causa más frecuente de crisis sintomática es la esclerosis mesial temporal con atrofia hipocampal en el 18,6% de los casos, coincidiendo el resto de las causas con los porcentajes de la mayoría de los estudios señalados. Puede deberse esta predominancia a que la mayoría de los pacientes incluidos procedían de consultas monográficas de epilepsia.
En una revisión de la literatura, French en el 2007 observaba que entre el 20 y el 40% de los pacientes son farmacorresistentes24. Varía su cuantía según la definición de la misma, el origen del estudio (poblacional o clínico) o el tiempo de inicio de la epilepsia (nuevo diagnóstico o crónico), y el pronóstico depende fundamentalmente de la etiología o el síndrome epiléptico25.
En una serie clínica de la Unidad de Epilepsia del Hospital Western Infirmary de Glasgow, la mayoría de los pacientes presentaban un curso evolutivo constante desde el inicio de la epilepsia (59% tenían controladas sus crisis y el 25% eran farmacorresistentes) y un 16% fluctuaba entre periodos de remisión y recidiva de sus crisis26. Cuatro análisis sucesivos en esta misma Unidad, practicados sobre una serie de pacientes reclutados entre 1982 y 2012, mostraron una tasa de remisión igual o mayor a un año en el 64%, en el primero (1999) y último (2014) periodo analizado27. En nuestro estudio, la tasa de pacientes farmacorresistentes era del 32,4%, cifra aproximada al estudio de Glasgow, pero el periodo de remisión debía ser igual o mayor de 2años.
Se ha incrementado el empleo global de FAE en los últimos años debido a su mayor utilización en otras enfermedades y a expensas fundamentalmente al empleo de los nuevos FAE. En los registros de prescripciones el estudio de Abasolo Osinaga et al., realizado en el País Vasco (1992-2004), sobre el consumo global de FAE, para todas su indicaciones, detecta un incremento de la dosis diaria por 1.000 habitantes/día (DHD), desde 5,53 DHD al inicio a 9 DHD al final del periodo y del aumento de utilización de los nuevos FAE, conservándose estable el empleo de los clásicos: CBZ y VPA, y con un descenso de PB y PHT28. Baftiu et al., en un estudio similar realizado en Noruega (2008-2012) sobre la prescripción de FAE en la población con y sin epilepsia, observaron en 2012 que el 53% de las prescripciones de FAE fueron en pacientes sin epilepsia. En epilepsia, los FAE más empleados fueron, por este orden: LTG, LEV, CBZ y VPA. El número de mujeres que empleaba VPA disminuyó un 26% a lo largo del estudio. Los nuevos FAE fueron los más empleados y sus tasas de retención fueron superiores a los FAE clásicos en todas las indicaciones29. Landmark et al., también en Noruega, observan en el 2009 que el 49% de las prescripciones farmacéuticas para epilepsia en exclusiva eran con nuevos FAE y que su empleo presentaba pronunciadas diferencias según edad y sexo de los pacientes. En el sexo femenino predominaba el empleo de FAE nuevos30. Nicholas et al., en Reino Unido (1993-2008), en un estudio sobre los registros de las prescripciones de médicos generales, mostraba un aumento de la prescripción de LTG del 2-17% y de LEV del 0-8,6% a lo largo del periodo y la asociación más frecuente al final del mismo era de VPA con LTG31.
En registros hospitalarios, Strzelczyk et al., en Alemania (2013), en 2cohortes de pacientes con epilepsia activa registrados en 2003 y 2008, con más de 5años de seguimiento, empleaban nuevos FAE en la cohorte del 2003 el 45% de los pacientes y en la del 2008 un 70%. Los FAE más empleados fueron en la primera cohorte: CBZ 40%, VPA 37%, LTG 32%, LEV 22% y TPM 11%, y en la segunda: LTG 41%, LEV 36%, VPA 32%, CBZ 16% y OXC 15%32. En nuestro estudio, el 65% de los FAE empleados eran nuevos y los recibían el 85% de los pacientes. El LEV fue el más empleado, tanto en monoterapia como en politerapia, en crisis parciales por ambos sexos y VPA en crisis generalizadas.
Hay poca evidencia de calidad a partir de los ensayos clínicos que aconseje el empleo de nuevos FAE en monoterapia o en terapia añadida sobre los clásicos.
El estudio SANAD, un ensayo controlado, aleatorizado, no ciego, llevado a cabo en más de 7.000 pacientes ambulatorios de hospitales del Reino Unido, comparó la eficacia de CBZ con GBP, LTG, OXC y TPM en crisis parciales de inicio, y demostró que la LTG es una alternativa a la CBZ con una relación coste-efectiva33. Y en los pacientes con epilepsia generalizada o no clasificada, que el VPA se tolera mejor que el TPM y es más eficaz que la LTG34. Este estudio está clasificado por varios autores como de clase iii de evidencia, al tratarse de un estudio abierto, por el modo de titulación de los FAE y falta de precisión en la correcta clasificación de las crisis35.
El estudio KOMET, de Trinka et al., en 2013, que comparaba LEV con CBZ y VPA, ambos en forma retardada en monoterapia, no mostró ninguna diferencia entre ellos; en el pronóstico global, tanto en eficacia como en tolerancia, y el tiempo de retirada de estos FAE fue similar en pacientes de nuevo diagnóstico con epilepsias focales o generalizadas36.
Los estudios comparativos entre los nuevos FAE son escasos o poco concluyentes. En algunos de ellos, se comparan en terapia añadida. LEV, LTG y LCM muestran un mayor control de crisis y tasas de retención respecto a los de su misma generación37,38.
Donde mejor se observan las diferencias significativas que favorecen a los nuevos FAE es en su comparación frente a placebo en terapias añadidas. Beyenburg et al., en una revisión sistemática y metaanálisis en epilepsias refractarias en terapia añadida frente a placebo, mostró una diferencia a favor de los nuevos FAE de un 6% para el control absoluto de crisis y un 21% en la reducción del 50% de la frecuencia critica previa39.
Wilby et al., en una revisión sistemática de la literatura, concluyen que los nuevos FAE pueden ser coste-efectivos usados en monoterapia para el tratamiento de pacientes que han experimentado falta de eficacia y efectos adversos con los FAE clásicos o cuando estos están contraindicados9.
La incorporación terapéutica de los nuevos FAE inicialmente es en terapia añadida y posteriormente si cumplen las normas de las agencias reguladoras se incorporan al tratamiento en monoterapia. En la actualidad, la mayoría de los nuevos FAE han sido aprobados para su empleo en monoterapia.
Las principales guías de práctica clínica (GPC) en epilepsia incorporan la mayoría de los nuevos FAE (GBP, LEV, LTG, OXC, TPM, ZNS) en crisis parciales, en el tratamiento en monoterapia y a todos ellos para terapia añadida y en crisis generalizadas tónico-clónicas: LEV, LTG, TPM, ZNS. Varían entre las GPC los niveles de evidencia y fuerza de las recomendaciones respecto a la elección de los fármacos, sean clásicos o nuevos, pero hay un consenso general de adaptar la elección de los fármacos a las características demográficas y clínicas del paciente40-46. Recientemente, ha sido aprobada la LCM para su empleo en crisis parciales también en monoterapia.
El principal inconveniente que presentan los FAE clásicos, PB, PRM, PHT, CBZ y VPA, es su metabolismo hepático, lo que facilita las interacciones entre FAE y otros tipos de fármacos o vías metabólicas endógenas de metabolismo hepático. Además de su potencial teratógeno y afectación cognitiva. La mayoría de los nuevos FAE tienen un mejor perfil de tolerancia y un menor potencial de interacciones47,48.
Los nuevos FAE presentan un perfil de seguridad superior a los FAE clásicos. Un metaanálisis reciente de Zaccara et al. (2017) de estudios aleatorizados frente a placebo sobre la tolerancia a corto plazo de todos los nuevos FAE empleados en adultos a dosis terapéuticas y para todas sus indicaciones, los mejor tolerados fueron LEV y GBP49. Sin embargo, varios de los nuevos FAE, como FBM y RTG, han sido retirados del mercado por grave toxicidad y VGB ha restringido su uso para algunas epilepsias infantiles refractarias, por el mismo motivo.
La asociación entre epilepsia y otras enfermedades somáticas está asociada al incremento de las necesidades de atención sanitaria, el descenso de la calidad de vida y la mortalidad prematura50. Aproximadamente el 50% de los adultos con epilepsia activa tienen al menos una comorbilidad asociada, que puede ser causa, consecuencia o factor de riesgo para la epilepsia51. En nuestro estudio, el 59% de los pacientes la presentaban y estaba íntimamente relacionada con la refractariedad.
El potencial teratógeno de cualquier FAE es de importancia en las mujeres en edad fértil. Tomson et al., en una revisión sistemática de los registros prospectivos de embarazo y epilepsia sobre malformaciones congénitas en hijos de madre con epilepsia y tratamiento con FAE, demuestran que el riesgo es mayor entre los FAE clásicos especialmente con VPA que con los nuevos FAE52. La Agencia Española del Medicamento y Productos Sanitarios y los expertos desaconsejan el empleo de VPA en la mujer en edad fértil y la necesidad de una mayor experiencia con los nuevos FAE53,54. En nuestra serie, el porcentaje de VPA en mujeres es del 20,7% (68% en edad fértil) y, aunque inferior al de los hombres (31%), continúa siendo elevado.
Nuestros pacientes farmacorresistentes, a los que se asocia más comorbilidad, emplean en mayor cuantía la combinación de FAE (clásicos + nuevos), lo que podría explicarse por el empleo de un mayor número de FAE en estos pacientes.
Pugliatti M. et al., en una revisión sobre el coste global (costes directos e indirectos) de la epilepsia en Europa, el tratamiento farmacológico representa el 3% del coste55. Bolin y Forsgren, en una revisión de la literatura sobre el coste de los nuevos tratamientos en epilepsia, concluyen que el control de las crisis no debe ser contemplado solo desde el coste de los FAE, mayor con los nuevos FAE, porque el principal objetivo del tratamiento de la epilepsia es el control de las crisis sin efectos adversos. La elección de los FAE basada en el coste económico es improbable que sea coste-efectiva en el tratamiento a largo plazo de los pacientes con epilepsia, en especial si se incluyen los costes indirectos de la enfermedad, como son la reducción de la vida laboral56. Por ello, la mayoría de los autores desaconsejan los cambios a formulaciones genéricas o de FAE nuevos a clásicos, basados exclusivamente en el coste y en especial en pacientes bien controlados57.
Continúa vigente como buena práctica clínica del tratamiento farmacológico de la epilepsia el consejo de basar la elección de los FAE según el tipo de crisis, síndrome epiléptico, edad y sexo, otras medicaciones y comorbilidades concomitantes de los pacientes, y la eficacia, la tolerabilidad y la seguridad de los FAE. Estas últimas son favorables a la utilización de los nuevos FAE, como refleja su mayor empleo en nuestro estudio.
Límites del estudioEl diseño de este estudio no refleja de forma global la prescripción farmacológica de la población con epilepsia en España porque recoge fundamentalmente a pacientes que, por dificultades de control de sus crisis, consultan con una mayor frecuencia a las consultas ambulatorias de neurología, de manera especial a las dedicadas de forma monográfica a la atención de pacientes con epilepsia, los cuales consumen más FAE.
Aprobación del estudioLa Agencia Española de Medicamentos y Productos Sanitarios clasificó el estudio con código: EPI-EPI-2015-01 como «Estudio post-autorización con otros diseños diferentes al de seguimiento prospectivo» (abreviado como EPA-OD), con fecha 27 de marzo del 2015.
Comité de Ética de la Investigación de Almería, con fecha 29 de julio del 2015.
Los datos recogidos y análisis de los mismos han sido supervisados por el Comité Científico del Estudio (J.M. Mercadé, F.J. López y P. Serrano).
Conflicto de interesesTodos los participantes en el estudio son neurólogos pertenecientes a la Sociedad Española de Neurología y no declaran ningún conflicto de interés con el presente estudio.
A Patricia Santagueda (BIODATOS), por el tratamiento estadístico de la muestra.
| Dr. Juan Mercadé Cerdá | Málaga |
| Dr. José Ángel Mauri Llerda | Zaragoza |
| Dr. Pedro Serrano Castro | Almería |
| Dr. Francisco Javier López González | Santiago de Compostela |
| Dr. Jerónimo Sancho Rieger | Valencia |
| Dr. Jaime Parra Gómez | Madrid |
| Dr Juan Luis Becerra Cuñat | Badalona |
| Dr. Jordi Ciurans Molist | Badalona |
| Dr. Juan Carlos Sánchez Álvarez | Granada |
| Dr. Joaquín Ojeda | Madrid |
| Dra. Isabel Ybor Gorrin | Madrid |
| Dr. Fernando Ayuga Loro | Toledo |
| Dra. M. Rosa Querol Pascual | Badajoz |
| Dra. Aránzazu Alfaro Sáez | Orihuela |
| Dra. Rosana Saiz Díaz | Madrid |
| Dr. Manuel Toledo Argany | Barcelona |
| Dr. Javier Abella Corral | Ferrol |
| Dra. María Gomez Eguilaz | Logroño |
| Dra. Marian Barcala Simó | Tarragona |
| Dra. Carmen Arenas Cabrera | Sevilla |
| Dra. Clara Isabel Cabeza Álvarez | Toledo |
| Dr. Vicente Bertol Alegre | Zaragoza |
| Dr. Javier Díaz de Terán | Madrid |
| Dra. Júlia Miró Lladó | Hospitalet de Llobregat |
| Dra. Mercè Falip Centelles | Hospitalet de Llobregat |
| Dra. Laura Pulido Fontes | Pamplona |
| Dr. Juan José Poza Aldea | Donostia |
| Dr. Asier Gómez | Valencia |
| Dra. Montserrat Asensio Asensio | Alicante |
| Dra. Maribel Chamorro Muñoz | Málaga |
| Dra. M. Dolores Castro Vilanova | Vigo |
| Dra. Amaya Castela | Sevilla |
| Dra. Inés Aranzabal Alustiza | Baracaldo |
| Dr. Esteban Santamarina Pérez | Barcelona |
| Dra. M. José Aguilar Amat Prior | Madrid |
| Dra. Patricia Esteve | Tortosa |
| Dra. M. Luisa Galiano Fraguas | Madrid |
| Dr. Juan Miguel Galán Barranco | Sevilla |
| Dra. Xiana Rodríguez Osorio | Santiago de Compostela |
| Dr. Santiago Fernández Fernández | Barcelona |
| Dr. Alfonso Falcón García | San Pedro de Alcántara |
| Dr. David Sopelana Garay | Albacete |
| Dr. José M. Flores Galdo | Tenerife |
| Dr. DiegoTortosa Conesa | Murcia |
| Dr. Luis Redondo Verge | Sevilla |
| Dra. María Pardo Parrado | Ourense |
| Dra. Dulce Campos Blanco | Valladolid |