La hemorragia intracraneal (HIC) en pacientes tratados con anticoagulantes orales antagonistas de la vitamina K (AVK) es una complicación grave y frecuentemente letal; en este trabajo estudiamos las características clínicas y los factores que se relacionan con la mortalidad en este grupo de pacientes.
MétodosRealizamos un estudio observacional, multicéntrico y retrospectivo, de ámbito nacional, basado en registros prospectivos de pacientes con ictus. Se incluyó a los pacientes ingresados en servicios de Neurología durante un período de un año y que cumplieran los criterios de inclusión: pacientes mayores de 18 años con HIC que estuvieran en tratamiento con AVK y que ingresaron durante el periodo de estudio. Se analizaron las variables clínicas y radiológicas y su evolución a 3 meses.
ResultadosIncluimos a 235 pacientes provenientes de 21 hospitales. La mortalidad a los 90 días fue del 42,6%. En el modelo bivariante los factores asociados con defunción fueron: mediana en la puntuación de la escala NIHSS al ingreso (5 [RIQ=9] vs. 17 [RIQ=14] puntos, p<0,01) y la presencia de una hemorragia hemisférica extensa (4,9% vs. 35%, p<0,01; X2). Las hemorragias hemisféricas extensas, además de ser las más letales, también presentaron el tiempo más corto hasta el fallecimiento (media 16,5 días; IC del 95%, 7,1-26). Realizamos un modelo de regresión logística que evidenció que solo la NIHSS basal predijo de forma independiente el fallecimiento (odds ratio=1,13 [IC del 95%, 1,08-1,17] por cada punto en la escala).
ConclusiónLa HIC en pacientes tratados con AVK conlleva una elevada mortalidad asociada principal e independientemente con la situación clínica al inicio del ictus.
Intracranial haemorrhages (ICH) represent a severe and frequently lethal complication in patients treated with vitamin K antagonists (VKA). The purpose of our study is to describe the factors and clinical features associated with mortality in these patients.
MethodsWe conducted an observational, retrospective, multi-centre study based on prospective stroke registries in Spain. We included all patients admitted to neurology departments during a one-year period who met the following inclusion criteria: being 18 or older, having a diagnosis of ICH, and receiving VKA. Clinical and radiological parameters and 3-month outcomes were analysed.
ResultsA total of 235 patients from 21 hospitals were included. Mortality rate at 90 days was 42.6%. Bivariate analysis showed a significant association between death and the following factors: median NIHSS score at admission (5 [IQR = 9] vs 17 [IQR = 14] points, P<.01) and presence of an extensive hemispheric haemorrhage (4.9% vs 35%, P < .01; χ2). Extensive hemispheric haemorrhages, in addition to being the most lethal type, were associated with a shorter time to death (mean of 16.5 days; 95% CI: 7.1-26). A logistic regression model showed that only baseline NIHSS scores independently predicted death (odds ratio=1.13 [95% CI: 1.08-1.17] for each point in the scale).
ConclusionICH in patients treated with VKA is associated with high mortality rates; mortality in these patients is mainly and independently associated with the clinical situation at stroke onset.
La hemorragia cerebral (HIC) supone el 8-15% de todos los ictus. Su mortalidad a corto plazo se sitúa alrededor del 20-30%, mayor que el infarto cerebral o la hemorragia subaracnoidea1,2. De forma global, se considera que su incidencia aumenta entre un 7 y un 10% en los pacientes anticoagulados3. Del total de las hemorragias cerebrales, hasta un 23,4% aparece en pacientes en tratamiento anticoagulante, con una mortalidad a los 3 meses entre el 52 y el 63%4,5. La mayor mortalidad en los pacientes anticoagulados se ha relacionado con múltiples factores: el mayor tamaño del hematoma en pacientes anticoagulados6-8, la predilección por la localización en troncoencéfalo9, el crecimiento del hematoma10,11 y el riesgo de expansión intraventricular de hemorragias lobares y profundas10-12. Además, no existe ninguna medida terapéutica específica que haya demostrado ser eficaz para reducir las secuelas o la mortalidad de este tipo de hemorragias.
Recientemente, se han publicado los datos de un estudio descriptivo multicéntrico realizado en España (Traditional Anticoagulation Complications Registry [TAC Registry]), que muestra una incidencia de la HIC asociada a tratamiento anticoagulante con antagonistas de la vitamina K (HIC-AVK) de 2,9 casos/100.000 habitantes, lo que supone un 1,94% del total de ictus y un 13,6% del total de hemorragias cerebrales. Este estudio reveló una mortalidad del 42,6% a los 3 meses13. El objetivo principal del presente trabajo fue describir la mortalidad de las HIC-AVK y determinar las características clínicas asociadas con el fallecimiento, en los pacientes estudiados en el TAC Registry.
Materiales y métodosEl estudio TAC Registry es un estudio observacional, multicéntrico y retrospectivo de ámbito nacional, basado en registros y bases de datos construidas de forma prospectiva en las que se incluye a pacientes consecutivos con ictus. Los pacientes estudiados fueron aquellos ingresados en servicios de Neurología (mayoritariamente en unidades de ictus) durante un período de un año (del 1 de septiembre del 2012 al 31 de agosto del 2013). Los centros participantes fueron hospitales generales, con una población de referencia bien delimitada, atención urgente las 24 h, disponibilidad de TC o resonancia magnética cerebral las 24 h, que atendieran a pacientes con ictus en fase aguda, que dispusieran de unidad o servicio de Neurología, en los que todos los pacientes con diagnóstico de ictus ingresasen a cargo de Neurología o en otro servicio bajo supervisión de un neurólogo y que dieran su conformidad para participar en el estudio. Los criterios de inclusión fueron: pacientes mayores de 18 años con HIC, que estuvieran en tratamiento con AVK y que ingresaron durante el periodo de estudio. Se excluyó a aquellos pacientes con diagnóstico de hematoma epidural o subdural, hemorragia subaracnoidea, infarto cerebral con transformación hemorrágica o hemorragia traumática.
Se diseñó un formulario electrónico para que cada centro volcara en él los datos clínicos de los pacientes incluidos (datos demográficos, factores de riesgo vascular, tipo de anticoagulación oral [AO] indicada, motivo de indicación de la AO, INR al ingreso, tratamientos concomitantes, fallecimiento intra o extrahospitalario, fecha del fallecimiento, gravedad del ictus al ingreso y al alta (medida por la escala de la National Institute of Health [NIHSS]), evolución a los 3 meses (medida por la escala de Rankin modificada). La topografía de la hemorragia se clasificó en los siguientes grupos: lobar, profunda (ganglios de la base o tálamo), troncoencefálica, cerebelosa, supratentorial hemisférica extensa (volumen > 100ml, independientemente del origen aparente del sangrado, calculado según la fórmula ½ [a × b × c]), e intraventricular (fueran primarias o por invasión intraventricular de hemorragias hemisféricas o troncoencefálicas).
Dado el carácter retrospectivo y observacional del estudio, en el que no se recogieron datos que pudieran ser identificativos de cada caso particular, no se requirió de consentimiento informado. El estudio contó con la aprobación del comité de ética del centro promotor. Los datos se estudiaron utilizando la mediana y los percentiles 25 y 75 para las variables cuantitativas discontinuas, así como las continuas que no tuvieron una distribución normal, y se analizaron utilizando técnicas de estadística no paramétrica; las variables categóricas se estudiaron usando tasas porcentuales y para el estudio de su asociación con la mortalidad se utilizó la X2. La asociación de los diversos factores con el tiempo desde el ictus hasta el fallecimiento se estudió por medio del análisis de supervivencia de Kaplan-Meier. Se consideró la significación estadística cuando p<0,05. Los datos se analizaron con los siguientes programas informáticos: SPSS® v 13.0, Microsoft Excel® 2010 y R v3.0.1.
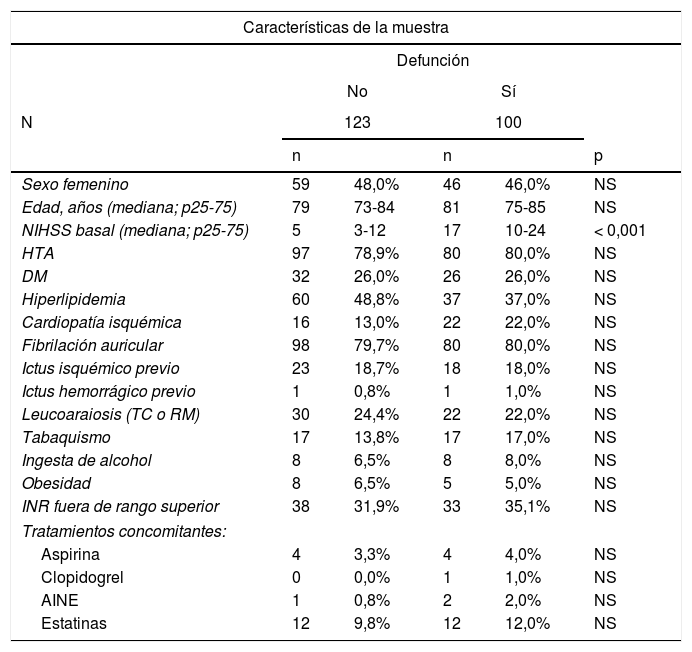
ResultadosCaracterísticas de la muestraDurante el periodo de estudio se encontraron un total de 235 casos de HIC-AVK provenientes de 21 hospitales. Se completó el seguimiento a 90 días de 223 casos con una tasa de pérdidas de seguimiento del 5,1%. La tasa de mortalidad en los primeros 90 días fue del 42,6%. Las características basales de la muestra se representan en la tabla 1, donde se comparan características clínicas, factores de riesgo vascular, estado de la anticoagulación al ingreso (medido por el INR) y la medicación concomitante entre los 2 grupos de estudio. La mediana en la puntuación de la escala NIHSS al ingreso fue mayor en el grupo de pacientes que fallecieron en comparación con los que sobrevivieron (17 [RIQ: 14] vs. 5 [RIQ: 9] puntos, p<0,01); ninguna de las otras variables tuvo una asociación estadísticamente significativa con un desenlace fatal.
Características de la muestra
| Características de la muestra | |||||
|---|---|---|---|---|---|
| Defunción | |||||
| No | Sí | ||||
| N | 123 | 100 | |||
| n | n | p | |||
| Sexo femenino | 59 | 48,0% | 46 | 46,0% | NS |
| Edad, años (mediana; p25-75) | 79 | 73-84 | 81 | 75-85 | NS |
| NIHSS basal (mediana; p25-75) | 5 | 3-12 | 17 | 10-24 | < 0,001 |
| HTA | 97 | 78,9% | 80 | 80,0% | NS |
| DM | 32 | 26,0% | 26 | 26,0% | NS |
| Hiperlipidemia | 60 | 48,8% | 37 | 37,0% | NS |
| Cardiopatía isquémica | 16 | 13,0% | 22 | 22,0% | NS |
| Fibrilación auricular | 98 | 79,7% | 80 | 80,0% | NS |
| Ictus isquémico previo | 23 | 18,7% | 18 | 18,0% | NS |
| Ictus hemorrágico previo | 1 | 0,8% | 1 | 1,0% | NS |
| Leucoaraiosis (TC o RM) | 30 | 24,4% | 22 | 22,0% | NS |
| Tabaquismo | 17 | 13,8% | 17 | 17,0% | NS |
| Ingesta de alcohol | 8 | 6,5% | 8 | 8,0% | NS |
| Obesidad | 8 | 6,5% | 5 | 5,0% | NS |
| INR fuera de rango superior | 38 | 31,9% | 33 | 35,1% | NS |
| Tratamientos concomitantes: | |||||
| Aspirina | 4 | 3,3% | 4 | 4,0% | NS |
| Clopidogrel | 0 | 0,0% | 1 | 1,0% | NS |
| AINE | 1 | 0,8% | 2 | 2,0% | NS |
| Estatinas | 12 | 9,8% | 12 | 12,0% | NS |
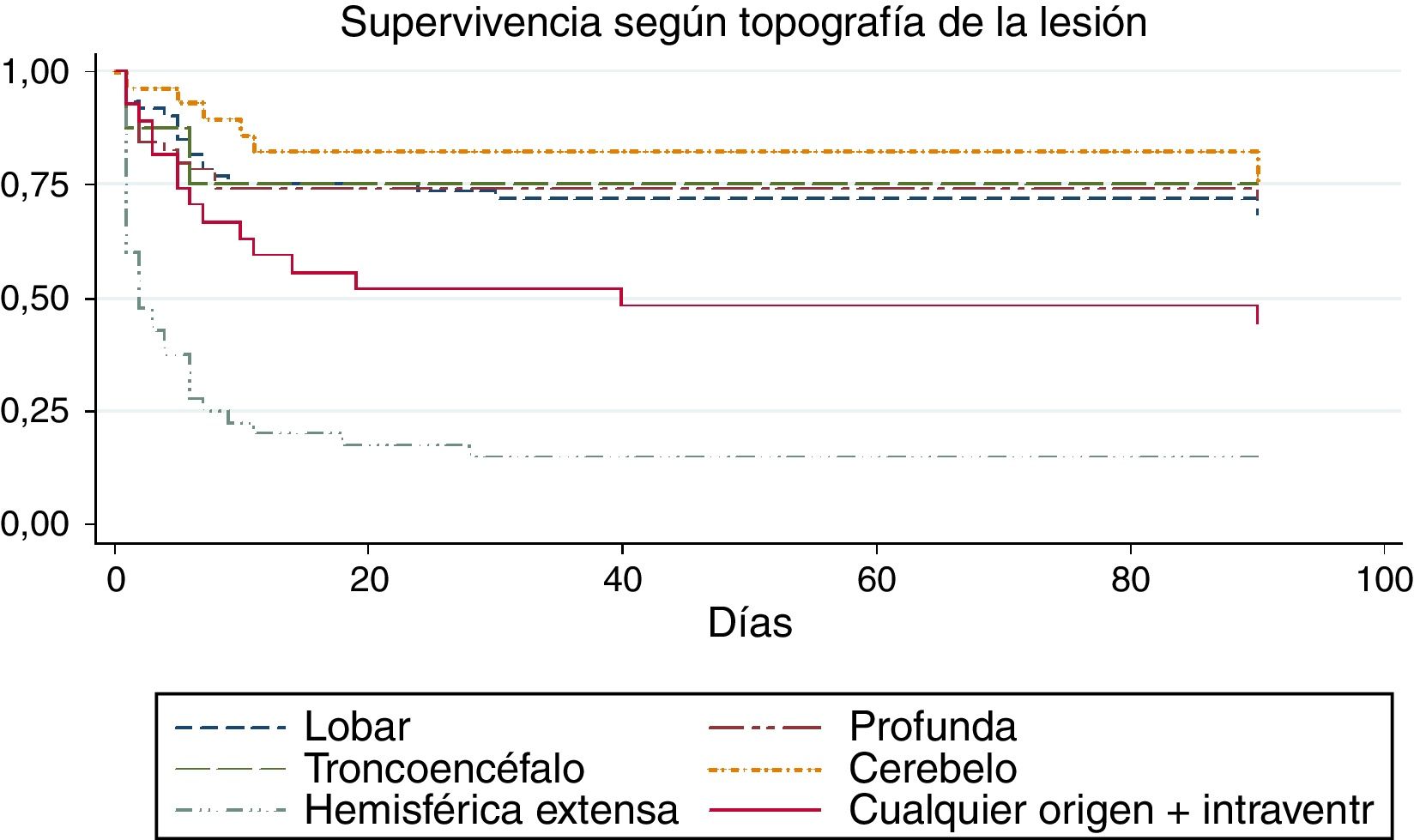
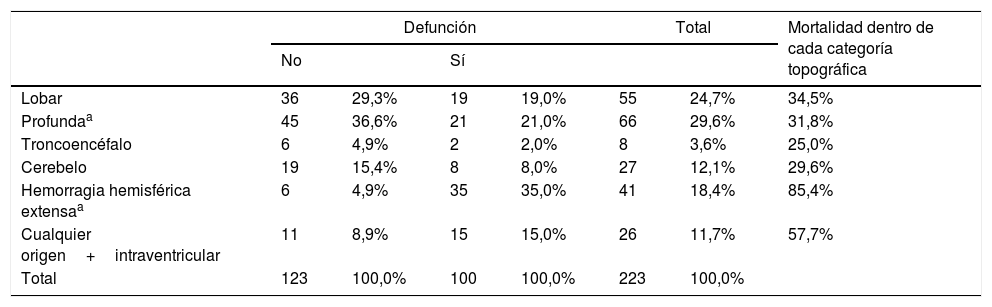
En el total de la muestra la ubicación más frecuente de la hemorragia fue en territorios hemisféricos profundos (29,8%), seguida por aquellas de localización lobar (25,5%) (tabla 2). Dentro de los diferentes subgrupos topográficos (tabla 3), la presencia de una hemorragia hemisférica extensa (definida como aquella con un volumen mayor de 100ml, pudiendo asociar hemorragia intraventricular también) se asoció significativamente a la evolución a defunción (35% vs. 4,9%, p<0,01; χ2 y corrección de Bonferroni); en segundo lugar de letalidad se encontraron aquellas hemorragias que asociaban sangrado intraventricular independientemente de su origen y con un volumen menor de 100ml.
Ubicación de la lesión y mortalidad
| Defunción | Total | Mortalidad dentro de cada categoría topográfica | |||||
|---|---|---|---|---|---|---|---|
| No | Sí | ||||||
| Lobar | 36 | 29,3% | 19 | 19,0% | 55 | 24,7% | 34,5% |
| Profundaa | 45 | 36,6% | 21 | 21,0% | 66 | 29,6% | 31,8% |
| Troncoencéfalo | 6 | 4,9% | 2 | 2,0% | 8 | 3,6% | 25,0% |
| Cerebelo | 19 | 15,4% | 8 | 8,0% | 27 | 12,1% | 29,6% |
| Hemorragia hemisférica extensaa | 6 | 4,9% | 35 | 35,0% | 41 | 18,4% | 85,4% |
| Cualquier origen+intraventricular | 11 | 8,9% | 15 | 15,0% | 26 | 11,7% | 57,7% |
| Total | 123 | 100,0% | 100 | 100,0% | 223 | 100,0% | |
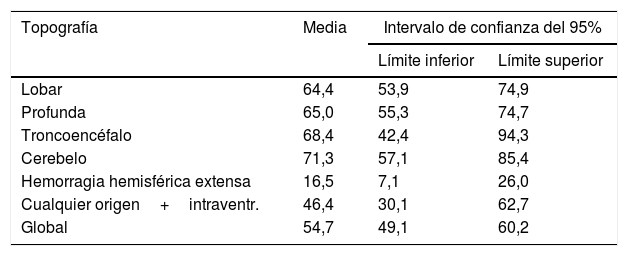
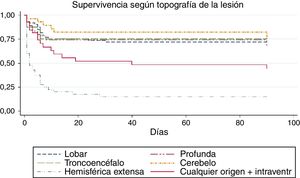
Para valorar la relación entre la topografía de la lesión y el tiempo ictus-defunción dentro de los primeros 90 días de evolución, realizamos un análisis de supervivencia. La curva de Kaplan-Meier correspondiente se representa en la figura 1, donde encontramos una asociación entre la topografía y el tiempo de supervivencia (log rank, p<0,01). De forma global (tabla 4), el tiempo promedio ictus-defunción dentro de los primeros 90 días fue de 54,7 días (IC del 95%, 49,1-60,2 días), las hemorragias hemisféricas extensas, además de ser las más letales, también presentaron el tiempo más corto hasta el fallecimiento (media 16,5 días; IC del 95%, 7,1-26).
Promedio de tiempo ictus-defunción según la localización de la lesión
| Topografía | Media | Intervalo de confianza del 95% | |
|---|---|---|---|
| Límite inferior | Límite superior | ||
| Lobar | 64,4 | 53,9 | 74,9 |
| Profunda | 65,0 | 55,3 | 74,7 |
| Troncoencéfalo | 68,4 | 42,4 | 94,3 |
| Cerebelo | 71,3 | 57,1 | 85,4 |
| Hemorragia hemisférica extensa | 16,5 | 7,1 | 26,0 |
| Cualquier origen+intraventr. | 46,4 | 30,1 | 62,7 |
| Global | 54,7 | 49,1 | 60,2 |
Para determinar qué variables se asociaron de forma independiente con el desarrollo de fallecimiento, realizamos una regresión logística en cuyo modelo máximo se incluyeron aquellas variables que se asociaron con defunción en el análisis bivariante (NIHSS basal y hemorragia hemisférica extensa). Del modelo resultó que solo la NIHSS basal predijo de forma independiente el fallecimiento (odds ratio: 1,13 [IC del 95%, 1,08-1,17] por cada aumento de un punto en la escala NIHSS al ingreso).
DiscusiónEn nuestro estudio encontramos que la puntuación en la escala NIHSS al ingreso y la presencia de hemorragia hemisférica extensa (que además mostró un menor tiempo de supervivencia) se asociaron de forma significativa a la evolución a defunción en pacientes anticoagulados con AVK. Sin embargo, en el análisis multivariante solo la puntuación en la escala NIHSS se mostró como un factor de riesgo independiente para fallecimiento. Ni el estado de anticoagulación previo, ni los factores de riesgo vascular, ni la medicación concomitante se relacionaron con este desenlace.
La mortalidad de la hemorragia intracerebral asociada a tratamiento anticoagulante es elevada, de un 42,6%, en nuestra serie. Debido al aumento de prescripción de estos fármacos y a la mayor edad de los pacientes tratados, las complicaciones derivadas de estos tratamientos son cada vez más frecuentes6. Un estudio comparativo entre pacientes anticoagulados con y sin hemorragia intracerebral8 ha relacionado el riesgo de sangrado intracerebral con una menor duración del tratamiento anticoagulante, con el tiempo de protrombina, la presencia de infarto cerebral previo y el uso de acenocumarol, sin encontrar asociación con la edad o con la indicación para la anticoagulación. En otro estudio reciente realizado en España en más de 20.000 pacientes en tratamiento anticoagulante, se detectaron 190 eventos hemorrágicos graves (8,02%) de un total de 2.369 eventos hemorrágicos. De ellos, 43 pacientes tuvieron hemorragias cerebrales graves, presentando la mayor probabilidad de muerte (uno de cada 3)14, lo que ha convertido a las HIC-AVK en una de las complicaciones más temidas de la terapia anticoagulante15.
En varios trabajos previos se han tratado de establecer variables pronósticas y de evolución a mortalidad una vez producida la HIC en pacientes anticoagulados. Por ejemplo, se ha planteado que la edad de los pacientes al ingreso sea un marcador pronóstico16; de hecho, en nuestro estudio los pacientes mayores de 85 años presentaron una mayor probabilidad de mortalidad (51,7% vs. 36,6%), estas son tasas similares a las descritas. De esta manera, se ha descrito asociación estadísticamente significativa y de forma independiente con: extensión intraventricular y volumen del hematoma5; volumen del hematoma y estado de consciencia17 y extensión intraventricular, tamaño del hematoma y crecimiento del mismo4,18. Berwaerts et al.19 establecieron un modelo de regresión que predecía el riesgo de mortalidad en pacientes con HIC-AVK en función de la escala de Glasgow al inicio, el tamaño del hematoma y los signos de enfermedad cerebrovascular en la TC cerebral; otros factores que también se vieron relacionados fueron la localización en la fosa posterior, el desplazamiento de línea media y la presencia de hemorragia intraventricular.
De esta forma, los factores pronósticos relacionados de forma más constante en los diferentes estudios previos serían el nivel de consciencia al ingreso y el volumen inicial del hematoma15, lo que concuerda con los resultados de nuestro estudio. En un estudio realizado en España en 201320 también se encontró que el único factor que predijo la mortalidad de forma independiente fue la puntuación basal en la escala NIHSS. Cabe destacar también que la presentación de las hemorragias cerebrales en forma de síndrome lacunar se ha asociado con un buen pronóstico funcional y vital, con una mortalidad del 0%21.
Uno de los aspectos más controvertidos es el impacto del valor del INR sobre el pronóstico. Se ha descrito que aproximadamente el 68% de las hemorragias ocurre con un INR<3,04; de hecho, en nuestra serie, el 29,4% se encontraba en rango terapéutico y solo aproximadamente 1/3 en rango supraterapéutico13. Según nuestros resultados, un INR fuera de rango superior no se relacionó con un mayor riesgo de evolución a defunción. El estudio de Alonso de Leciñana et al.20 no logró relacionar el volumen del hematoma con el INR y tampoco logró establecer una relación entre el INR basal, la reversión de la anticoagulación o el crecimiento del hematoma con el pronóstico funcional. No obstante, otros autores4,22 han establecido una mayor mortalidad en pacientes con mayor INR basal, lo que quizás se explique por el mayor volumen de hemorragia con INR>311. Esta aparente discrepancia puede deberse a varios factores, principalmente a que, en nuestro estudio, al igual que en otros, no se dispone de imagen de control que valore el posible aumento del hematoma, y además se desconoce el tiempo desde la última toma de la medicación, el comienzo de la hemorragia y la determinación del INR.
Por otra parte, la influencia del uso concomitante de tratamiento antiagregante también ha mostrado datos discrepantes en la literatura. Algunos autores establecen que el tratamiento concomitante con fármacos antiplaquetarios no es un factor de riesgo independiente de mortalidad23, lo que concuerda con nuestros resultados. Sin embargo, otros autores han relacionado el uso concomitante de tratamiento antiagregante con un peor pronóstico a corto plazo y un aumento de mortalidad, en posible relación con un mayor aumento del volumen del hematoma24.
En cualquier caso, casi todos los autores comparten la observación de que la probabilidad de muerte aumentaría a mayor número de factores de mal pronóstico, independientemente del tratamiento quirúrgico o conservador empleado25. Son varios los estudios en los que se ha descrito que, a pesar de la corrección del INR, la morbimortalidad de esta entidad permanece elevada12. La administración aislada de vitamina K tarda varias horas en revertir la anticoagulación26, por lo que en la práctica clínica se emplean otras medidas adicionales, aun en ausencia de una evidencia clínica suficiente. Un estudio multicéntrico retrospectivo27 demostró que no recibir tratamiento con plasma fresco congelado y/o complejo protrombínico se asocia a un incremento de más de 2 veces del riesgo de mortalidad a los 30 días frente a los pacientes tratados, especialmente frente a aquellos que recibieron ambos tratamientos, sin establecer diferencias estadísticamente significativas a favor de uno de los 2 tratamientos. Por otra parte, se ha demostrado que la reversión de la anticoagulación hasta INR < 1,3, igual que un descenso de la presión arterial sistólica < 160mmHg en las primeras 24 h, se asocian a un menor crecimiento del hematoma28. Estos datos contrastan con un estudio previo en el que no se logró establecer una correlación entre el INR inicial y/o el tiempo hasta la corrección del mismo y la expansión de la HIC15.
Cabe destacar también que los anticoagulantes de acción directa (ACOD), según lo demostrado en los correspondientes ensayos clínicos pivotales29-32, tienen una tasa igual o inferior de sangrados intracraneales en comparación con los AVK. Se ha descrito que la mortalidad en pacientes tratados con ACOD que desarrollan una HIC es del 28%33 y además parece que las HIC tienen mejor pronóstico funcional y menor volumen de sangrado en los pacientes tratados con ACOD en comparación con los tratados con AVK34.
Nuestro estudio no está exento de limitaciones. Al tratarse de un estudio retrospectivo, solo disponemos de los datos de aquellos pacientes que fueron atendidos por un servicio de Neurología del sistema público de salud. Por otra parte, disponemos solo de los datos de la primera evaluación, lo que implica que no disponemos de hallazgos en neuroimagen de control (crecimiento del hematoma, expansión intraventricular, etc.) que, como describíamos otros estudios, han relacionado con el pronóstico final. Tampoco se recogió el valor absoluto del volumen del hematoma, sino que se clasificó en mayores o menores de 100ml, lo que nos impide realizar una correlación más precisa. Una de las mayores limitaciones de nuestro estudio es la ausencia de datos sobre el tratamiento aplicado en estos pacientes, por lo que no se ha podido analizar su posible repercusión en diferentes parámetros radiológicos y de laboratorio, así como en la evolución clínica de nuestros pacientes, en los que tampoco se recogió la causa de la muerte.
En vista de estos resultados, podemos concluir que las HIC-AVK tienen una elevada mortalidad asociada principal e independientemente con la situación clínica al inicio del ictus.
FinanciaciónEste trabajo ha recibido financiación parcial a través de una beca de investigación internacional de Bristol Myers Squibb.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Asturias: Hospital Universitario Central de Asturias: Dr. Sergio Calleja. Castilla-La Mancha: Hospital Universitario de Albacete: Dra. Eva Fernández y Dr. Tomás Segura. Castilla y León: Hospital Universitario de León: Dr. Javier Tejada García y Dra. Noelia González Nafría; Hospital Universitario de Salamanca: Dr. José Carlos Gómez. Cataluña: Hospital del Mar: Dr. Jaume Roquer; Hospital Universitari Arnau de Vilanova: Dr. Francisco Purroy; Hospital de la Santa Creu i Sant Pau: Dr. Alejandro Martínez Domeño y Dr. Joan Martí Fábregas. Extremadura: Hospital San Pedro de Alcántara: Dr. Ignacio Casado. Galicia: Hospital Clínico Universitario de Santiago de Compostela: Dr. Manuel Rodríguez Yáñez. Islas Baleares: Hospital Universitari Son Espases: Dra. Bárbara Vives y Dra. Carmen Jiménez Martínez. Islas Canarias: Hospital Universitario de Gran Canaria Dr. Negrín: Dr. Juan Carlos López Fernández. Madrid: Hospital Universitario Ramón y Cajal: Dr. Jaime Masjuán Vallejo; Hospital Universitario 12 de Octubre: Dr. Jaime Díaz Guzmán; Hospital Universitario Clínico San Carlos: Dra. Talía Liaño y Dr. José Egido; Hospital Universitario La Paz: Dr. Borja Enrique Sanz Cuesta y Dra. Blanca Fuentes; Hospital General Universitario Gregorio Marañón: Dr. Andrés García Pastor, Dr. Raúl Domínguez y Dr. Antonio Gil; Hospital Universitario de La Princesa: Dr. Gustavo Zapata Wainberg, Dr. Álvaro Ximénez-Carrillo, Dra. Sonia Quintas y Dr. José Vivancos. Navarra: Complejo Hospitalario de Navarra: Dr. Jaime Gállego Culleré. País Vasco: Hospital Universitario Basurto: Dr. Juan Luis Idro Montes y Dra. María del Mar Freijó. Valencia: Hospital Clínico Universitario de Valencia: Dra. Anna Martín y Dr. José Miguel Laínez; Hospital Universitario y Politécnico La Fe: Dra. Aída Lago.