La neuroinflamación está involucrada en la fisiopatología de diferentes trastornos neurológicos, en particular la enfermedad de Alzheimer (EA) y la enfermedad de Parkinson (EP). Las alteraciones en la barrera hematoencefálica pueden permitir la entrada al sistema nervioso central de linfocitos periféricos, los cuales pueden participar en la patología de las enfermedades.
ObjetivoEvaluar el perfil de linfocitos periféricos en pacientes con EA y EP y su asociación con la enfermedad y su progresión.
MétodosSe incluyeron 20 pacientes con EA, 20 pacientes con EP y un grupo de individuos sanos. Diez de los pacientes con EA y 12 de los pacientes con EP fueron evaluados una segunda vez de 17 a 27 meses después del inicio del estudio. Las subpoblaciones de linfocitos y su estado de activación se determinaron mediante citometría de flujo. Todos los pacientes fueron evaluados neurológicamente utilizando escalas validadas internacionalmente.
ResultadosLos pacientes con EA y EP mostraron un aumento significativo en los niveles de linfocitos activados, linfocitos susceptibles a la apoptosis, células T de memoria central y células T y B reguladoras con respecto a los sujetos sanos. A medida que las enfermedades progresaron se observó una disminución significativa de las células activadas (CD4+ CD38+ y CD8+ CD38+ en EP y EA; CD4+ CD69+ y CD8+ CD69+ en EP), de las células T susceptibles a la apoptosis y de algunas poblaciones reguladoras (CD19+ CD5+ IL10+ en EP y EA; CD19+ CD5+ IL10+ FoxP3+, CD4+ FoxP3+ CD25+ CD45RO+ en EP). En pacientes con EA la progresión de la enfermedad se asoció con porcentajes más bajos de CD4 + CD38 + y mayores porcentajes de células CD4 efectoras al comienzo del estudio. Se observaron diferencias significativas entre ambas enfermedades.
ConclusionesEste estudio proporciona evidencia de cambios en los fenotipos de linfocitos periféricos asociados a EA y EP y a su gravedad. Teniendo en cuenta la comunicación efectiva sangre-cerebro, nuestros resultados abren nuevas vías para explorar terapias de inmunomodulación para tratar estas enfermedades.
Neuroinflammation is involved in the pathophysiology of various neurological disorders, in particular Alzheimer disease (AD) and Parkinson's disease (PD). Alterations in the blood-brain barrier may allow peripheral blood lymphocytes to enter the central nervous system; these may participate in disease pathogenesis.
ObjectiveTo evaluate the peripheral blood lymphocyte profiles of patients with AD and PD and their association with the disease and its progression.
MethodsThe study included 20 patients with AD, 20 with PD, and a group of healthy individuals. Ten of the patients with AD and 12 of those with PD were evaluated a second time 17 to 27 months after the start of the study. Lymphocyte subpopulations and their activation status were determined by flow cytometry. All patients underwent neurological examinations using internationally validated scales.
ResultsCompared to healthy individuals, patients with AD and PD showed significantly higher levels of activated lymphocytes, lymphocytes susceptible to apoptosis, central memory T cells, and regulatory T and B cells. As the diseases progressed, there was a significant decrease in activated cells (CD4+ CD38+ and CD8+ CD38 + in PD and AD, CD4+ CD69+ and CD8+ CD69+ in PD), T cells susceptible to apoptosis, and some regulatory populations (CD19+ CD5+ IL10+ in PD and AD, CD19+ CD5+ IL10+ FoxP3+, CD4+ FoxP3+ CD25+ CD45RO+ in PD). In patients with AD, disease progression was associated with lower percentages of CD4+ CD38+ cells and higher percentages of effector CD4 cells at the beginning of the study. Significant differences were observed between both diseases.
ConclusionsThis study provides evidence of changes in peripheral blood lymphocyte phenotypes associated with AD and PD and their severity. Considering effective blood-brain communication, our results open new avenues of research into immunomodulation therapies to treat these diseases.
La prevalencia de enfermedades neurodegenerativas aumenta continuamente, principalmente debido a la mayor sobrevida humana1,2. Si bien el factor de riesgo más evidente es la edad avanzada, también intervienen otros factores3–5. La enfermedad de Alzheimer (EA) y la enfermedad de Parkinson (EP) son los trastornos neurodegenerativos más frecuentes6,7. En el ámbito clínico la EA se caracteriza por pérdida de memoria y deterioro cognitivo; por otro lado, aunque sí existen síntomas no motores en la EP, los signos distintivos de la enfermedad son temblor, bradicinesia y rigidez muscular8. A nivel patológico ambos trastornos se caracterizan por una pérdida neuronal progresiva, principalmente en la corteza cerebral, el hipocampo y la amígdala en la EA, y se restringen principalmente a las neuronas dopaminérgicas de la sustancia nigra pars compacta en la EP9. Adicionalmente, existen diferencias en los sellos patológicos de ambas enfermedades. Las placas amiloides extracelulares y los ovillos neurofibrilares intracelulares son los principales hallazgos en la EA10, mientras que la agregación de la proteína alfa-sinucleína plegada formando inclusiones intracelulares, denominadas cuerpos de Lewy, es la principal característica en la EP11,12.
Es claro que existe una respuesta neuroinflamatoria en ambas enfermedades. La activación de la microglía y de los astrocitos, la presencia de citocinas proinflamatorias y las alteraciones en la barrera hematoencefálica permiten a las células periféricas infiltrarse en el sistema nervioso central, lo cual ya ha sido evidenciado en ambas enfermedades13,14. Aunque el papel de la neuroinflamación en la patogenia de estas enfermedades no se conoce por completo, es considerado generalmente como un fenómeno deletéreo, que interviene en el proceso neurodegenerativo15,16. Por lo tanto, el estudio de perfiles de linfocitos periféricos en pacientes que padecen estas enfermedades es relevante por varias razones17. En primer lugar, podrían ser biomarcadores para el cribado de enfermedades y permitir un diagnóstico precoz14,18. Además, dado que las células inmunitarias periféricas pueden alcanzar el sistema nervioso central, podrían participar diferencialmente, dependiendo de su fenotipo, en la modulación de las tasas de progresión de la enfermedad19.
La distribución de fenotipos de linfocitos periféricos en pacientes con EA y EP ha sido evaluada en varios estudios20. Aunque los resultados han sido divergentes, la mayoría de los estudios que evaluaron pacientes con EA y los compararon con controles mostraron una disminución en el porcentaje y números absolutos de linfocitos CD3+ y CD19+21,22 asociados con un aumento en el porcentaje y números absolutos de CD4+ activados y células T CD8+22,23. Además, el porcentaje de células CD4+ vírgenes (CD45RA+ /CCR7+) se reportó como disminuido, mientras que el de memoria efectora CD4+ (CD45RA-/CCR7−) y de memoria efectoras diferenciadas (CD45RA+/CCR7−) se incrementaron significativamente24. Las diferencias en la distribución de linfocitos periféricos también se han observado en pacientes con EP. Particularmente, las células T CD4+ se encontraron disminuidas con respecto a los controles, así como el porcentaje de células CD4+/CD45RA+ y CD4+/CD31+, mientras que el porcentaje de células CD4+/CD45RO+ y CD4+/FAS+ se incrementó25. Estos cambios fueron más pronunciados en los casos más graves25. Otro reporte encontró un aumento en las ratios de células Th1/Th2 y células Th17/T reg en pacientes con EP; el aumento de la ratio Th1/Th2 se asoció con un incremento de la disfunción motora26.
Teniendo en cuenta estos antecedentes, este estudio fue diseñado para explorar más a fondo los cambios en las subpoblaciones periféricas de linfocitos en pacientes con EA y EP, y para identificar alteraciones que podrían ayudarnos a predecir la progresión de la enfermedad.
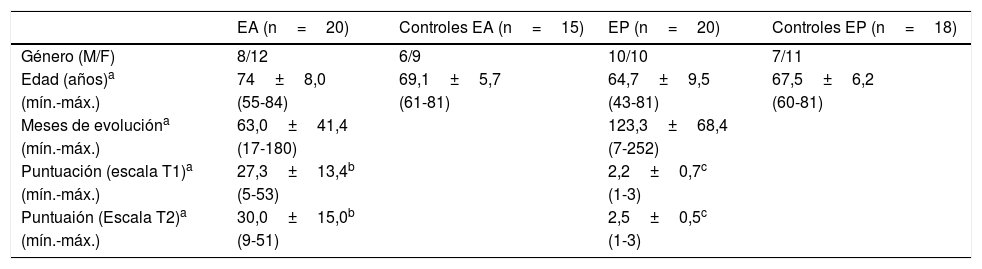
Materiales y métodosPacientesSe realizó un estudio longitudinal en el cual se incluyeron 20 pacientes con EA y 20 pacientes con EP. Doce pacientes con EP y 10 pacientes con EA fueron seguidos durante aproximadamente 2 años (17 a 27 meses). No pudimos hacer el seguimiento de todos los pacientes inicialmente evaluados, ya que parte de ellos, por voluntad propia, no regresaron a sus citas planeadas. También se incluyó un grupo control de pacientes sanos, pareados con los casos en sexo y edad (tabla 1). Solo se incluyeron pacientes que cumplieron con los criterios de la NINCDS-ADRDA27 para el diagnóstico clínico de EA y los de la UK Parkinson's Disease Society Brain Bank28 para la EP. Todos los pacientes con EA y EP presentaban una enfermedad esporádica; al inicio de la enfermedad los pacientes con EP tenían más de 40 años, mientras que los pacientes con EA tenían más de 55 años.
Características principales de los pacientes y controles incluidos
| EA (n=20) | Controles EA (n=15) | EP (n=20) | Controles EP (n=18) | |
|---|---|---|---|---|
| Género (M/F) | 8/12 | 6/9 | 10/10 | 7/11 |
| Edad (años)a | 74±8,0 | 69,1±5,7 | 64,7±9,5 | 67,5±6,2 |
| (mín.-máx.) | (55-84) | (61-81) | (43-81) | (60-81) |
| Meses de evolucióna | 63,0±41,4 | 123,3±68,4 | ||
| (mín.-máx.) | (17-180) | (7-252) | ||
| Puntuación (escala T1)a | 27,3±13,4b | 2,2±0,7c | ||
| (mín.-máx.) | (5-53) | (1-3) | ||
| Puntuaión (Escala T2)a | 30,0±15,0b | 2,5±0,5c | ||
| (mín.-máx.) | (9-51) | (1-3) |
EA: enfermedad de Alzheimer; EP: enfermedad de Parkinson.
Los criterios de exclusión, tanto para pacientes como para controles, fueron: no sufrir infecciones, enfermedades inflamatorias, cáncer y/o enfermedades metabólicas no controladas, y no haber estado bajo tratamientos antiinflamatorios durante 3 meses previos al momento de la inclusión.
En el momento de la inclusión, y al final del período de seguimiento, los pacientes fueron evaluados clínicamente por neurólogos expertos utilizando la escala de Hoehn y Yahr (pacientes con EP) y la Dementia Severity Rating Scale, escala de clasificación de la gravedad de la demencia para pacientes con EA29,30. Las diferencias en la puntuación entre ambos tiempos de evaluación se usaron para evaluar la progresión de la enfermedad.
MétodosAislamiento de células mononucleares de sangre periféricasSe obtuvo una muestra de sangre venosa de 24ml en tubos recubiertos con ácido etilendiaminotetraacético (EDTA) (BD Vacutainer). Las muestras se mantuvieron a temperatura ambiente y se procesaron en 2horas. Las células mononucleares de sangre periféricas se aislaron en un gradiente de Ficoll/Hypaque.
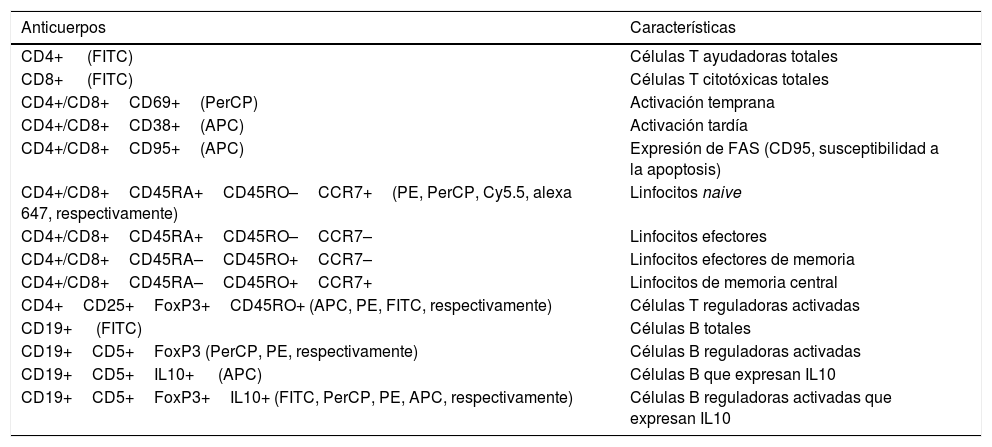
Fenotipificación de linfocitosLos anticuerpos monoclonales humanos utilizados para el fenotipado de leucocitos mediante citometría de flujo se muestran en la tabla 2. Todos los anticuerpos se titularon para la detección óptima de poblaciones positivas antes de su uso, siguiendo las concentraciones recomendadas por el fabricante (BioLegend, San Diego, CA, EE. UU.). Las combinaciones de anticuerpos se utilizaron para definir diferentes poblaciones de linfocitos (tabla 2). Se incluyeron los controles de isotipo apropiados.
Combinaciones de anticuerpos utilizados en citometría
| Anticuerpos | Características |
|---|---|
| CD4+ (FITC) | Células T ayudadoras totales |
| CD8+ (FITC) | Células T citotóxicas totales |
| CD4+/CD8+CD69+(PerCP) | Activación temprana |
| CD4+/CD8+CD38+(APC) | Activación tardía |
| CD4+/CD8+CD95+(APC) | Expresión de FAS (CD95, susceptibilidad a la apoptosis) |
| CD4+/CD8+CD45RA+CD45RO–CCR7+(PE, PerCP, Cy5.5, alexa 647, respectivamente) | Linfocitos naive |
| CD4+/CD8+CD45RA+CD45RO–CCR7– | Linfocitos efectores |
| CD4+/CD8+CD45RA–CD45RO+CCR7– | Linfocitos efectores de memoria |
| CD4+/CD8+CD45RA–CD45RO+CCR7+ | Linfocitos de memoria central |
| CD4+CD25+FoxP3+CD45RO+ (APC, PE, FITC, respectivamente) | Células T reguladoras activadas |
| CD19+ (FITC) | Células B totales |
| CD19+CD5+FoxP3 (PerCP, PE, respectivamente) | Células B reguladoras activadas |
| CD19+CD5+IL10+ (APC) | Células B que expresan IL10 |
| CD19+CD5+FoxP3+IL10+ (FITC, PerCP, PE, APC, respectivamente) | Células B reguladoras activadas que expresan IL10 |
APC: aloficocianina; FITC: isotiocianato de fluoresceína; PE: ficoeritrina; PerCP: clorofilil peridinina.
Aproximadamente 106 células mononucleares de sangre periféricas se incubaron con la mezcla de anticuerpos correspondiente durante 30minutos a 4°C. Después del lavado las células marcadas con anticuerpos de superficie se fijaron con paraformaldehído al 2% en PBS. Las células que requerían tinción intracelular se suspendieron en una solución de permeabilización/fijación (Invitrogen, eBioscienceTM, San Diego, CA, EE. UU.), y se incubaron durante 16-18horas a 4°C. Posteriormente, las células se centrifugaron y se trataron con 20μl de suero de rata normal diluido en solución de permeabilización al 10% (Invitrogen) durante 1hora a 4°C, seguido de incubación con el anticuerpo intracelular apropiado (FoxP3-PE para CD4/CD25/CD45RO T células y FoxP3-PE e IL10-APC para células B CD19/CD25). Después del lavado, las células se fijaron con paraformaldehído al 2% en PBS.
Para la adquisición de las células marcadas se utilizó un citómetro FACS Calibur. El software FCS Express 4 Plus, Research Edition, se utilizó para el análisis de datos.
Análisis estadísticoLos datos fueron recogidos y organizados en Excel (Microsoft, Redmond, VA) y analizados con los programas SPSS15.0 (SSPS Inc., Chicago, IL) y Graphpad. Las comparaciones estadísticas entre variables se realizaron utilizando pruebas paramétricas o no paramétricas, según la distribución de datos. La comparación de medias se realizó utilizando la prueba «t» de Student (pareada cuando se requería) o la prueba de Mann-Whitney. La correlación entre las variables numéricas se evaluó mediante la prueba «t» de Pearson o la prueba de Spearman, según la normalidad de los datos.
Declaración de éticaEste estudio se realizó de acuerdo con la Declaración de Helsinki y fue aprobado por el Comité de Ética del Instituto Nacional de Neurología y Neurocirugía (Ciudad de México, México; protocolo n.° 134/10). El consentimiento informado por escrito para participar y publicar este artículo se obtuvo de los pacientes o parientes cercanos.
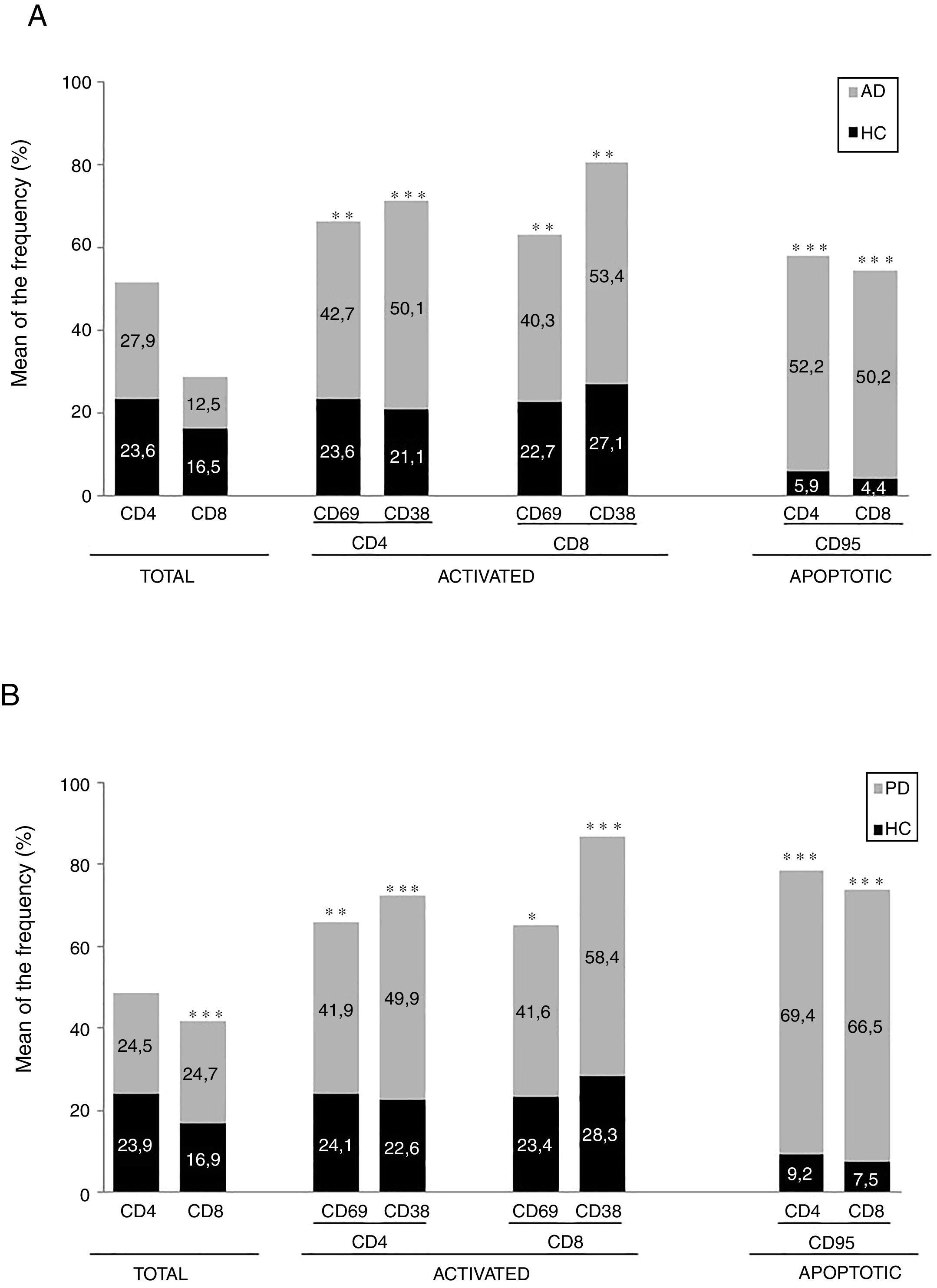
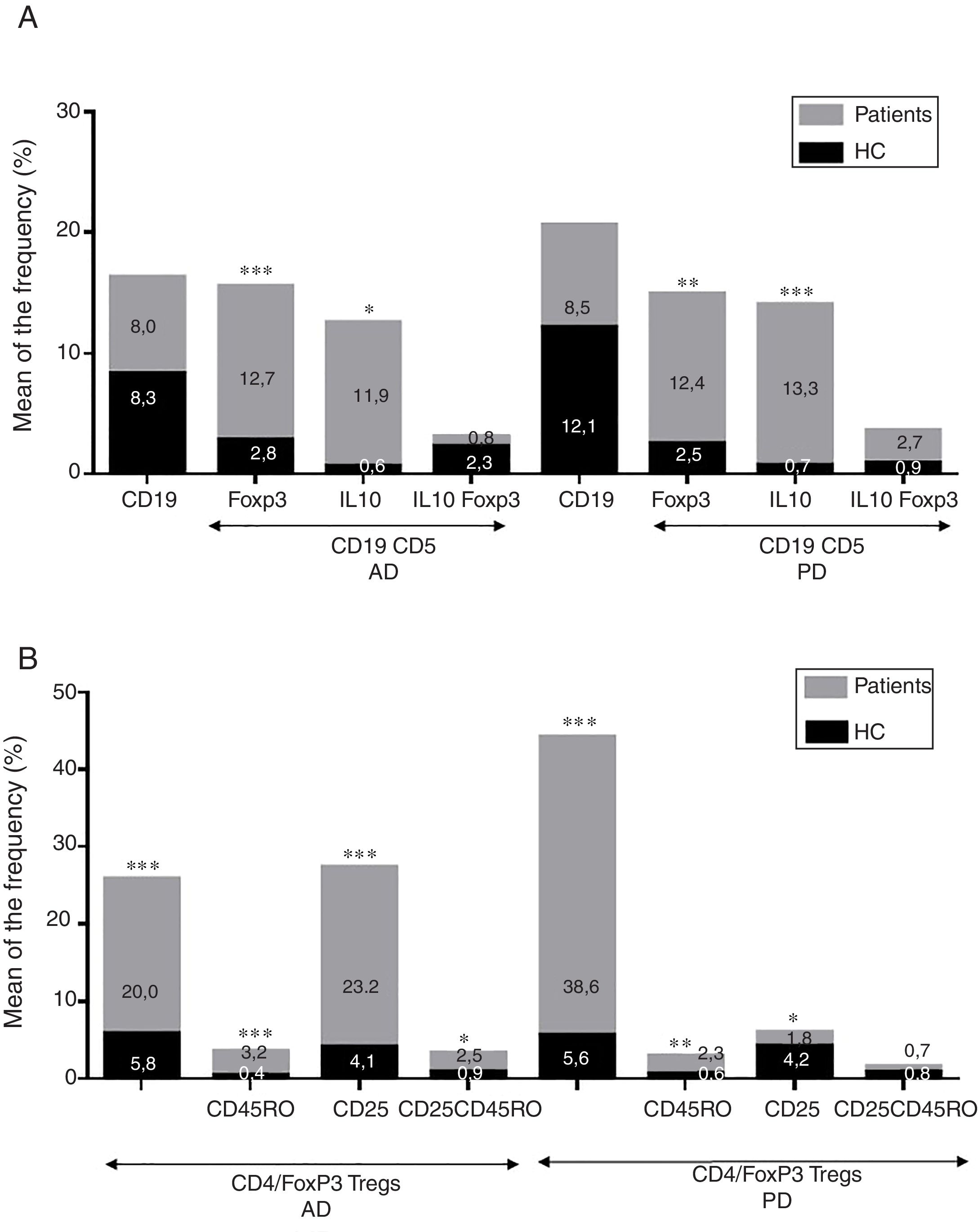
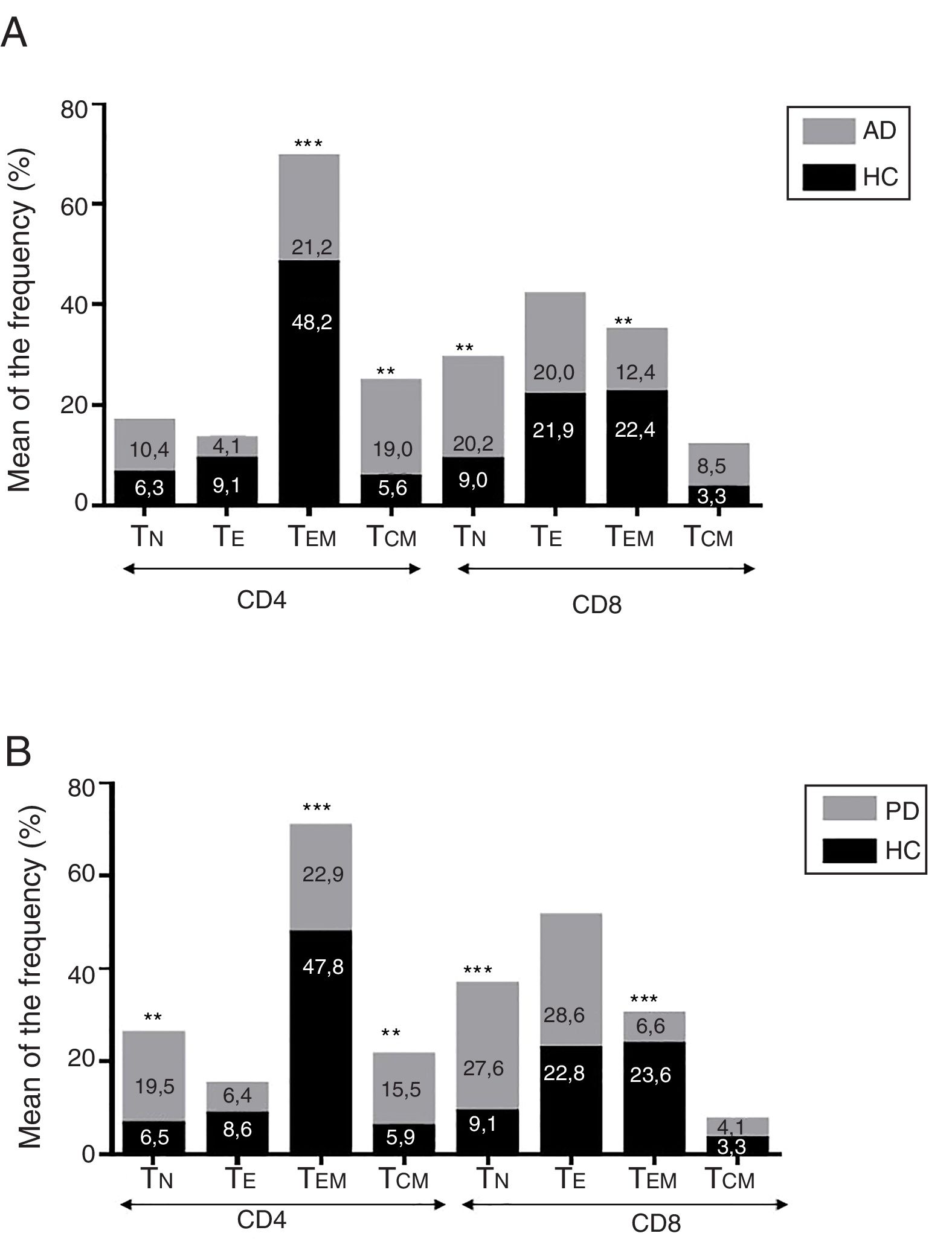
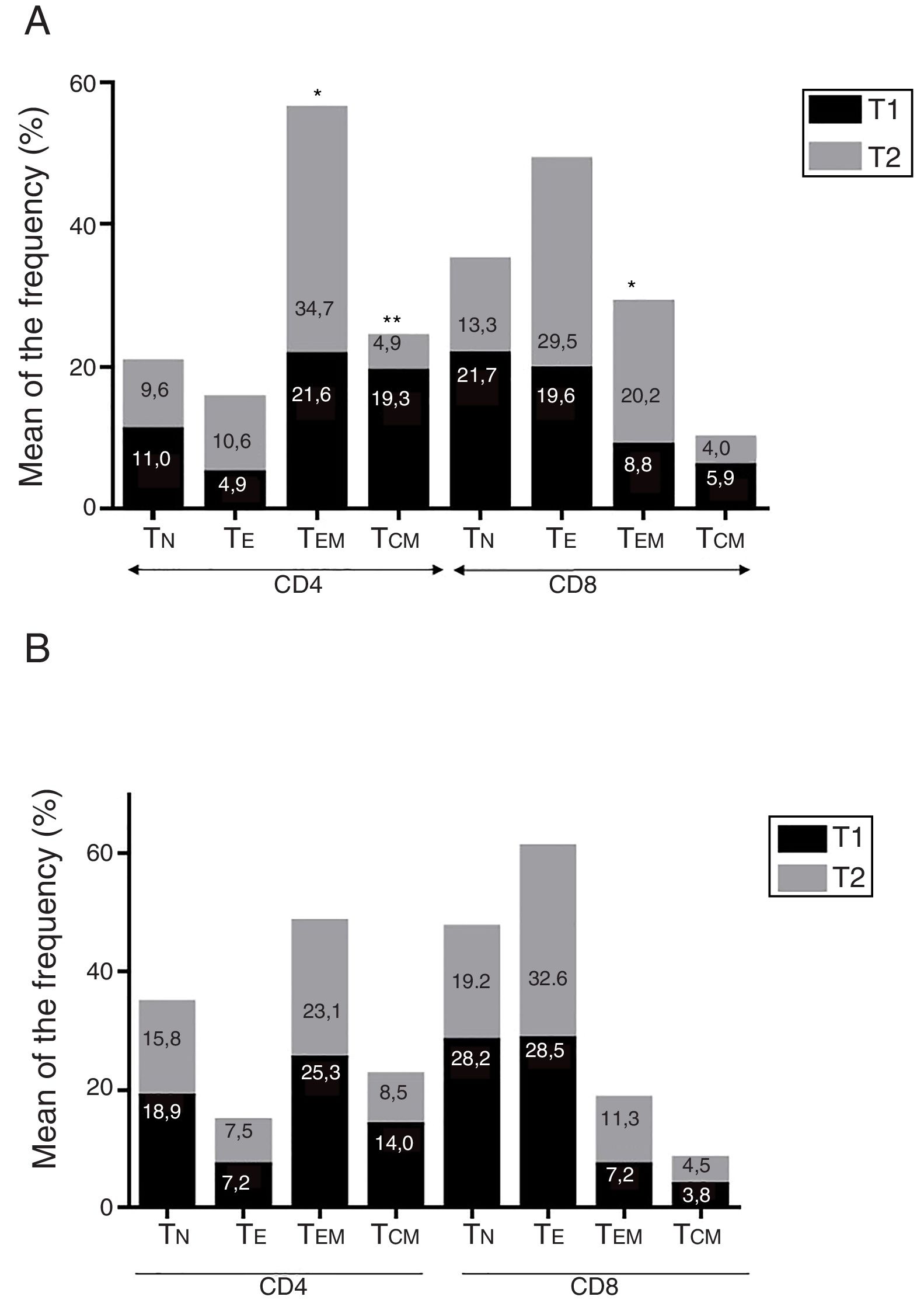
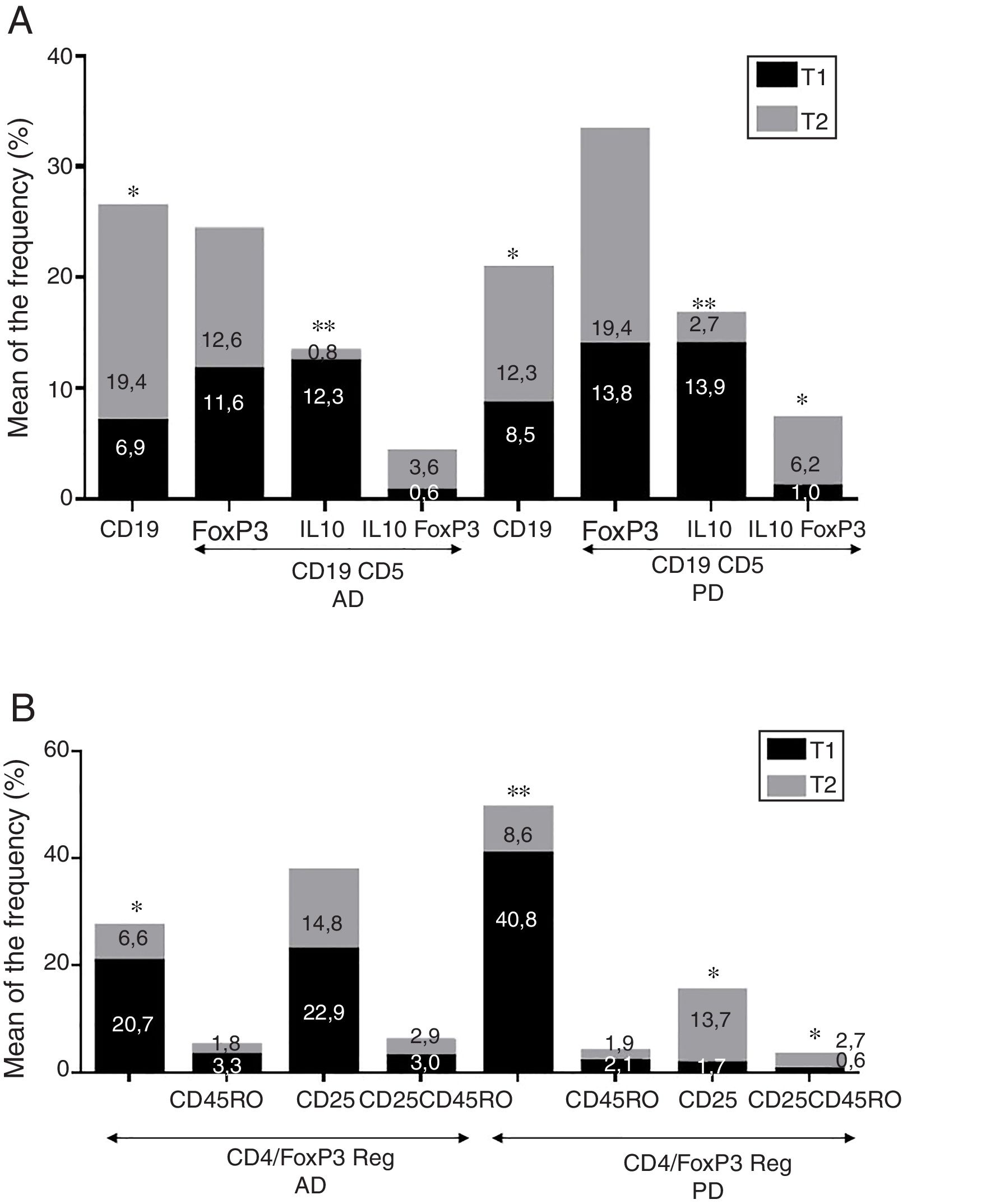
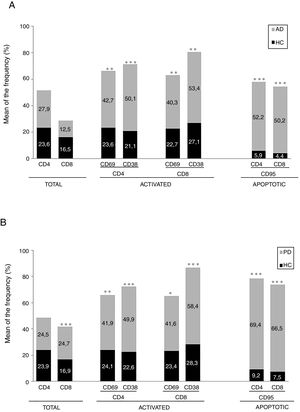
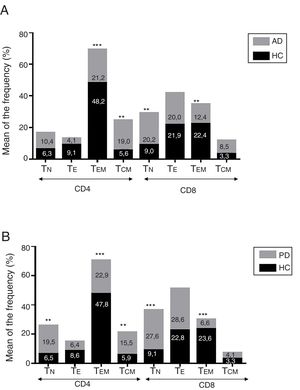
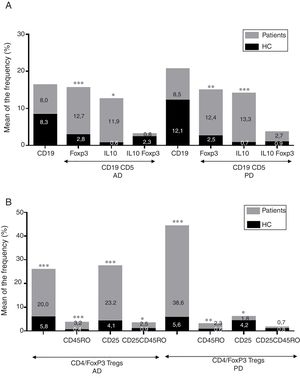
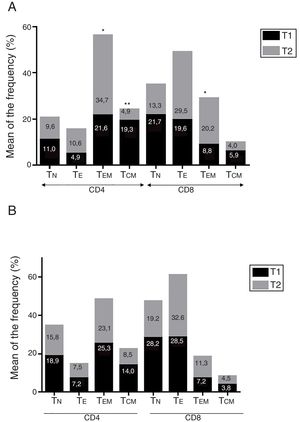
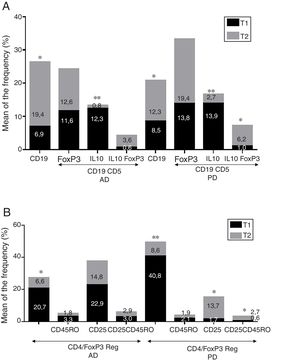
ResultadosEnfermedad de AlzheimerDiferencias en el fenotipo de linfocitos entre pacientes con enfermedad de Alzheimer y controlesNo se observaron diferencias entre los pacientes con EA y los controles con respecto al porcentaje de linfocitos, CD4, CD8, ni células CD19 (fig. 1A y fig. 2A). Sin embargo, se encontraron diferencias estadísticamente significativas en varios fenotipos de linfocitos. Se observó un aumento significativo en el porcentaje de linfocitos T CD4 y CD8 temprano (CD69+) y tardío (CD38+) y de linfocitos que expresan el marcador de susceptibilidad a la apoptosis CD95 (fig. 1A). Por otro lado, también se observó un aumento en el porcentaje de linfocitos CD8 TN y CD4 TCM, y una disminución en el porcentaje de células TEM CD4/CD8 (fig. 3A). En pacientes las relaciones TE/TN y TEM/TCM, tanto en CD4 (0,4 y 1,1, respectivamente) como en linfocitos T CD8 (0,99 y 1,45, respectivamente) fueron significativamente menores que en controles sanos (1,4 y 8,6 para CD4 y 2,4 y 6,8 para CD8, respectivamente). Los pacientes con EA exhibieron un aumento significativo en el porcentaje de células reguladoras B (CD19+ CD5+ FoxP3+ y CD19+ CD5+ IL10+) (fig. 2A), y en todos los fenotipos de células T reguladoras (fig. 2B).
En el momento de la inclusión los pacientes con un cuadro clínico más severo según la Dementia Severity Rating Scale mostraron un porcentaje significativamente mayor de linfocitos CD4+ CD95+ (R=0,48; p=0,03) y una mayor proporción de células reguladoras B que expresan IL10 (CD19+ CD5+ FoxP3+ IL10+, R=0,50; p=0,02).
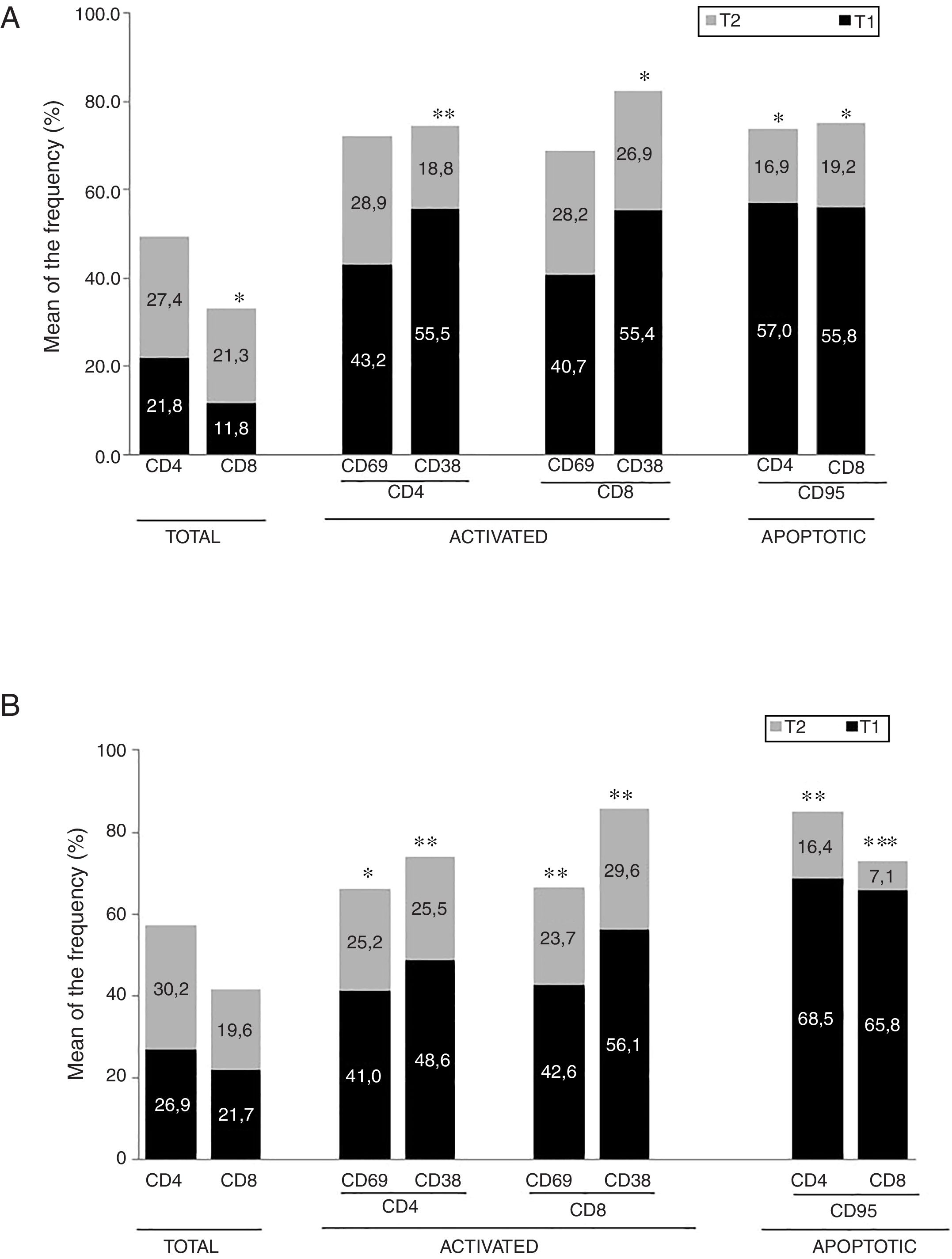
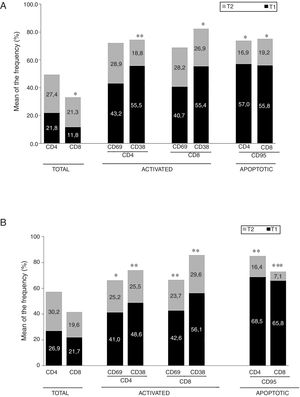
Diferencias en los fenotipos de linfocitos entre el ingreso y el seguimientoSe observaron diferencias significativas en la proporción del fenotipo entre los 2 puntos temporales del estudio (figs. 4-6). Particularmente, como se muestra en la figura 4, el porcentaje de CD8 aumentó (p=0,03), mientras que el porcentaje de CD4 y CD8 que expresaron el marcador de activación tardía CD38 disminuyó (p=0,001 y p=0,01, respectivamente), así como aquellos expresando el marcador CD95 (p=0,01 y p=0,04, respectivamente). También se observó un aumento en TEM de CD4 y CD8 (p=0,03 y p=0,01, respectivamente), junto con una disminución en células CD4 TCM (fig. 5A) y un aumento en las relaciones TE/TN y TEM/TCM, tanto en linfocitos T CD4 (1,1 vs. 0,4, y 7,1 vs. 1,1, respectivamente) y T CD8 (2,2 vs. 0,9 y 5,0 vs. 1,5, respectivamente). Se observó un aumento en los linfocitos B (p=0,05) y una disminución en los linfocitos B que expresan IL10 (p=0,005) (fig. 6A) y en los linfocitos T CD4 FoxP3 (fig. 6B).
En el momento de la inclusión los pacientes con una menor proporción de linfocitos CD4+ CD38+ mostraron tasas de progresión de la enfermedad más altas (R=–0,62; p=0,01); los pacientes con un menor porcentaje de CD8+ CD38+ mostraron una tendencia similar, aunque en el límite de la significación (R=–0,61, p=0,059). Adicionalmente, se encontró una correlación positiva entre el porcentaje de linfocitos CD4 TE y las tasas de progresión de la enfermedad (R=0,93; p<0,001).
Enfermedad de ParkinsonDiferencias en fenotipos de linfocitos entre pacientes con enfermedad de Parkinson y controlesSe observaron diferencias claras entre los pacientes con EP y los controles sanos. Se encontró una disminución significativa en el porcentaje de linfocitos B y T (27,9±2,2 vs. 39,6±3,6, p=0,008) y un aumento significativo en el porcentaje de células T CD8+ en pacientes con EP con respecto a sujetos sanos (fig. 1B). La proporción de linfocitos activados temprana y tardíamente (CD4 y CD8) y de linfocitos susceptibles a la apoptosis (CD4 y CD8) fue significativamente mayor en los pacientes que en los controles (fig. 1B). Una proporción significativamente más alta de células reguladoras TN (CD4 y CD8), TCM (CD4), T (CD4+ FoxP3+), B (CD19+ CD5+ IL10+ y CD19+ CD5+ FoxP3+) y T (CD4+ FoxP3+ CD45RO+) se encontraron en pacientes con EP con respecto a los controles (figs. 2A y B, fig. 3B). En comparación con controles sanos también se observó una disminución significativa en la proporción de linfocitos TEM (CD4 y CD8) (fig. 3B), así como una disminución en las relaciones TE/TN y TEM/TCM en linfocitos CD4 (0,32 vs. 1,3 y 1,4 vs. 8,1, respectivamente) y CD8 (1,0 vs. 2,5 y 1,6 vs. 7,1, respectivamente).
Fenotipos de linfocitos asociados con la gravedad inicialEn el momento de la inclusión los pacientes con cuadros clínicos más severos según la escala de Hoehn y Yahr mostraron una proporción significativamente menor de células reguladoras B que expresan IL10 (R=–0,47; p=0,05).
Diferencias en fenotipos de linfocitos entre los 2 puntos de tiempo en estudioSe observaron diferencias significativas en la proporción del fenotipo entre los 2 puntos temporales estudiados. Particularmente, el porcentaje de linfocitos totales aumentó (p=0,02), mientras que la población de linfocitos CD4 y CD8 activados temprana y tardíamente disminuyó, así como la población de linfocitos susceptibles a apoptosis CD4 y CD8 (fig. 4B). Aunque no se observaron cambios significativos en las frecuencias de las células TN, TCM, TEM y TE (fig. 5B), un ligero aumento en la relación de TE/TN y TEM/TCM tanto en linfocitos T CD4 (0,47 vs. 0,38 y 2,7 vs. 1,8, respectivamente) y T CD8 (1,7 vs. 1,0 y 2,5 vs. 1,9, respectivamente) se observó en el segundo tiempo evaluado. Adicionalmente, la proporción de células reguladoras B (CD19+ CD5+ IL10+) (fig. 6A) y de células T (CD4+ FoxP3+) (fig. 6B) disminuyó, mientras que la proporción de linfocitos B (CD19+) y linfocitos reguladores T (CD4+ FoxP3+ CD25+ y CD4+ FoxP3+ CD25+ CD45RO+) aumentó (figs. 6A y B).
Fenotipos de linfocitos asociados con mayores tasas de progresiónNo se encontró asociación significativa entre las tasas de progresión de la enfermedad y el porcentaje de poblaciones de linfocitos en la evaluación inicial. Sin embargo, se encontraron 2 tendencias: mayores tasas de progresión se asociaron con un menor porcentaje de CD4+ CD38+ (R=–0,55, p=0,06) y con un menor porcentaje de CD8+ CD95+ (R=–0,63; p=0,07) en el tiempo inicial del estudio.
Diferencias entre pacientes con enfermedad de Alzheimer y enfermedad de ParkinsonSe observaron diferencias significativas en algunos fenotipos entre pacientes con EA y EP. En particular, la proporción de linfocitos fue más alta en EA que en pacientes con EP (45,2±18,9 vs. 27,9±9,7; p=0,0001), mientras que la proporción de CD8 fue mayor en pacientes con EP que en pacientes con EA (24,7±7,5 vs. 12,5±7,8, p<0,0001). Además, la proporción de células CD4/CD8 TE y TN fue significativamente mayor en EP que en pacientes con EA (p=0,01 para ambas poblaciones de TE, p=0,005 y p=0,0009 para TN, respectivamente (figs. 3A y B). Por otro lado, la proporción de linfocitos TEM CD8 fue mayor en EA que en pacientes con EP (p=0,007).
DiscusiónEs ahora evidente que el estado «privilegiado» del cerebro con respecto a su protección de los eventos sistémicos no es absoluto31,32. En particular, se ha demostrado que los procesos inflamatorios periféricos tienen un papel significativo en el desarrollo de enfermedades neurodegenerativas33. Además, los antígenos cerebrales pueden atravesar la barrera hematoencefálica y llegar a la periferia, lo que puede desencadenar una inmunidad adaptativa contra los antígenos centrales que participan en la progresión de diferentes enfermedades neurológicas34. En EA y EP se han encontrado células periféricas, principalmente linfocitos, en el tejido cerebral de los pacientes afectados14,35,36. Estas células participan en el proceso neurodegenerativo, y el conocimiento de sus fenotipos en la sangre periférica podría permitir entender mejor los cambios degenerativos asociados.
En el presente estudio encontramos en los pacientes con ambas enfermedades neurodegenerativas, respecto a los controles sanos, un aumento en la proporción de linfocitos CD4+/CD8+ activados y de linfocitos susceptibles a la apoptosis, un aumento en el porcentaje de células CD4 TCM, una disminución en el porcentaje de linfocitos TEM y un aumento de células B y T con propiedades reguladoras. Estos hallazgos confirmaron informes previos22,23,37, aunque no concuerdan con otros, particularmente con respecto a las poblaciones TN/TEM/TCM18,24. Los altos niveles de células T activadas y apoptóticas en ambas enfermedades reflejan la posible participación de componentes de la inmunidad adaptativa en la fisiopatología de estas enfermedades. Aunque la naturaleza del antígeno que desencadena estas respuestas (PAMPs o DAMPs) se desconoce, estas observaciones sugieren que los pacientes son más propensos a reaccionar a antígenos exógenos (por ejemplo infecciones) o incluso a proteínas propias, vinculando estas enfermedades con trastornos autoinmunes, como se postuló previamente38. Los cambios en los subconjuntos de células T de memoria periférica son interesantes. En ambas enfermedades observamos una reducción considerable en el porcentaje de células TEM, con una expansión concomitante de CD4/CD8 TN y de CD4 TCM. Considerando que una vez que las células T vírgenes tienen contacto con el antígeno, se activan y adquieren funciones efectoras, dando lugar a poblaciones de memoria (TEM y TCM), y tomando en cuenta que tanto en la EA como en la EP hubo un aumento en las células T activadas y CD95+, es probable que los cambios observados reflejen un flujo dinámico activo TN → TACT → TE → (TEM y TCM) → TE → (apoptosis o memoria), el cual podría modularse en cada enfermedad mediante nuevos retos antigénicos o por la respuesta a un antígeno de memoria.
La mayoría de los fenotipos de las células T y B con posibles funciones reguladoras se incrementaron en ambas enfermedades con respecto a los controles, probablemente para contrarrestar la inflamación resultante. Es, sin embargo, relevante resaltar que si bien observamos un aumento de las células T CD4+ FoxP3+ en ambas enfermedades, la expresión de la subpoblación CD4+ FoxP3+ CD25+ fue alta en pacientes con EA y baja en pacientes con EP. Esta notable diferencia puede implicar la existencia de diferentes mecanismos reguladores en ambas enfermedades; particularmente, el consumo de IL2 podría ser más relevante para las funciones reguladoras de estas células en la EA que en la EP39. Se requieren más estudios para confirmar la funcionalidad de estas subpoblaciones de Treg. Ciertas observaciones respaldan el papel dicotómico de las Tregs, el cual podría ser beneficioso o nocivo en diferentes neuropatologías, según el contexto de la enfermedad40. Por un lado, algunos estudios han encontrado que su acción en estas enfermedades es positiva para el paciente. Por ejemplo, en un modelo murino de EA, la expansión de Tregs se asoció con un aumento en el número de microglía asociada a placas de amiloide y a la mejora de las funciones cognitivas, mientras que la depleción de las Tregs aceleró la aparición de déficits cognitivos41. Además, en el modelo murino MPTP de EP las Tregs pueden atenuar la microgliosis y proteger contra la muerte neuronal dopaminérgica en la sustancia nigra y el striatum42,43. Las Tregs pueden interactuar con otras células inmunes, incluidas las células microgliales, favoreciendo su cambio de un fenotipo neurotóxico M1 a un fenotipo M2 neurotrófico42,44,45. Pero, por otro lado, se ha mostrado que una reducción transitoria en los niveles periféricos de Tregs o en su actividad afecta los plexos coroideos, promoviendo el reclutamiento de células inmunorreguladoras en el sistema nervioso central, permitiendo el aclaramiento de las placas de β-amiloide, lo que reduce la neuroinflamación y revierte el deterioro cognitivo46. Así mismo, observamos un aumento significativo de las subpoblaciones de células B reguladoras (CD19+ CD5+ FoxP3+ y CD19+ CD5+ IL10+) en los pacientes con ambas enfermedades (fig. 3A). Estos fenotipos de Bregs se han descrito como críticos para mantener la homeostasis inmunitaria47, y podrían conllevar la supresión de la respuesta inmune local.
Al respecto de los cambios entre los 2 puntos de tiempo evaluados, se observó una disminución en el porcentaje de células CD4 y CD8 activadas, de células T susceptibles a la apoptosis y de algunas poblaciones reguladoras en ambas enfermedades. En pacientes con EA se observó una disminución adicional en las células memoria central CD4 y un aumento en los linfocitos de memoria efectora relacionados con la progresión de la enfermedad. Por el momento, es difícil proponer una explicación clara de los cambios observados en el contexto de estas enfermedades neurodegenerativas. Se ha postulado que una vez que salen del estado de memoria, las células TEM y TCM son propensas a producir citocinas Th1 y Th2; sin embargo, las células TCM tienen mejores respuestas proliferativas, lo que explica su mayor persistencia in vivo48. Este hallazgo, junto con el hecho de que las células TEM se convierten en TCM después de la eliminación del antígeno48, sugiere que la progresión de la enfermedad se asocia con la persistencia de los antígenos que desencadenaron la inmunidad adaptativa. La correlación positiva observada entre CD4TE y las tasas de progresión de la enfermedad en pacientes con EA podría vincularse con esta observación.
A pesar de las similitudes claras entre ambas enfermedades, algunas diferencias fueron evidentes. Particularmente, la proporción de linfocitos CD4/CD8 TN y TE fue mayor en pacientes con EP, mientras que la proporción de células CD8TEM fue mayor en pacientes con EA. Estos hallazgos podrían reflejar una relación más precisa entre estimulación inmunológica crónica y enfermedad en EA que en EP.
Encontramos ciertas limitaciones en nuestro estudio, la primera es que no evaluamos la respuesta Th1/Th2 asociada a las poblaciones de linfocitos estudiadas. Se sabe que las citoquinas pueden regular la diferenciación de las células T y que diferentes poblaciones de linfocitos pueden producir citocinas pro o antiinflamatorias, dependiendo de varios factores. La segunda fue la no evaluación de los niveles plasmáticos de los péptidos amiloides. Se ha demostrado en diferentes estudios que los pacientes con EA presentan niveles mayores que los sujetos controles49. Así mismo, la estimulación de células mononucleares de sangre periférica con estos péptidos genera más citocinas proinflamatorias en pacientes con EA que en sujetos sanos49. Estos marcadores (citocinas, péptidos amiloides) y su relación con las poblaciones linfocitarias deberán estudiarse posteriormente para entender el fenómeno inflamatorio de manera más global.
ConclusiónEste estudio señala diferencias claras en el perfil linfocitario entre pacientes afectados por EA, EP y controles. En particular, se muestra claramente la activación periférica de la respuesta inmune en los pacientes afectados, así como la presencia de una respuesta reguladora. Estos hallazgos, cuyos mecanismos deben ser esclarecidos, podrían ser en favor de la utilización de inmunomoduladores como estrategia terapéutica para modificar la progresión de estas enfermedades.
FinanciaciónEste trabajo se financió parcialmente con el Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT, DGAPA, UNAM), número de proyecto: IB201812 y por Clinical Pfizer Research Fund Award 2012, otorgado por Pfizer Scientific Institute.
Conflicto de interesesNo hay conflicto de intereses relacionado con el estudio.
Los autores agradecen a Juan Francisco Rodríguez la corrección del artículo en su versión en inglés.