La hemorragia intracerebral sólo representa entre el 10 y el 15% de todos los ictus, sin embargo condiciona un peor pronóstico, con unas tasas más elevadas de morbilidad y mortalidad. Es frecuente que durante las primeras horas tras el inicio de los síntomas se produzca un empeoramiento clínico, lo cual condiciona un peor pronóstico, por lo que la hemorragia intracerebral constituye una emergencia neurológica en la que debe realizarse un diagnóstico y tratamiento adecuado de manera precoz. En esta guía realizamos una revisión de los procedimientos diagnósticos y los factores que influyen en el pronóstico de los pacientes con hemorragia intracerebral y establecemos unas recomendaciones para la estrategia asistencial, sistemática diagnóstica, tratamiento en fase aguda y prevención secundaria en la hemorragia intracerebral.
Intracerebral haemorrhage accounts for 10%-15% of all strokes; however it has a poor prognisis with higher rates of morbidity and mortality. Neurological deterioration is often observed during the first hours after onset and determines poor prognosis. Intracerebral haemorrhage, therefore, is a neurological emergency which must be diagnosed and treated properly as soon as possible. In this guide we review the diagnostic procedures and factors that influence the prognosis of patients with intracerebral haemorrhage and we establish recommendations for the therapeutic strategy, systematic diagnosis, acute treatment and secondary prevention for this condition.
La hemorragia intracerebral (HIC) es una colección de sangre dentro del parénquima cerebral, producida por una rotura vascular no traumática. Aunque pueda abrirse al sistema ventricular o al espacio subaracnoideo, siempre se inicia en el tejido cerebral, lo que la diferencia de la hemorragia subaracnoidea y la hemorragia intraventricular primaria.
En función de la causa que origine el sangrado, se clasifica en primaria o secundaria. Las HIC primarias son las más frecuentes y se deben a la rotura de cualquier vaso de la red vascular normal del encéfalo, cuya pared se ha debilitado por procesos degenerativos secundarios a la hipertensión arterial (HTA) o a la angiopatía amiloide. Las HIC secundarias están producidas por la rotura de vasos congénitamente anormales, neoformados o con alteraciones de su pared o por alteraciones de la coagulación, y se asocian a procesos como tumores, malformaciones arteriovenosas (MAV), alteraciones de la coagulación, abuso de drogas o sangrados en el interior de la isquemia1.
La incidencia de las HIC varía en función del país, la raza, la edad y el sexo, y se relaciona estrechamente con la prevalencia de la HTA. Su incidencia en Europa es de aproximadamente 15 casos por cada 100.000 habitantes2. La HIC sólo representa el 10-15% de todos los ictus; sin embargo, condiciona un peor pronóstico, con unas tasas más elevadas de morbilidad y mortalidad. El 40,4% de todos los pacientes fallecen durante el primer mes3, la mayoría en los dos primeros días, y sólo un 20% son independientes al cabo de 6 meses tras la HIC4. La mortalidad a 30 días se correlaciona con el tamaño y la localización de la HIC. En pacientes con un volumen inicial > 60 cc, la mortalidad para las hemorragias profundas es del 93% y del 72% para las lobulares. Si el volumen inicial es menor de 30 cc, la mortalidad es del 39% para las profundas, el 7% para las lobulares y el 57% para las cerebelosas3.
La incidencia de la HIC tiende a aumentar a pesar del mejor control de algunos de los factores de riesgo, en relación con el envejecimiento de la población. Sin embargo, esta mayor incidencia en personas de edad avanzada puede contribuir al descenso en la mortalidad que se aprecia en los últimos años, en relación con un mayor grado de atrofia cerebral.
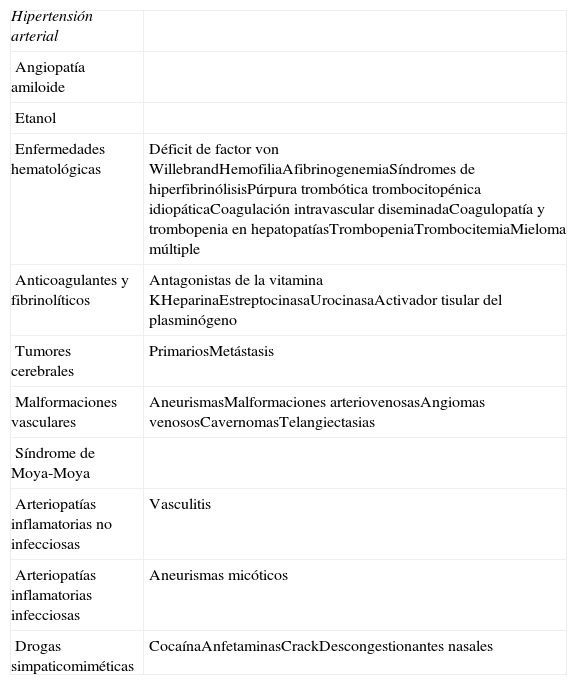
El factor de riesgo más importante para el desarrollo de HIC en todos los grupos de edad y sexo es la HTA, tanto sistólica como diastólica, estando presente en el 60% de los casos. La HTA crónica condiciona alteraciones degenerativas de la pared de las arteriolas, que favorecen la obstrucción vascular, originando infartos lacunares y leucoaraiosis, así como la rotura vascular, siendo responsables del desarrollo de HIC5. La HTA también puede ocasionar HIC de forma aguda, al incidir sobre pequeñas arteriolas no protegidas por la hipertrofia de sus paredes, siendo esta la causa de algunas hemorragias, como las producidas por algunas drogas o las que se producen tras realizar una endarterectomía o una angioplastia6. Otra causa importante de HIC es la angiopatía cerebral amiloidea, que constituye la primera causa de hemorragia lobular en el anciano. Se trata de un proceso degenerativo que afecta a pequeñas arterias y arteriolas situadas en las leptomeninges y en la corteza cerebral. Este tipo de hemorragias son superficiales, frecuentemente recidivantes y múltiples, suelen localizarse en regiones posteriores del cerebro, aparecen en personas de edad avanzada y hasta la mitad de los pacientes presentan deterioro cognitivo7. Finalmente, existen otras causas de HIC menos frecuentes, que se resumen en la tabla 1.
Causas de hemorragia intracerebral no traumática
| Hipertensión arterial | |
| Angiopatía amiloide | |
| Etanol | |
| Enfermedades hematológicas | Déficit de factor von WillebrandHemofiliaAfibrinogenemiaSíndromes de hiperfibrinólisisPúrpura trombótica trombocitopénica idiopáticaCoagulación intravascular diseminadaCoagulopatía y trombopenia en hepatopatíasTrombopeniaTrombocitemiaMieloma múltiple |
| Anticoagulantes y fibrinolíticos | Antagonistas de la vitamina KHeparinaEstreptocinasaUrocinasaActivador tisular del plasminógeno |
| Tumores cerebrales | PrimariosMetástasis |
| Malformaciones vasculares | AneurismasMalformaciones arteriovenosasAngiomas venososCavernomasTelangiectasias |
| Síndrome de Moya-Moya | |
| Arteriopatías inflamatorias no infecciosas | Vasculitis |
| Arteriopatías inflamatorias infecciosas | Aneurismas micóticos |
| Drogas simpaticomiméticas | CocaínaAnfetaminasCrackDescongestionantes nasales |
La HIC constituye una emergencia neurológica, por lo que su rápido diagnóstico y manejo es fundamental debido a que, como se ha mencionado anteriormente, es frecuente el empeoramiento clínico durante las primeras horas de evolución de una HIC, factor que se asocia de manera directa con un peor pronóstico funcional. Diversos estudios observacionales demuestran que uno de cada tres pacientes con hemorragia supratentorial y la mayoría de los pacientes con hemorragia de fosa posterior presentan alteración del nivel de consciencia8. Debido al riesgo elevado de deterioro neurológico precoz, lo cual se asocia a un peor pronóstico a largo plazo, es necesario que la atención de los pacientes con HIC sea lo más rápido posible.
Atención extrahospitalariaEl principal objetivo en la valoración prehospitalaria es el mantenimiento adecuado de la función ventilatoria y cardiovascular, así como el traslado al centro hospitalario más cercano que esté preparado para el manejo de pacientes con ictus en fase aguda. Otros objetivos son la obtención de la historia clínica con especial interés en la hora del inicio de los síntomas y la información acerca de los antecedentes del paciente. Es importante avisar al centro hospitalario receptor sobre la llegada de un paciente con un posible ictus para que se pongan en marcha las vías de necesarias para la valoración del mismo, lo cual reduce significativamente el tiempo de retraso para la realización de las pruebas de neuroimagen en los servicios de urgencias9.
Atención en el servicio de urgenciasUna vez conseguida la estabilización hemodinámica y cardiorrespiratoria, los objetivos posteriores van encaminados a confirmar la naturaleza hemorrágica del ictus y diferenciarlo de la isquemia u otras lesiones cerebrales, obtener información sobre la etiología de la HIC, prevenir las posibles complicaciones e iniciar el tratamiento adecuado.
El curso clínico de la HIC puede no tener ningún dato diferenciador con otros tipos de ictus, sin que existan datos clínicos patognomónicos de la presencia de una hemorragia cerebral. Sin embargo, existen unos signos y síntomas que apuntan más hacia la presencia de HIC y no de isquemia. Un síntoma que aparece con frecuencia es la cefalea, estando presente en el 40% de las HIC y sólo en el 17% de los ictus isquémicos. También son frecuentes las náuseas, los vómitos y la disminución del nivel de consciencia, que están presentes en el 50% de las HIC y es excepcional en los isquémicos, y el aumento de la presión arterial que ocurre casi en el 90% de los casos10.
En la realización de la historia clínica se debe insistir en datos como el tiempo de inicio de los síntomas, los factores de riesgo vascular (HTA, diabetes, hipercolesterolemia), el consumo de tóxicos (tabaco, alcohol, cocaína, anfetaminas), fármacos (anticoagulantes, antiagregantes, descongestivos nasales, píldoras adelgazantes, estimulantes, simpaticomiméticos), antecedente traumático o cirugías recientes (en especial endarterectomía o angioplastia carotídeas, ya que pueden asociarse al síndrome de reperfusión), la existencia de deterioro cognitivo previo (en relación con la presencia de angiopatía amiloide), convulsiones, enfermedades sistémicas asociadas a coagulopatías (enfermedades hepáticas, vasculitis, cáncer, discrasias sanguíneas) y la historia familiar de enfermedades neurológicas asociadas a un aumento de riesgo de sangrado cerebral (incluidas malformaciones arterio-venosas y aneurismas intracraneales).
En la exploración inicial, además de la evaluación del déficit neurológico, se debe valorar la respiración y el estado hemodinámico, por lo que es necesario realizar un electrocardiograma y una radiografía de tórax. Una exploración física detallada en la que no debe faltar el examen cardiovascular y el fondo de ojo, ayuda en muchas ocasiones al diagnóstico etiológico. En aquellos casos en los que el paciente haya permanecido inmóvil durante periodos prolongados se debe evaluar la presencia de posibles complicaciones asociadas como úlceras de decúbito, síndromes compartimentales, rabdomiólisis y lesiones traumáticas.
Pruebas de laboratorioEs importante realizar un análisis de sangre que incluya recuento sanguíneo completo, electrolitos, urea, creatinina, función hepática y glucosa. Los niveles elevados de creatinina y glucosa se asocian al crecimiento de la hemorragia y a un peor pronóstico funcional11,12. También debe realizarse un estudio de la coagulación incluyendo el tiempo parcial de tromboplastina activada (TTPA) y el INR, ya que las hemorragias asociadas al tratamiento anticoagulante se asocian con un mayor riesgo de morbi-mortalidad13,14, y requieren de tratamiento urgente para intentar revertir el trastorno de la coagulación.
En los pacientes jóvenes se debe realizar un análisis de orina para la detección de tóxicos como cocaína y otras drogas simpaticomiméticas y en las mujeres en edad fértil se debe realizar una prueba de embarazo.
NeuroimagenLa presencia de un déficit neurológico focal de inicio brusco sugiere un origen vascular, salvo que se demuestre otra causa. A pesar de que algunos síntomas descritos previamente, como la presencia de cefalea, vómitos o disminución del nivel de consciencia, son sugestivos de HIC, ninguno de estos hallazgos son específicos y no nos permiten diferenciar si el déficit neurológico se debe a una isquemia cerebral o una hemorragia, por lo que las pruebas de neuroimagen son imprescindibles. Tanto la tomografía computarizada (TC) como la resonancia magnética (RM) son adecuadas para el diagnóstico inicial. La TC es una técnica muy sensible para la identificación de la hemorragia en fase aguda y es considerada la técnica de elección. Las técnicas de eco de gradiente de RM son tan sensibles como la TC para la detección de sangre en fase aguda y son más sensibles para detectar hemorragias antiguas15. Sin embargo, la disponibilidad de la TC, el menor coste y el tiempo de realización de la técnica hace que su uso esté más extendido que el de la RM.
La TC permite identificar la localización precisa de la hemorragia y sus efectos (efecto masa, edema, extensión ventricular y subaracnoidea). Además, la administración de contraste por vía intravenosa permite diagnosticar algunas causas de HIC secundarias, como las debidas a MAV o tumores. En las primeras horas la HIC se presenta como un aumento de la densidad en el parénquima cerebral debida a la hemoglobina que contiene la sangre extravasada. En los días siguientes la hemorragia aparece rodeada de un anillo hipodenso, inicialmente debido a la retracción del coágulo, y posteriormente debido a la aparición de edema vasogénico. Al cabo de semanas la densidad elevada inicial de la hemorragia comienza a disminuir, desde la periferia hacia el centro. El estado final de la evolución de la HIC en la TC es la reabsorción completa del tejido hemorrágico, lo que origina una cavidad residual que lo hace indistinguible de un infarto cerebral antiguo16.
Algunos datos acerca de la localización y morfología de la HIC detectada en la TC pueden ser de importancia en el diagnóstico etiológico. La localización más común de las HIC hipertensivas es el putamen (30-50%), seguido de la sustancia blanca subcortical (30%) y el cerebelo (16%). Si la localización es lobular, el papel de la HTA es menos significativo, y es más frecuente la angiopatía amiloide como causa, especialmente en pacientes mayores de 60 años con cierto grado de deterioro cognitivo17. Otras causas frecuentes de hemorragia lobular son las malformaciones arterio-venosas (7-14%), tumores (7-9%) y discrasias sanguíneas, incluyendo el tratamiento anticoagulante (5-20%). En el 3% de los pacientes la hemorragia se encuentra confinada al sistema intraventricular18.
Dadas la frecuencia de crecimiento de la hemorragia en la fase aguda y su asociación con el deterioro neurológico y una mayor morbi-mortalidad19, actualmente se están investigando técnicas que ayuden a predecir dicho crecimiento. El empleo de angiografía por TC (angio-TC) con contraste puede ayudar a la identificación de pacientes en riesgo de expansión de la hemorragia basado en las presencia de extravasación de contraste en la hemorragia (spot sign)20,21. Esta técnica también es útil para la detección de causas secundarias de HIC, como malformaciones arterio-venosas, tumores o trombosis venosas.
La RM permite añadir información sobre el momento evolutivo de la HIC. Esta ventaja se debe a las diferentes imágenes que ofrece el catabolismo de la hemoglobina. En el estadio precoz de la fase aguda de la HIC (horas), la hemorragia es rica en oxihemoglobina y la RM muestra imágenes de hiposeñal en T1 e hiperseñal en T2. En el periodo de estado de la fase aguda de la HIC (días), la oxihemoglobina se va reduciendo, desde el centro a la periferia, a deoxihemoglobina, lo que en la RM se aprecia como hiposeñal en T2, rodeado de un anillo de hiperseñal que corresponde al edema. En el estadio tardío de la HIC (semanas), la deoxihemoglobina se va transformando en metahemoglobina desde la periferia hacia el centro, apareciendo una hiperseñal periférica en T1, que progresivamente va afectando a la totalidad de la hemorragia. En la fase secuelar de la HIC (meses) toda la hemoglobina se ha transformado en hemosiderina, lo que condiciona una marcada hiposeñal en secuencias T2. Las secuencias de eco de gradiente de RM tienen una alta sensibilidad para la detección de pequeños sangrados crónicos (< 5mm) llamados microsangrados. Estos microsangrados aparecen como lesiones puntiformes hipointensas, y representan depósitos crónicos de hemosiderina22. La angiografía por RM (angio-RM) es una técnica de gran utilidad para la detección de lesiones vasculares asociadas a la HIC, ya que permite identificar la presencia de aneurismas y MAV con alta sensibilidad23. También es útil la angio-RM en fase venosa cuando existe sospecha de trombosis de senos como causa de la lesión hemorrágica, teniendo la misma fiabilidad que la angio-TC con contraste en fase venosa.
La arteriografía convencional puede ser de utilidad cuando existe una sospecha alta de causa secundaria y los estudios no invasivos son negativos. Los signos radiológicos que sugieren una causa secundaria son la presencia de hemorragia subaracnoidea, la forma inhabitual (no circular) de la hemorragia, la presencia de edema desproporcionado al tiempo de evolución de la hemorragia, la localización infrecuente o la presencia de estructuras anormales. En estos casos, la posibilidad de detección de una causa secundaria mediante angiografía es más elevada24. En los casos de sospecha de vasculitis, la angiografía convencional es la técnica de elección, y en algunos casos, como el de los angiomas cavernosos, la angiografía convencional puede ser negativa. En los pacientes hipertensos mayores de 45 años con hemorragias en putamen, tálamo o fosa posterior, la realización de arteriografía no es de utilidad25.
- 1.
Se recomienda la realización de TC o RM cerebral de manera urgente para distinguir la HIC de una lesión isquémica u otras lesiones estructurales (nivel de evidencia 1, grado de recomendación A).
- 2.
La angiografía por TC con contraste puede ser de utilidad para identificar pacientes con riesgo de crecimiento de la hemorragia (nivel de evidencia 2b, grado de recomendación B).
- 3.
La angiografía por TC y/o la angio-RM pueden ser útiles para la identificación de lesiones estructurales etiológicamente relacionadas con la HIC cuando existe una sospecha radiológica (nivel de evidencia 2a, grado de recomendación B).
- 4.
La angiografía convencional debe valorarse en pacientes con HIC de etiología no aclarada por métodos no invasivos en los que presenten signos radiológicos sugerentes de lesión estructural (nivel de evidencia 4, grado de recomendación C).
El tratamiento del paciente con HIC es fundamentalmente médico y se basa en el mantenimiento del soporte vital, la monitorización neurológica, el mantenimiento de la homeostasis y la prevención de complicaciones26, todo ello con el objetivo fundamental de evitar el aumento del tamaño de la hemorragia, con el consiguiente aumento de efecto de masa y de presión intracraneal, y el deterioro neurológico secundario. Todo paciente con HIC debe ser asistido en un hospital que disponga de neurólogo, neurocirujano, tomografía computarizada, unidad de ictus y unidades de cuidados intensivos disponibles las 24h del día. Si el paciente no requiere ventilación asistida, las medidas de soporte deben llevarse a cabo en la unidad de ictus27–30, siempre que se disponga de la posibilidad de valoración por neurocirujano y de traslado a unidad de cuidados intensivos (UCI) si fuese necesario las 24h del día.
Cuidados generalesSoporte vitalTodo paciente con HIC debe ser asistido en un hospital que cuente con unidad de ictus y UCI 24 horas al día. Si el paciente no requiere respiración asistida, las medidas de soporte deben llevarse a cabo en una unidad de ictus, siempre y cuando se disponga de la posibilidad de consulta con un neurocirujano y de traslado a una UCI las 24h del día. El ingreso en una UCI general frente a una UCI neurológica especializada incrementa en 3.4 veces el riesgo de muerte31, y a la inversa, ingresar en una unidad de ictus aumenta las posibilidades de supervivencia y de mejor pronóstico funcional en un 64%32. Recientes estudios de base poblacional sugieren que un buen cuidado médico tiene una repercusión importante en la mortalidad y morbilidad de la HIC33.
Una primera aproximación al paciente nos permitirá evaluar el estado de vigilia y la capacidad del mismo para respirar de manera espontánea. Sin embargo, incluso en aquellos pacientes que mantienen un nivel de consciencia adecuado, es recomendable conocer la saturación de oxígeno para lo cual el método más sencillo es la colocación de un pulsioxímetro. Si la saturación arterial de oxígeno es < 92% se debería administrar oxigenoterapia mediante mascarilla a una concentración que permita mantener la saturación de oxígeno por encima de dicho valor. La realización de un estudio gasométrico arterial será opcional dependiendo de la situación del paciente. Hasta un tercio de los pacientes con hemorragia supratentorial y prácticamente todos los pacientes con hemorragia en fosa posterior presentan disminución de nivel de consciencia o disfunción de musculatura bulbar que precisan intubación34. La intubación precoz en casos de hemorragias de gran tamaño con disminución del nivel de consciencia puede ser de utilidad para la prevención de neumonías aspirativas. De forma general, está indicada la intubación endotraqueal y el aspirado gástrico en pacientes con una puntuación en la escala de coma de Glasgow (GCS) inferior a 8. La intubación debe realizarse después de la administración de fármacos que bloqueen el reflejo traqueal, ya que condiciona un aumento de la presión intracraneal y agravamiento de la lesión neurológica. En cualquier caso, la indicación de intubación orotraqueal es discutida y quizá debería valorarse sólo si se plantea la realización de otras medidas terapéuticas encaminadas a la mejora de la situación neurológica del paciente.
Monitorización neurológicaDebido a que un número considerable de pacientes se deteriora durante las primeras horas, debe realizarse una monitorización periódica al menos durante las primeras 72h del nivel de consciencia y el déficit neurológico. Las escalas más recomendadas son la escala neurológica del Instituto de Salud Americano (NIHSS)35 para el déficit neurológico y la GCS para el nivel de consciencia, debido a su sencillez y fiabilidad36.
Control de la presión arterialEn la mayoría de los pacientes con hemorragia intracerebral, las cifras de presión arterial están elevadas durante la fase aguda, incluso con valores más altos que los observados en el caso del ictus isquémico37. Aunque generalmente la presión arterial suele disminuir espontáneamente en días después de la hemorragia, en muchos pacientes persisten cifras elevadas. Los potenciales mecanismos fisiopatológicos que conducen a la elevación de la presión arterial incluyen la activación del sistema neuroendocrino (simpático, eje renina-angiotensina o sistema glucocorticoide) debido a la situación del estrés y la elevación de la presión intracraneal (efecto Cushing).
Las cifras elevadas de presión arterial en los pacientes con HICpodrían asociarse a un mayor crecimiento de la hemorragia38, lo cual empeora el pronóstico de los pacientes. En el caso del ictus isquémico, la presión arterial ejerce un efecto en «U», observándose que tanto cifras elevadas como disminuidas incrementan el riesgo de deterioro neurológico, mortalidad y peor pronóstico funcional39. En modelos animales de HICse ha descrito un daño secundario, originado posiblemente por una compresión mecánica de la microvasculatura que induce una zona de isquemia alrededor de la hemorragia40, lo que ha llevado a pensar que una disminución de la presión arterial podría contribuir a una disminución del flujo sanguíneo en la región perihemorragia, condicionando un mayor deterioro neurológico. Sobre la base de estos datos, se recomendaba mantener la presión arterial sistólica por debajo de 180mmHg durante la fase aguda de la HIC. Sin embargo, estudios de neuroimagen no han conseguido demostrar la presencia de isquemia alrededor de la hemorragia en la clínica humana41,42, por lo que este aspecto todavía resulta controvertido.
El estudio INTERACT43 aporta nuevos datos acerca del manejo de la presión arterial durante la fase aguda de la HIC. Este estudio se diseñó con el objetivo de valorar el efecto de un control más intensivo de la presión arterial en el crecimiento de la hemorragia y el desarrollo de edema perilesional. Para ello se incluyó a 404 pacientes con HIC espontánea de menos de 6h de evolución que presentaban cifras de presión arterial sistólica ≥ 150mmHg y ≤ 220mmHg. Los pacientes fueron asignados de manera aleatoria para recibir tratamiento de los niveles de presión arterial según las recomendaciones de las guías internacionales o un control más intensivo de dichos niveles. En los pacientes que recibieron el control según las guías internacionales se mantuvo la presión arterial sistólica por debajo de 180mmHg. El objetivo del control de la presión arterial en el grupo de pacientes de pacientes con control intensivo fue alcanzar cifras de presión arterial sistólica de 140mmHg durante la primera hora y mantenerla por debajo de esos niveles durante los siguientes 7 días. Los resultados del estudio demostraron que el grupo de pacientes asignado a control más intensivo de la presión arterial presentó un menor crecimiento de la hemorragia y una tendencia en la disminución del edema perihemorragia, sin evidenciarse un mayor porcentaje de deterioro neurológico ni peor pronóstico funcional, aunque el estudio no fue diseñado para evaluar este aspecto. Los datos del estudio parecen demostrar que el control intensivo de la presión arterial parece seguro. Sin embargo, sigue sin conocerse el nivel de presión arterial más adecuado en los pacientes con HIC, cuál debe ser la duración del tratamiento antihipertensivo y el efecto de éste en el pronóstico funcional. Actualmente, se encuentra en marcha el estudio INTERACT 244, que tiene como objetivo principal la evaluación del efecto del control intensivo de la presión arterial durante la fase aguda en el pronóstico funcional en pacientes con HIC.
Los fármacos recomendados para el control de la presión arterial son aquellos que no produzcan vasodilatación cerebral ni hipotensión brusca, como el labetalol intravenoso (bolos de 10-20mg en 1-2min, repitiéndose cada 10-20min hasta el control de la presión arterial o dosis máxima de 200mg), enalapril por vía intravenosa (bolo de 1mg) o urapidil por vía intravenosa (bolos de 25mg en 20s, repitiéndose a los 5min si no hay respuesta).
Control de la glucemiaLas cifras elevadas de glucemia al ingreso se asocian a un mayor riesgo de mortalidad y mal pronóstico en pacientes con hemorragia intracerebral45,46. Un ensayo clínico muestra que el mantenimiento de la glucosa en pacientes críticos en general o con ictus agudo, en un rango entre 80-110mg/dl mediante insulina por vía intravenosa se ha asociado a una mayor incidencia de episodios de hipoglucemia tanto sistémica como cerebral y, posiblemente, un riesgo aún mayor de la mortalidad en los pacientes tratados con estas medidas47,48.
No existen estudios de intervención que se hayan diseñado específicamente en las HIC, por lo que todavía no está aclarado cuál es el objetivo del control de la glucemia en la HIC. Sin embargo, en el ictus isquémico las cifras por encima de 155mg/dl se han asociado a un mal pronóstico49, por lo que si superan ente nivel, sería conveniente su corrección. Debe evitarse la hipoglucemia, administrando suero glucosado al 10-20%.
Control de la temperaturaLa fiebre, sea cual sea su causa, se asocia a deterioro neurológico y mal pronóstico50. Aunque no hay evidencia de que el tratamiento mejore ese riesgo, se recomienda abordar un tratamiento sintomático con fármacos antipiréticos, como paracetamol. En caso de fiebre es recomendable solicitar una radiografía de tórax, hemocultivos, cultivo de esputo, urocultivo y sedimento de orina con el fin de descartar y tratar proceso infeccioso asociado, además de la revisión sistemática de vías periféricas para descartar procesos flebíticos.
Respecto al beneficio de la hipotermia moderada, algunos estudios recientes han demostrado el beneficio en algunas enfermedades como traumatismos craneales; sin embargo, su efecto no ha sido investigado en el caso de los pacientes con HIC.
Manejo de la hemostasiaLas alteraciones de la hemostasia, como el tratamiento con anticoagulantes orales, déficit de factores de la coagulación o anormalidades plaquetarias, pueden contribuir a un crecimiento de la hemorragia, condicionando un deterioro neurológico, por lo que es importante corregir estos factores lo más rápido posible.
En los casos en los que el paciente esté recibiendo anticoagulantes orales se debe corregir el INR hacia valores de normalidad de manera urgente51, para lo cual debe utilizarse vitamina K intravenosa y/o plasma fresco congelado y/o complejo protrombínico52,53. La eficacia del plasma fresco congelado está limitada por el riesgo de reacciones alérgicas e infecciones, además del tiempo de procesado y de la sobrecarga de líquidos. Los concentrados de complejos de protrombina contienen además los factores II, VII, IX y X, siendo capaces de normalizar de manera rápida los valores de INR, por lo que constituyen el tratamiento de elección para el tratamiento de HIC relacionadas con anticoagulación oral54; sin embargo, es necesario combinarlos con vitamina K dado que la vida media de los anticoagulantes orales excede con creces a la de los factores dependientes de la vitamina K. En los casos en los que los pacientes han recibido heparina por vía intravenosa y tienen un TTPAprolongado debe administrarse sulfato de protamina. Si la HIC se debe a tratamiento fibrinolítico, puede ser necesaria la administración de plasma fresco congelado, plaquetas o antifibrinolíticos como el ácido épsilon-amino-caproico o el tranhexámico. La administración de factor VII recombinante activado debe realizarse en aquellos pacientes con hemofilia con HIC.
El factor VII recombinante activado también se ha estudiado en pacientes con HIC sin trastornos de la hemostasia. Un estudio en fase 2ha demostrado que la administración de factor VII recombinante activado limita el crecimiento de la hemorragia y mejora el pronóstico funcional de los pacientes en relación con placebo, a pesar de que incrementa la frecuencia de complicaciones tromboembólicas55. Un estudio en fase 3 confirmó que la administración de factor VII recombinante limita el crecimiento de la hemorragia, pero no se observaron diferencias significativas en cuanto al pronóstico en relación con el placebo56. Está todavía por demostrar si la administración de factor VII recombinante puede presentar algún beneficio en pacientes seleccionados; sin embargo, la administración de forma universal en pacientes con HIC no mejora el pronóstico y aumenta el riesgo de complicaciones tromboembólicas.
Los pacientes con HIC y trombocitopenia deben recibir concentrados de plaquetas. En el caso de los pacientes sin trombocitopenia pero tratados con antiagregantes plaquetarios existen datos contradictorios: aunque se ha relacionado la disfunción plaquetaria con aumento del volumen de la hemorragia y peor resultado funcional57, en un ensayo clínico sobre neuroprotección en hemorragia cerebral58 entre los pacientes que recibieron placebo no hubo diferencias con respecto al tratamiento previo con antiagregantes. No existe por lo tanto indicación de reposición plaquetaria en pacientes antiagregados con recuento normal de plaquetas.
Prevención de complicacionesTrombosis venosa profunda y embolia pulmonarLos pacientes con HIC tienen un mayor riesgo de presentar complicaciones tromboembólicas59. La utilización de medias de compresión elástica de manera aislada no han demostrado eficacia en la prevención de trombosis venosas profundas60; sin embargo, la combinación de compresión mecánica intermitente y medias de compresión elástica resulta más eficaz61. La utilización de heparinas de bajo peso molecular, a partir del día 1 tras la hemorragia cerebral, disminuye el riesgo de complicaciones tromboembólicas en pacientes con HIC y no incrementa el riesgo de sangrado62.
Crisis convulsivasLa presencia de crisis convulsivas aumenta la demanda metabólica cerebral y empeora la lesión neurológica en los pacientes con HIC, por lo que deben ser tratadas, en caso de aparición, inicialmente con benzodiacepinas y posteriormente con fármacos antiepilépticos. Sin embargo, la administración de fármacos antiepilépticos en pacientes con HIC que no han presentado una crisis convulsiva se asocia con una mayor morbi-mortalidad, especialmente la fenitoína63,64, por lo que no se recomienda el tratamiento profiláctico de las crisis convulsivas.
Manejo de la presión intracranealEl control de la presión intracraneal (PIC) es uno de los objetivos del tratamiento específico de la HIC y debe ser dirigido a la causa subyacente. Las causas más habituales de elevación de la PIC son la hidrocefalia debido a la hemorragia intraventricular y el efecto masa de la hemorragia.
La implantación de dispositivos que miden la PIC incrementa el riesgo de hemorragia e infección, por lo que no deben utilizarse de forma rutinaria. Sin embargo, existen técnicas no invasivas que nos permiten estimar la presión intracraneal en pacientes con HIC, como la utilización del Doppler transcraneal. El aumento del índice de pulsatilidad en la arteria cerebral media del hemisferio no afecto indica la presencia de hipertensión intracraneal y ha demostrado ser un predictor de mortalidad65.
Los datos sobre el manejo de la PIC en la HIC son limitados, por lo que las recomendaciones son extrapoladas de las empleadas en el manejo de los pacientes con traumatismo craneoencefálico66. Se recomienda considerar el control y tratamiento de la PIC en pacientes con HIC que presentan una puntuación en la escala de Glasgow ≤ 8, evidencia clínica de herniación transtentorial o aquellos con hemorragia intraventricular significativa o hidrocefalia. Sin embargo, hay que tener en cuenta que los estudios que han intentado determinar la utilidad de la monitorización de la PIC en pacientes con HIC son muy escasos y en su mayoría han fracasado en el intento de discriminar aquellos pacientes que podrían ser candidatos a la evacuación quirúrgica de la hemorragia y aquellos que deberían recibir tratamiento exclusivamente médico.
La posición de la cabeza centrada y con la cabecera elevada a 20-30° permite mejorar el retorno venoso y disminuir ligeramente la PIC. La hiperventilación disminuye la presión arterial de O2, originando vasoconstricción cerebral y reducción de la PIC. El objetivo es alcanzar una presión de CO2 entre 28-35mmHg, manteniéndola posteriormente entre 25-30mmHg si persiste PIC elevada. Esto consigue una disminución rápida de la PIC, aunque el efecto es transitorio, por lo que hay que instaurar otras medidas que mantengan la PIC controlada. Deben evitarse aquellas situaciones que aumentan la PIC tales como fiebre, maniobras de Valsalva (como tos o vómitos), convulsiones, estrés, dolor, HTA e hiponatremia. La osmoterapia reduce la PIC aumentando la osmolaridad en el plasma, lo que consigue desplazar agua del tejido cerebral sano al compartimento vascular. Los fármacos más empleados son el manitol y los diuréticos de asa, como la furosemida. La dosis recomendada de manitol al 20% oscilan entre 0,7-1g/kg (250ml), seguido de 0,3-0,5g/kg (125ml) cada 3-8h, no durante más de 5 días, para evitar el efecto rebote. La furosemida (10mg cada 2-8h) puede utilizarse de forma simultánea para mantener el gradiente osmótico. La utilización de corticoides no es eficaz e incluso aumenta el número de complicaciones67. La sedación con fármacos por vía intravenosa, como benzodiacepinas, barbitúricos, narcóticos y butirofenonas, reducen el metabolismo cerebral y disminuyen el flujo sanguíneo cerebral y la PIC; sin embargo, presentan un gran número de complicaciones, como la hipotensión arterial o infecciones respiratorias.
La hidrocefalia que se produce por la presencia de sangre intraventricular es uno de los factores que se asocian a mal pronóstico y mayor mortalidad68,69, por lo que la ventriculostomía debe considerarse en los casos en los que exista hidrocefalia y disminución del nivel de consciencia. Actualmente, está en marcha el estudio aleatorizado CLEARIII, que evalúa la eficacia y la seguridad de la infusión de trombolíticos intraventriculares en pacientes con hemorragia parenquimatosa e invasión ventricular.
Pronóstico de la HICA la luz de diversos estudios se han postulado diversos factores relacionados con el pronóstico del paciente. Entre las variables relacionadas podemos considerar la edad, las puntuaciones en las escalas de GCS y NIHSS, el volumen y localización de la hemorragia, o la presencia de sangrado intraventricular70. De la presencia de datos que pudiesen predecir mal pronóstico se podrían establecer medidas que limitasen los cuidados, decisión que repercute en la mortalidad, especialmente en la precoz71–73. A la vista de las evidencias no se puede establecer un pronóstico de certeza, por lo que no puede ser recomendado la decisión de limitar los cuidados de forma precoz.
- 1.
Si la saturación arterial de oxígeno < 92% se debería administrar oxigenoterapia mediante mascarilla a una concentración que permita mantener la saturación de oxígeno por encima de dicho valor.
- 2.
Se recomienda la intubación precoz en los casos de HIC de gran volumen en los que exista bajo nivel de consciencia (GCS < 8) si existe un buen estado funcional previo, salvo que hayan desaparecido todos los signos de tronco (nivel de evidencia 5, grado de recomendación C).
- 1.
Debe valorarse periódicamente el nivel de consciencia y el déficit neurológico, al menos durante las primeras 72h de evolución. La monitorización del déficit neurológico se llevará a cabo mediante la utilización de la escala NIHSS y el nivel de consciencia se monitorizará mediante la escala de coma de Glasgow (nivel de evidencia 5, grado de recomendación C).
- 1.
A la espera de los resultados de los nuevos ensayos clínicos, se recomienda tratamiento cuando la presión arterial sistólica sea superior a 180mmHg (nivel de evidencia 2b, grado de recomendación C).
- 2.
En pacientes con cifras de presión arterial sistólica entre 150-220mmHg, la reducción rápida de la presión arterial sistólica hasta el límite de 140mmHg es seguro (nivel de evidencia 2a, grado de recomendación B).
- 1.
Debe realizarse un control regular de la glucosa en sangre, evitando cifras de hiperglucemia > 155mg/dl (nivel de evidencia 2c, grado de recomendación C). En caso de superarse, convendría corregirlas con insulina, y las cifras las cifras por debajo de 70mg/dl con suero glucosado al 10-20% (nivel de evidencia 5, grado de recomendación C).
- 1.
Se debe tratar la hipertermia por encima de 37,5° C con paracetamol por vía intravenosa (nivel de evidencia 5, grado de recomendación C).
- 1.
Los pacientes con deficiencia de factores de coagulación o trombocitopenia grave deben recibir los factores deficitarios o plaquetas respectivamente (nivel de evidencia 1, grado de recomendación B).
- 2.
Los pacientes con HIC y tratamiento anticoagulante con INR elevado deben recibir complejo protrombínico y vitamina K por vía intravenosa y si es necesario plasma fresco para reemplazar factores dependientes de vitamina K, hasta la normalización del INR (nivel de evidencia 1, grado de recomendación B).
- 3.
Los pacientes que han recibido tratamiento con heparina intravenosa y tienen un TTPA prolongado deben recibir tratamiento con sulfato de protamina (nivel de evidencia 5, grado de recomendación C).
- 4.
En los pacientes con HIC que han recibido tratamiento trombolítico debe realizarse trasfusión de plasma fresco y plaquetas o antifibrinolíticos como el ácido épsilon-amino-caproico o el tranhexámico (nivel de evidencia 5, grado de recomendación C).
- 1.
En la prevención de trombosis venosa profunda debe emplearse la combinación de compresión mecánica intermitente y medias de compresión elástica (nivel de evidencia 1, grado de recomendación B) y a partir del día 1 podría iniciarse profilaxis con heparinas de bajo peso molecular (nivel de evidencia 2b, grado de recomendación B).
- 1.
La presencia de crisis convulsivas requiere la administración de fármacos antiepilépticos (nivel de evidencia 1, grado de recomendación A).
- 2.
No está indicado el tratamiento profiláctico con fármacos antiepilépticos (nivel de evidencia 3, grado de recomendación B).
- 1.
En los pacientes con GCS ≤ 8, con evidencia de herniación transtentorial o con hidrocefalia debe realizarse un control de la PIC (nivel de evidencia 2b, grado de recomendación C).
- 2.
En los pacientes con hidrocefalia se debe considerar la colocación de un drenaje ventricular (nivel de evidencia 2a, grado de recomendación B).
- 3.
Como primera opción se recomienda el uso de diuréticos osmóticos, aunque no se recomienda su uso de forma profiláctica (nivel de evidencia 5, grado de recomendación C).
- 4.
En los casos que no respondan a tratamiento con diuréticos osmóticos se recomienda la hiperventilación, siempre y cuando el paciente pueda tener un buen pronóstico funcional (nivel de evidencia 5, grado de recomendación C).
- 5.
Los corticoides no se recomiendan en el manejo de la HIC primaria (nivel de evidencia 2, grado de recomendación B).
La decisión sobre el tratamiento quirúrgico en pacientes con HIC es un aspecto controvertido. Aunque la cirugía podría disminuir los efectos derivados de la compresión mecánica de la hemorragia y los efectos tóxicos de la sangre sobre el tejido cerebral circundante, los riesgos quirúrgicos pueden ser mayores, y en la mayoría de los pacientes el beneficio de la cirugía no compensa el posible daño del tratamiento quirúrgico.
Un factor que influye en la decisión del tratamiento quirúrgico es la localización de la hemorragia. Las hemorragias cerebelosas mayores de 3cm de diámetro o aquellas con compresión del tronco cerebral o hidrocefalia, presentan un mejor pronóstico con tratamiento quirúrgico respecto al tratamiento médico74,75. En estos casos, la implantación de un drenaje ventricular sin evacuación de la hemorragia no es suficiente, por lo que su colocación de forma aislada no es recomendable. Por otro lado, las hemorragias cerebelosas menores de 3cm, sin compresión del tronco cerebral ni hidrocefalia, no tienen indicación quirúrgica.
El ensayo clínico STICH observó que en los pacientes con hemorragia lobular, localizada a menos de 1cm de la corteza cerebral, se encontraba una tendencia al beneficio del tratamiento quirúrgico, sin observarse significación estadística76. También se encontró una tendencia no significativa al beneficio de la cirugía en pacientes con hemorragia lobular y una puntuación en la GCS entre 9 y 12; sin embargo, son necesarios nuevos ensayos clínicos que demuestren este beneficio. En los casos de las hemorragias localizadas a más de 1cm de la corteza cerebral con una GCS ≤ 8 el pronóstico es peor en los pacientes sometidos a tratamiento quirúrgico77.
Los estudios relacionados en el caso de las hemorragias localizadas en ganglios basales no muestran mejores resultados con el tratamiento quirúrgico, teniendo en cuenta además que el acceso a la hemorragia requiere atravesar tejido cerebral sano, por lo que la cirugía genera mayores secuelas77,78.
Las técnicas recomendadas del tratamiento quirúrgico incluyen la realización de craniectomía con descompresión y evacuación de la hemorragia; sin embargo, se han intentado desarrollar técnicas menos invasivas. Algunos estudios han estudiado el beneficio de la realización de una cirugía guiada con esterotaxia, combinada con trombólisis local78,80 o aspiración endoscópica81,82. Estas técnicas consiguen una mejor eliminación de la hemorragia y disminuyen la mortalidad cuando se realizan dentro de las primeras 72h; sin embargo, no se ha demostrado que mejoren el pronóstico funcional de los pacientes. Un ensayo clínico comparó la realización de cirugía con craneopunción mínimamente invasiva con el tratamiento médico en hemorragias en ganglios basales de pequeño volumen, observando que es una técnica segura que puede mejorar el pronóstico funcional en estos pacientes79.
Existe asimismo controversia con respecto al momento más indicado para proceder a una extracción quirúrgica de la hemorragia, sin que se hayan demostrado diferencias entre los estudios que han incluido cirugía en menos de 24, 48, 72 o hasta 96h, salvo en los tratados con técnicas mínimamente invasivas, citados anteriormente.
- 1.
En los pacientes con hemorragias cerebelosas que presenten deterioro neurológico, compresión del tronco cerebral o hidrocefalia se recomienda el tratamiento quirúrgico lo antes posible (nivel de evidencia 1, grado de recomendación B).
- 2.
En los pacientes con hemorragia lobular de más de 30ml de volumen, localización a menos de 1cm de la corteza cerebral con deterioro neurológico debe considerarse el tratamiento quirúrgico (nivel de evidencia 2b, grado de recomendación B).
- 3.
No se recomienda la cirugía evacuadora en los casos de hemorragias profundas (nivel de evidencia 2, grado de recomendación B), y aunque la cirugía mínimamente invasiva podría ser una alternativa en el futuro, no existen datos suficientes para recomendar la realización de cirugía esterotáxica con evacuación de la hemorragia en el momento actual (nivel de evidencia 2, grado de recomendación B).
El riesgo de recurrencia tras una primera HICestá entre el 2,1 y 3,7% anual83,84; sin embargo, las hemorragias lobulares relacionadas con angiopatía amiloide85, las secundarias a anticoagulación84, haber padecido una hemorragia cerebral previa86, la edad avanzada84 o la presencia de microsangrados en RM con eco de gradiente87 aumentan el riesgo de recurrencia.
La HTA es el factor modificable que más influye en el riesgo de recurrencia de las HIC, por lo que es importante un control adecuado de la presión arterial. El adecuado control de la presión arterial disminuye el riesgo de recurrencia tanto en hemorragias hipertensivas como en las secundarias a angiopatía amiloide88. Aunque no se conoce la cifra óptima de presión arterial para reducir el riesgo de recurrencia tras una HIC, el objetivo razonable es mantener cifras normales de presión arterial (por debajo de 120/80mmHg)89.
La anticoagulación oral incrementa el riesgo de recurrencia tras una HIC84, por lo que debe analizarse el beneficio de la anticoagulación en la prevención de eventos tromboembólicos y el riesgo de recurrencia de HIC. El riesgo de recurrencia es superior en las hemorragias lobulares, por lo que en los pacientes con fibrilación auricular debe suspenderse definitivamente la anticoagulación90. En los casos de hemorragias profundas, el riesgo de recurrencia es menor; sin embargo, de forma general debe considerarse retirar la anticoagulación durante la fase aguda, salvo en los casos de riesgo tromboembólico elevado (como los portadores de válvulas mecánicas) y riesgo de hemorragia bajo90. Cuando el riesgo tromboembólico es alto (puntuación en la escala CHA2DS2-VASc ≥ 2), se recomienda reintroducir la anticoagulación oral pasados 7-10 días91. El efecto de los antiagregantes en el riesgo y gravedad de las hemorragias es menor que el de los anticoagulantes orales92, por lo que ésta puede ser una alternativa a la anticoagulación en los pacientes de riesgo moderado (CHA2DS2-VASc ≤ 1) o con dependencia funcional (puntuación en la escala de Rankin modificada 4-5)91.
En el caso de las hemorragias secundarias a lesión subyacente, el tratamiento específico disminuye el riesgo de recurrencia. Así, los angiomas cavernosos (tasa anual de sangrado del 0,7% por año y por lesión)93, si son accesibles quirúrgicamente, se recomienda la cirugía en función del riesgo de resangrado. En las lesiones profundas es preferible realizar un seguimiento estrecho, reservando la cirugía para los casos en los que se produzca déficit progresivo o sangrados recurrentes. Cuando se trata de las MAV el riesgo de resangrado es elevado, siendo del 18% el primer año94 y del 2% anual posteriormente95, por lo que se recomienda el tratamiento que los excluya de la circulación, si es posible. En este caso las alternativas son el tratamiento quirúrgico, la terapia endovascular o la radiocirugía. El tratamiento quirúrgico depende de la localización, siendo habitualmente inoperables las localizadas en ganglios de la base, diencéfalo o tronco cerebral. La terapia endovascular se desarrolló inicialmente para facilitar la resección de las MAV de gran tamaño o como alternativa a la cirugía de alto riesgo96; sin embargo, en casos de lesiones pequeñas se puede conseguir la oclusión completa con terapia endovascular. La radiocirugía es más efectiva en MAV menores de 3cm97 y también puede utilizarse en casos de MAV no accesibles a ninguna otra técnica. En las HIC secundarias a tumores el tratamiento generalmente es quirúrgico, con extirpación del tumor subyacente, aunque el tratamiento depende de la situación funcional del paciente y el tipo y localización del tumor.
- 1.
Se recomienda el control de la presión arterial por debajo de 120/80mmHg en todos los pacientes con HIC(nivel de evidencia 2a, grado de recomendación B).
- 2.
Debe evitarse la anticoagulación tras una HIClobular en los casos de fibrilación auricular no valvular (nivel de evidencia 2a, grado de recomendación B). El tratamiento antiagregante puede ser una alternativa a la anticoagulación en estos pacientes (nivel de evidencia 2, grado de recomendación B).
- 3.
En el caso de angiomas cavernosos accesibles se debe valorar el tratamiento quirúrgico en función del riesgo de sangrado (nivel de evidencia 5, grado de recomendación D). En los de localización profunda es recomendable realizar seguimiento y valorar la cirugía si se produce resangrado o empeoramiento neurológico (nivel de evidencia 5, grado de recomendación D).
- 4.
En el caso de las MAV se recomienda el tratamiento mediante cirugía, terapia endovascular y/o radiocirugía en función del riesgo quirúrgico y del tamaño y localización de la lesión (nivel de evidencia 5, grado de recomendación D).
Las guías de actuación clínica se editan periódicamente porque están sometidas a continuas innovaciones por los avances en ensayos clínicos, existiendo una continuidad tanto con las anteriores de la SEN como con las actuales recomendaciones del European Stroke Initiative98 y de la American Heart Association Stroke Council99, cuyas recomendaciones se han tenido en cuenta en la elaboración de las que ahora presentamos. De igual modo, para mantener una uniformidad con el resto de guías internacionales, hemos seguido los niveles de evidencia y grados de recomendación de la clasificación del centro de medicina basada en la evidencia de la Universidad de Oxford (addendum 2 y 3)100.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Comité ad hoc del Grupo de estudio de ECV de la SEN para la redacción de las Guías de actuación clínica en el ictus.
Coordinador: Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid.
A.1. Comisión de Redacción
Exuperio Díez-Tejedor (coord.), Hospital Universitario La Paz, Madrid; Blanca Fuentes (secretaría), Hospital Universitario La Paz, Madrid; María Alonso de Leciñana, Hospital Universitario Ramón y Cajal, Madrid; José Álvarez-Sabin, Hospital Universitario Valle de Hebron, Barcelona; Juan Arenillas, Hospital Universitario Clínico de Valladolid; Sergio Calleja, Hospital Universitario Central de Asturias, Oviedo; Ignacio Casado, Hospital San Pedro, Cáceres; Mar Castellanos, Hospital Josep Trueta, Gerona; José Castillo, Hospital Clínico Universitario, Santiago de Compostela; Antonio Dávalos, Hospital Universitario German Trias i Pujol, Badalona; Fernando Díaz-Otero, Hospital Universitario Gregorio Marañón, Madrid; Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid; José Antonio Egido, Hospital Clínico Universitario San Carlos, Madrid; Juan Carlos Fernández, Hospital Universitario Dr. Negrín, Las Palmas; Mar Freijo, Hospital Universitario de Basurto, Bilbao; Blanca Fuentes, Hospital Universitario La Paz, Madrid; Jaime Gállego, Hospital General de Navarra, Pamplona; Andrés García Pastor, Hospital Universitario Gregorio Marañón, Madrid; Antonio Gil-Núñez, Hospital Universitario Gregorio Marañón, Madrid; Francisco Gilo, Hospital Universitario La Princesa, Madrid; Pablo Irimia, Clínica Universitaria de Navarra, Pamplona; Aida Lago, Hospital Universitario La Fe, Valencia; José Maestre, Hospital Universitario Virgen de las Nieves, Granada; Jaime Masjuan, Hospital Universitario Ramón y Cajal, Madrid; Joan Martí-Fábregas, Hospital de la Santa Cruz y San Pablo, Barcelona; Patricia Martínez-Sánchez, Hospital Universitario La Paz, Madrid; Eduardo Martínez-Vila, Clínica Universitaria de Navarra, Pamplona; Carlos Molina, Hospital Universitario Valle de Hebron, Barcelona; Ana Morales, Hospital Universitario Virgen de la Arrixaca, Murcia; Florentino Nombela, Hospital Universitario La Princesa, Madrid; Francisco Purroy, Hospital Universitario Arnau de Vilanova, Lérida; Marc Ribó, Hospital Universitario Valle de Hebron, Barcelona; Manuel Rodríguez-Yáñez, Hospital Clínico Universitario, Santiago de Compostela; Jaime Roquer, Hospital del Mar, Barcelona; Francisco Rubio, Hospital Universitario de Bellvitge, Barcelona; Tomás Segura, Hospital Universitario de Albacete, Albacete; Joaquín Serena, Hospital Joseph Trueta, Gerona; Patricia Simal, Hospital Clínico Universitario San Carlos, Madrid; Javier Tejada, Hospital Universitario de León, León; José Vivancos, Hospital Universitario La Princesa, Madrid.
A.2. Comisión de revisión o institucional
José Álvarez-Sabín, Hospital Universitario Valle de Hebron, Barcelona; José Castillo, Hospital Clínico Universitario, Santiago de Compostela; Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid; Antonio Gil-Núñez, Hospital Universitario Gregorio Marañón, Madrid; José Larracoechea, Hospital de Cruces, Bilbao; Eduardo Martínez-Vila, Clínica Universitaria de Navarra, Pamplona; Jaime Masjuan, Hospital Universitario Ramón y Cajal, Madrid; Jorge Matías-Guiu, Hospital Clínico Universitario San Carlos, Madrid; Francisco Rubio, Hospital de Belltige, Barcelona.
| Nivel de evidencia | Tipo de estudio |
| 1a | Revisión sistemática de ensayos clínicos aleatorizados, con homogeneidad |
| 1b | Ensayo clínico aleatorizado con intervalo de confianza estrecho |
| 1c | Práctica clínica («todos o ninguno»)a |
| 2a | Revisión sistemática de estudios de cohortes, con homogeneidad |
| 2b | Estudio de cohortes o ensayo clínico aleatorizado de baja calidadb |
| 2c | Outcome researchc, estudios ecológicos |
| 3a | Revisión sistemática de estudios de casos y controles, con homogeneidad |
| 3b | Estudio de casos y controles |
| 4 | Series de casos o estudios de cohortes y de casos y controles de baja calidadd |
| 5 | Opinión de expertos sin valoración crítica explícita, o basados en la fisiología, bench research o first principlese |
Cuando todos los pacientes mueren antes de que un determinado tratamiento esté disponible, y con él algunos pacientes sobreviven, o bien cuando algunos pacientes morían antes de su disponibilidad, y con él no muere ninguno.
El término outcome research hace referencia a estudios de cohortes de pacientes con el mismo diagnóstico en los que se relacionan los eventos que suceden con las medidas terapéuticas que reciben.
Estudio de cohortes: sin clara definición de los grupos comparados y/o sin medición objetiva de las exposiciones y eventos (preferentemente ciega) y/o sin identificar o controlar adecuadamente variables de confusión conocidas y/o seguimiento completo y suficientemente prolongado. Estudio de casos y controles: sin clara definición de los grupos comparados y/o sin medición objetiva de las exposiciones y eventos (preferentemente ciega) y/o sin identificar o controlar adecuadamente variables de confusión conocidas.
Las filiaciones de los autores y composición del comité se relacionan en el addendum 1