Excluyendo los casos de vasoespasmo tras rotura de aneurismas saculares de la arteria cerebral anterior (ACA) y/o de la arteria comunicante anterior, los infartos de la ACA justifican el 0,6-3% de los ictus isquémicos agudos1. El ictus de ACA bilateral es extremadamente infrecuente en ausencia de anormalidades angioarquitecturales, como un segmento horizontal o precomunicante -A1- hipoplásico, una ACA bihemisférica (irrigación del territorio bilateral de la ACA por un solo segmento vertical o poscomunicante -A2-) o una ACA ácigos (un vaso impar solitario originado a partir de la confluencia del segmento A1 de ambas ACAs, dando lugar a un único tronco A2)2. Los mecanismos embolígenos son su principal causa, habitualmente acompañados de hipoplasia de la ACA contralateral1-3. En los últimos años, disponemos de una mayor evidencia científica correlacionando la fibrilación auricular (FA) y el infarto agudo de miocardio (IAM), a través de un proceso de comorbilidad bidireccional, inducido por un estado proinflamatorio y protrombótico4-6. Así pues, presentamos un caso excepcional de IAM e ictus isquémico subagudo de ACA bilateral con transformación hemorrágica y doble fuente cardioembolígena, como forma de presentación de una FA.
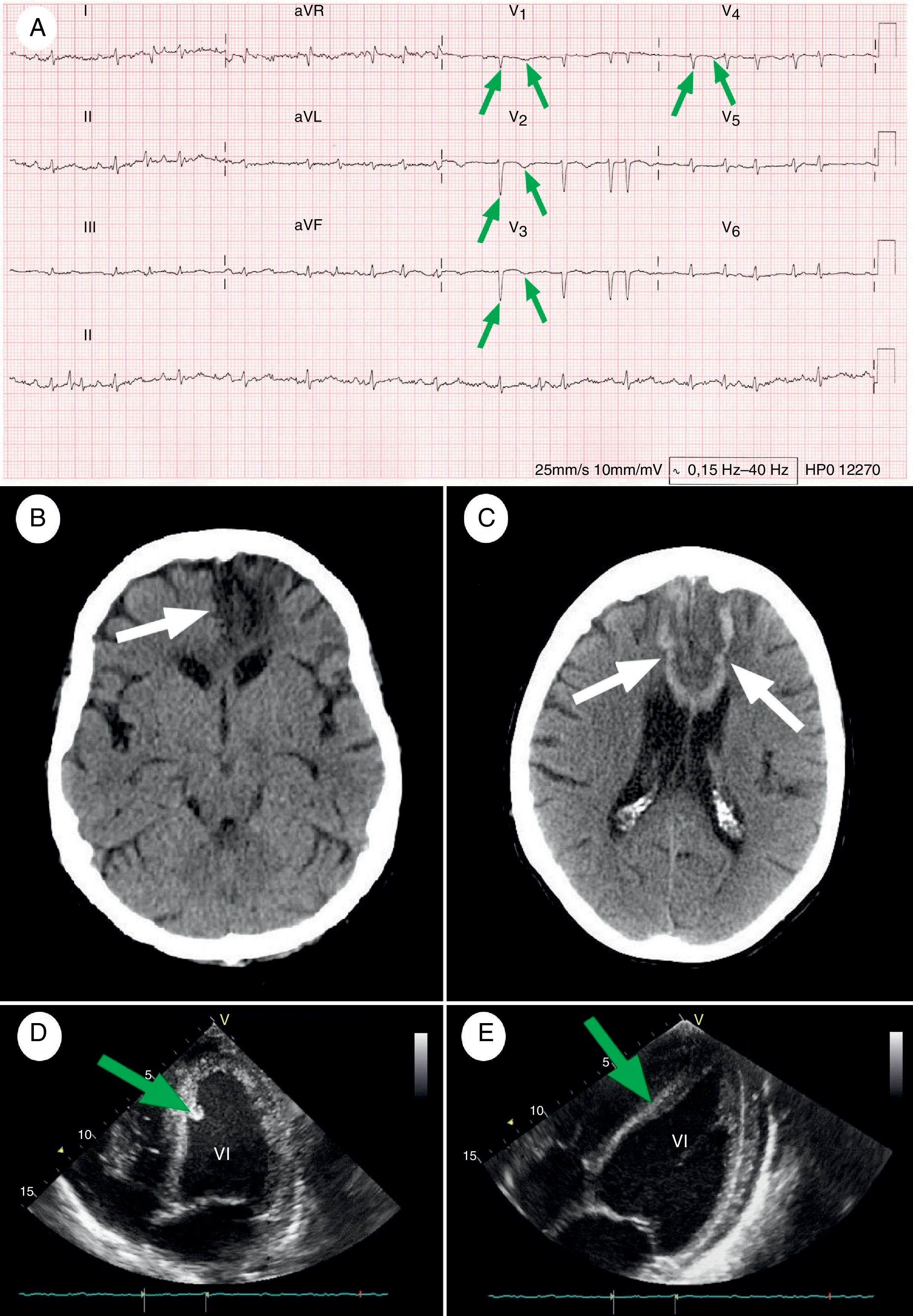
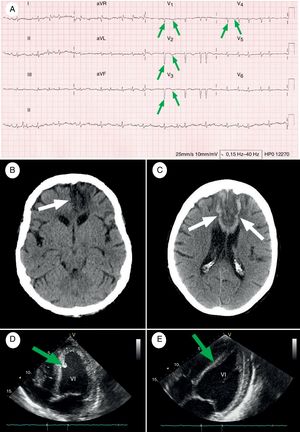
Caso clínicoSe trataba de una mujer de 67 años, manidextra, con antecedentes de hipertensión arterial, diabetes mellitus tipo 2, dislipidemia y obesidad, pero sin historia previa de cardiopatía ni arritmias (mRS: 1), quien fue atendida en el Servicio de Urgencias Hospitalarias, por un cuadro clínico de 26 h de evolución, iniciado de forma abrupta tras levantarse, estando en reposo, con sensación de palpitaciones y después, disnea, dolor opresivo retroesternal, con posterior dificultad para emitir lenguaje y debilidad del miembro inferior derecho. Con presión arterial de 96/70mmHg (en ambos brazos), T.ª de 36,9°C y pulso arterial irregular a 160 latidos/min, siendo el resto del examen físico normal. En la exploración neurológica destacaban: somnolencia, desviación oculocefálica hacia la izquierda, parálisis facial central derecha con movimientos de chupeteo y succión, hemiplejía derecha (mayor a nivel crural), hiperreflexia en el hemicuerpo derecho incluyendo reflejo de prensión marcado en mano derecha y signo de Babinski, anestesia del miembro inferior derecho, afasia transcortical motora, disartria y heminegligencia derecha (NIHSS: 23). La analítica inicial reveló elevación de biomarcadores cardiacos (entre paréntesis figuran los valores normales del laboratorio de referencia): CPK-MB 261 U/L (0-16 U/L) y troponina T 1,5ng/mL (0-0,1ng/mL). Una muestra sanguínea extraída 6 h más tarde arrojó un valor de troponina T de 2,3ng/mL, confirmando una curva de crecimiento, con posterior descenso durante los 8 días siguientes. El electrocardiograma hizo patente la aparición de una FA, con respuesta ventricular rápida y ondas Q patológicas en derivaciones V1-V4 (fig. 1A). Además, la tomografía axial computarizada (TAC) craneal urgente y el ecocardiograma transtorácico (ETT) demostraron un infarto cerebral isquémico a nivel de la ACA izquierda (fig. 1B) y una acinesia ventricular izquierda con trombo mural (fig. 1D), respectivamente. Ante esta coyuntura cronopatológica, las terapias de reperfusión cardiocerebral fueron desestimadas, y a tenor de los resultados imagenológicos (sobre todo ecocardiográficos, con la existencia de un trombo mural), se inició anticoagulación con heparina sódica intravenosa (tratando de mantener el valor del TTPa 1,5-2 veces el tiempo de control); tras valoración por el Servicio de Cardiología, se adicionó doble antiagregación con ácido acetilsalicílico 100mg/día y clopidogrel 75mg/día, como prevención secundaria del síndrome coronario agudo (SCA), cursando ingreso en la Unidad de Ictus, para proseguir con los cuidados médicos y el proceso de evaluación diagnóstica. Sin embargo, el 8.° día postictus, la paciente desarrolló un cuadro de mutismo acinético. Una nueva TAC craneal, constató ictus subagudos, exhibiendo zonas de conversión hemorrágica del tejido neuronal isquémico, en el territorio de ambas ACAs (fig. 1C), pero sin anomalías vasculares en la angiorresonancia magnética de cabeza y cuello. Un mes después, tras presentar una rectorragia con disminución de 5,3g/dL en la concentración de hemoglobina, la triple terapia (anticoagulación+doble antiagregación plaquetaria) fue reemplazada por enoxaparina 40mg/día y clopidogrel 75mg/día. La analítica general (incluyendo perfiles de autoinmunidad, hipo e hipercoagulabilidad), la TAC body y la colonoscopia, fueron normales, con cese paulatino de la proctorragia y una evolución analítica posterior favorable. En el examen neurológico al alta hospitalaria, en el 6.° mes postictus, destacaban abulia, apatía, disfasia motora y tetraparesia moderada de predominio en miembros inferiores (NIHSS: 9, mRS: 5), sin encontrar trombos en el ETT de control (fig. 1E). Finalmente, en el 9.° mes postictus, la paciente falleció tras una insuficiencia respiratoria secundaria a una neumonía por broncoaspiración.
Pruebas complementarias al inicio y durante el seguimiento de la paciente. A) ECG de 12 derivaciones al ingreso (transcurridas 26 h de la presentación clínica): se pone de manifiesto un ritmo de FA a 114 lpm, con ondas Q patológicas e inversión de ondas T en derivaciones precordiales V1-V4 (flechas verdes), indicando la presencia de necrosis en la pared anterior del ventrículo izquierdo y del septum interventricular. Velocidad del registro en papel=25mm/s. B) TAC craneal simple basal: se visualiza una hipodensidad con morfología de cuña corticosubcortical, en el territorio vascular de la ACA izquierda, afectando al cuerpo calloso (fecha blanca), el territorio de la arteria recurrente de Heubner, y a las regiones orbitofrontal, medial y superior del lóbulo frontal izquierdo. C) TAC craneal simple (adquirido a los 8 días del comienzo semiológico): se objetivan áreas hipodensas con zonas de transformación hermorrágica, en relación con infartos subagudos en evolución del territorio de ambas ACA (flechas blancas). Zonas oscuras: áreas de isquemia; zonas blancas: áreas de hemorragia. D) ETT al ingreso: se aprecia un área acinética en el ápex cardíaco durante la diástole, junto con una zona hiperecogénica alrededor del ápex septal interventricular, compatible con un trombo mural (flecha verde). Todo ello asocia una reducción de la fracción de eyección del ventrículo izquierdo (FEVI) hasta un 45% durante la sístole. E) ETT de control realizado en el 6.° mes de ingreso: se vislumbra una mejoría notable de la motilidad regional de la pared antero-apical del ventrículo izquierdo, que previamente se mostraba acinética durante la diástole, con una desaparición casi completa del trombo mural (flecha verde). Asimismo, se corrobora un incremento de la FEVI hasta un 60%.
VI: ventrículo izquierdo.
En la mayoría de reportes, el ictus de la ACA está más a menudo asociado con aterosclerosis de la arteria carótida interna (ACI) que con trombosis primaria de la ACA1. Por el contrario, en una serie retrospectiva de 100 pacientes coreanos con ictus de la ACA, en 68 se encontró aterosclerosis local de la ACA7. En el Lausanne Stroke Registry prospectivo suizo, 17 de 27 pacientes (63%) tenían émbolos procedentes de la ACI o del corazón8. En un estudio retrospectivo español reciente, en 23 de 51 pacientes (45,1%), el origen era cardioembólico9. La semiología difiere ampliamente entre los pacientes con ictus de la ACA; para saber integrarla dentro del proceso nosológico, se debe estar familiarizado con la topografía neuroanatómica relevante irrigada por la ACA1,8. El IAM y la enfermedad coronaria son factores de riesgo bien establecidos de desarrollar una FA, principalmente a través del remodelado auricular y/o isquemia ventricular transitoria con una sobrecarga diastólica auricular subsecuente. Sin embargo, varios estudios novedosos demuestran que, a la inversa, la FA puede conducir hacia un IAM, debido al aumento de la frecuencia cardíaca, con incremento de la demanda de oxígeno, hiperactivación simpática, disfunción endotelial y efectos proinflamatorios y protrombóticos ulteriores4-6. Si bien, por el momento, carecemos de una evidencia sólida sobre la reducción del riesgo de ictus y/o el IAM en pacientes con FA mediante la triple terapia en comparación con la anticoagulación sola, la excepción pueden ser los casos con enfermedad coronaria clínicamente evidente, particularmente el SCA, ya que casi el 20% de los pacientes con ictus isquémico relacionado con FA también presentan este tipo de dolencia cardíaca10. Hasta ahora no se han confeccionado ensayos clínicos aleatorizados (ECAs) para evaluar el tratamiento antitrombótico ideal, para la prevención de trombo mural e ictus en pacientes con SCA. Sin embargo, en un ECA abierto, que comparó warfarina, ácido acetilsalicílico o la combinación de ambos en 3.630 pacientes con IAM, seguidos por una media de 4 años, la terapia combinada redujo la variable de resultado compuesta por re-IAM e ictus isquémico tromboembólico no fatales en un 29% comparado con el grupo que sólo tomaba ácido acetilsalicílico (RR 0.71, IC 95%: 0.60–0.83; p=0.001) y en un 13% con respecto al grupo que tomaba warfarina sola (RR 0.87, IC 95%: 0.73–1.03; p=0.18), si bien en este último caso no alcanzó significación estadística y además con respecto a los otros dos grupos de estudio se asoció con un mayor riesgo de sangrado (especialmente a nivel gastrointestinal)11. Por otro lado, las recomendaciones de consenso de la Sociedad Europea de Cardiología sobre el manejo de pacientes con FA y SCA, con alto riesgo hemorrágico (HAS-BLED ≥ 3) y tromboembólico (CHA2DS2-VASc ≥ 2), son administrar triple terapia durante 4 semanas, seguida de doble terapia con anticoagulación oral (AO) y clopidogrel 75mg/día (o ácido acetilsalicílico 100mg/día) hasta el 12.° mes, y posteriormente AO de forma indefinida12,13. Tras completar una búsqueda bibliográfica exhaustiva, mediante la base de datos de acceso libre y especializada en Ciencias de la Salud, PubMed (http://www.ncbi.nlm.nih.gov/pubmed), no hemos encontrado otro caso reportado en forma de IAM e ictus de ACA bilateral como forma de comienzo de una FA. El clínico debe considerar esta posibilidad etiológica, al enfrentarse a un caso inicialmente compatible con este escenario inusual y complejo, incluso en ausencia de anomalías del sistema vascular encefálico y/o antecedentes de estados de hipercoagulabilidad, especialmente en pacientes con factores de riesgo cardiovascular, para lograr con celeridad el diagnóstico y la administración del tratamiento adecuados, disminuyendo con ello el riesgo de reembolización. Para satisfacer esta premisa diagnóstico-terapéutica, se requieren ECAs que recluten a pacientes con ictus isquémico de origen cardioembólico, con comorbilidad embolígena por FA e IAM, para hallar el esquema de triple terapia antitrombótica, con un balance de eficacia/seguridad más óptimo en este tipo de eventos ictales aditivos.
Como punto final aclaratorio, queremos hacer constar que la principal limitación diagnóstica para ayudar a filiar la etiología exacta de nuestro caso es no poder disponer de una coronariografía que nos permita refrendar de una manera más fidedigna la secuencia de acontecimientos fisiopatológicos acontecidos, dado que, por una parte, no existía una indicación clara de su utilidad como terapia de reperfusión al haber transcurrido más de 24 h de evolución clínica en el momento de la llegada de la paciente a Urgencias, y por otra parte, ante la petición de sus familiares de evitar la realización de cualquier tipo de prueba invasiva que no aportara una mejoría significativa del pronóstico en cuanto a su independencia funcional, optándose en último término, por un manejo interdisciplinar conservador.
FinanciaciónNuestro trabajo ha sido redactado libremente, sin financiación por ninguna empresa o entidad pública o privada.
Conflicto de interesesTodos los autores firmantes han aprobado la presentación de este manuscrito. No existen conflictos de intereses.
A el Dr. Juan Camilo Rodríguez Carrillo, la Dra. Clara Aguirre Hernández, el Dr. Álvaro Ximénez-Carrillo Rico, el Dr. Francisco Cabrera Valdivia y el Dr. José Tejeiro Martínez.
Trabajo presentado como e-poster en la 25th European Stroke Conference (Venecia, Italia, 14 de abril del 2016).