El origen embólico de los ictus esta bien establecido. Desde el punto de vista histopatológico, los émbolos cerebrales tienen una composición variable1. En la mayor parte de los casos estos émbolos están formados por agregados de plaquetas, fibrina y colesterol, y en menor medida por calcio. Los embolismos cálcicos han sido escasamente descritos, afectando preferentemente a la circulación anterior, aunque en la literatura se describen casos con compromiso de la arteria cerebral posterior2. El abordaje terapéutico en este tipo de pacientes es controvertido. Se han publicado casos aislados con fibrinólisis intravenosa, aunque con resultados dispares2-4. Presentamos un paciente con infarto cerebral isquémico secundario a émbolo cálcico, tratado con trombólisis intravenosa y rescate intraarterial de forma ineficaz, alertando y realizando especial hincapié en el papel que las diferentes modalidades de tratamiento fibrinolítico pueden tener en este tipo de situaciones.
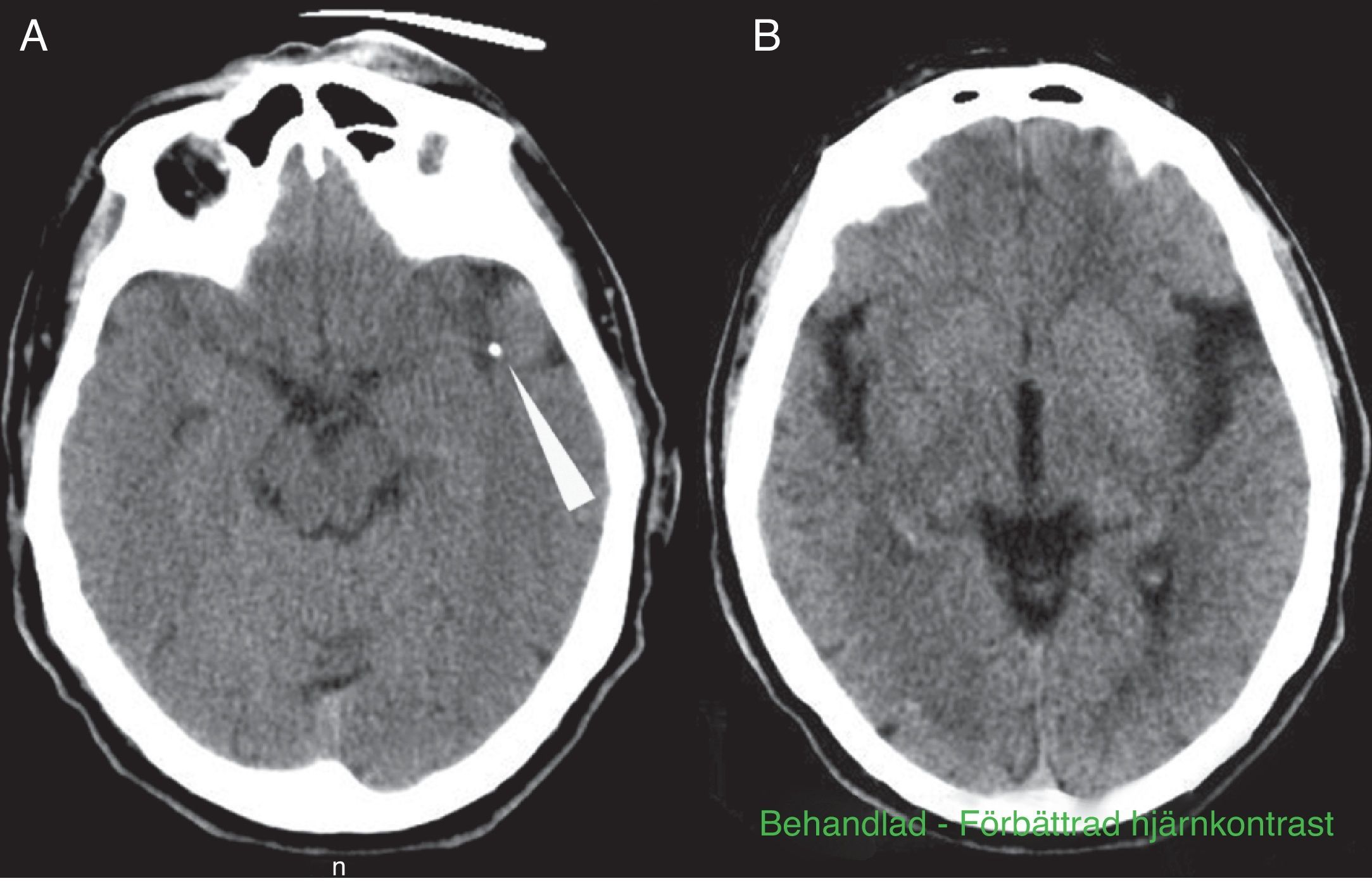
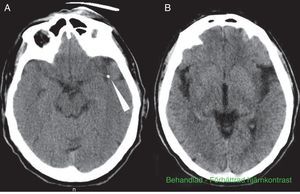
Varón de 69 años, con antecedentes de hipertensión arterial y dislipemia en tratamiento. Independiente para todo tipo de actividades (mRankin 0, I Barthel 100). Acude al servicio de urgencias por focalidad neurológica hemisférica izquierda, con hora de inicio desconocida. La última vez que se le había visto asintomático fue a las 9.30. Es encontrado a las 13.45 por los familiares en su domicilio, con menor movilidad del hemicuerpo derecho y dificultad en la expresión. Es valorado en urgencias por Neurología a las 15.40. En la exploración neurológica se constata ausencia total de expresión, con comprensión abolida y plejía hemicorporal derecha: NIHSS 21. El estudio Doppler puso de manifiesto ausencia de flujo en la ACM izquierda a una profundidad de 55mm, compatible con oclusión del segmento M1 distal. La TC craneal al ingreso demostró una imagen hiperdensa en el segmento M1 distal de la ACM izquierda y una tenue hipodensidad isquémica en la región insular y temporal izquierda ASPECTS 8 (fig. 1A y B). El estudio de TC perfusión demostró una discordancia del 60%. La angio-TC confirmó la oclusión del segmento M2 proximal y la presencia de una placa calcificada significativa en el cayado aórtico (fig. 2A y B). Se comenzó el tratamiento con tPA por vía intravenosa a las 16.05, a dosis de 0,9mg/kg, sin objetivar cambios clínicos ni neurosonológicos durante los 60 min siguientes. A los 40 min de la perfusión, se avisó a la neurorradióloga intervencionista y al servicio de Anestesia, iniciando el tratamiento intravascular de rescate a las 17.15, (unos 70 min después de haber iniciado el tratamiento fibrinolítico intravenoso). Inicialmente. y por 2 veces, se intentó extraer el trombo con un dispositivo Bonnet. Al no lograr movilizar el material obstructivo, y ante la sospecha de que se tratara de una placa calcificada in situ, se decidió hacer angioplastia con balón, dándose por finalizado el procedimiento a las 19.30, sin conseguir una adecuada recanalización del lecho distal. Tras uno de los hinchados del balón de angioplastia, se constató una extravasación de contraste (fig. 2C). Trasladado el paciente a reanimación, nos avisan a las 20.00 por bajo nivel de consciencia, anisocoria izquierda y descerebración al estímulo nociceptivo. La TC urgente demostró un gran hematoma intraparenquimatoso temporoparietal izquierdo, de unos 100 cc, con vertido ventricular, subaracnoideo y desplazamiento de la línea media (fig. 2D y E). El paciente falleció a las 20.30.
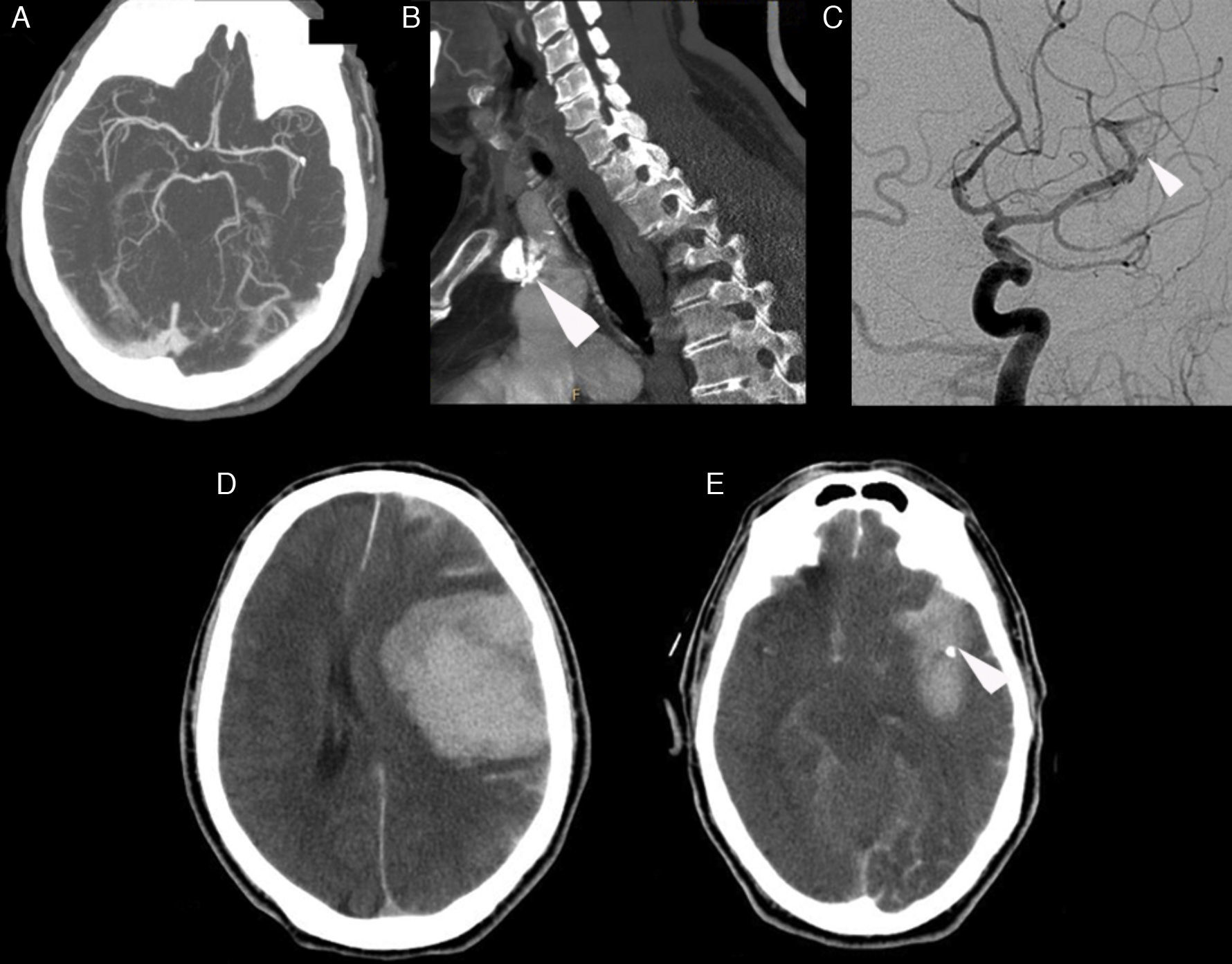
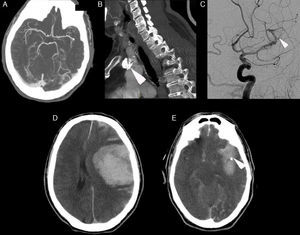
A) Angiografía por tomografía computarizada craneal mostrando oclusión segmento M2 proximal. B) Angiografía por tomografía computarizada mostrando la presencia de una placa calcificada en cayado aórtico (flecha). C) Angiografía craneal convencional mostrando repermeabilización parcial de la arteria, sin apertura del lecho distal mediante Bonnet y angioplastia, presentado extravasación de contraste (flecha). D) Tomografía computerizada craneal mostrando extenso hematoma intraparenquimatoso temporoparietal izquierdo de unos 100 cc, con vertido ventricular, subaracnoideo y desplazamiento de la línea media. E) Tomografía computarizada craneal mostrando persistencia de posible punto calcio en el segmento M1 distal/M2 proximal (flecha).
La composición de la placa de ateroma influye en el potencial embólico, de manera que diversos estudios han evidenciado un menor riesgo en las placas calcificadas respecto de aquellas que tienen una composición heterogénea y con un menor componente cálcico5. El origen de los embolismos calcios suele ser iatrogénico, sobre todo por manipulación carotídea, cateterismo cardíaco o cirugía cardíaca. La causa más frecuente de embolismos cálcicos espontáneos es la calcificación del anillo valvular mitro-aórtica6,7, aunque los émbolos también pueden proceder de placas cálcicas localizadas en la arteria carótida interna ipsolateral2,8,9, en el cayado aórtico3, o en el tronco-braquiocefálico10. En nuestro caso, consideramos la embolia cálcica procedente del cayado aórtico como el mecanismo más plausible, a tenor del resultado de las pruebas complementarias y la normalidad del resto del árbol vascular. En la TC craneal, el embolismo cálcico aparece como una o más imágenes puntiformes de densidad calcio en el interior de un vaso. Respecto del tratamiento en fase aguda en este tipo de situaciones, no hay evidencias concluyentes acerca de cuál es la mejor opción, dado el escaso número de casos publicados y la disparidad de resultados, tanto favorables2,3, como desfavorables4. En este sentido, debemos de ser conscientes y alertar sobre el hecho de que la presencia de placas con alto componente cálcico puede limitar la recanalización farmacológica o el rescate mediante dispositivos mecánicos e incrementar el riesgo de daño vascular o de rotura mecánica de la pared, siendo este último mecanismo el más verosímil para explicar la hemorragia cerebral de nuestro paciente. No obstante, a pesar de las dificultades que nos podemos encontrar a la hora extraer el trombo y del incremento de complicaciones, no debemos considerar este tipo de émbolos una contraindicación absoluta para el tratamiento fibrinolítico en ninguna de sus modalidades11. Es necesario, por otro lado, insistir en la importancia de la composición del material embólico. La cada vez más extendida utilización de dispositivos mecánicos de embolectomía nos está permitiendo obtener muestras de trombos frescos y su caracterización anatomopatológica12. El mayor conocimiento de la naturaleza del émbolo causal del evento isquémico nos permitirá estratificar riesgos, evaluando la eficacia y la seguridad de los diferentes tratamientos de recanalización, ayudándonos de esta forma a tomar una decisión final.