El infarto hemisférico maligno (IHM) constituye un tipo específico y devastador de ictus isquémico. Usualmente afecta el territorio completo de la arteria cerebral media, aunque a veces involucra además otros territorios, presentando evolución clínica frecuentemente catastrófica, cuando solo se aplica tratamiento médico convencional.
ObjetivoEl propósito de esta revisión es analizar la evidencia científica disponible sobre el tratamiento de esta entidad.
DesarrolloEl IHM tiene una morbimortalidad elevada. Clínicamente se caracteriza por deterioro neurológico temprano y síndrome hemisférico severo. Su sello distintivo es el desarrollo de edema cerebral ocupante de espacio, entre el primer y tercer día del inicio de los síntomas. El efecto de masa provoca desplazamientos, distorsiones y herniaciones de las estructuras encefálicas, aun en ausencia inicial de hipertensión endocraneal. Hasta hace pocos años, el IHM era considerado una entidad fatal e intratable, ya que la mortalidad asociada al tratamiento convencional podía superar el 80%. En este contexto desfavorable, la hemicraniectomía descompresiva ha resurgido como una alternativa terapéutica eficaz en casos seleccionados, reportándose un descenso de la mortalidad entre un 15-40%.
ConclusionesEn los últimos años diversos estudios clínicos aleatorizados han demostrado el beneficio de la hemicraniectomía descompresiva en los pacientes con IHM, la cual no solo ha disminuido la mortalidad sino que también ha mejorado los resultados funcionales.
Malignant hemispheric infarction (MHI) is a specific and devastating type of ischemic stroke. It usually affects all or part of the territory of the middle cerebral artery although its effects may extend to other territories as well. Its clinical outcome is frequently catastrophic when only conventional medical treatment is applied.
ObjectiveThe purpose of this review is to analyse the available scientific evidence on the treatment of this entity.
DevelopmentMHI is associated with high morbidity and mortality. Its clinical characteristics are early neurological deterioration and severe hemispheric syndrome. Its hallmark is the development of space-occupying cerebral oedema between day 1 and day 3 after symptom onset. The mass effect causes displacement, distortion, and herniation of brain structures even when intracranial hypertension is initially absent. Until recently, MHI was thought to be fatal and untreatable because mortality rates with conventional medical treatment could exceed 80%. In this unfavourable context, decompressive hemicraniectomy has re-emerged as a therapeutic alternative for selected cases, with reported decreases in mortality ranging between 15% and 40%.
ConclusionsIn recent years, several randomised clinical trials have demonstrated the benefit of decompressive hemicraniectomy in patients with MHI. This treatment reduces mortality in addition to improving functional outcomes.
La enfermedad cerebrovascular (ECV) es una de las causas más frecuentes de muerte e incapacidad funcional a nivel mundial1. Un estudio epidemiológico catalán que engloba ambos tipos de ECV (isquémica y hemorrágica) reveló una incidencia anual por cada 100.000 habitantes de 218 y 127 para hombres y mujeres respectivamente. La mortalidad cruda reportada a los 28 días del ictus fue del 36%, habiéndose producido la misma fuera del ámbito hospitalario en el 62,5% de los casos2.
Las consecuencias clínicas de las lesiones isquémicas cerebrales dependen de su extensión y de la elocuencia funcional del parénquima afectado3. Su morbimortalidad varía ampliamente, desde eventos clínicamente silentes, hasta grandes infartos que amenazan la vida3–5. Los infartos silvianos presentan una mortalidad del 17% al ingreso hospitalario6, mientras que en un tipo específico, denominado genéricamente «maligno», la mortalidad superaba el 80%7. Hoy día, tanto el abordaje multidisciplinario como el avance logrado en cuidados críticos, neuromonitorización, técnicas de neuroimagen y quirúrgicas han logrado un descenso drástico de la mortalidad, la cual oscila entre el 25 y el 40%5,7,8.
El concepto de «infarto cerebral maligno» fue acuñado en 1996 por Hacke et al.9 para definir un tipo muy específico de ictus isquémico, caracterizado por afectar usualmente el territorio completo de la arteria cerebral media (ACM), además de su frecuente extensión a otros territorios vasculares; causar efecto de masa secundario a edema predominantemente citotoxico y evolución clínica casi siempre catastrófica10. Su etiología más frecuente corresponde a la oclusión embólica o trombótica de la arteria carótida interna distal o del tronco principal de la ACM (segmento M1), los cuales rara vez alcanzan la recanalización ya sea espontánea o tras la administración travenosa de factor activador del plasminógeno tisular5,7–9.
Aunque este tipo de infartos representan menos del 10% de los ictus isquémicos supratentoriales5,7–9, el enorme impacto en términos de mortalidad y calidad de vida han condicionado la búsqueda de estrategias terapéuticas alternativas. En la última década diversos grupos de investigación demostraron excelentes resultados en modelos experimentales de isquemia con el uso de hipotermia moderada10, los cuales no pudieron confirmarse en el terreno clínico11–15.
Por otro lado, estudios aleatorizados recientemente finalizados han establecido el beneficio de la hemicraniectomía descompresiva (HCD), en términos de supervivencia y resultados funcionales16–19.
El propósito de esta revisión es analizar en forma crítica y racional las opciones disponibles para el tratamiento del infarto hemisférico maligno (IHM).
Fisiopatología del infarto hemisférico malignoEl sustrato fisiopatológico distintivo del IHM es el edema cerebral, que se manifiesta usualmente entre el primer y tercer día luego del inicio de los síntomas20, ejerciendo efecto de masa, compresión, distorsión y herniación de las estructuras cerebrales los cuales ocasionan deterioro del estado neurológico que pueden llevar a la muerte5,7–9. Desde el punto de vista fisiopatológico, el descenso crítico del flujo sanguíneo cerebral en el territorio isquémico compromete el normal funcionamiento en las membranas celulares de la bomba Na+/K+ ATPasa, ocasionando la acumulación intracelular de sodio y agua, generando edema citotóxico7,21,22. En esta fase temprana de incremento del volumen cerebral no hay componente añadido proveniente del espacio intravascular. Por otra parte, la isquemia incrementa la permeabilidad de la barrera hematoencefálica, permitiendo la acumulación extracelular de fluidos, incrementando el volumen del tejido afectado (edema vasogénico)7,21,22. En consecuencia, tanto el edema citotóxico como el vasogénico están presentes en el IHM. El aumento del volumen del parénquima cerebral incrementa las presiones tisulares, compromete el normal funcionamiento de la vasculatura y altera tanto el metabolismo como la autorregulación cerebral, cerrando un círculo vicioso que perpetúa y agrava el daño isquémico7,21,22.
Finalmente, aunque solo en algunos casos, la pérdida de integridad de las células endoteliales permite el paso de macromoléculas y hematíes al espacio intersticial, originando transformación hemorrágica del tejido isquémico7,21,22.
Infartos «malignos» de la arteria cerebral media: definición, criterios diagnósticosHacke acuño el término «infarto maligno» debido a la elevada mortalidad (cercana al 80%) de estos infartos, aun con tratamiento médico máximo y optimizado9. A pesar de que han pasado más de 15 años, aun no disponemos de una definición consensuada, validada y de aceptación universal. Clínicamente se caracteriza por deterioro progresivo del estado de consciencia y déficits neurológicos severos, conjuntamente con evidencia imagenológica de compromiso isquémico de gran magnitud (>50% del territorio de la ACM)5,7–9,22,23. Los parámetros antedichos fueron tomados como criterios de inclusión en los diferentes estudios clínicos que evaluaron aleatoriamente la utilidad de la HCD16,17,19. En dichos ensayos clínicos, la definición de IHM incluyó el examen clínico (puntuación en la escala de coma de Glasgow y/o en la escala del Instituto Nacional de Salud americano [NIH]), conjuntamente con la evaluación de la extensión del tejido cerebral isquémico observado en la neuroimagen (tomografía computarizada y/o resonancia magnética craneal)16,17,19.
¿Cómo predecir la evolución a malignidad de un infarto de arteria cerebral media?En la evaluación de pacientes con infartos masivos de la ACM resulta esencial la evaluación clínica y el análisis de las neuroimágenes. Ambos parámetros brindan los datos necesarios para adoptar precozmente las conductas más apropiadas. A continuación detallaremos los factores predictivos de mayor relevancia, los cuales resumimos en la tabla 1.
Infarto de arteria cerebral media. Predictores clínicos-radiológicos de evolución a malignidad
| Predictores clínicos | Predictores radiológicos |
|---|---|
| Edad | >50% compromiso del territorio de la ACM |
| Hipertensión arterial | Volumen de infarto>82cm3Insuficiencia cardiaca >5mm desviación línea media |
| Altas puntuaciones en escala NIH | Afectación simultánea de otros territorios vasculares |
| Depresión consciencia | |
| Náuseas y vómitos | |
| Asimetría pupilar | |
| Fiebre |
En primer lugar, cobran importancia ciertos antecedentes, entre los que se destacan historia previa de insuficiencia cardiaca, hipertensión arterial, cardiopatía isquémica y fibrilación auricular8,24–26.
En el examen clínico los factores demográficos de mayor poder predictivo son la edad y, en menor medida, el sexo femenino8,27, mientras que en la evaluación neurológica inicial, la puntuación en la escala de ictus del Instituto de Salud americano (NIHSS) o en el Glasgow se encuentran estrechamente relacionados con la evolución clínica intrahospitalaria, el pronóstico vital y funcional tanto a corto como a largo plazo25. El riesgo de deterioro temprano del estado de consciencia y morbimortalidad es especialmente elevado en los pacientes con una puntuación en la escala NIHSS dentro de las primeras 6h después del inicio de los síntomas (≥20 cuando el compromiso es del hemisferio izquierdo y ≥15 cuando es del derecho)8,25. Los hallazgos semiológicos característicos del infarto completo de la ACM incluyen desviación conjugada de la mirada, déficits motores y sensitivos severos, afasia global en infartos de hemisferio dominante y desatención cuando el hemisferio derecho está comprometido. La presencia de debilidad severa de la pierna sugiere infarto de las estructuras subcorticales irrigadas por la ACM (cápsula interna) o compromiso simultáneo del territorio de la arteria cerebral anterior. Oclusión de la arteria carótida intracraneal con isquemia frontal extensa debe sospecharse en casos en los que el paciente presente trastornos tempranos en el nivel de la conciencia, los cuales pueden ser fluctuantes28–31. Náuseas, vómitos o hipertermia dentro de las 24h del inicio de los síntomas son premonitorios de edema maligno7,24,25.
Se han descrito ciertos marcadores bioquímicos con capacidad de predecir evolución maligna, entre los que se encuentran: hiperglucemia32, leucocitosis (>10.000 leucocitos/mm3)24, fibronectina, metaloproteinasa de matriz extracelular-933 y proteína S10034.
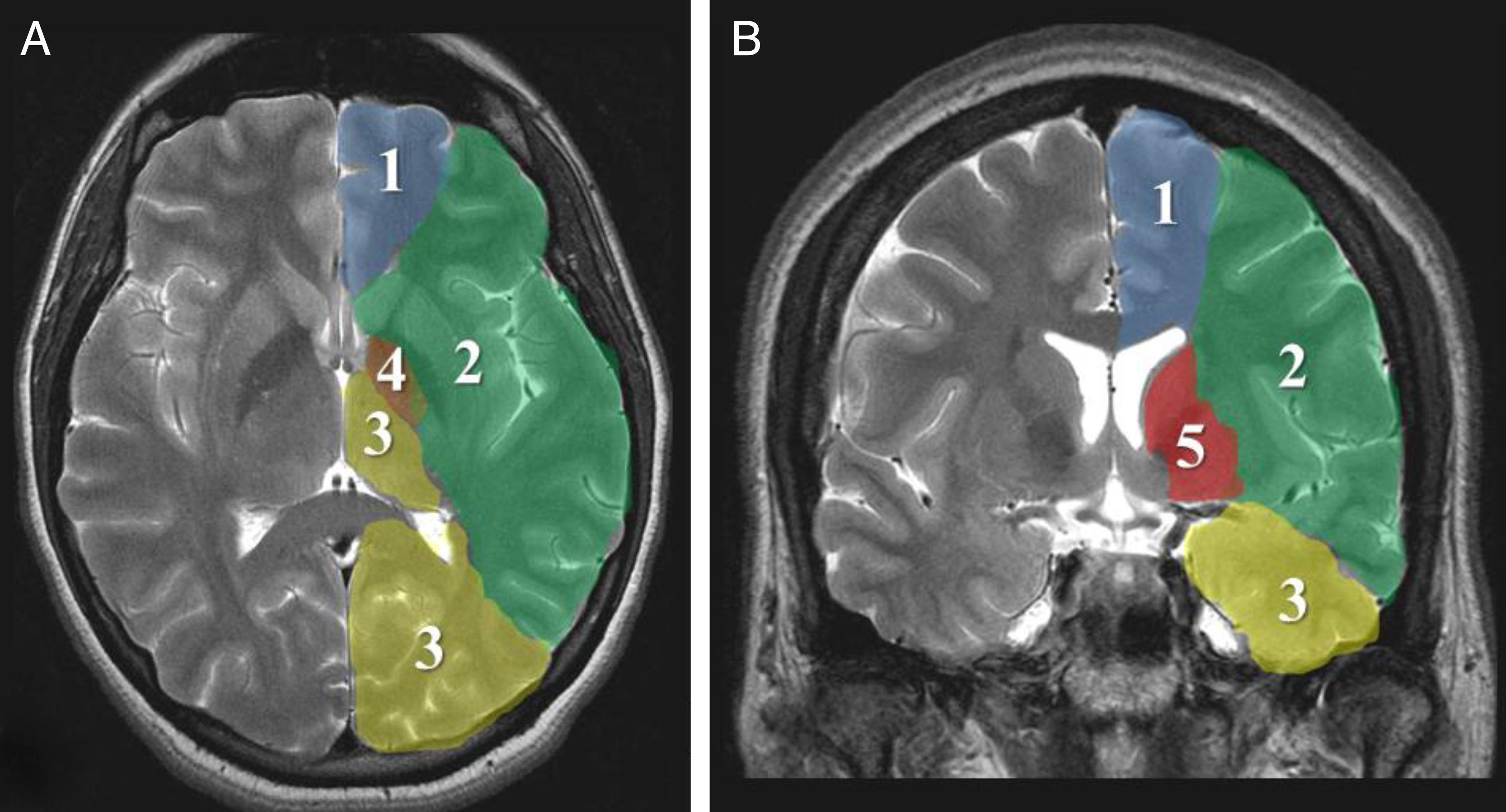
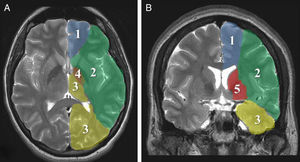
Parámetros imagenológicosLa evolución «maligna» del ictus isquémico está relacionada con el compromiso extenso del territorio de la ACM, incluyendo tejidos profundos perfundidos por ramas lenticuloestriadas (fig. 1). La oclusión simultánea de otros territorios vasculares (cerebral anterior, posterior y coroidea anterior) triplica el riesgo de edema maligno26.
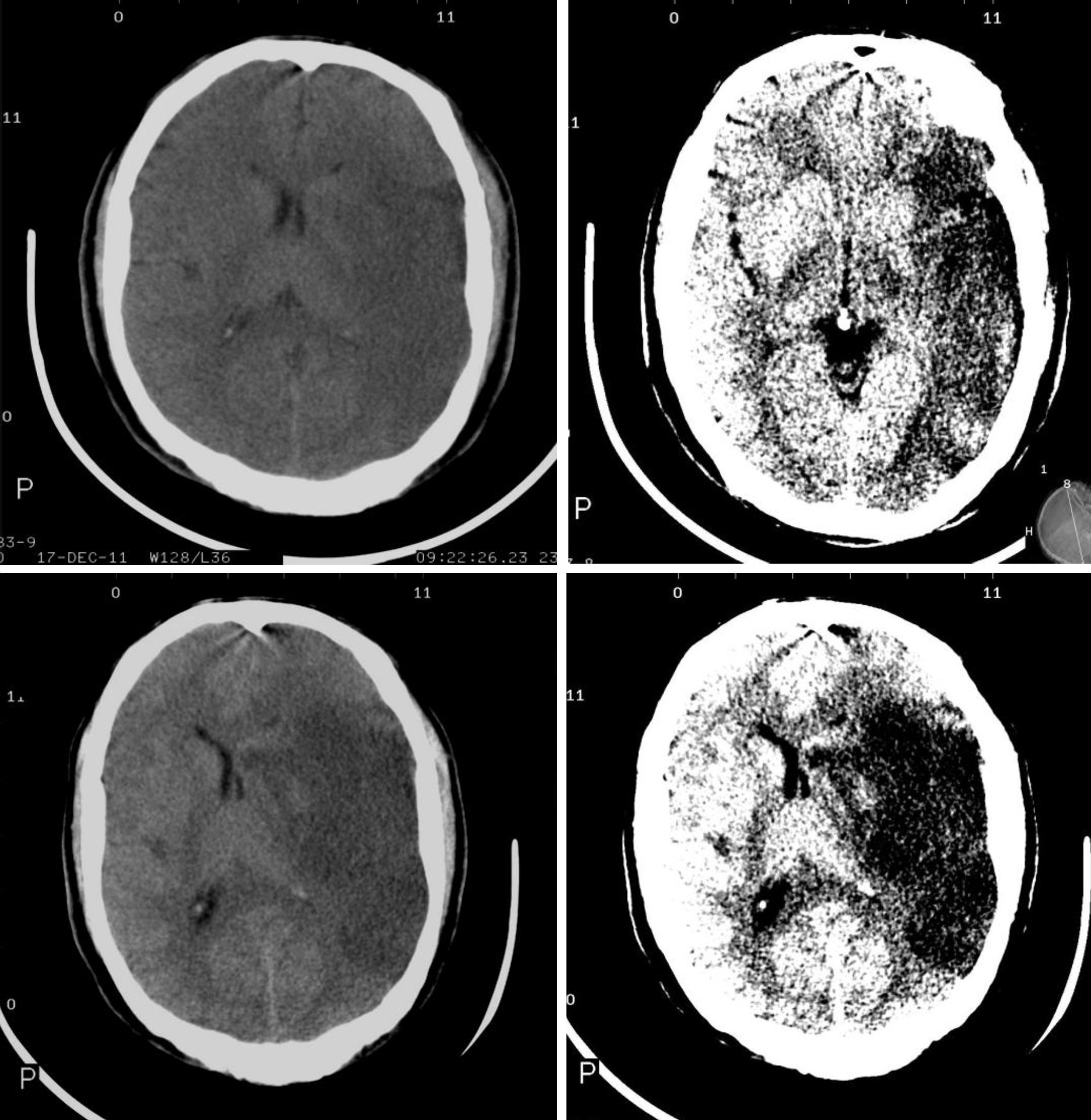
Los signos tomográficos de mayor poder predictivo de evolución hacia malignidad son: compromiso de más de 2 tercios del territorio de la ACM, afectación simultánea de otros territorios vasculares (anterior, posterior) o desplazamiento de la línea media7,8,26,27,35 (fig. 2).
Aunque la tomografía computarizada sin contraste es la técnica empleada con mayor frecuencia en la evaluación inicial del ictus agudo36, el aumento de la disponibilidad de la resonancia magnética nuclear ha incrementado las posibilidades de conocer con más certeza la fisiopatología de esta entidad. Las secuencias de difusión (DWI-ADC) son mucho más sensibles a cambios isquémicos hiperagudos producidos por la falla de la bomba Na+/K+ ATPasa37–39. El cálculo de volumen de tejido cerebral que demuestra restricción de la difusión permite pronosticar un eventual deterioro del estado de consciencia y la probabilidad de herniación cerebral37–39 Oppenheim et al.40 demostraron que un volumen de tejido isquémico mayor de 145cm3 identificaba casi el 100% de los pacientes que subsecuentemente sufrieron deterioro del estado de consciencia. Estudios recientes utilizando puntos de corte menores (82–89cm3) han evidenciado una sensibilidad ligeramente inferior (85%), mientras que la especificidad es cercana al 95%, aun si el estudio es realizado dentro de las primeras 2 a 6h del inicio de los síntomas37,41.
Siguiendo preceptos fisiológicos, la tolerancia al aumento del volumen del tejido cerebral debido a edema es mayor en presencia de grandes espacios subaracnoideos. Los pacientes añosos con atrofia cerebral toleran más los incrementos de volumen, a diferencia de los pacientes jóvenes, cuya principal causa de muerte en esta entidad es las herniación cerebral dentro de la primera semana del evento27,29. Los cambios volumétricos del tejido cerebral han sido ampliamente estudiados en pacientes con ictus. En individuos con oclusión de la arteria carótida interna o tronco principal de la ACM en el momento de la admisión hospitalaria, el volumen del líquido cefalorraquídeo (LCR), y en particular la relación volumen sanguíneo cerebral/LCR, puede predecir el curso maligno. Específicamente la relación volumen sanguíneo cerebral/LCR inferior a 0,92 fue un factor predictivo de deterioro clínico con una sensibilidad del 96,2% y una especificidad del 96,2%42.
Otros estudios de imagen utilizados son la tomografía o resonancia magnética con análisis de perfusión, PET y SPECT. Sin embargo, estas modalidades diagnósticas permanecen mayormente limitadas al campo experimental5,43.
NeuromonitorizaciónLal monitorización de la presión intracraneal (PIC) no es un buen predictor de deterioro neurológico ni de evolución a infarto maligno, ya que solo se encuentra elevada en no más del 25% de los casos44,45. Recientemente la monitorización multimodal ha aportado nueva información. Una presión tisular de oxígeno<10,5mmHg predice evolución a malignidad con un 94% de sensibilidad y un 100% de especificidad8,43. En microdiálisis, los niveles de glutamato, glicerina y lactato se incrementan en el área que subyace al infarto8,43. Estas y otras técnicas como el electroencefalograma continuo y la detección de diseminación cortical de despolarizaciones (spreading depression) se encuentran en plena fase de desarrollo8.
Tratamiento neurointensivoNeuroprotección fisiológicaLa terapia médica del IHM, como en otras situaciones de daño cerebral agudo, debe estar dirigida a evitar «daños secundarios», definidos como aquellas condiciones nocivas sistémicas o intracraneales, capaces de empeorar la lesión primaria3,36,46 (tabla 2).
Daños secundarios que suelen empeorar la lesión isquémica cerebral primaria
| Sistémicos | Intracraneales |
|---|---|
| Hipotensión arterial | Hipertensión endocraneal |
| Hipoxemia | Hematomas cerebrales tardíos |
| Hipercapnia | Edema cerebral |
| Hipocapnia severa | Hiperemia cerebral |
| Fiebre | Vasoespasmo |
| Hiponatremia | Convulsiones |
| Hipoglucemia | |
| Hiperglucemia | |
| Anemia severa | |
| Acidosis | |
| Coagulación intravascular | |
| SRIS |
SRIS: síndrome de respuesta inflamatoria sistémica.
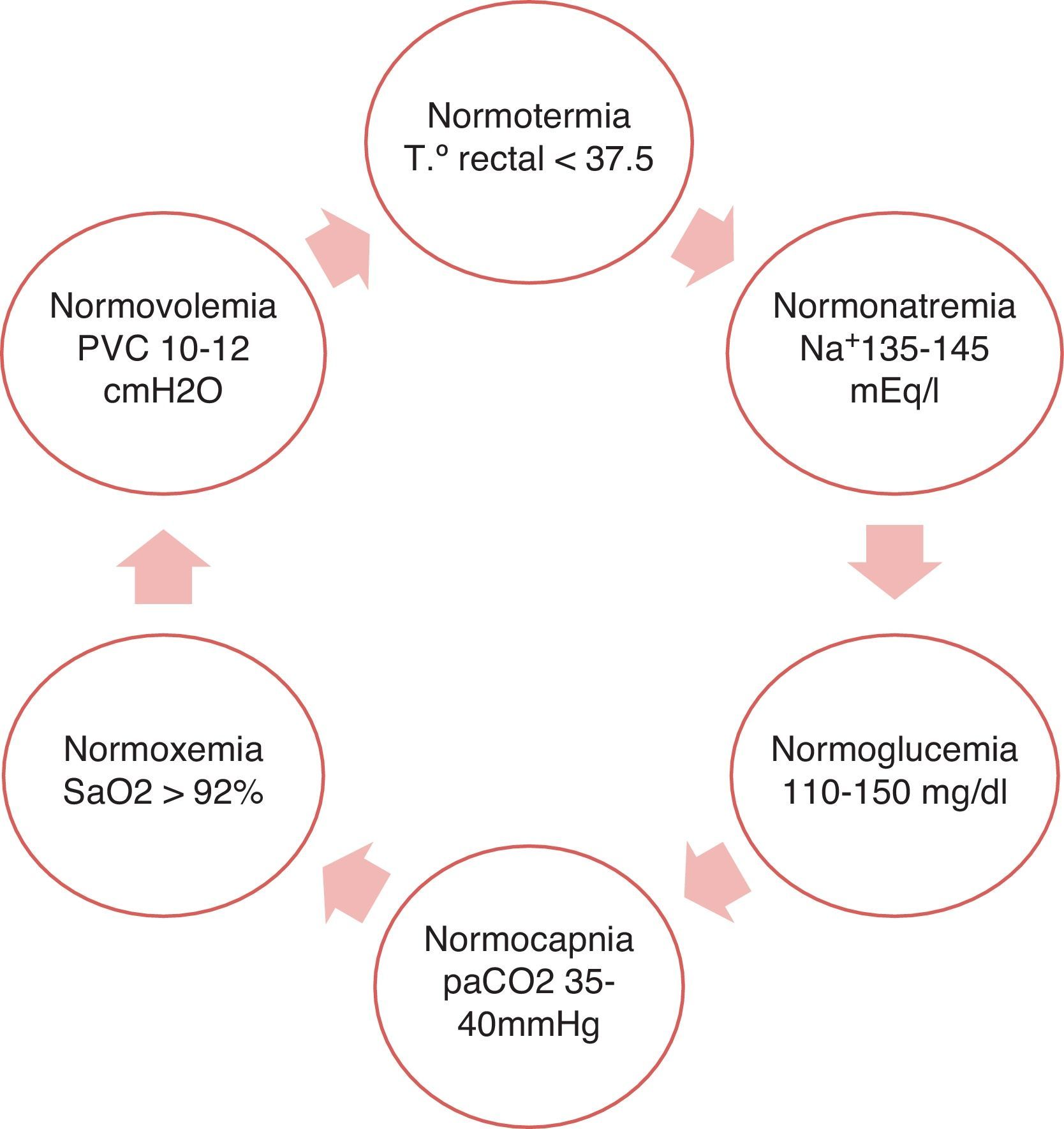
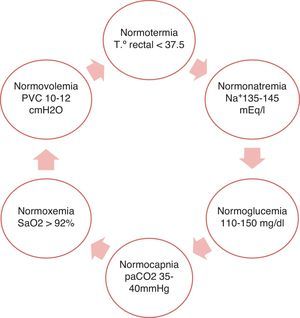
Dicho objetivo se cumple con el logro del equilibrio fisiológico a través de la regla de las 6N2. (fig. 3).
Con respecto a la tensión arterial, las recomendaciones en nada difieren al resto de las víctimas de ictus isquémico3,36,46. En el posoperatorio de HCD se sugiere mantener cifras de tensión sistólica entre 140-160mmHg para minimizar los riesgos de sangrado36.
No deben olvidarse medidas generales comunes a pacientes críticos tales como profilaxis del sangrado digestivo, de la enfermedad tromboembólica, soporte nutricional, etc.3,36,46.
Recanalización del vaso ocluidoLa trombolisis intravenosa dentro de la ventana estrecha de tiempo que se extiende hasta las 4,5h del inicio de los síntomas es el único tratamiento disponible que cuenta con evidencia clase I47, recordando que el ECASS III no incluyó a pacientes con puntuación en la escala del NIH mayor a 2548. La pronta restauración de la circulación puede disminuir tanto el tamaño del infarto como el área de edema, con lo cual es posible, al menos en teoría, prevenir la evolución hacia malignidad47,48. Las tasas de recanalización tras la administración del activador tisular del plasminógeno son bajas en casos de oclusiones de grandes arterias como la carótida interna o el tronco principal de la ACM49. Trombolisis intraarterial y técnicas endovasculares de embolectomía pueden alcanzar grados mayores de recanalización, aunque estas modalidades no han sido probadas en ensayos clínicos aleatorizados y controlados49.
Terapia específica antiedemaEs fundamental la aplicación de principios básicos de cuidados neurocríticos como evitar la administración de fluidos hipotónicos (dextrosa 5%, Ringer lactato) e hipoventilación, ya que la hiponatremia y la hipercapnia exacerban el edema cerebral3,50. La cabeza debe mantenerse en posición neutra (no flexionada ni extendida) pero existe controversia sobre si es preferible mantenerla en un grado de elevación o en posición plana. La elevación a 30° favorece el drenaje venoso y del LCR y adicionalmente disminuye la posibilidad de microaspiraciones de contenido gástrico2,48. Estudios clínicos en pacientes con IMACM sugieren que tanto la presión de perfusión cerebral como las velocidades medias en el Doppler transcraneal son mayores en posición horizontal (0°)51,52.
El análisis detallado de las opciones disponibles para tratar el edema cerebral que se produce tras la isquemia escapa del objetivo de la presente revisión, sin embargo, todas y cada una de las medidas terapéuticas disponibles tienen características en común que deben sopesarse antes de decidir su utilización3,50:
- •
La mayoría necesitan preservación de la fisiología cerebrovascular (autorregulación, reactividad al CO2, permeabilidad intacta de la barrera hematoencefálica).
- •
Los efectos terapéuticos generalmente son transitorios y limitados.
- •
Pueden tener el efecto contrario al buscado.
- •
Su suspensión puede ocasionar el efecto contrario (rebote).
- •
Potencialmente pueden desencadenar efectos indeseables severos y aun letales.
- •
Su empleo no tiene evidencia científica sólida según los cánones de la medicina basada en la evidencia53,54.
Algunos conceptos específicamente vinculados al manejo del IHM merecen ser subrayados5,6,50,55–58. La hiperventilación se debe reservar para situaciones de urgencia, como la aparición de signos clínicos de herniación, y debe ser utilizada moderadamente (PCO2 30-48mmHg) durante periodos breves para evitar empeoramiento de la isquemia por exceso de vasoconstricción5,8,49,55–58. Los agentes osmoterapéuticos que pueden utilizarse son el manitol, el glicerol, y las soluciones salinas hipertónicas. Estas últimas tienen la ventaja de requerir menor volumen de infusión y son preferibles en pacientes con daño renal, en quienes el manitol no es recomendable5,7,8,49,55–58. Aunque los estudios comparativos entre solución salina hipertónica y manitol son escasos, ambas opciones pueden alcanzar eficacia similar si son administradas en concentraciones equimolares5,7,8,49,55–58. El uso de soluciones salinas hipertónicas en concentración superior al 3% requiere vía venosa central y su uso debe ser cuidadosamente monitorizado en pacientes con cardiopatía congestiva5,7,8,49,55–58. El coma barbitúrico debe ser reservado para los casos más refractarios, siendo su valor cuestionable debido a la elevada tasa de graves complicaciones5,7,8,49,55–58. Los corticoides no tienen lugar en el tratamiento del edema isquémico5,7,8,56–58.
Con respecto a la hipotermia, si bien son conocidos sus efectos neuroprotectores, pocos estudios han sido dirigidos a su utilización en casos de IHM. Los ensayos clínicos aleatorizados que han comparado hipotermia moderada (33°C durante 24h) con tratamiento médico estándar en ictus isquémico severo, aunque no limitado a pacientes con patrón «maligno», han sido estudios de fase temprana, según los cuales no es posible llegar a conclusiones firmes59,60. Debido a la elevada tasa de neumonías en ICTuS-L60 y a la ausencia de beneficio funcional59,60, el uso de hipotermia en IHM debe permanecer limitado a ensayos clínicos.
La hipotermia fue comparada con HCD en una cohorte de pacientes con grandes infartos61. En este estudio, 36 individuos fueron tratados de acuerdo al hemisferio afectado: pacientes con infarto en hemisferio dominante fueron tratados con hipotermia moderada, mientras que aquellos con infartos de hemisferio no dominante recibieron HCD. Entre ambos grupos no hubo diferencias en cuanto a la edad, estatus neurológico valorado a través de la escala del NIH o el volumen del área infartada. La mortalidad fue significativamente mayor en el grupo hipotermia (47 vs. 12%) debido principalmente a hipertensión endocraneal refractaria61.
Se ha sugerido que la hipotermia podría combinarse con HCD, ya que ambas modalidades actúan de manera distinta y por ende sus efectos benéficos podrían potenciarse62. En una serie pequeña de 25 pacientes sometidos a HCD, en 12 de ellos se indujo a posteriori hipotermia moderada (35°)62. Si bien no hubo diferencias de mortalidad entre los grupos, se evidenció una tendencia a mejores resultados funcionales a los 6 meses (evaluados por las escalas de Barthel y del NIH) en el grupo tratado con hipotermia62.
En conclusión, la eficacia de la hipotermia necesita evaluación en estudios de mayor escala y cuidado diseño. El ensayo DEPTH-SOS se encuentran actualmente en ejecución63.
Monitorización de presión intracraneal: ¿sí o no?La incidencia precoz de hipertensión endocraneal en pacientes con IHM no supera el 25%, y en la mayoría de los casos el deterioro clínico ocurre en ausencia de niveles elevados de PIC44. Poca et al. relacionaron los valores de PIC mediante monitorización parenquimatosa del hemisferio isquémico con el desarrollo de alteraciones pupilares y hallazgos en las neuroimágenes45. La PIC permaneció normal en el 63% de los pacientes con desviación de línea media mayor de 5mm (6,7±2mm) y volumen de tejido infartado ≥241,3±83cm3 e incluso en 2 pacientes con anisocoria45.
Schwab et al. reportaron una serie de pacientes en donde el tratamiento de hipertensión endocraneal seguía un protocolo estandarizado con monitorización de PIC y medidas convencionales64. La terapéutica médica fue ineficaz y los signos clínicos de herniación precedían al incremento de la PIC, la cual no es un buen predictor de deterioro en estos pacientes64.
La monitorización de la PIC puede tener valor en determinadas circunstancias65: a) cuando el equipo tratante decide tratamiento médico; en estos casos los valores de PIC pueden guiar la terapéutica a utilizar y ayudar a evaluar la respuesta a la misma (hiperventilación, osmoterapia; etc.); b) en situaciones donde el examen clínico está restringido debido a los efectos anestésicos o la sedoanalgesia durante ventilación mecánica; c) postoperatorio; aquí cambios súbitos en la PIC pueden señalar hemorragias por descompresión, acumulación de sangre extraaxial, o empeoramiento del efecto de masa por hemicraniectomía insuficiente65.
Otros métodos de monitorización como la presión tisular de oxígeno podrían aportar información valiosa para ayudar en la toma de decisiones basadas en la fisiopatología de la enfermedad5. La monitorización tomográfica o por sonografía dúplex seriada de la desviación de línea media son herramientas útiles que deberían considerarse en el control evolutivo de este grupo de pacientes66.
Descompresión quirúrgica: efectividad clínicaLa HCD es una técnica quirúrgica destinada a incrementar el volumen de la cavidad craneal, permitiendo que el cerebro edematoso se expanda en forma excéntrica, evitando compresión del tronco encéfalo, disminuyendo la PIC, e incrementado el flujo sanguíneo cerebral y la oxigenación tisular.
Los estudios clínicos que evaluaron HCD demostraron consistentemente que los efectos a corto y mediano plazo son benéficos. Sin embargo, la controversia subsiste en cuanto a los resultados funcionales alcanzados.
Tres estudios europeos multicéntricos, aleatorizados, controlados, analizaron los efectos de HCD en IHM, 2 de los cuales finalizaron prematuramente por baja tasa de reclutamiento y por diferencias significativas en la mortalidad a favor del grupo quirúrgico17,19.
El estudio DECIMAL incluyó a 38 pacientes intervenidos dentro de las 30h del inicio de los síntomas. La mortalidad al año del ictus se redujo un 52,8%19, mientras que el DESTINY, con solo 32 pacientes, demostró una reducción absoluta de la tasa de mortalidad del 41%17.
En 2009 fueron publicados los resultados del estudio HAMLET, el cual aleatorizó a 64 pacientes dentro de las 96h luego del inicio de los síntomas16. Aunque no hubo diferencias en el estado funcional entre los grupos, los individuos sometidos a HCD dentro de las 48h iniciales tuvieron mayor beneficio. El análisis grupal de los estudios HAMLET, DESTINITY y DECIMAL18 demostró que el 75% de los pacientes sometidos a HCD alcanzaron una mRS≤4, en comparación con un 24% en el grupo tratado médicamente. Es posible que el beneficio funcional se deba a que se evita mayor compromiso de la microcirculación en el área de penumbra por el efecto de masa regional. Sin embargo, se necesitan estudios adicionales para determinar los mecanismos que permiten una mejor recuperación neurológica en pacientes operados67–71.
La edad es el principal predictor del resultado funcional después de HCD67–69. Una revisión sistemática que comparó los resultados clínicos en pacientes mayores y menores de 60 años demostró diferencias significativas en mortalidad (51,3 vs. 20,8%) y tasas de discapacidad severa (81,8 vs. 33,1%) en favor de los más jóvenes67. Recientemente se publico un estudio de China, prospectivo, aleatorizado que incluyo a 47 pacientes hasta 80 años de edad. Más de la mitad de los que fueron sometidos a HCD (n=29) tenían más de 60 años (61-78). Los resultados mostraron un beneficio franco en el grupo quirúrgico en términos de mortalidad y resultados funcionales. Al analizar el subgrupo de individuos de más de 60 años, los resultados fueron similares72. Actualmente se encuentra en desarrollo el ensayo DESTINY II cuyo objetivo es determinar el valor de HCD específicamente en pacientes entre 60 y 75 años73.
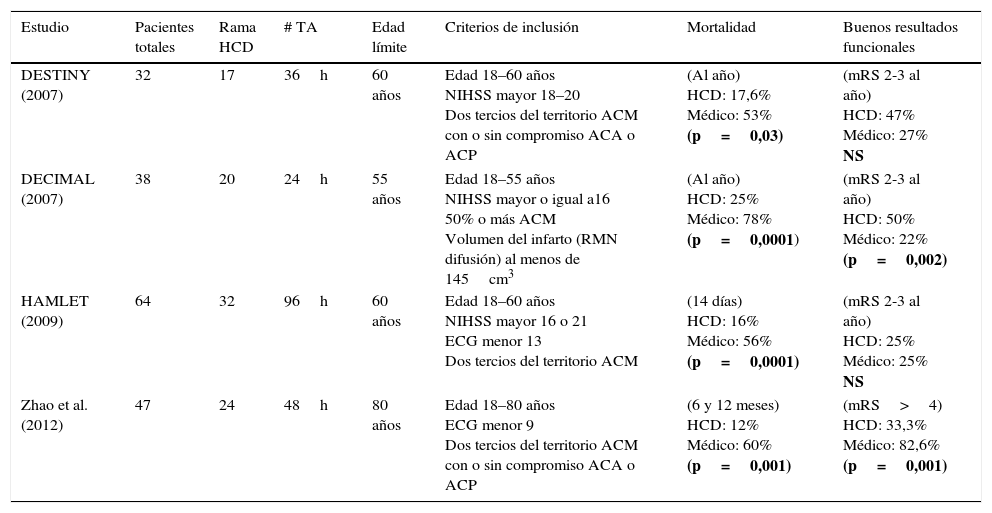
La comparación de las características principales de los estudios aleatorizados que valoraron HCD en IHM, puede observarse en la tabla 3.
Características de los estudios aleatorizados y publicados que efectuaron HCD en IMACM
| Estudio | Pacientes totales | Rama HCD | # TA | Edad límite | Criterios de inclusión | Mortalidad | Buenos resultados funcionales |
|---|---|---|---|---|---|---|---|
| DESTINY (2007) | 32 | 17 | 36h | 60 años | Edad 18–60 años NIHSS mayor 18–20 Dos tercios del territorio ACM con o sin compromiso ACA o ACP | (Al año) HCD: 17,6% Médico: 53% (p=0,03) | (mRS 2-3 al año) HCD: 47% Médico: 27% NS |
| DECIMAL (2007) | 38 | 20 | 24h | 55 años | Edad 18–55 años NIHSS mayor o igual a16 50% o más ACM Volumen del infarto (RMN difusión) al menos de 145cm3 | (Al año) HCD: 25% Médico: 78% (p=0,0001) | (mRS 2-3 al año) HCD: 50% Médico: 22% (p=0,002) |
| HAMLET (2009) | 64 | 32 | 96h | 60 años | Edad 18–60 años NIHSS mayor 16 o 21 ECG menor 13 Dos tercios del territorio ACM | (14 días) HCD: 16% Médico: 56% (p=0,0001) | (mRS 2-3 al año) HCD: 25% Médico: 25% NS |
| Zhao et al. (2012) | 47 | 24 | 48h | 80 años | Edad 18–80 años ECG menor 9 Dos tercios del territorio ACM con o sin compromiso ACA o ACP | (6 y 12 meses) HCD: 12% Médico: 60% (p=0,001) | (mRS>4) HCD: 33,3% Médico: 82,6% (p=0,001) |
ACA: arteria cerebral anterior; ACM: arteria cerebral media; ACP: arteria cerebral posterior; ECG: escala coma de Glasgow; h: horas; HCD: hemicraniectomía descompresiva; IMACM: infarto maligno arteria cerebral media; mRS: escala de Rankin modificada; NIHSS: escala de ictus del Instituto de Salud americano; RMM: resonancia magnética nuclear; TA: tiempo aleatorización.
La HCD ha sido adoptada en la práctica de manera muy limitada. A pesar de la difusión de sus indicaciones dentro de las recomendaciones de la Organización Europea de Ictus, la utilización de este tratamiento permanece muy baja; en un estudio solo un 10% de los pacientes fueron tratados con cirugía74. Esto posiblemente refleja la creencia de que los pacientes intervenidos tendrán pobre función neurológica y deficiente calidad de vida, a pesar de que los ensayos clínicos aleatorizados hasta la fecha han evidenciado lo contrario70,75. Diferentes estudios han dividido arbitrariamente el pronóstico funcional de los pacientes como bueno (mRS≤3) o pobre (mRS≥4) con el fin de realizar análisis dicotómicos. Sin embargo, se ha demostrado que los pacientes con puntuación en la mRS de 4, a pesar de presentar limitaciones para la subsistencia independiente, pueden desenvolverse en un entorno social en la medida que cuenten adecuado soporte de sus allegados70,75,76.
En cuanto a la calidad de vida, en varios estudios se logró demostrar una relación positiva entre HCD y movilidad, manejo en el hogar, cuidado corporal e independencia para tareas habituales77–81. Aunque la mayoría de los pacientes con IHM presentan secuelas que impiden el normal desempeño en la vida cotidiana, los índices de calidad de vida son mejores en los pacientes que fueron sometidos a HCD16,77. Esto se ve reflejado en la proporción de pacientes que brindarían su consentimiento retrospectivo, es decir, que al presentársele el cuadro clínico preoperatorio y con el conocimiento del estado funcional actual, autorizarían la realización de la descompresión quirúrgica77–81. Hofmeijer et al. encontraron que aunque 22 de los 38 sobrevivientes tenían una mRS de 4 o 5, 21 de ellos reportaron estar satisfechos con el manejo recibido16.
Por todo lo anterior, siempre antes de la propuesta quirúrgica debe ofrecerse una amplia y adecuada información según la mejor evidencia disponible con el fin de promover un adecuado entendimiento de los beneficios reales del procedimiento y de que es posible que el paciente pueda requerir cuidados especiales de por vida.
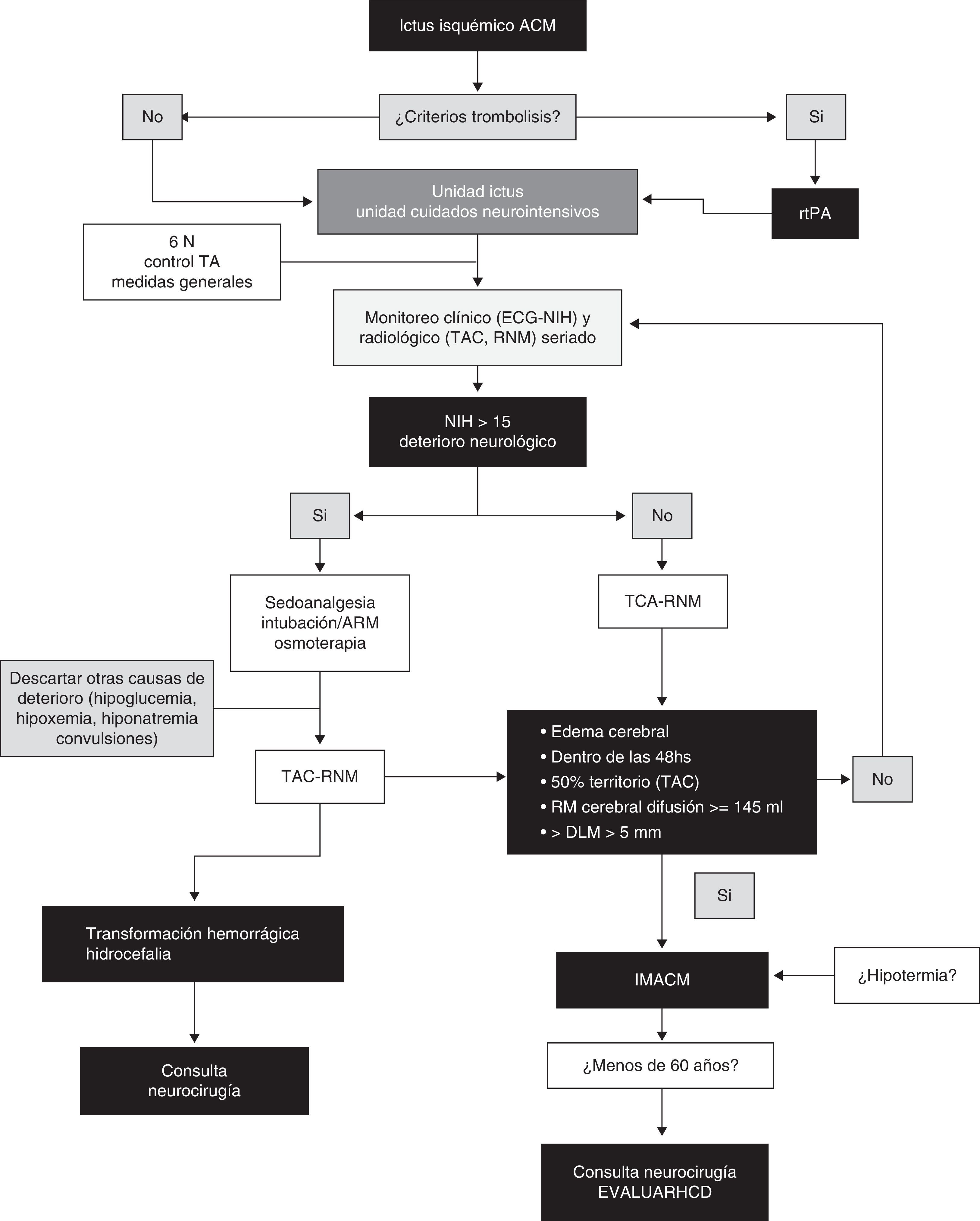
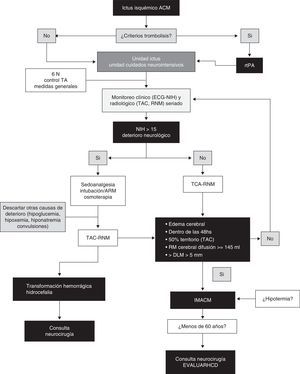
ConclusionesLa característica principal del IHM es el edema cerebral con efecto de masa, siendo el factor de mayor poder predictivo el tamaño del mismo en la neuroimagen. El efecto de masa con herniación lateral es la causa del deterioro clínico y usualmente no está asociada a hipertensión intracraneal por lo que la monitorización de la PIC no es una medida confiable para la identificación de herniación. La HCD disminuye la mortalidad significativamente y mejora los resultados funcionales en casos seleccionados en comparación con el manejo médico conservador. Sin embargo, es importante mencionar que la mayor parte de los sobrevivientes permanece con discapacidad moderada o severa por lo que la percepción de la calidad de vida por parte de los sobrevivientes sometidos a HCD requiere más investigación. Existen en desarrollo estudios evaluando distintos aspectos de la HCD para establecer con mayor precisión el momento ideal de la cirugía, sus indicaciones, contraindicaciones, grupos etarios óptimos y el impacto de las complicaciones inherentes a la intervención. Asimismo, aunque el papel de la monitorización multimodal y la combinación de HCD con hipotermia parecen prometedores, requieren más evaluación. Finalmente, la piedra angular en el tratamiento de estos pacientes es el equipo multidisciplinario. Delineamos a manera de sugerencia un algoritmo de manejo, reflejado en la figura 4.
Algoritmo práctico sugerido para la toma de decisiones en IMACM.
ACM: arteria cerebral media; ARM: asistencia respiratoria mecánica; DLM: desviación de línea media; ECG: escala coma de Glasgow; HCD: hemicraniectomía descompresiva; IMACM: infarto maligno arteria cerebral media; NIH: escala del Instituto de Salud americano; RMN: resonancia magnética nuclear; rtPA: activador tisular del plasminógeno; TA: tensión arterial; TAC: tomografía axial computarizada.
Los autores declaran no tener ningún conflicto de interés.