La citotoxicidad del líquido cefalorraquídeo (LCR) de pacientes con esclerosis lateral amiotrófica en cultivos celulares que incluyen neuronas puede plantearse como un mecanismo de difusión de la enfermedad, debido a la cercanía del LCR a la médula espinal.
DesarrolloLos diferentes estudios de la literatura indican una mayor susceptibilidad del efecto citotóxico en las motoneuronas, frente a otro tipo de células neuronales y la inclusión de glía en los cultivos. La revisión de la composición del LCR en la esclerosis lateral amiotrófica no permite indicar mediante qué mecanismo se producen cambios preapoptóticos y apoptóticos con la adición del LCR a los cultivos, aunque podría estar relacionado con los receptores del glutamato, en mayor medida, aquellos que responden a AMPA/kainato, e intervenir en canales iónicos.
ConclusionesLa citotoxicidad del LCR es una singularidad de la esclerosis lateral amiotrófica que podría explicar aspectos evolutivos de la enfermedad. Para el mejor conocimiento de este mecanismo, es necesario que nuevos estudios incluyan una mayor identificación de los pacientes de quienes se obtienen las muestras, así como sus características, y diferenciar si son formas familiares o esporádicas.
The cytotoxicity of cerebrospinal fluid (CSF) in patients with lateral amyotrophic sclerosis in cell cultures that include neurons may be considered as a diffusion mechanism of the disease, due to the proximity of the CSF to the spinal column.
DevelopmentVarious literature studies suggest that the motor neurons are more susceptible to cytotoxicity compared to other neuron cells, including glial, in cell cultures. The review of the composition of CSF in lateral amyotrophic sclerosis gives few clues on how this mechanism causes pre-apoptotic and apoptotic changes on the addition on CSF to the cultures, although it could be associated with the glutamate receptors, to a greater extent in those that respond to AMPA/kainate, and have a role in ion channels.
ConclusionsThe cytotoxicity of CSF is a peculiarity of lateral amyotrophic sclerosis, which could explain some aspects of how the disease progresses. More studies are required in order to understand more about this mechanism, including better identification of patients from whom samples are obtained, as well as their characteristics, differentiating them into familial or sporadic.
La posibilidad de que los materiales biológicos procedentes de pacientes con esclerosis lateral amiotrófica (ELA), tanto en su forma familiar como esporádica, presenten algún tipo de elemento capaz de causar un efecto tóxico fue descrita ya por diferentes autores, que muestran mayor citotoxicidad con suero1–4 o cambios bioquímicos o ultraestructurales en cultivos celulares5,6, aunque otros estudios posteriores no pudieron confirmar estos efectos7–11. También se ha propuesto la toxicidad del líquido cefalorraquídeo (LCR) en otras enfermedades neurodegenerativas, como la enfermedad de Parkinson, donde se ha apuntado a que el LCR de estos pacientes pudiera inhibir el crecimiento de neuronas dopaminérgicas en cultivo12–16, aunque estos estudios no han sido reproducidos. Sin embargo, se ha descrito repetidamente el potencial efecto nocivo del LCR de pacientes con ELA (LCR-ELA) en distintos cultivos celulares17–32, aunque algún estudio no lo ha encontrado33. Así, Iwasaki et al34, en cultivo celular procedente del asta anterior de médula espinal en ratas embrionarias, no muestran diferencias en la supervivencia producida por LCR-ELA o en los controles y Gredal et al35, en un cultivo de neuronas corticales de ratón, tampoco observan diferencias en la respuesta al calcio o al cloruro potásico al LCR-ELA, lo que indica que no se modifica la homeostasis del calcio, que es uno de los mecanismos de la lesión de mecanismo excitotóxico.
Contrariamente a estos pocos estudios negativos, un número importante de experimentos confirman el efecto citotóxico del LCR-ELA en diversos cultivos celulares (tabla 1). Este efecto tóxico es mayor en cultivos de neuronas motrices que en las que no lo son28 y cuando en el cultivo hay mayor porcentaje de glía28 que aquellos que incluyen mayoritariamente neuronas29. El efecto deletéreo del LCR-ELA también puede estar mediado por microglía25, pero Anneser et al29 han demostrado el efecto citotóxico en cultivos con un porcentaje muy bajo de estas células. La tabla 2 muestra los estudios que evidencian cambios ultraestructurales producidos por LCR-ELA en las células como incremento en la fosforilación de los neurofilamentos18,19,26, astrocitosis21,26,27, vacuolización28,31, signos preapoptóticos o apoptóticos25,29,30 o signos de muerte celular28.
Efecto tóxico del líquido cefalorraquídeo (LCR) en esclerosis lateral amiotrófica (ELA), en cultivos celulares.
| Autor/año | Cultivo | Resultado |
| Courantier et al17, 1993 | Neuronas de rata en cultivo | Supervivencia celular con LCR-ELA del 47% frente al 80% de los controles |
| Terro et al20, 1996 | Células corticales de rata | Incremento de la tasa de muerte neuronal de casi el triple sobre el control |
| Smith et al23, 1998 | Células VSC-4,1, que son células colinérgicas | Cuando el LCR contiene valores elevados de 4-hidroxinonenal, un producto de peroxidación lipídica produce un incremento del 50% de la muerte celular; si tiene contenidos bajos, no hay incremento |
| Tikka et al25, 2002 | Células de médula espinal de rata embrionaria | Reducción de un 34% en supervivencia neuronal |
| Sen et al28, 2005 | Células de médula espinal de ratas embrionarias | En neuronas motrices, la supervivencia celular disminuyó un 50%, mientras que en motoneuronas y otras neuronas, un 20% |
| Anneser et al29, 2006 | Motoneuronas de médula espinal embrionarias de ave | Reducción de un 10% de la supervivencia celular |
| Anneser et al29, 2006 | Cultivo mixto de motoneuronas y glía de médula espinal embrionarias de ave | Reducción del 50% de la supervivencia celular. No se modifica con la adición de glutamato |
Cambios ultraestructurales o bioquímicos por el efecto tóxico del líquido cefalorraquídeo (LCR) en esclerosis lateral amiotrófica (ELA) en cultivos celulares.
| Autor/año | Cultivo | Resultado |
| Nagaraja et al18, 1994 | Células de médula espinal embrionaria de una especie de aves | Aumento de neurofilamentos fosforilados |
| Rao et al19, 1995 | Neuronas motoras espinales de ratas neonatales | Incremento en la fosforilación de neurofilamento en asta anterior pero no en asta posterior |
| Shahani et al21, 1998 | Células espinales de ratas neonatales | Astrocitosis intensamente GFAP positivos en sustancias gris y blanca |
| Manabe et al22, 1999 | Células espinales lumbares de rata | Aumento de células Fos positivas en asta posterior |
| Tikka et al25, 2002 | Células de médula espinal de rata embrionaria | Fragmentación del ADN y signos preapoptóticos y apoptóticos. Desfosforilación de neurofilamentos |
| Shahani et al26, 2004 | Administración en el LCR de ratas, y se analiza el tejido de la médula espinal | Aumento de LDH, de anticuerpos de NF fosforilados y de astrocitos reactivos |
| Anneser et al27, 2004 | Células gliales procedentes de embrión de ave | Aumento de la proliferación astrocitaria y la expresión de vimentina |
| Sen et al28, 2005 | Células de médula espinal de ratas embrionarias | Retracción neurítica, edema celular, vacuolización citoplasmática e incluso muerte celular. Elevación transitoria, pero pronunciada, de calcio en neuronas motrices y no motrices, aunque mayor en las motrices |
| Anneser et al29, 2006 | Motoneuronas de médula espinal embrionarias de ave | Fragmentación del ADN y signos preapoptoticos |
| Ramamohan et al30, 2007 | Neuronas motrices espinales de ratas neonatales | Fragmentación del aparato de Golgi en las neuronas por el LCR de ELA |
| Shobha et al31, 2007 | Neuronas motrices espinales de ratas neonatales | Células vacuoladas a las 48 h. Disminución de la expresión de GLT-1 en astrocitos de sustancia gris, con normalidad de GLAST. Aumento de actividad LDH |
| Gunasekaran et al32, 2009 | Neuronas motrices espinales de ratas neonatales | Disminución de la expresión de los canales de Nav1.6. Disminución de la expresión de los canales de Kv1.6 |
El LCR contiene proteínas y fragmentos de proteínas descargadas por las células afectadas, que podrían servir de biomarcadores para las enfermedades neurodegenerativas36–41. En el caso de la ELA, con independencia de la búsqueda de un marcador biológico, tiene interés tratar de determinar cuál es el mecanismo que le confiere este carácter tóxico sobre los cultivos celulares42. El factor tóxico podría producir la degeneración neuronal de forma directa24 o bien ser un mediador de propagación de la lesión. La posibilidad de que en el LCR se encuentre un elemento causal es poco probable, pero no descartable, dado que se trata de una enfermedad en que se considera que su presentación puede estar influida por factores ambientales43,44, y por ello, se ha tratado de buscar este factor, que algun autor lo ha denominado misterioso42.
Siempre se ha considerado el glutamato como el mejor candidato a justificar un efecto directo; por ello, diferentes estudios se han centrado en la investigación de aminoácidos neurotrasmisores en LCR. Contrariamente, se ha encontrado que los valores de glutamato están disminuidos en los pacientes graves, los de aspartato son normales o elevados y los de glicina son variables; hay pacientes con valores altos y bajos, mientras que la concentración de GABA está elevada en pacientes con progresión moderada y avanzada45. En un estudio de 17 pacientes no se detectaron valores altos de glutamato, aspartato, glicina o beta-N-metilamino-L-alanina46. En otro estudio, los valores de glutamato, isoleucina, leucina, metionina y tirosina fueron normales, mientras que hubo un aumento de las concentraciones de serina, glutamina y alanina en pacientes de inicio espinal47. Los valores de quinurénico, un antagonista endógeno de los receptores de AA, aparecieron significativamente elevados en los pacientes, y eran más altos en enfermos avanzados48. Es por ello, que aunque se ha apuntado a una neurotoxicidad mediada por los receptores AMPA17,28 o NMDA22 del glutamato o a través de GTL1 astrocitario31 para explicar el efecto tóxico del LCR-ELA, no parece fácil de justificar por la composición del propio LCR. Por otra parte, ni Tikka et al25 ni Anneser et al29 han conseguido probar que el glutamato influya en éste. También se han analizado otros neurotrasmisores u hormonas. Así, en pacientes con afección moderada y avanzada, un ultrafiltrado de CSF contra AchE mostró que la actividad estaba disminuida49. Los valores de sustancia P en el LCR están aumentados, especialmente en pacientes con una duración mayor de dos años y medio50. El contenido de 3-metoxi-4-hidroxifenilglicol (MHPG) se halló elevado en el LCR de pacientes, mientras que el ácido homovanílico y la somatostatina fueron normales51. En otro estudio, las concentraciones de LCR de péptido vasoactivo intestinal (VIP) se hallaron disminuidas, mientras que las de colecistoquinina (CCK) y la molécula celular de adhesión neural (NCAM) fueron normales52. Los valores de adenosina en LCR están aumentados, pero no de neopterina, en otro estudio53. Los valores de prostaglandina E fueron altos en comparación con el grupo control, pero sin relación con el estado clínico, el tipo de ELA o la duración de la enfermedad54, datos que reprodujo otro estudio55. Los valores de T3 en LCR se han encontrado discretamente aumentados en un estudio, mientras que los de T4 eran normales56. Los valores de CRF se han detectado disminuidos57. La proteína S-100 está disminuida en el LCR en estos 20 pacientes58, de forma similar a lo encontrado en suero59. EL GMPc se ha encontrado disminuido en el LCR, pero sin correlacionar con el estado clínico60, aunque otro estudio no halla esta alteración61.
Varios autores han propuesto la posibilidad de que el factor tóxico esté mediado por el metabolismo oxidativo20,31. Diferentes estudios han analizado sus marcadores en el LCR. Así, se han determinado las concentraciones de las formas reducidas y oxidadas de la coenzima Q10 (CoQ10) y 8-hidroxi-2’-desoxiguanosina (8-OHdG) en el LCR-ELA. Los porcentajes de ox-CoQ10 y 8-OHdG fueron mayores que en controles y estaban relacionados con la duración de la enfermedad. La ox-CoQ10 se correlacionó con 8-OHdG en ELA esporádica62,63. La forma ox-CoQ10 ya se había observado en 20 pacientes con ELA esporádica en una serie64, y sin aumento en otra serie de 30 pacientes con ELA65. En un estudio donde se analizó en el LCR un conjunto de proteínas oxidativas, la capacidad antioxidante total por la reducción de Fe, la cifra de 4-hidroxinonenal y la suma de nitritos y nitratos como indicadores de productos oxidantes, la capacidad de reducir Fe estaba disminuida en el LCR y el conjunto de proteínas oxidantes aumentadas en LCR y plasma, mientras que la suma de nitritos y nitratos, contrariamente a lo hallado en varones en otro estudio66, y la cifra de 4-hidroxinonenal eran similares a los controles67, datos reproducidos en otro trabajo68. Esta sustancia está aumentada en las muestras de LCR-ELA que producen mayor grado de efecto tóxico según Smith et al23. Los valores de nitratos están aumentados en otro estudio en ELA esporádica69. No se ha demostrado aumento en el LCR por HPLC en ELA de alfatocofenol (vitamina E)70. Los valores de 3-nitroxitiroxina también están disminuidos71. Los metabolitos del óxido nítrico están altos y la actividad superóxido dismutasa (SOD) baja en ELA esporádica72. La eritropoyetina en el LCR está disminuida en la ELA, en comparación con pacientes con cefaleas tensionales y demencias73,74; es menor en los pacientes con una progresión más rápida75. El F-2 isoprostano, que es un marcador de neurodegeneración oxidativa, está normal en ELA y aumentado en Alzheimer76. La comparación de los valores de radical hidroxilo, ascorbato libre, la actividad SOD1 y SOD2 y 8-OHdG mostró que, en ELA familiar y esporádica, las concentraciones de ascorbato y 8-OHdG en LCR eran mayores que en los controles, mientras que las actividades SOD eran menores. La concentración de cobre en ELA esporádica era mayor que en los controles77.
Considerando que la fosforilación de los neurofilamentos es una de las observaciones demostradas en los cultivos celulares tras la adición de LCR-ELA18,19,26, y más por su potencial uso como biomarcador, hay diferentes estudios que han analizado estas proteínas en el LCR, así como las que influyen en la agregación. Así, la determinación de proteína de neurofilamentos ligeros en LCR estuvo elevada en los pacientes, en comparación con los controles, y correlacionó inversamente con la evolución y la cifra era menor en las SOD-ELA familiar78. Los valores de otra proteína de neurofilamentos, NfHSMI35, estuvieron elevados en la ELA y más que en pacientes con Alzheimer. Los valores de NfHSMI35 en LCR fueron más altos en los pacientes con inicio en motoneurona superior y en aquellos con evolución más rapida y no correlacionaron con los valores de la proteína tau. Rosengren et al79 mostraron que la proteína de los filamentos estaba aumentada en LCR. En otro estudio los valores de tau en el LCR no se han encontrado aumentados en 18 pacientes80. Otros autores encuentran, sin embargo, un valor de tau aumentado en el LCR de 20 pacientes con ELA esporádica, especialmente en las fases iniciales. La proteína beta-amiloide 42 está disminuida en la ELA, según un estudio, mientras que las proteínas tau y fosfo-tau son normales en el LCR81, lo que se reproduce en otro estudio80. La determinación en LCR de NfHSMI35ha sido 5 veces mayor en 69 pacientes con ELA que en controles y 10 veces mayor que en pacientes con Alzheimer, y es mayor en pacientes cuyo inicio es por lesión de motoneurona superior, y no correlaciona con los valores de tau en LCR, que tambien están aumentados82. En relación con la TDP-43 en LCR, no se han encontrado incrementos destacables en ELA83 ni en degeneración lobular frontotemporal-ELA, aunque un estudio ha mostrado valores elevados en pacientes con ELA en estadios precoces, que disminuyen con la duración de la enfermedad84.
La adición de LCR-ELA supone la aparición de cambios preapoptóticos o apoptóticos25,28,29,30 en los cultivos celulares. El LCR-ELA contiene marcadores relacionados con la apoptosis, como la metaloproteasa de matriz 9 (MMP-9), que en un estudio de 24 pacientes con ELA y 15 controles se demostró algo inferior en los casos, sin llegar a la significación estadística, con una tendencia a disminuir con la evolución85. Los valores de MMP-2 y MMP-9 y del inhibidor de MMPS, TIMP2, fueron normales, mientras que los de TIMP1 estuvieron elevados en otro estudio86. En la evaluación del citocromo C en el LCR de 40 pacientes con ELA, éste apareció disminuido en el 46% de los pacientes en comparación con los controles, y no hubo variación significativa en el suero ni relación con las características clínicas87.
Shahani et al24 han propuesto a la posibilidad de que pueda haber un mecanismo inmunitario que explique la toxicidad del LCR-ELA. Diferentes estudios han medido marcadores inmunitarios en el LCR de los pacientes con ELA. Así, la determinación de RANTES (una beta-quimiocina), quimioatrayente para linfocitos y monocitos, mostró valores más elevados en la ELA que en procesos neurológicos no inflamatorios88. El ligando Flt3 es una citocina con actividad neurotrófica y antiapoptótica, que favorece la supervivencia neuronal y se ha detectado significativamente elevada en la ELA89. Se ha descrito un aumento del complemento de CD4 en LCR90. Anticuerpos contra las células del asta anterior de la médula están en el LCR de la mayoría de los pacientes con ELA91, así como se han detectado anticuerpos contra estructuras de la glía y axones en el LCR de un alto porcentaje de pacientes, además de anticuerpos contra células92. Se han observado títulos aumentados de anticuerpos antigangliósidos GM1, AGM1 y sulfátidos en un porcentaje de pacientes con ELA93. Los resultados sobre los valores de interleucina 6 en el LCR son discordantes, puesto que para algunos está elevada94, mientras que otros estudios la han encontrado normal95, aunque también se ha interpretado que ésta se eleva por la hipoxemia96.
Gunasekaran et al32 han señalado el potencial efecto protector de determinados factores de crecimiento, como BDNF y CNTF. Las cifras de BDNF no están alteradas en la ELA, al contrario que las de GDNF, que están aumentadas97. En relación con otros factores de crecimiento, se han hallado valores aumentados de proteína quimiotáctica de monocito 1 (MCP-1) en el LCR de pacientes con ELA, y disminuidos del factor de crecimiento vascular endotelial (VEGF), aunque sin demostración significativa. La MCP-1 se correlaciona positivamente con la escala de Norris, según un estudio que propone que el índice MCP1/VEGF en LCR podría diferenciar la ELA de otras enfermedades neurodegenerativas98. La MCP-1 está aumentada en otro trabajo99. Las concentraciones del factor de estimulación de colonias de granulocitos (G-CSF) y la MCP-1 en LCR están aumentadas en comparación con controles100. Otro estudio, contrariamente, demuestra que los valores de VEGF en LCR están aumentados significativamente en enfermedades de larga duración y de inicio en extremidades101. No se ha encontrado correlación del VEGF con el grado de hipoxia, aunque sus cifras son altas en pacientes hipoxémicos102. Otro estudio encuentra una disminución de los valores de VEGF en las fases iniciales de la ELA103. El factor de crecimiento epidérmico (EGF) está reducido en el LCR de ELA, según un estudio104. El factor de crecimiento transformador beta 1 puede proteger a las neuronas del daño oxidativo e inhibir la apoptosis; su valor en LCR se ha encontrado dentro de la normalidad, aunque ha aparecido elevado en pacientes de larga duración105. Se ha observado una disminución significativa en el LCR de hormona del crecimiento, insulina e IGF1106, así como de los valores de óxido nítrico, IGF 1 y 2, que aparecen como normales107.
DiscusiónEl LCR se encuentra muy cercano a muchas de las lesiones patológicas que se desarrollan en la ELA, especialmente medulares. Es posible que por ello pueda visualizarse en él determinados cambios bioquímicos más fácilmente que en otras enfermedades neurodegenerativas. Sin embargo, ello no justifica que pueda haber en el LCR algún factor que genere procesos patológicos en modelos celulares inespecíficos. Esto apoyaría que en el mecanismo de desarrollo de la enfermedad puedan intervenir más factores ambientales que de susceptibilidad genética. Aunque clínicamente pueden ser similares, la ELA familiar, especialmente las formas relacionadas con SOD1, y la ELA esporádica pueden tener mecanismos distintos108 y una respuesta diferente al tratamiento, lo que podría explicar el reciente fracaso del ensayo clínico con minociclina109,110, aunque puede haber otras justificaciones111. Las formas familiares asociadas a SOD1 basan el modelo experimental de animal transgénico más usado en la investigación en la enfermedad112. No es posible conocer si los distintos subtipos de ELA presentan una acción citotóxica diferente, ya que en pocos artículos se decribe esta información23,25,32. En el trabajo de Tikka et al25 se incluyen LCR procedentes de 26 pacientes, 5, familiares-SOD1, por la mutación D90A; 5, familiares distintas de SOD1, y 16, esporádicas, sin diferencias entre los 3 grupos en cuanto a fragmentación del ADN o el grado de fosforilación de los neurofilamentos, lo que parece indicar que el comportamiento de los grupos en cuanto a citotoxicidad puede ser similar. Aunque algunos estudios parecen indicar que la citotoxicidad del LCR-ELA no se correlaciona con la duración de la enfermedad25,29, la mayoría no describe esta información, por lo que no puede descartarse que el factor tóxico pueda aparecer o desaparecer en un momento de la evolución.
Un aspecto importante que considerar es la mayor o menor susceptibilidad de los cultivos celulares en los que se ha demostrado el efecto citotóxico, ya que la mayoría se constituye con células obtenidas de médula espinal, embrionarias o adultas, o corticales (tablas 1 y 2). En todo caso, parece que el efecto tóxico tendría una mayor afinidad por las motoneuronas28 y que está potenciado por las celulas gliales en el cultivo25. Esta observación es compatible con los datos de Clement et al113, que demostraron que para que se produzca degeneración neuronal en el modelo de ratón transgénico con mutación de la SOD1, es preciso que, junto con la acumulación de la SOD1 anómala en la neurona, haya participación de las células no neuronales, que podría ser a través de una alteración de las proteínas transportadoras de glutamato GTL1 y EAAT2114–117, lo que es uno de los argumentos a favor de la terapia celular en la enfermedad118. Tikka et al25 han señalado que el efecto citotóxico podría estar mediado por la microglía, en consonancia con la hipótesis de Boillee et al119, aunque Anneser et al29 lo encuentran en cultivos con escasa presencia de estas células.
El experimento de Anneser et al29 señala que el factor tóxico debe tener un bajo peso molecular y ser resistente al calor. El análisis de la proteómica en LCR está representando un modelo de investigación en las enfermedades neurológicas120,121, es idóneo para moléculas pequeñas y, por lo tanto, podría dar información adicional. En nuestro conocimiento, en la literatura sólo hay cuatro estudios de proteómica en el LCR en la ELA. Ramstrom et al122 no hallan ninguna proteína diferente en los controles utilizando espectrometría de masa. Ranganathan et al123,124 encuentran 3 proteínas diferentes, 2 disminuidas y una elevada. Una de las proteínas disminuidas es cistatina C y la otra es transtiretina (TTR); la proteína aumentada es un fragmento de la proteína neuroendocrina 7B2. La transtiretina también se ha encontrado en la enfermedad de Alzheimer125,126, aunque la disminución es mayor en la ELA, y relacionada con los estadios finales. En pacientes fallecidos, con LCR obtenidos en la necropsia, también aparecen aumentadas las cadenas alfa y beta de la hemoglobina, probablemente debido a la rotura de la barrera hematoencefálica. En el tercer estudio, Pasinetti et al127 encuentran 3 proteínas distintas de las de los controles, que identifican como cistatina C, que aparece disminuida, una de 4,8 kDa, que puede ser beta-2-microglobulina, también aumentada en la enfermedad de Alzheimer128 y otra que es un fragmento peptídico de la proteína neurosecretora VGF; también Ranganathan et al124 hicieron estos descubrimiento in vivo. Brettschneider et al129 analizan el LCR de 14 pacientes y observan 2 proteínas sobrerreguladas y 3 infrarreguladas. Dos de estas últimas son la Zn-alfa-2-glucoproteína y la proteína precursora de la ceruloplasmina. El papel de la cistatina C en la ELA ya ha sido discutido previamente en otro artículo108.
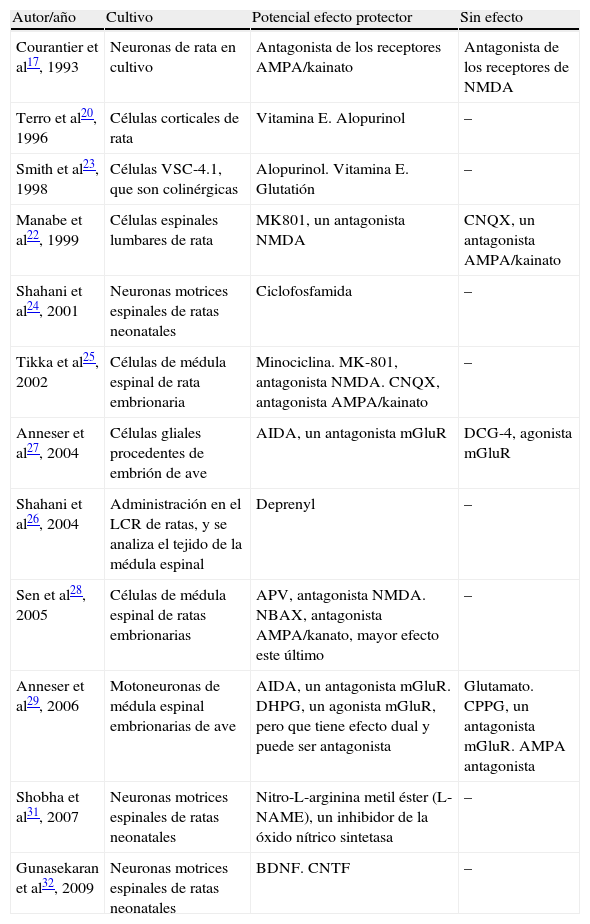
La tabla 3 incluye el resultado de las intervenciones farmacológicas sobre el cultivo y la respuesta sobre el efecto citotóxico. El efecto del factor tóxico parece estar mediado por el incremento de calcio, que se correlaciona directamente con el grado de muerte celular producido por el LCR-ELA28, pero también por los canales de Nav1.6 o Kv1.632. Tanto antagonistas de los receptores AMPA/kainato17,28 como de NMDA22 del glutamato, aunque con mayor intensidad los primeros, reducen parcialmente el efecto citotóxico, aunque también se ha asociado a la presencia de radicales libres20 o por mediación del óxido nítrico31. En todo caso, la respuesta a estas intervenciones sobre el cultivo puede estar más relacionada con los mecanismos de lesión de las células que con la propia composición del LCR-ELA. Gunasekaran et al32 señalan el potencial beneficio de la aplicación de BDNF o CNTF al cultivo.
Efecto de sustancias en la toxicidad del líquido cefalorraquídeo (LCR) en la esclerosis lateral amiotrófica.
| Autor/año | Cultivo | Potencial efecto protector | Sin efecto |
| Courantier et al17, 1993 | Neuronas de rata en cultivo | Antagonista de los receptores AMPA/kainato | Antagonista de los receptores de NMDA |
| Terro et al20, 1996 | Células corticales de rata | Vitamina E. Alopurinol | – |
| Smith et al23, 1998 | Células VSC-4.1, que son colinérgicas | Alopurinol. Vitamina E. Glutatión | – |
| Manabe et al22, 1999 | Células espinales lumbares de rata | MK801, un antagonista NMDA | CNQX, un antagonista AMPA/kainato |
| Shahani et al24, 2001 | Neuronas motrices espinales de ratas neonatales | Ciclofosfamida | – |
| Tikka et al25, 2002 | Células de médula espinal de rata embrionaria | Minociclina. MK-801, antagonista NMDA. CNQX, antagonista AMPA/kainato | – |
| Anneser et al27, 2004 | Células gliales procedentes de embrión de ave | AIDA, un antagonista mGluR | DCG-4, agonista mGluR |
| Shahani et al26, 2004 | Administración en el LCR de ratas, y se analiza el tejido de la médula espinal | Deprenyl | – |
| Sen et al28, 2005 | Células de médula espinal de ratas embrionarias | APV, antagonista NMDA. NBAX, antagonista AMPA/kanato, mayor efecto este último | – |
| Anneser et al29, 2006 | Motoneuronas de médula espinal embrionarias de ave | AIDA, un antagonista mGluR. DHPG, un agonista mGluR, pero que tiene efecto dual y puede ser antagonista | Glutamato. CPPG, un antagonista mGluR. AMPA antagonista |
| Shobha et al31, 2007 | Neuronas motrices espinales de ratas neonatales | Nitro-L-arginina metil éster (L-NAME), un inhibidor de la óxido nítrico sintetasa | – |
| Gunasekaran et al32, 2009 | Neuronas motrices espinales de ratas neonatales | BDNF. CNTF | – |
Es indudable que el LCR puede permitir identificar biomarcadores en la ELA130,131, pero además su citotoxicidad es una singularidad que podría explicar aspectos evolutivos de la enfermedad. Los estudios realizados e incluidos en esta revisión adolecen de información clínica, sin que pueda correlacionarse el efecto citotóxico con situaciones clínicas de los pacientes o especialmente sobre si son formas familiares o esporádicas. Parece evidente que, para el conocimiento de este mecanismo, es necesario que nuevos estudios incluyan una mayor identificación de los pacientes de quienes se obtienen las muestras.
Conflicto de interesesLa investigación en la que se basa este artículo está financiada por el proyecto “Vulverabilidad selectiva de la motoneurona a los efectos neurotóxicos del líquido cefalorraquídeo de pacientes en esclerosis lateral amiotrófica (ELA)” concedido por la Fundación Mútua Madrileña.