Los receptores de la acetilcolina de tipo nicotínico (R-Ach-n) son expresados ampliamente en diferentes regiones del cerebro. Particularmente, la conformación de los subtipos α4β2 y la α7 ha sido involucrada con la organización de diferentes tipos de memoria. Además, debido a su localización, estos pueden controlar la liberación de diferentes tipos de neurotransmisores, así como su participación en la plasticidad sináptica.
MétodosSe conformaron 3 grupos de trabajo, un grupo experimental (E), un grupo control (C) y un grupo testigo (T). Al grupo E se le realizó la lesión farmacológica por vía estereotáxica en la región anteroventral del núcleo del rafe dorsal (NRD) con 1μ/μl de 5,7-dihidroxitriptamina. Al grupo C, se le sometió a cirugía y se le aplicó la solución vehículo y finalmente el grupo T no recibió ningún tratamiento; 20 días después de la cirugía, los animales de los 3 grupos fueron sacrificados por decapitación para el análisis de la expresión de las subunidades, α4 y α7 de los R-Ach-n mediante la técnica de biología molecular.
ResultadosLa denervación 5-HTérgica a la CPF de la rata modifica la expresión de los receptores α4 y α7 de manera diferencial. La expresión de las subunidades α4 se incrementa, mientras que las subunidades α7 disminuyen.
ConclusiónLas diferencias de expresión que tuvieron las 2 subunidades podrían deberse a la localización que presentan. La subunidad α4 se localiza en sitios post sinápticos y podría estar relacionada con cambios post sinápticos adaptativos, en tanto que la de la α7 se localiza en sitios presinápticos, por lo que la lesión y eliminación de fibras 5-HTérgicas en la CPF provoca su disminución.
Nicotinic acetylcholine receptors (nAChRs) are widely expressed throughout several brain regions. Formation of the α4β2 and α7 subtypes in particular is involved in the organisation of different types of memory. Furthermore, due to their location, these receptors can control the release of various types of neurotransmitters and contribute to synaptic plasticity.
MethodsRats were divided into three groups, an experimental group (E), a sham-operated group, (S) and an intact group (T). In group E, stereotactic guidance was used to induce a chemical lesion with 1 μ/μL of 5,7-dihydroxytryptamine (5,7-DHT) in the anteroventral part of the dorsal raphe nucleus (DRN). In the sham-operated group (S), animals underwent surgery including delivery of the same excipient solution to the same site. The intact group (T) received no treatment whatsoever. Twenty days after surgery, animals in all groups were euthanised by decapitation to evaluate the expression of α4 and α7 nAChRs by means of molecular biology techniques.
Results5-HT denervation of the rat PFC differentially modified the expression of α4 and α7 receptors: while α4 receptor expression increased, α7 expression decreased.
ConclusionExpression differences observed between the two subtypes may be due to their separate locations. The α4 subtype is found in postsynaptic locations and may be related to adaptive changes in postsynaptic cells, while the location of α7 is presynaptic. This explains why the lesion and the elimination of 5-HT fibres in the CPF would cause a decrease in α7 expression.
La actividad eléctrica cortical es modulada por la interacción de los sistemas colinérgico y serotoninérgico, correlativamente con la expresión conductual del aprendizaje y la memoria, en los cuales ambos sistemas de neurotransmisión han sido involucrados de manera interactiva1. Particularmente, los receptores colinérgicos de tipo nicotínico (R-Ach-n) participan en dicha expresión conductual2 y se ha reportado que la administración sistémica de dosis altas de mecamilamina, un antagonista del receptor nicotínico, provoca déficit en el rendimiento de la memoria en el laberinto radial en ratas3, en tanto que a dosis bajas mejora la memoria4. Además, se ha demostrado que la activación de estos receptores con agonistas mejora el rendimiento de la memoria, tanto en roedores5 como en monos6. Se ha demostrado que estructuras cerebrales como el hipocampo7 y la amígdala están involucradas en la memoria a través de la activación de los R-Ach-n y se ha reportado que el uso de antagonistas a los subtipos de receptores α7 y α4α2 deteriora la memoria de trabajo8.
Los R-Ach-n son estructuras pentaméricas formadas por la combinación de subunidades α (α2-α10) y subunidades β (β2-β4) (heteroméricas); en cambio, las subunidades α7 forman estructuras pentaméricas de forma homomérica y se encuentran localizadas tanto en la presinapsis como en la post sinapsis de neuronas colinérgicas, GABAérgicas y glutamatérgicas9.
Ambas formas de R-Ach-n se encuentran en la corteza prefrontal (CPF), región involucrada en la memoria de trabajo10. Se ha demostrado que los R-Ach-n y muscarínicos de la corteza prefrontal de la rata están relacionados con la memoria de trabajo. Sin embargo, existe poca información acerca de la participación de los R-Ach-n corticales sobre la memoria, tanto en animales como en humanos11. Se ha reportado que la pérdida de la subunidad α4 está correlacionada con el bajo rendimiento de la memoria en pacientes con la enfermedad de Alzheimer12. Además, la estimulación de los R-Ach-n con agonistas selectivos minimiza las deficiencias relacionadas con la memoria causada por la pérdida de R-Ach-n corticales13.
Debido a la distribución y ubicación de los R-Ach-n sobre terminales presinápticas, estos pueden regular la liberación de diferentes tipos de neurotransmisores14. Asimismo, dichos receptores se localizan sobre terminales 5-HTérgicas y se ha demostrado que su estimulación regula la liberación de serotonina (5-HT) en la corteza prefrontal de la rata15.
Por otro lado, se sabe que cuando hay neurodegeneración de segmentos axonales, las neuronas intactas son parcialmente desaferentadas y, a su vez, pueden morir o iniciar un fenómeno plástico de tipo compensatorio, además dichas neuronas aumentan la sensibilidad al neurotransmisor que inicialmente liberaba la sinapsis (hipersensibilidad por denervación). Tal hipersensibilidad se debe a un aumento en el número de receptores posinápticos16. Por otro lado, se ha demostrado que la lesión farmacológica del núcleo del rafe dorsal (NRD) con 5,7-dihidroxitriptamina (5,7-DHT) en la rata provoca cambios plásticos en las neuronas de la corteza prefrontal correlativamente con alteraciones en la ejecución de una tarea de memoria de corto plazo (MCP)17, así como una disminución en los niveles basales de 5-HT y acetilcolina (Ach)18. Sin embargo, la estimulación de los receptores 5-HT1A con el agonista 8-OH-DPAT incrementa liberación de Ach. En cambio, la estimulación de los receptores 5-HT2A con el agonista α-me-5-HT no tuvo efecto sobre la liberación de Ach en comparación con los animales intactos. Sin embargo, la liberación de Ach disminuyó con respecto al agonista 8-OH-DPAT18. Sobre la base de estos resultados y la amplia distribución de los R-Ach-n en la corteza prefrontal, es importante conocer más acerca de la participación de dichos receptores en aspectos relacionados con la memoria, y de manera particular de la respuesta plástica que presentan ante la denervación farmacológica del NRD, objetivo del presente trabajo.
Material y métodosTodos los experimentos se llevaron a cabo de acuerdo con la «Guía para el cuidado y uso de animales de laboratorio» del Instituto Nacional de Salud (NIH Publicación N.° 8023, 1978).
Debido a que las ratas hembra muestran una actividad mayor de la enzima que sintetiza 5-HT y una capacidad alta de almacenamiento de la misma en neuronas serotoninérgicas, en el presente trabajo se utilizaron 30 ratas hembra de 250-300g de peso de la cepa Sprague-Dawley, las cuales fueron mantenidas en condiciones estándar de bioterio con ciclos luz-oscuridad 12:12 y acceso libre al agua y a la comida. Por otro lado, y para evitar la posible influencia de los niveles hormonales sobre dicho estudio, los animales fueron sacrificados entre los periodos de anestro, esto es, entre metaestro y diestro19.
Lesión de aferencias serotoninérgicas a la corteza prefrontalSe conformaron 3 grupos de trabajo: un grupo fue designado como experimental (E), un grupo control (C) y el último como testigo (T). Al grupo E (n=10) se les produjo una lesión vía estereotáxica20 en la región anteroventral del NRD: antero-posterior a Bregma, 8,0mm; lateral, 2,0mm; profundidad, 7,2mm, y angulación, 19°. Con una jeringa microlítrica se inyectaron 0,2μl de una solución compuesta de: 1μg/μl de 5,7-DHT y ácido ascórbico al 0,1% en NaCl al 0,9%21. Al grupo C (n=10) se le sometió a la cirugía y se le aplicó una solución vehículo (ácido ascórbico al 0,1% en NaCl al 0,9%) en el sitio cerebral correspondiente a las mismas coordenadas esterotáxicas; el grupo T (n=10) no recibió ningún tratamiento. Treinta minutos antes de la cirugía los animales de los grupo E y C recibieron una dosis de 50mg/kg de peso de desipramina por vía intraperitoneal (ip) para proteger terminales noradrenérgicas22, dado que la 5,7-DHT es tóxica para neuronas noradrenérgicas. El estado de anestesia fue inducido mediante la aplicación de 1mg/kg de dehidrobenzoperidol por vía ip y, por último, después de 15min se les aplicó 50mg/kg de ketamina.
Veinte días después de la cirugía los animales de los 3 grupos de trabajo fueron sacrificados por decapitación. Se extrajo el encéfalo en condiciones asépticas y se utilizó material previamente estéril y fue disecada la CPF dorso medial. El tejido se almacenó a –70 °C hasta el día de su utilización para la extracción del ácido ribonucleico (ARN) total.
Obtención y cuantificación del ARN totalLa extracción del ARN total se realizó mediante el método de isotiocianato de guanidina23. El precipitado de ARN que se formó fue suspendido en agua tratada con dietil pirocarbonato al 1%. La cantidad y la calidad del ARN extraído fueron evaluadas mediante el índice de absorbancia de 260/280nm, considerándose óptimas aquellas muestras cuyo índice de absorbancia fue de 1,7 a 2,0.
Transcriptasa reversa y reacción en cadena de la polimerasa semicuantitativaPara la síntesis del ácido desoxirribonucleico complementario (ADNc) se utilizó la transcriptasa reversa del virus de la leucemia murina de Molovney. Se tomaron 2μg de ARN de cada muestra, se adicionó agua estéril a un volumen total de 6μl. Las muestras se desnaturalizaron a 70°C durante 10 min. Inmediatamente después, se incubaron en baño de hielo con agitación continua durante 5 min. Posteriormente, se adicionó un volumen total de 14μl de la mezcla de retrotranscriptasa, que consistió en lo siguiente: amortiguador para RT 5X, dNTPs (desoxinucleótidos trifosfatados 2,5mM), ditotreitol (1,0mM), indicadores aleatorios (Random primers) 1μg/μl e inhibidor de ARNasa (1 U/μl). La mezcla fue incubada con la transcriptasa reversa (200 U/μl) a 37°C durante 1 hora. Con una etapa final a 95°C durante 10 min y al final se adicionaron 5μl de agua estéril.
Para la reacción en cadena de la polimerasa, se utilizó una mezcla de reacción con la siguiente composición: agua estéril inyectable, iniciadores correspondientes a los genes de interés (tabla 1) dNTPs (2,5mM), amortiguador 10X para PCR, MgCl2 (50mM), ADNc y Taq ADN polimerasa (1 U/μl).
Secuencias de oligonucleótidos utilizados para PCR semicuantitativa
| Subunidad | Gen BANK | Secuencia | Producto | Ciclos |
| α4 | Posición 181-600NM_024354 | 5′-GGCAATATCT CAGATGTGGTCCTCGT-3′5′- GCAAGATTGACTTAGTGAGCATTCAT-3′ | 420 pb | 30 |
| α7 | Posición 298-570NM_012832.3 | 5′- GTTCGTTTTCCAGATGGCCAGATTTG-3′5′- TGCAAGAGGCAGATATCAGCAGCTAT-3′ | 273 pb | 35 |
| β-actina | Posición 684-1201NM_031144 | 5′-CACCACAGCTGAGAGGGAAATCGTGCGTGA-3′5′- ATTTGCGGTGCACGATGGAGGGGCCGGACT-3 | 518 pb | 22 |
A las reacciones de amplificación se les adicionó aceite mineral para evitar su evaporación y las condiciones del termociclador fueron de una primera etapa 95°C por 5 min y se corrieron en forma automática según el ciclo correspondiente para cada receptor. Cada ciclo consistió de 95°C por 1 min, 60°C por 1 min y 72°C por 1,5 min, con una etapa final de extensión a 72°C por 5 min. Además, se utilizó como control de la PCR la expresión del gen para β-actina.
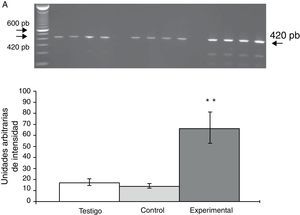
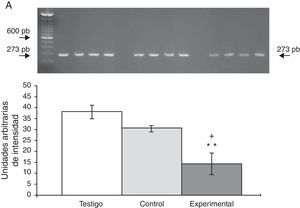
Los productos amplificados de la PCR se analizaron en una cámara horizontal de electroforesis, junto con un marcador de peso molecular de 100 pb en un gel de agarosa al 1,5% que contenía bromuro de etidio 0,5mg/ml por 45min a 70 voltios en amortiguador TBE 1X (Tris-borato-EDTA). La intensidad de las bandas fue determinada mediante el sistema de fotodocumentación equipado con un software de análisis (Molecular Image Gel Doc XR System Quantity One 1-D Analysis Software). Los valores para la expresión de cada receptor se calcularon y normalizaron contra el área representada por la expresión del gen constitutivo para la β-actina. Los resultados fueron expresados en unidades arbitrarias del área por la intensidad máxima.
Análisis estadísticoLos resultados fueron expresados como la media±error estándar; se realizó la prueba de análisis de varianza de una vía (ANOVA) y como prueba post hoc se usó la prueba Tukey para comparar los diferentes grupos de estudio. El nivel de significancia aceptado fue p ≤ 0,05.
ResultadosHistologíaSe realizó el análisis histológico del NRD de todos los grupos de trabajo con el objetivo de solo considerar para este trabajo a aquellos sujetos cuya lesión estuviera circunscrita a la región intermedia al fascículo longitudinal medial (zona que inerva de manera preferentemente la CPF).
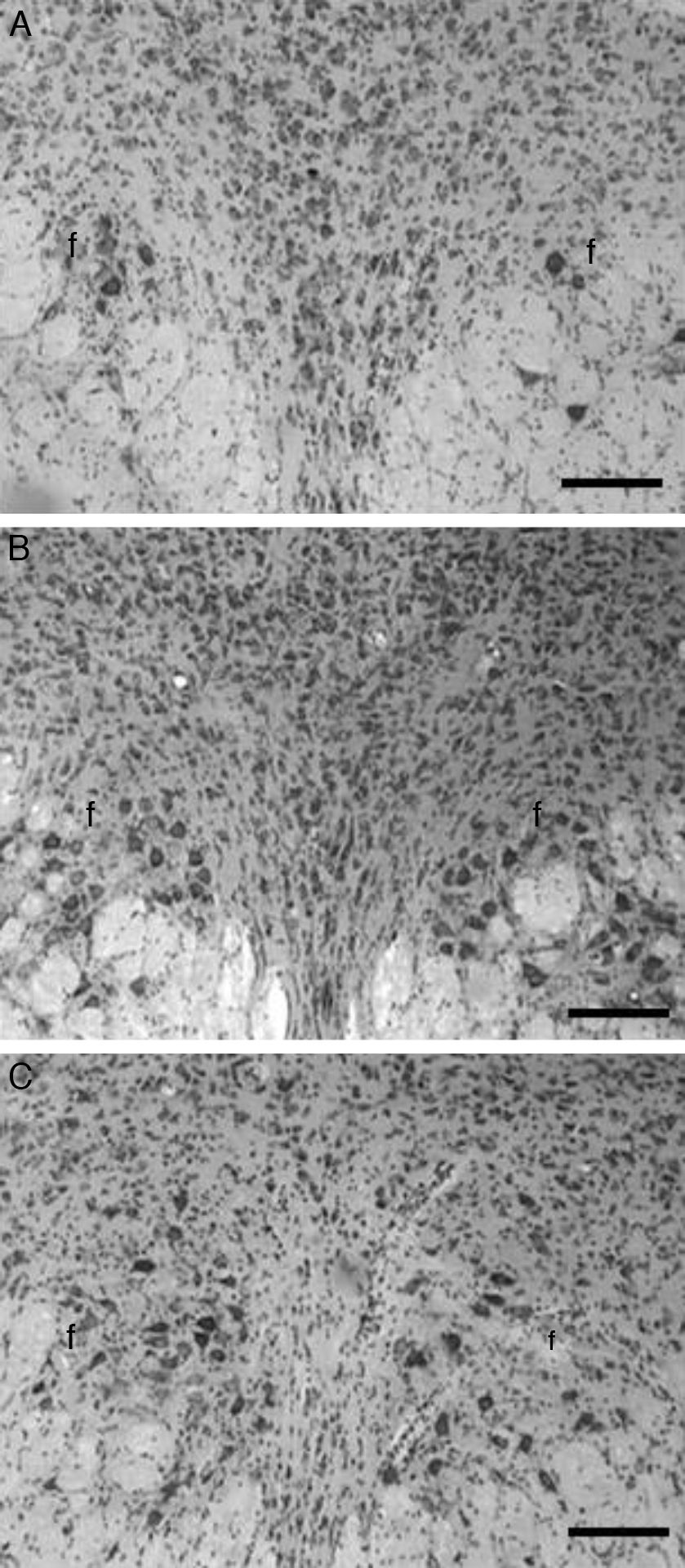
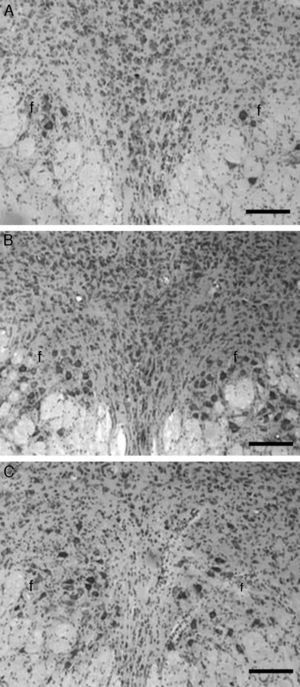
En las imágenes histológicas analizadas de los animales del grupo T se aprecia una gran cantidad de cuerpos neuronales en la zona intermedia al fascículo longitudinal medial (fig. 1A), en tanto que el análisis en la misma zona cerebral en los animales correspondientes al grupo C se apreció una leve pérdida de cuerpos celulares y una actividad glial moderada, 20 días después de la aplicación de la solución vehículo (fig. 1B). Por otro lado, en el grupo E, 20 días después de la lesión con el neurotóxico 5,7-DHT el análisis histológico reveló una pérdida masiva de cuerpos neuronales a nivel de la zona intermedia al fascículo longitudinal medial, así como una gran cantidad de glía reactiva (fig. 1C).
Imágenes histológicas representativas de cortes coronales del núcleo del rafe dorsal, en los que se aprecia la histología normal del grupo testigo (A), así como las características histopatológicas después de la microinyección de la solución vehículo en los animales del grupo control (B), o después de la aplicación de la neurotoxina 5,7-dihidroxitriptamina utilizada para destruir neuronas serotoninérgicas en los animales experimentales (C). Nótese la ausencia casi total de neuronas en el grupo lesionado, así como la mayor cantidad de glía en este último, respecto del grupo control y testigo. f: fascículo longitudinal medial; violeta de cresilo, barra=100μm.
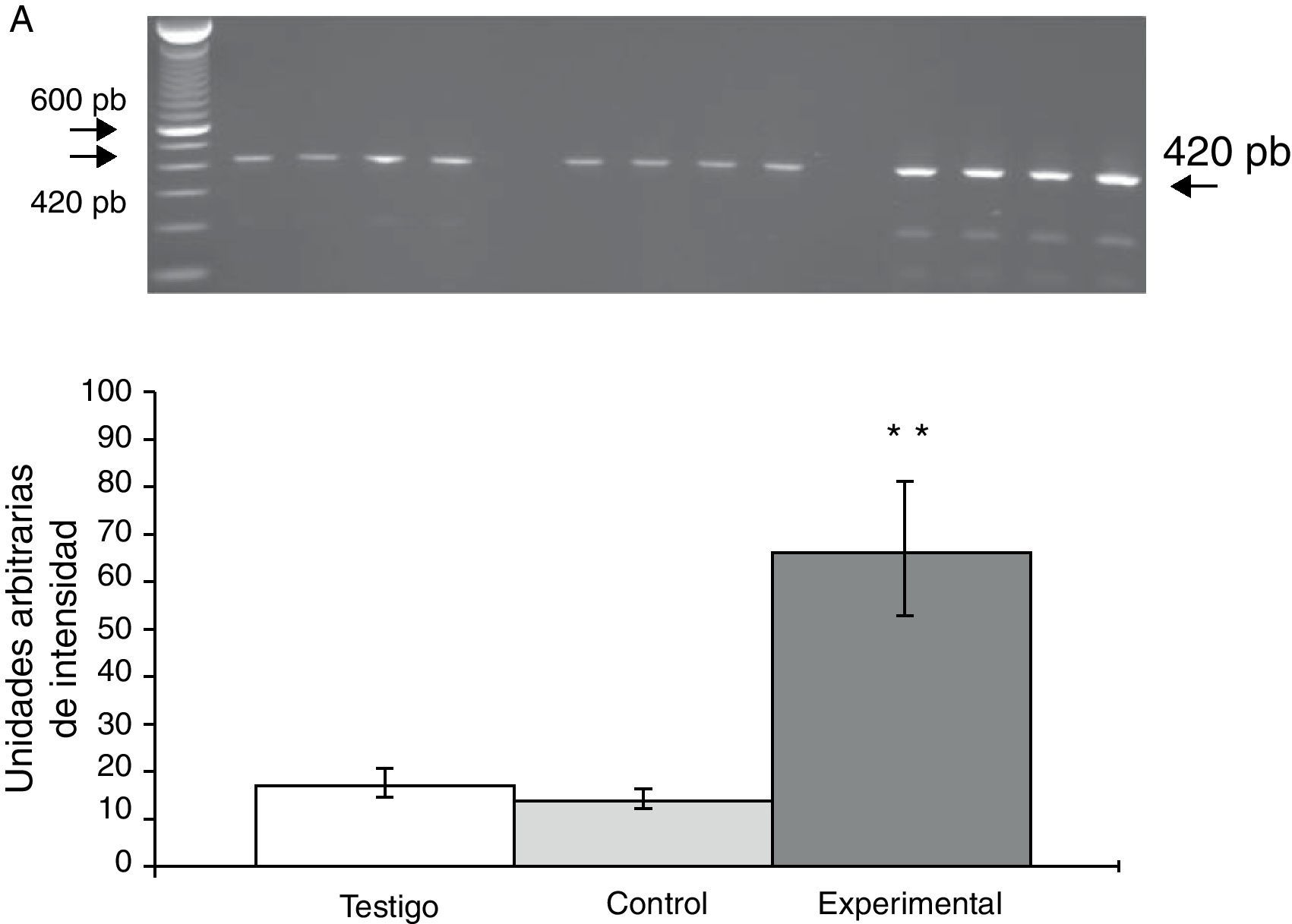
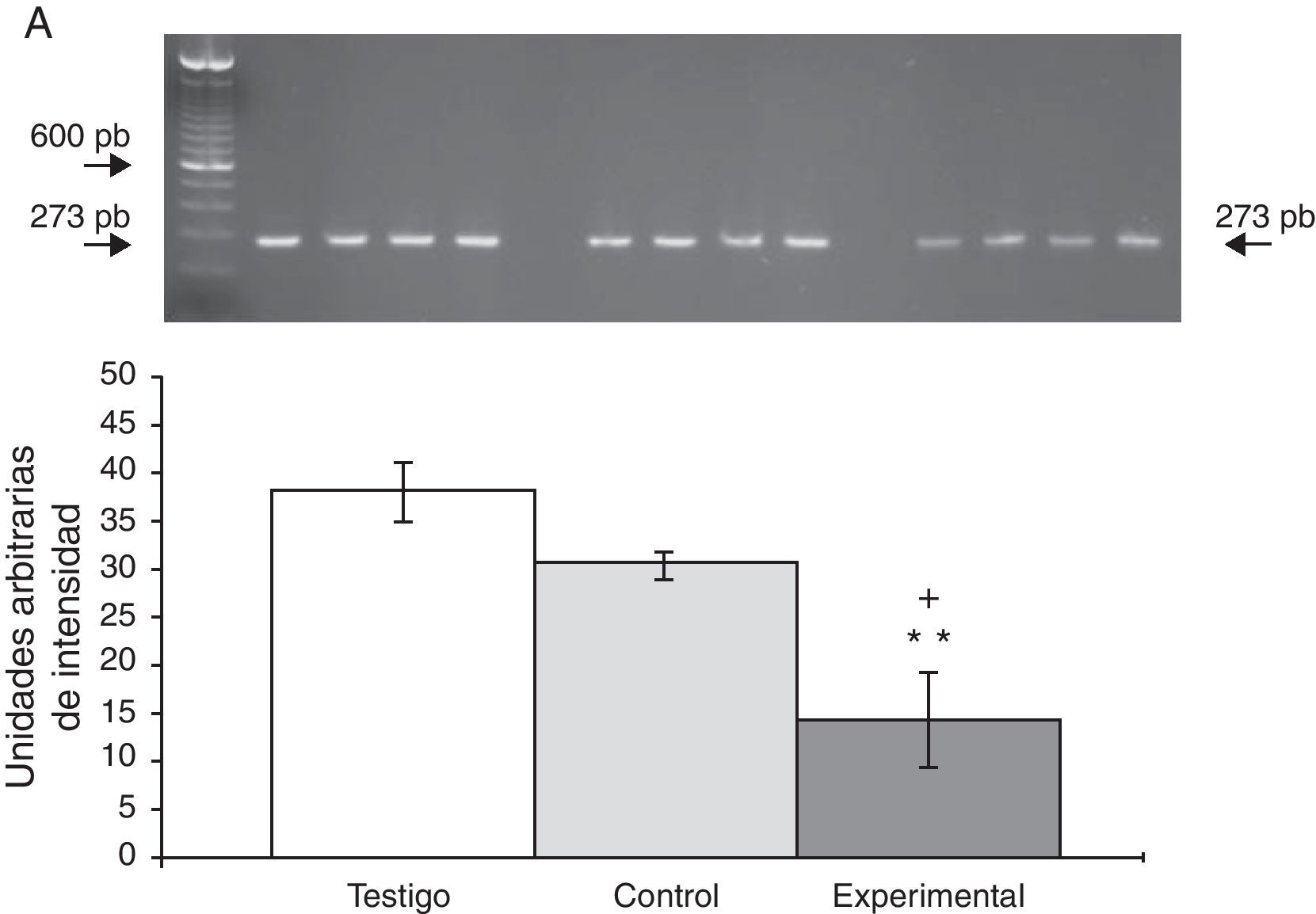
La expresión del ARNm para la subunidad α4 en la CPF de la rata mostró un importante incremento (65±6) después de la lesión del NRD en comparación con los animales del grupo T (15±3) y C (13±4) (fig. 2), en tanto que la expresión de la subunidad α7 mostró una disminución en los animales a los cuales se les lesionó el NRD (15±6) en comparación con los animales del grupo C (30±3) y T (40±5), respectivamente (fig. 3).
La CPF es el centro responsable de las funciones ejecutivas del cerebro y participa en la planificación de conductas cognitivas complejas; de manera particular, participa en el procesamiento de la información mantenida en la memoria de trabajo24 a través de la activación de los R-Ach-n25. Dichos receptores se localizan tanto en la presinapsis como en la post sinapsis de diferentes estructuras cerebrales26. Los resultados obtenidos en el presente trabajo demostraron que la denervación 5-HTérgica córtico frontal incrementa la expresión de la subunidad α4 en la CPF. Una de las combinaciones más ampliamente distribuidas y abundantes en el cerebro de la rata es la forma heteromérica α4β226 y además se ha reportado que esta participa en la MCP (subtipo de memoria de trabajo)12. En este sentido, se ha demostrado que la denervación 5-HTérgica córtico frontal provoca una mejora en la realización de una tarea que requiere de la evocación de información adquirida en el corto plazo, correlativamente con modificaciones morfológicas en neuronas piramidales de la CPF17, por lo que dichas alteraciones podrían deberse al incremento en la expresión de la subunidad α4. Sin embargo, para sustentar esta premisa es necesario realizar el análisis de la expresión de la subunidad β2. Por otro lado, la sobreexpresión de la subunidad pudo ser el resultado de un fenómeno plástico de tipo compensatorio puesto en marcha por la CFP para modular la liberación o interacción de la acetilcolina u otras moléculas neurotransmisoras. Al respecto, se sabe que los R-Ach-n localizados en sitios post sinápticos participan de manera importante en la plasticidad sináptica y la regulación de los efectos propios de la acetilcolina26.
Por su parte, la baja expresión de algunas subunidades del receptor se ha asociado con la patogénesis de diversas enfermedades neurodegenerativas27.
En relación con la expresión del ARNm de la subunidad α7, esta mostró una disminución después de la denervación 5-HTérgica a la CPF. Al respecto, se ha reportado que los R-Ach-n en la CPF participan en la formación de la memoria a corto y largo plazo; así, la disminución de la subunidad α7 en la CPF se ha correlacionado con una disminución o pérdida de la formación de la memoria en pacientes con enfermedad de Alzheimer12. Bajo el modelo de denervación 5-HTérgica se han reportado alteraciones en la ejecución de una prueba que requiere de la memoria de corto plazo17 y se ha demostrado que la liberación basal de 5-HT y Ach en la CPF disminuye18. En el presente trabajo, se observó una disminución en la expresión de la subunidad de los receptores α7, los cuales son expresados ampliamente en la CPF y de manera particular cuando son activados promueven vías de señalización necesarias para la formación de la memoria de referencia y de trabajo26. Además, debido a su localización presináptica de forma homomérica en diferentes sistemas de neurotransmisión, su principal función es modular la liberación de acetilcolina26. Por otro lado, la disminución de la expresión de la subunidad α7 se debe a la disminución del contingente de fibras 5-THérgicas a la CPF tras la lesión farmacológica del NRD28. Se ha demostrado que la liberación de 5-HT en la CPF de la rata es promovida por la estimulación de diferentes conformaciones de los R-Ach-n15. Sin embargo, la combinación exacta de subtipos de R-Ach-n en dicho efecto no se conoce. Se ha sugerido que este efecto de liberación de 5-HT, al menos en el hipocampo, es regulado por los R-Ach-n29 y la estimulación de estos puede aumentar o disminuir la liberación de 5-HT. En el primer caso, la liberación está promovida por la acción directa de R-Ach-n presentes sobre terminales 5-THérgicas en presencia de concentraciones altas de nicotina29. En segundo lugar, su disminución es promovida por la propia liberación de Ach, mediante un efecto de tipo inhibidor sobre la liberación de 5-HT. En la actualidad, se desconoce el mecanismo preciso involucrado en esta interacción15.
Cabe mencionar que en el presente trabajo también se pudo apreciar una leve disminución en la expresión del ARNm para el subtipo de receptor α7 en el grupo de animales control en comparación con el grupo testigo. Esto podría deberse a la lesión parcial inducida por la manipulación mecánica de la cirugía y química del ácido ascórbico en las neuronas del NRD, ya que se ha reportado que el ácido ascórbico puede inducir estrés oxidativo hasta llevar a las células a apoptosis30. Esto podría explicar la relativa disminución de los receptores α7 en la CPF en los animales de este grupo. Estos mismos resultados fueron observados en los animales del grupo experimental, pero con un cambio mayor.
En este estudio, se demostró que la lesión farmacológica del NRD modifica la expresión de los receptores α4 y α7 en la CPF de la rata. Además, ambos responden de una forma diferente a la lesión. Por un lado, la expresión de los receptores α4 incrementa y la de los α7 disminuye. Estos resultados podrían proporcionar una aproximación acerca de su participación en los procesos cognitivos. Sin embargo, es necesario realizar más experimentos para evaluar la expresión de todas las subunidades que componen a los R-Ach-n. Esto permitirá obtener información más completa acerca de su respuesta ante fenómenos de lesión relacionado con la plasticidad cerebral y, por ende, su posible participación en procesos relacionados con la memoria a corto plazo.
Así, los resultados obtenidos en este trabajo junto con aquellos reportados por nuestro grupo de trabajo demuestran la existencia de un efecto plástico de tipo compensatorio que pudiese estar mediando las posibles alteraciones en la transmisión de información cortical que subyace a la expresión conductual de la MCP bajo el modelo de denervación 5-HTérgica de la CPF.
FinanciaciónTrabajo parcialmente financiado por PROMEP, oficio 103.5/07/2636 con folio PTC-427, así como por el Fondo COECYTJAL-UDG mediante el folio del proyecto PS-209-515.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.