La exposición a dosis bajas de O3 conduce a un estado de estrés oxidativo. Algunos estudios muestran que el estado de estrés oxidativo puede modular tanto el SNC como la inflamación sistémica, que son importantes para el desarrollo de la enfermedad de Alzheimer.
ObjetivoEvaluar la frecuencia de células tipo Th17, la concentración de IL-17A en plasma y la inmunorreactividad del hipocampo a IL-17A en ratas expuestas a dosis bajas de O3.
MétodosCiento ocho ratas Wistar machos fueron divididas en 6 grupos (n=18) con los siguientes tratamientos: control (sin O3) y O3 (0,25ppm, diario por 4h) durante 7, 15, 30, 60 y 90 días. De cada grupo se decapitaron 12 animales, se tomó una muestra de sangre periférica para aislar el plasma y las células mononucleares. La IL-17A plasmática se evaluó mediante LUMINEX y la frecuencia de células de tipo Th17 por citometría de flujo. Las ratas restantes se anestesiaron y se perfundieron para inmunohistoquímica en el hipocampo.
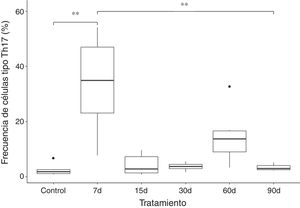
ResultadosMuestran que la exposición durante 7 días a O3 produce un aumento significativo en la frecuencia de células tipo Th17 y los niveles de IL-17A en sangre periférica. Sin embargo, existe una disminución de Th17/IL-17A en la periferia desde el día 15. También se encontró un aumento de IL-17A en el hipocampo desde los 30 días de exposición.
ConclusiónEl O3 produce un efecto sistémico a corto plazo de tipo Th17/IL-17A y un aumento de IL-17A en el tejido del hipocampo durante el proceso neurodegenerativo crónico.
Exposure to low doses of O3 leads to a state of oxidative stress. Some studies show that oxidative stress can modulate both the CNS and systemic inflammation, which are important factors in the development of Alzheimer disease (AD).
ObjectiveThis study aims to evaluate changes in the frequency of Th17-like cells (CD3+CD4+IL-17A+), the concentration of IL-17A in peripheral blood, and hippocampal immunoreactivity to IL-17A in rats exposed to low doses of O3.
MethodsOne hundred eight male Wistar rats were randomly assigned to 6 groups (n=18) receiving the following treatments: control (O3 free) or O3 exposure (0.25ppm, 4hours daily) over 7, 15, 30, 60, and 90 days. Twelve animals from each group were decapitated and a peripheral blood sample was taken to isolate plasma and mononuclear cells. Plasma IL-17A was quantified using LUMINEX, while Th17-like cells were counted using flow cytometry. The remaining 6 rats were deeply anaesthetised and underwent transcardial perfusion for immunohistological study of the hippocampus.
ResultsResults show that exposure to O3 over 7 days resulted in a significant increase in the frequency of Th17-like cells and levels of IL-17A in peripheral blood. However, levels of Th17/IL-17A in peripheral blood were lower at day 15 of exposure. We also observed increased IL-17A in the hippocampus beginning at 30 days of exposure.
ConclusionThese results indicate that O3 induces a short-term, systemic Th17-like/IL-17A effect and an increase of IL-17A in the hippocampal tissue during the chronic neurodegenerative process.
La contaminación atmosférica es uno de los principales problemas de salud en las ciudades densamente pobladas, así como en las ciudades industrializadas1. El ozono es uno de los principales contaminantes del aire y se produce por reacciones fotoquímicas en la atmósfera baja2. Ha sido descrito que la inhalación aguda y crónica de este gas produce un estado de estrés oxidativo3. El estado crónico de estrés oxidativo es un factor crítico para el desarrollo de las enfermedades neurodegenerativas4.
En estudios previos de nuestro grupo de trabajo se demostró que la exposición crónica a bajas dosis de ozono (0,25ppm) durante 4h diarias induce un estado de estrés oxidativo y neurodegeneración progresiva irreversible5. En el hipocampo, este proceso se caracteriza por las alteraciones mitocondriales que inducen el déficit energético, el estrés del retículo endoplásmico y las alteraciones del aparato de Golgi, los cambios nucleares, la activación y la proliferación de la glía, la muerte celular por apoptosis y necrosis, los acúmulos intracelulares de beta-amiloide 1-42 (βA-1-42), así como también el déficit en la respuesta reparadora del cerebro y las alteraciones en los procesos de memoria y aprendizaje; similar a lo que ocurre en el humano durante el desarrollo de la enfermedad de Alzheimer6 (EA).
Otro factor crucial para el desarrollo y la progresión del proceso neurodegenerativo es la pérdida de la regulación de la respuesta inflamatoria. Normalmente, la respuesta inflamatoria es reparadora y autolimitada. Sin embargo, en las enfermedades crónico-degenerativas dicha respuesta se caracteriza por la producción anormal de citocinas proinflamatorias, quimiocinas, factores de crecimiento, ROS y RNS, así como por la activación de la microglía y de las células de la inmunidad adaptativa7, formando un círculo vicioso que impide que esta respuesta se autolimite.
En el contexto de la inmunidad adaptativa, las células Th17 desempeñan un papel importante en la defensa del huésped, pero en muchos casos se han asociado a varios trastornos inflamatorios, incluyendo las enfermedades neurodegenerativas como la EA8. Una de las citocinas más características de esta subpoblación celular es la IL-17A, un factor que produce señales que crean un puente entre la inmunidad innata y la adaptativa, ya que ejerce efectos en una amplia variedad de linajes celulares (macrófagos, células dendríticas, células endoteliales, etc.) e induce la expresión de diversos mediadores inflamatorios9 (citocinas, quimiocinas y factores de crecimiento).
En un modelo animal de la EA inducida por la administración del péptido βA-1-42 se demostró que las células Th17 periféricas se infiltran en el parénquima cerebral debido a la alteración de la barrera hematoencefalica10. Asimismo, se observó que la expresión de las citocinas proinflamatorias Th17, IL-17A e IL-22 en el hipocampo y la concentración de estas en el líquido cefalorraquídeo y el suero de las ratas tratadas está elevada en la aparición y el desarrollo de la EA. Estos hallazgos proporcionan una fuerte evidencia de la participación de la respuesta Th17 en la neuroinflamación de dicha enfermedad.
Es importante mencionar que se ha observado que el proceso inflamatorio en la EA no es exclusivo del sistema nervioso central (SNC). Existe una gran cantidad de evidencias que indican un papel importante de la inflamación sistémica en la patogénesis de la EA11, por lo tanto, la inflamación del SNC y la inflamación sistémica no pueden ser vistas de forma aislada. Incluso, la inflamación sistémica de bajo grado podría tener consecuencias importantes en el SNC12 y es probable que los efectos perjudiciales sean aún más severos en los sujetos con EA.
El objetivo de este trabajo fue estudiar los cambios en la frecuencia de células tipo Th17 (CD3+, CD4+, IL-17A+) en sangre periférica, la concentración de la IL-17A en el plasma y la presencia de IL-17A en el hipocampo de ratas crónicamente expuestas a bajas dosis de ozono.
Materiales y métodosAnimalesSe utilizaron 108 ratas Wistar macho de 250-300g que fueron alojadas en cajas de acrílico individuales con libre acceso a agua y alimento (NutriCubo, Purina, EE. UU.). Los animales se mantuvieron en un bioterio con condiciones de temperatura y humedad controladas. El cuidado y el manejo de los animales se realizaron de acuerdo con el National Institute of Health Guidelines for Animal Treatment y siguiendo la Norma Oficial Mexicana NOM-062-SSA-2-2002. Este estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad Nacional Autónoma de México.
Procedimiento generalLas ratas fueron separadas aleatoriamente en 6 grupos experimentales (n=18 por grupo). El grupo control fue expuesto 30 días durante 4 h a un flujo de aire libre de ozono; por otro lado, los grupos 2, 3, 4, 5 y 6 fueron expuestos a ozono (0,25ppm) durante 4h diarias 7, 15, 30, 60 y 90 días, respectivamente.
Exposición a ozonoLos animales fueron colocados dentro de una cámara con un difusor conectado a un generador de ozono de flujo variable (5l/s). Este procedimiento ha sido previamente descrito13. Brevemente, el generador utiliza aire filtrado para producir ozono. La concentración de ozono producido fue proporcional a la intensidad y flujo de aire. Asimismo, para medir la concentración de ozono dentro de la cámara se utilizó el monitor Ozone Switch Model OS-06 (Ecosensors, Alemania). Para exponer a aire libre de ozono a los animales control se utilizó la misma cámara, conectada a un flujo de aire libre de ozono.
Después de 2 h de exposición a aire u ozono, 12 animales de cada grupo fueron decapitados y la sangre procedente de la arteria carótida fue recolectada en tubos Vacutainer de 4.0ml con 7,2mg de EDTA (BD Vacutainer, NJ, EE. UU.) para la cuantificación de la frecuencia de células tipo Th17 y los niveles de IL-17A. Las 6 ratas restantes se anestesiaron profundamente con pentobarbital sódico (50mg/kg), se perfundieron con paraformaldehído al 4%. Se extrajeron los cerebros y se colocaron en la misma solución fijadora durante 24 horas a 4°C. Posteriormente, se realizaron técnicas histológicas convencionales para obtener tejido incrustado en parafina. Se cortaron secciones sagitales de 5μm de espesor y las que contenían el hipocampo se usaron para inmunofluorescencia.
Procesamiento de las muestras de sangre periféricaLas muestras sanguíneas fueron centrifugadas a 2.500rpm durante 10min. El plasma fue separado y colocado a –70°C para su conservación. Las células mononucleares de sangre periférica (PBMC) fueron aisladas mediante la realización del protocolo de Ficoll-Hypaque14. Una vez separados las PBMC, se les hizo un marcaje de superficie con los anticuerpos monoclonales FITC anti CD3 (BD Pharmigen, San Diego, California, EE.UU.) y PE-Cy5 anti CD4 (BD Pharmigen, San Diego, California, EE.UU.). Las muestras fueron incubadas con los anticuerpos por 30min a 4°C en la oscuridad y posteriormente lavadas con 1ml de PBS a 3.000rpm durante 5min. A continuación, se efectuó la permeabilización de la membrana celular utilizando el kit comercial Cytofix/Cytoperm (BD Biosciences, San Diego, California, EE.UU.); posteriormente se realizó un marcaje intracelular con el anticuerpo PE anti IL-17A (eBioscience, San Diego, California, EE.UU.).
Las células marcadas fueron resuspendidas en 0,2ml de solución de paraformaldehído al 3% para su posterior adquisición en el citómetro de flujo.
Niveles plasmáticos de la interleucina-17ALas muestras de plasma fueron descongeladas a temperatura ambiente para ser analizadas por el equipo Magpix (Bio-Plex® MAGPIX™ Multiplex Reader, Biorad), utilizando un kit comercial para la cuantificación de 9 analitos (Milliplex MAP Rat Cytokine/Chemokine Magnetic Bead Panel, Merck, Billerica, MA, EE.UU.). Las curvas estándar se elaboraron con estándares premezclados que están incluidos en el kit. La intensidad media de fluorescencia de cada muestra fue obtenida automáticamente a través del software Milliplex® Analyst 5.1 (Life Science Research).
Frecuencia de las células T CD4+ productoras de interleucina-17ALas células marcadas fueron evaluadas por citometría de flujo. Los datos adquiridos fueron exportados al software de análisis FlowJo 10.2 (Treestar, Ashland, Oregón, EE. UU.).
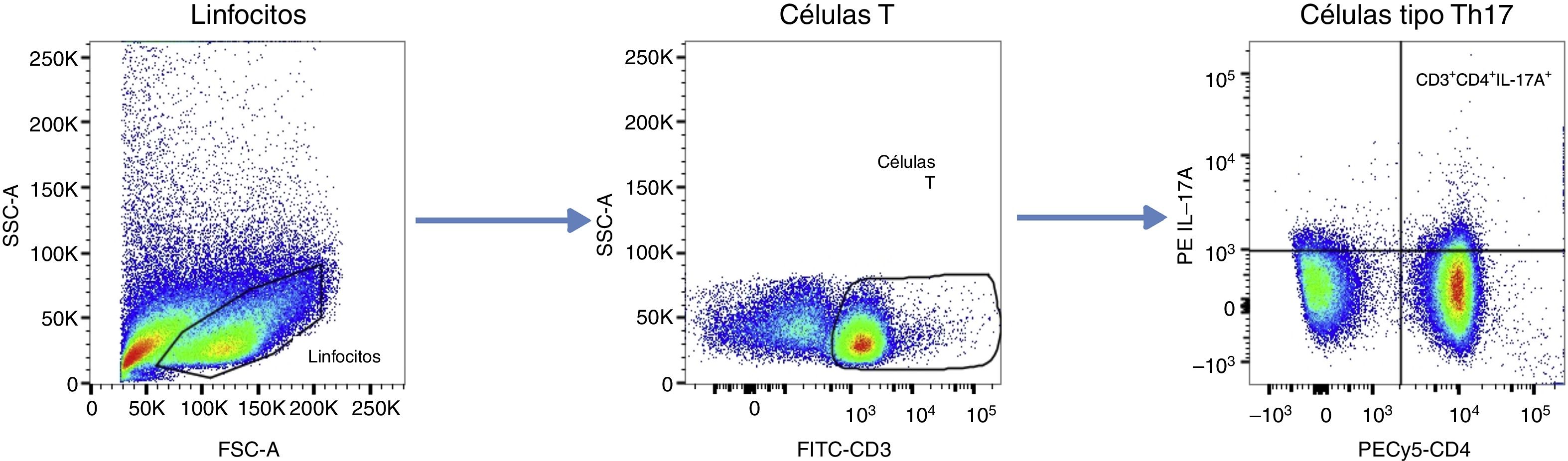
Para ajustar las ventanas de los gráficos de análisis, se utilizaron controles «fluorescence minus one». Los datos se presentan como frecuencias celulares (%), siguiendo el algoritmo de análisis que se presenta en la figura 1. Se definió como «células T CD4+ productoras de IL-17ª» o tipo Th17 a las CD3+, CD4+ e IL-17A+.
Algoritmo de análisis de citometría de flujo. Posterior a la discriminación de dobletes, las células linfoides fueron seleccionadas y las células T fueron identificadas con base en la expresión de CD3. La frecuencia de células T CD4+ productoras de IL-17A fue cuantificada. Las ventanas fueron ajustadas por medio de los controles FMO. Los datos se presentan como frecuencias celulares (%).
Las laminillas de tejido del hipocampo se desparafinaron con xileno y se rehidrataron. Después, las secciones se lavaron con solución salina tamponada con solución de fosfato (PBS 50mM, NaCl 0,15M, pH 7,4) y se incubaron con 2% de albúmina de suero bovino libre de ácidos grasos (fracción V de albúmina de suero bovino libre de ácidos grasos [MP Biomedical, LLC, Darmstadt, Alemania]) durante 30min para evitar la unión no específica. Las muestras se impregnaron con Triton™ 100x al 0,2% en PBS durante 10 min y, posteriormente, se realizó una incubación durante la noche a 4°C con el anticuerpo anti-IL17A de conejo. Después de lavar los portaobjetos, las muestras fueron incubadas con un anticuerpo de burro IgG anti-conejo acoplado al fluorocromo Alexa Fluor® 488. Las muestras se montaron sobre un portaobjetos de vidrio con el medio Vectashield (Vector Laboratories, Burlingame, CA, EE. UU.). Las secciones representativas del cerebro de cada grupo se examinaron con el microscopio Axioimager A2 (Zeiss, Jena, Alemania) y se fotografiaron con una cámara Axiocam HRm (Zeiss, Jena, Alemania), controlados por el software Zen (Zeiss, Jena, Alemania).
Análisis estadísticoSe realizó el análisis estadístico con el paquete R 3.3.2 para Mac. Se aplicó la prueba de normalidad Shapiro-Wilk para los datos correspondientes a la población estudiada.
Una vez que se estableció que el conjunto de datos no tenía una distribución normal, se realizó la prueba no paramétrica Kruskal-Wallis para identificar diferencias entre grupos y un análisis post hoc mediante la prueba de Tukey.
Asimismo, se calculó el coeficiente de correlación de Pearson para identificar el grado de covariación entre la frecuencia de células tipo Th17 y la concentración de IL-17A en suero.
La p<0,05 se considera como estadísticamente significativa.
ResultadosFrecuencia de las células tipo Th17 en sangre periféricaCon la finalidad de conocer si existe una asociación entre los niveles secretados de la IL-17A y las células tipo Th17, se calculó el coeficiente de correlación de Pearson, obteniéndose una r=0,3780812 (t34=2,3813, p=0,02299); esto nos indica que existe una correlación positiva débil.
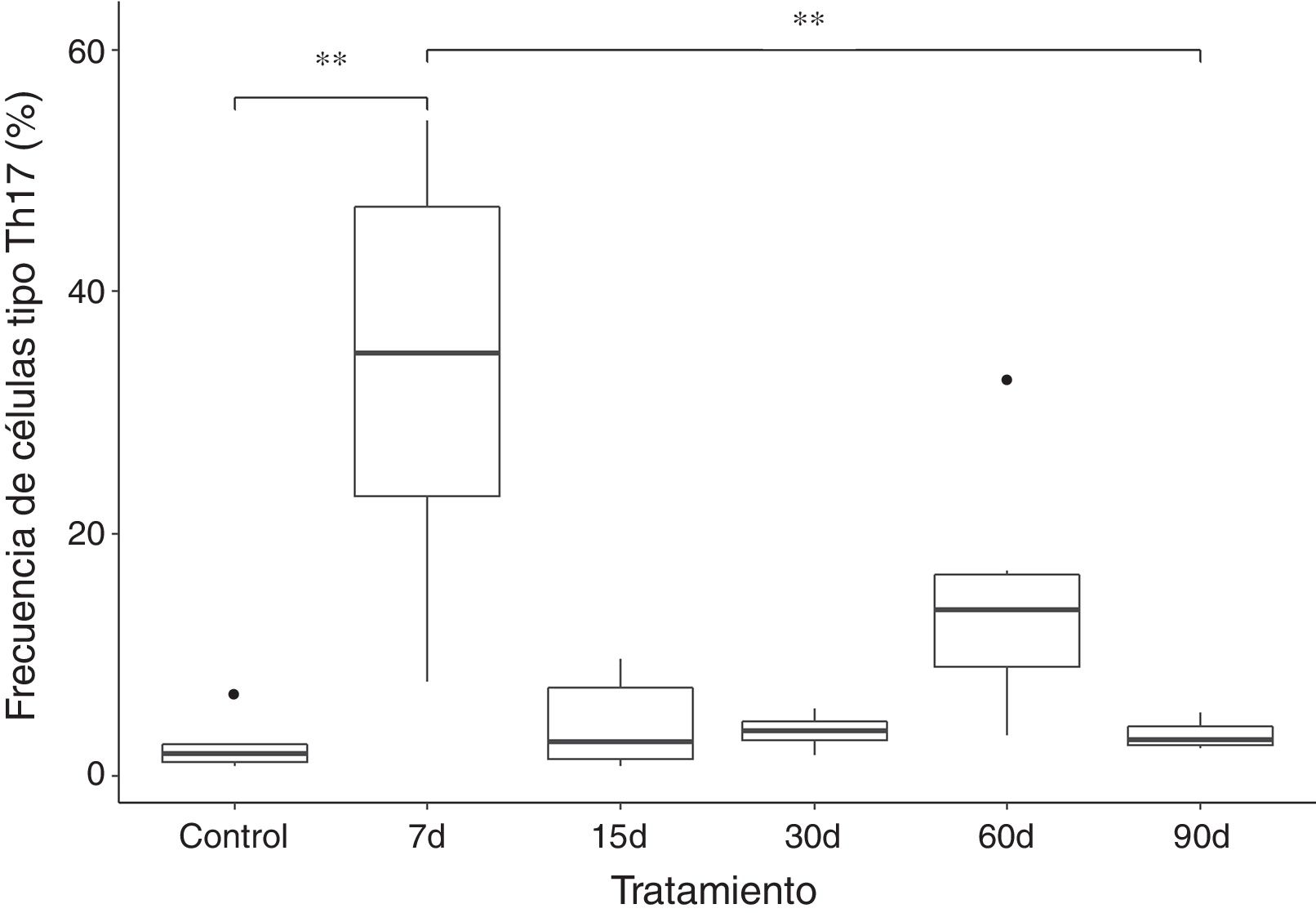
Los resultados muestran que la frecuencia de las células tipo Th17 aumenta aproximadamente 10 veces en el grupo que fue expuesto a ozono durante 7 días, al compararse con el grupo control y de 90 días de exposición. El incremento de esta población celular parece ser un efecto a corto plazo, ya que, posterior a ese tiempo ocurre una caída en la frecuencia de las células T CD4+ productoras de IL-17A. Sin embargo, podemos observar que a los 60 días de exposición a ozono existe una tendencia a incrementar la frecuencia de células tipo Th17, la cual no es significativa (fig. 2).
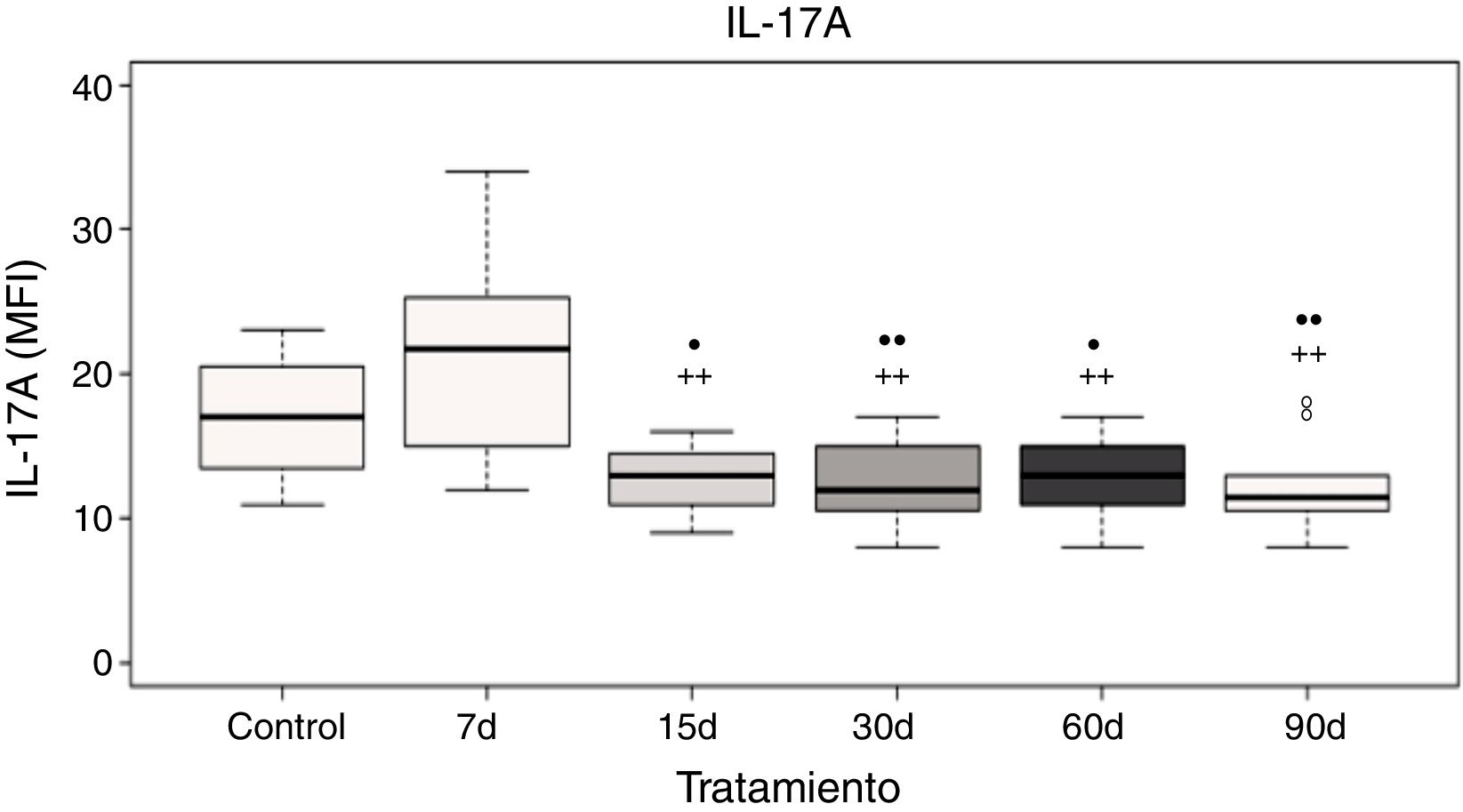
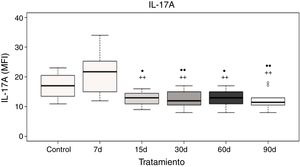
Niveles plasmáticos de interleucina-17AEl análisis de los datos muestra que no hubo diferencias significativas de la IL-17A a los 7 días de exposición a ozono cuando se compara con el grupo control; sin embargo, existe un incremento significativo en los niveles de la IL-17A a los 7 días de exposición a ozono cuando se compara con los grupos de 15, 30, 60 y 90 días de exposición a ozono (p<0.05). Además, los grupos de 15, 30, 60 y 90 días de exposición a ozono muestran un decremento significativo en los niveles de la IL-17A cuando se comparan con el grupo control (p<0,05) (fig. 3).
Niveles de la IL-17A en el plasma de ratas expuestas a ozono (7, 15, 30, 60 y 90 días) contra controles expuestos 30 días a un flujo de aire. El círculo negro (•) representa a un grupo con diferencia estadísticamente significativa con el control (ctrl), p < 0,05; los dos círculos negros (••) representan diferencias significativas con el control con un valor de p < 0,01. Los símbolos de suma representan las diferencias estadísticas de los tratamientos contra el grupo expuesto a ozono durante 7 días (+) p < 0,05 y (++) p < 0,01.
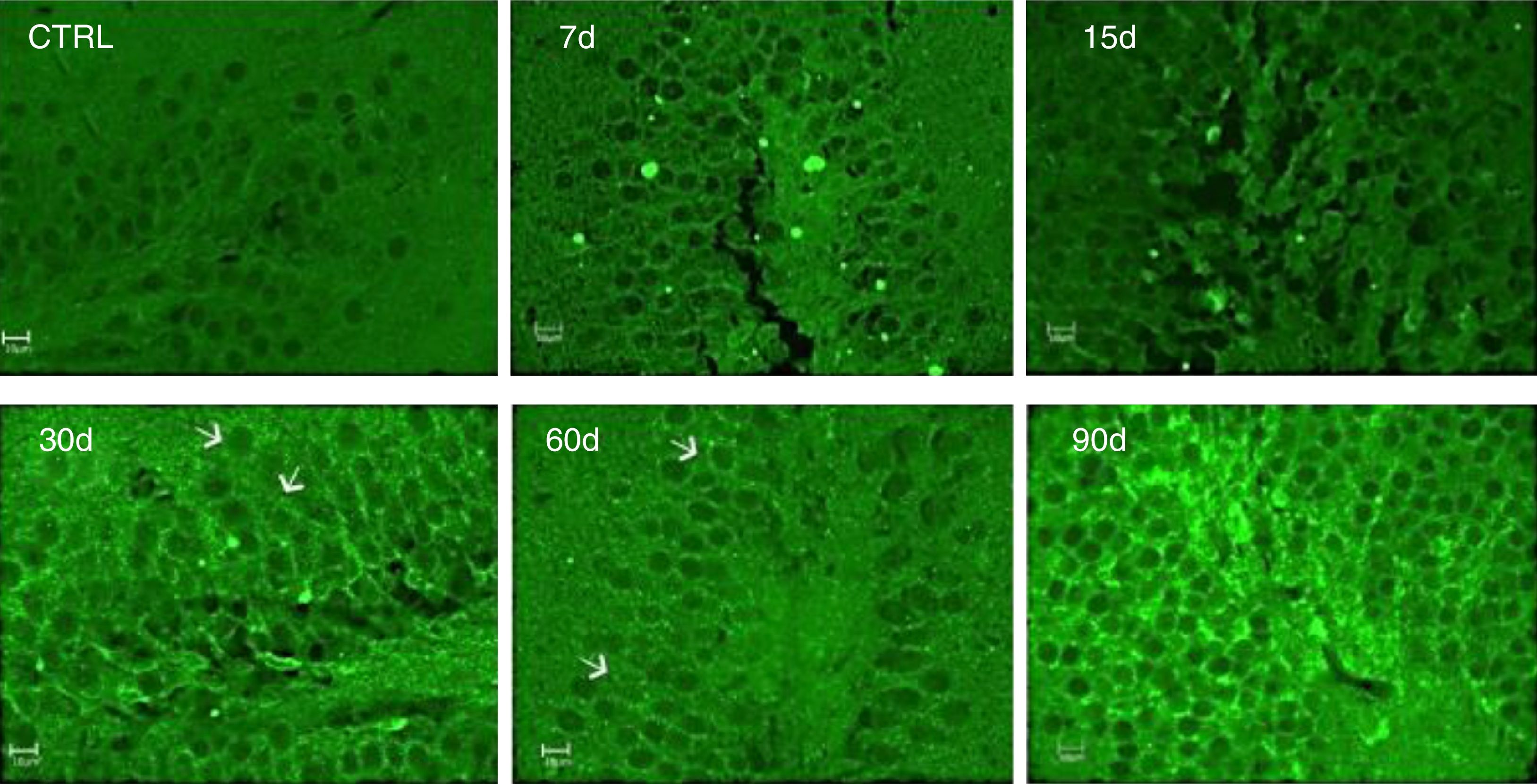
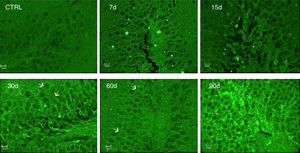
La inmunorreactividad a IL-17A fue evaluada por la técnica de inmunofluorescencia. Los resultados muestran un incremento de la IL-17A en el tejido hipocampal a los 30, 60 y 90 días de la exposición a ozono (fig. 4).
Efecto de la exposición a dosis bajas de ozono en la inmunorreactividad hipocampal a la IL-17A. Los animales fueron expuestos durante 7, 15, 30, 60 y 90 días. Las imágenes muestran el giro dentado a una magnificación de 40x. Nótese que la inmunorreactividad a la IL-17A incrementa considerablemente a los 30, 60 y 90 días de exposición. Las flechas indican la inmunorreactividad a la IL-17A.
Es importante mencionar que se observó inmunorreactividad a la IL-17A por parte de las neuronas del giro dentado.
DiscusiónLa exposición crónica a dosis bajas de ozono causa un estado de estrés oxidativo, el cual, dependiendo del tiempo de exposición, lleva a un proceso de neurodegeneración progresiva que se vuelve irreversible a partir de los 30 días de exposición15. Este proceso va acompañado de alteraciones metabólicas16, cambios en las vías de señalización intracelular17 y pérdida de la regulación de la respuesta inflamatoria a nivel tisular18; sin embargo, los cambios a nivel sistémico asociados a este proceso aún no están claros.
Como se puede observar, en este estudio se muestra un incremento de la IL-17A en el plasma de las ratas expuestas a bajas dosis de ozono a los 7 días de exposición y una disminución de IL-17A a partir de los 15 días, hasta los 90 días de exposición a dicho gas. Una respuesta similar a la anterior ocurre a nivel sistémico cuando analizamos la respuesta de los linfocitos tipo Th17; los resultados muestran también un incremento en la frecuencia de los linfocitos tipo Th17, seguido por una disminución de esta subpoblación celular a medida que se establece el proceso de neurodegeneración progresiva en el hipocampo de ratas expuestas a ozono. El incremento de la IL-17A y de los linfocitos tipo Th17 en la circulación periférica se presenta cuando el daño en el hipocampo aún es reversible. No obstante, cuando observamos la inmunorreactividad a la IL-17A en el tejido hipocampal, encontramos un incremento de su expresión a los 30, 60 y 90 días, precisamente cuando el proceso de neurodegeneración progresiva que se ha establecido ya es irreversible5.
A pesar de que las células T CD4+ pudieran ser la fuente principal de la IL-17A, en este estudio encontramos que existe una correlación positiva débil entre la IL-17A en el plasma y la frecuencia de las células tipo Th17, es decir, que otras poblaciones celulares pueden estar involucradas en la producción de esta citocina. En ese sentido, también se ha observado, que después de la exposición subaguda a ozono (0,3ppm O3 durante 24-72h) aumenta la expresión del ARNm del mensajero de la IL17A en los pulmones de ratones19 y que las principales productoras de la citocina eran los linfocitos T γδ.
Los resultados de este trabajo indican que el primer efecto observable tras la exposición a bajas dosis de ozono es una respuesta Th17/IL-17A sistémica que puede ser inducida por las especies reactivas producidas por la inhalación de ozono20. En este caso, la respuesta inflamatoria proviene de un sistema que aún se encuentra en equilibrio redox, en el cual las defensas antioxidantes todavía pueden proveer una protección contra los agentes oxidantes21. Sin embargo, la producción prolongada y persistente de especies reactivas, que genera un estado de estrés oxidativo, inhibe la proliferación de las células T y conduce a la muerte celular22. Es decir que es probable que la exposición crónica a ozono pueda provocar una disminución en la proliferación de las células productoras de IL-17A en la periferia. No obstante, debido a que el tejido hipocampal ya ha sido dañado, las señales de daño celular podrían ser las que inducen la secreción de IL-17A en distintos tipos celulares, incluyendo las neuronas del hipocampo. Lo anterior sería la causa que podría explicar el aumento de esta citocina en el hipocampo a los 30, 60 y 90 días de exposición.
Este estudio indica que la exposición crónica a contaminantes ambientales como al ozono en bajas dosis, por tiempos prolongados, está asociada a enfermedades crónico degenerativas, ya que causa un estado de estrés oxidativo crónico en el organismo. Dicho estado puede alterar la regulación de las vías de la respuesta inflamatoria, lo que conduce al aumento de una respuesta de tipo Th17. Nuestros resultados indican que dicha respuesta es, en primer lugar, inespecífica y sistémica; sin embargo, cuando los tejidos ya han sido dañados y el daño es progresivo e irreversible —como se ha observado en el hipocampo después de 30 días de exposición a ozono— la respuesta inflamatoria se convierte en una respuesta de tipo específica de tejido e involucra la acción de células residentes como las neuronas.
Una mejor comprensión de los eventos que permiten la transición de una respuesta inflamatoria Th17/IL-17A predominantemente sistémica a una local nos ayudará a entender mejor la inmunopatogénesis de la EA, lo que a futuro nos permitirá identificar posibles blancos moleculares que ayuden a prevenir el desarrollo de la enfermedad.
FinanciaciónEste proyecto de investigación fue financiado por la Dirección General de Asuntos de Personal Académico (IN22114 a SR-A).
Conflicto de interesesLos autores declaran no tener conflictos de interés.
Agradecemos a la Dra. Yolanda López-Vidal su generoso apoyo el cual nos permitió llevar a cabo la técnica de citometría de flujo, así como también a la Dra. Nancy Mejía, de la Red de Apoyo a la Investigación (UNAM), por apoyarnos con el análisis estadístico de los resultados de este trabajo. De igual forma, damos las gracias a Gabino Borgonio-Pérez por su ayuda en el manejo de animales de laboratorio y la toma de muestras.