La enfermedad de Huntington (EH) es un trastorno neurodegenerativo y hereditario. A partir del diagnóstico predictivo se han descrito características clínicas incipientes en la fase prodrómica, y varios estudios han reportado aumento de síntomas psiquiátricos en portadores de la mutación causante de la EH, sin síntomas motores, en esta fase.
Objetivo Identificar malestar psicológico en portadores de la mutación causante de la EH sin síntomas motores, mediante el Symptom Checklist 90 (SCL-90), y correlacionar con la carga y cercanía de la enfermedad.
MétodoUna muestra de 175 participantes de un Programa de Diagnóstico Predictivo de EH (PDP-EH) se dividió en portadores PEH (39,4%) y no portadores NPEH (61,6%) de la mutación causante de EH. Mediante fórmulas matemáticas se obtuvo la carga de enfermedad y cercanía a la etapa manifiesta en el grupo PEH y se correlacionó con los resultados del inventario SCL-90-R.
ResultadosAl comparar los resultados obtenidos en el SCL-90-R de los PEH y NPEH, la diferencia se observa en el índice de malestar por síntomas positivos, donde los portadores obtienen mayor puntuación promedio. Las correlaciones entre carga de enfermedad y síntomas psicológicos se dan en los dominios: obsesiones y compulsiones, sensibilidad interpersonal, hostilidad, índice de severidad global e índice de malestar somático positivo. Se observa una correlación baja entre la carga de enfermedad y las puntuaciones obtenidas en el malestar psicológico.
ConclusionesEn general encontramos que el grupo PEH obtiene un puntaje mayor en las dimensiones evaluadas con el SCL-90, muestran relación con la carga y diferencias por la cercanía de la enfermedad. Puntajes mayores en las dimensiones del SCL-90-R en portadores del gen para la EH pueden sugerir un hallazgo temprano de la sintomatología psicológica en la enfermedad.
Huntington's disease (HD) is a neurodegenerative and hereditary disorder, due to the predictive diagnosis, incipient clinical characteristics have been described in the prodromal phase. Several studies have reported an increase in psychiatric symptoms in carriers of the HD gene without motor symptoms.
ObjectiveTo identify psychological distress in carriers of the mutation that causes HD, without motor symptoms, utilizing the Symptom Checklist 90 (SCL-90), and to correlate with the burden and proximity of the disease.
MethodA sample of 175 participants in a HD Predictive Diagnostic Program (PDP-HD) was divided into HEP carriers (39.4%) and NPEH non-carriers (61.6%) of the HD-causing mutation. By means of mathematical formulas, the disease burden and proximity to the manifest stage in the PEH group were obtained and it was correlated with the results of the SCL-90-R.
ResultsComparing the results obtained in the SCL-90-R of the PEH and NPEH, the difference is observed in the positive somatic male index, where the PEH obtains higher average scores. The correlations between disease burden and psychological distress occur in the domains; obsessions and compulsions, interpersonal sensitivity, hostility, global severity index and positive somatic distress index. A low correlation is observed between the burden of disease and the scores obtained in psychological discomfort.
ConclusionsIn general, we found that the PEH group obtained a higher score in the dimensions evaluated with the SCL-90-R, showing a relationship with the burden and differences due to the proximity of the disease. Higher scores on the SCL-90-R dimensions in carriers of the HD gene may suggest an early finding of psychological symptoms in the disease.
La enfermedad de Huntington (EH) es un trastorno neurodegenerativo, autosómico dominante. El diagnóstico molecular se realiza cuantificando el número de repeticiones del triplete CAG. Menos de 27 repeticiones del triplete CAG se considera normal; entre 27 y 35 repeticiones se considera no penetrante; de 36 a 39 penetrancia reducida, y >40 penetrancia completa1,2.
La EH se manifiesta en la edad adulta con síntomas motores, cognitivos y psiquiátricos. El diagnóstico clínico se basa en la presencia de síntomas motores que incluyen corea, rigidez y bradicinesia. Los cambios cognitivos se caracterizan por problemas progresivos en el aprendizaje, atención y funciones ejecutivas, lo que puede generar un cuadro demencial3. Las manifestaciones psiquiátricas reportadas con frecuencia son depresión, irritabilidad, apatía, perseveraciones, obsesiones y ocasionalmente psicosis4.
Los síntomas psiquiátricos son un aspecto relevante en la EH; su presentación y progresión es variable debido a la degeneración diferencial de los circuitos estriato-corticales, su curso no se correlaciona con la progresión de los síntomas motores o cognitivos a excepción de la apatía5,6. Pueden surgir en diferentes fases de la enfermedad, de forma atípica, incluso 20 años previos al inicio de las manifestaciones motoras7.
Epping et al.8 encontraron que la prevalencia de síntomas en pacientes prodrómicos con EH no es diferente a la de la población general. Aunque existe una asociación entre el número de repeticiones de CAG y la edad de inicio de la EH, esta explica sólo una proporción (60%); aun cuando considera factores ambientales, no cuestiona la variación genética subyacente, ni se ha asociado a la gravedad de las manifestaciones psicológicas y psiquiátricas.
Varios estudios han cuestionado la prevalencia de los síntomas psiquiátricos en portadores de la mutación causante de la enfermedad, reportando aumento de dichos síntomas en la fase prodrómica de la EH9–12. El grupo de investigación PREDICT-HD13 analizó trastornos del estado de ánimo o afectivos (depresión, desesperanza y angustia emocional), utilizando evaluaciones autoinformadas y contestadas por el informante, reportando que el nivel promedio de malestar psicológico de las personas portadoras de la mutación causante de la EH es mayor en comparación con aquellas que no son portadoras de la mutación14,15. Estos autores sugieren, además, que los niveles de angustia se asocian en forma positiva con las puntuaciones motoras, por lo que las personas con probable EH, sin sintomatología motora, tienden a estar emocionalmente más estables que aquellos que sí la presentan15.
Gracias a las pruebas de diagnóstico predictivo para la EH, y al estudio de la carga y cercanía de la enfermedad, se han podido describir características clínicas incipientes que se presentan en la fase prodrómica y proponer marcadores clínicos de la enfermedad, además de estudiar el desarrollo de manifestaciones clínicas, como las psiquiátricas, a lo largo del tiempo. Por manifestaciones psiquiátricas nos referimos a síntomas emocionales, conductuales, psicológicos y psiquiátricos.
Para este estudio utilizamos el Inventario de Síntomas de Derogatis (SCL-90-R)16, con el objetivo de describir y analizar el malestar psicológico entre portadores (sin síntomas motores) y no portadores de la mutación causante de EH. Nuestras hipótesis sugieren que algunos dominios específicos del SCL-90-R permitirán identificar manifestaciones psicológicas en portadores de la mutación causante de la EH sin síntomas motores, además de que dichas manifestaciones se relacionan con la carga y cercanía de la enfermedad.
Material y métodoEl Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez (INNNMVS), a través del departamento de Genética, ofrece a personas en riesgo de heredar EH participar en el Programa de Diagnóstico Predictivo para la Enfermedad de Huntington (PDP-EH)17, siguiendo las directrices recomendadas por la Asociación Internacional de Huntington, la Federación Mundial de Neurología y el Grupo de Investigación sobre la Corea de Huntington18 y está aprobado por los comités de investigación y ética del INNNMVS.
El procedimiento del PDP-EH es: primero, se brinda asesoramiento genético, se solicita consentimiento informado de manera verbal y escrita19 (para las evaluaciones y muestra de sangre), se realizan todas las valoraciones (neurológica, neuropsicológica y psiquiátrica), y posteriormente se toma la muestra sanguínea y finalmente se realiza el análisis genético.
Para fines de este trabajo se analizaron datos de 175 participantes del PDP-EH, que durante el período de 2002 a 2019 cumplieron criterios de inclusión como ser mayores de 18 años, tener antecedentes familiares confirmados (con diagnóstico molecular) para la EH, no estar embarazada, no acudir bajo presión externa. El no otorgar el consentimiento y/o no concluir alguna fase del programa se consideraron como criterios de exclusión.
Se aplicó la Escala Unificada de valoración de la EH (UHDRS); como parte de la evaluación neuropsicológica se utilizó el Mini Mental State Examination (MMSE)20, los inventarios de depresión21 y ansiedad de Beck22, así como la evaluación de síntomas psiquiátricos obtenida mediante el inventario SCL-90-R16.
El Inventario de Depresión de Beck (BDI-IA)21 valora la presencia de síntomas de depresión en la semana previa a la aplicación mediante autoinforme, y consta de 21 ítems. La puntuación de severidad va de 0 a 63, y tiene adecuada consistencia interna (α=0,87). La puntuación utilizada como punto de corte para depresión y ansiedad severa fue de 31 puntos o más en las escalas de Beck. El Inventario de Ansiedad de Beck (BAI)22 consta de 21 ítems que evalúan la presencia de síntomas de ansiedad durante la última semana. La puntuación va de 0 a 63, y cuenta con una adecuada consistencia interna (α=0,911).
El SCL-90-R16 es un instrumento autoaplicado que evalúa el grado de malestar psicológico actual que experimenta una persona. Se utilizó la versión validada en población mexicana, que consta de un listado de 90 síntomas psiquiátricos con varios niveles de severidad, frente a los cuales la persona debe indicar en qué medida lo han molestado o perturbado cada uno de esos problemas durante el período comprendido entre el día de la evaluación y la semana inmediatamente anterior. Para responder, se ofrece una escala de 5 opciones: «nada», «muy poco», «poco», «bastante» y «mucho», valorada en un rango de 0 a 4 puntos. Una vez puntuadas las respuestas es posible caracterizar la sintomatología del evaluado en un perfil compuesto por 9 dimensiones primarias de síntomas (somatización, obsesiones, sensibilidad interpersonal, depresión, ansiedad, hostilidad, ansiedad fóbica, ideación paranoide y psicoticismo) y 3 índices globales de psicopatología: el índice de Gravedad Global (Global Severity índex [GSI]); el Índice de malestar por síntomas positivos (Positive Symptom Distress Index [PSDI]), que evalúa el estilo de respuesta, detectando tendencias a la minimización o a la exageración del estado de malestar, y el Total de Síntomas Positivos (Positive Symptom Total [PST]).
Manejo de datos y análisis estadísticoLos resultados obtenidos en las diferentes evaluaciones del PDP-EH se ingresaron a una base de datos en el programa SPSS versión 22.0. Para cumplir con los objetivos de este estudio se realizó la depuración de datos de dicha base de acuerdo a los siguientes criterios de exclusión: antecedentes de riesgo suicida o cualquier trastorno psiquiátrico no tratado, desconocimiento del resultado molecular, síntomas evidentes de la EH o de algún otro padecimiento neurológico. Finalmente, la muestra estuvo constituida por 175 personas, quienes completaron las escalas de valoración aplicadas y cumplieron los criterios establecidos, representando un 92,5% de la muestra total de 189 solicitantes de PDP-EH.
La muestra se categorizó como en otros estudios23–26 y se dividió en dos grupos: portadores de la mutación causante de la EH (PEH) aquellos que tuvieran ≥36 repetidos CAG del gen de la huntingtina y no portadores de la mutación causante de la EH (NPEH) quienes tuvieran ≤35 repeticiones CAG.
Una vez determinado el número de repetidos CAG en cada participante se buscó el valor de la carga de enfermedad (CAP=(Age at entry)× (CAG–35,5), fórmula propuesta por Penney et al.25, que es la más reportada y utilizada en estudios internacionales). Se obtuvo un rango de 30,00 a 957,00 (M=294,65; DE 122,22).
Se analizó la normalidad estadística de los datos mediante la prueba de normalidad de Kolmogorov-Smirnov. Se realizó análisis descriptivo de los datos demográficos, de las escalas de Ansiedad y Depresión de Beck, puntuaciones totales del MMSE y se compararon entre portadores (PEH) y no portadores (NPEH); dependiendo de la normalidad de los datos se utilizó Chi-cuadrada o Test de Fisher para las variables categóricas y t-test o U de Mann-Withney para conocer las diferencias por grupos. La correlación entre las variables se estudió mediante la prueba rho de Spearman. Por último, se realizó regresión lineal múltiple para estimar la fuerza de las asociaciones entre carga de la enfermedad y síntomas psiquiátricos. Se calcularon el coeficiente de regresión (β), valor p, R2 ajustado y los factores de inflación de la varianza. Para todas las comparaciones, se asumió un valor α=0,05.
Posteriormente, usamos la fórmula de Brandt et al.26 para categorizar a los PEH en tres grupos: 1) un grupo denominado «Lejos», es decir, lejano al diagnóstico, estimando que tardará más de 15 años en presentar síntomas cognitivos y ser diagnosticado; 2) un grupo denominado «Medio», estimando la presencia de síntomas cognitivos y/o posible diagnóstico entre 9 y 15 años; y 3) un grupo denominado «Cerca» con probabilidad de presentar síntomas cognitivos y diagnóstico cercano, estimado en menos de 9 años.
Debido a que las personas que participaron en PDP-EH provenían de zonas urbanas, se usaron datos de población general para producir puntuaciones T específicas para los resultados del SCL-90-R durante todo el análisis estadístico. Los puntajes del inventario SCL-90-R (variables dependientes) se compararon mediante Kruskal-Wallis, siendo la variable independiente la cercanía a la etapa manifiesta (cerca, medio, lejos).
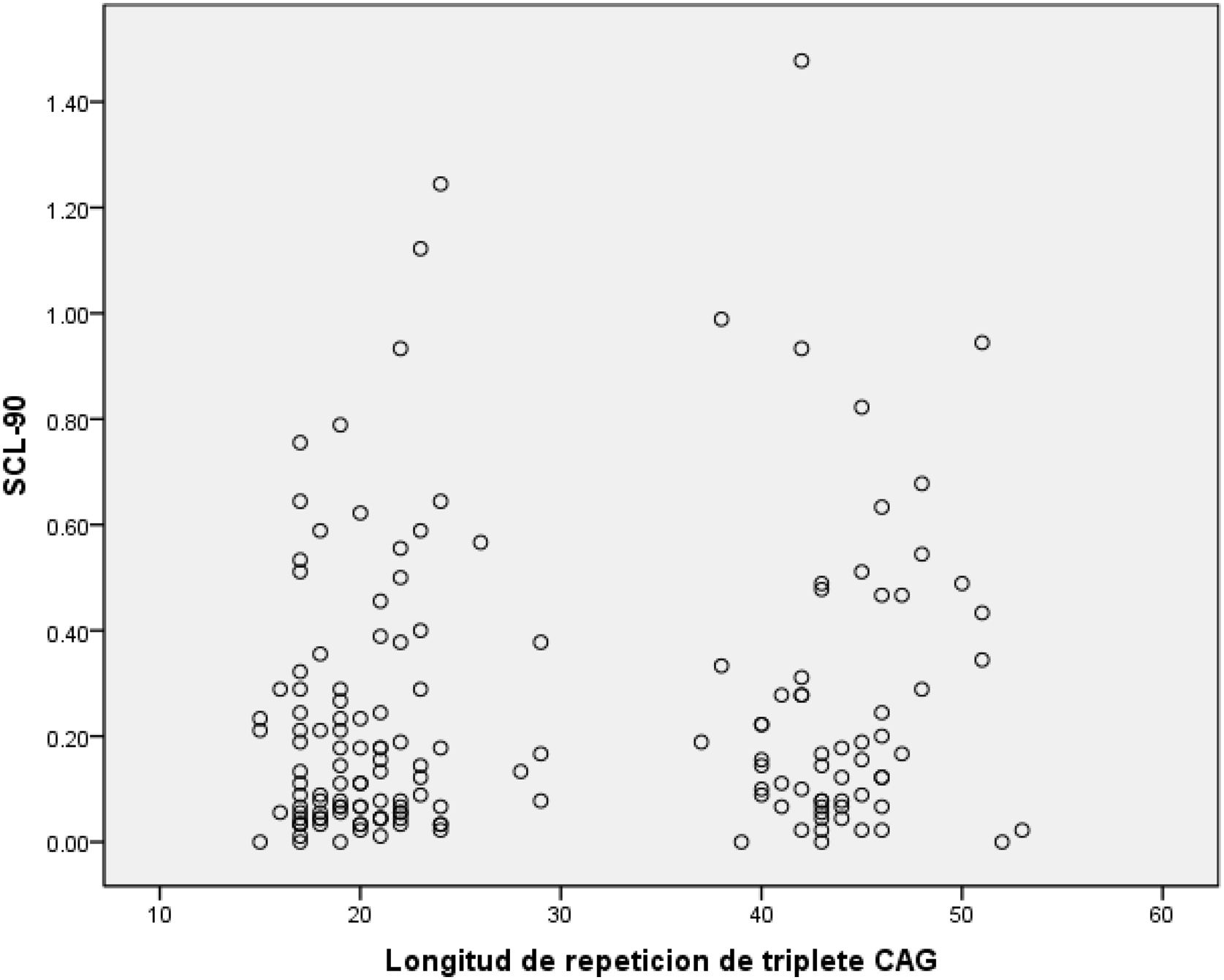
ResultadosDe los 175 participantes del PDP-EH, 69 (39,4%) fueron PEH y 106 (61,6%) NPEH. La media del número de repetidos CAG fue de 44,2 (DE 3,3 [R 37-53]) para los PEH y 20,5 (DE 3,7 [R 15-29]) para los NPEH (fig. 1). No hubo diferencias estadísticamente significativas en cuanto a edad y escolaridad entre grupos. Se observa un porcentaje mayor de mujeres en el grupo NPEH.
Para este estudio solo se tuvieron en cuenta los participantes sin deterioro cognitivo evaluado con el MMSE y un UHDRS de (0), que obtuvieron puntuaciones en los rangos de leve a moderado en los cuestionarios de Depresión y Ansiedad de Beck; por criterios de exclusión del PDP-EH los participantes con depresión severa no fueron incluidos. Del total de los participantes, un 6,3% presentó depresión leve, el 1,2% moderada, el 15,3% ansiedad leve y el 5,1% moderada. No hubo diferencias estadísticamente significativas en los puntajes totales de depresión y ansiedad entre grupos. Se observaron diferencias significativas en el MMSE (p=0,001). La tabla 1 describe dichas variables por grupo de pertenencia.
Variables demográficas, de salud mental y MMSE de ambos grupos
| Grupo | ||||
|---|---|---|---|---|
| PEH | NPEH | |||
| (n=69) | (n=106) | F | p | |
| Sexo | ||||
| Femenino | 38 (55,1) | 67 (63,6) | 0,361* | 0,548 |
| Masculino | 31 (44,9) | 39 (36,4) | ||
| Edad | ||||
| M (DE) | 35,3 (10,1) | 37,3 (11,6) | 1,229 | 0,221 |
| Rango | 20-63 | 19-66 | ||
| Escolaridad | ||||
| M (DE) | 14,4 (2,9) | 14,0 (3,2) | 0,945 | 0,346 |
| Rango | 7-18 | 6-18 | ||
| Depresión | ||||
| M (DE) | 3,5 (4,5) | 2,1 (3,2) | 2,126 | 0,023 |
| Rango | 0-25 | 0-25 | ||
| Ansiedad | ||||
| M (DE) | 4,4 (6,0) | 3,8 (6,1) | 0,572 | 0,568 |
| Rango | 0-30 | 0-30 | ||
| MMSE | ||||
| M (DE) | 27,8 (1,9) | 28,9 (1,2) | –4,566 | 0,001 |
| Rango | 23-30 | 23-30 | ||
| CAG | ||||
| M (DE) | 44,2 (3,3) | 20,5 (3,7) | 2.258,902 | 0,001 |
| Rango | 37-53 | 15-29 | ||
DE: desviación estándar; M: media; MMSE: Mini Mental State Examination; NPEH: no portadores de la enfermedad de Huntington; PEH: portador con enfermedad de Huntington.
Al comparar los resultados obtenidos del inventario SCL-90-R de los PEH y los NPEH, se observa que los portadores obtienen puntuaciones más altas en todas las dimensiones de síntomas psiquiátricos (tabla 2), aunque solo se observan diferencias estadísticamente significativas en el índice de malestar por síntomas positivos, donde el grupo PEH obtiene mayor puntuación promedio (1,32, DE=0,32) a diferencia del grupo NPEH (1,24, DE=0,39).
Malestar psicológico según SCL-90-R entre PEH y NPEH
| Grupos | ||||||
|---|---|---|---|---|---|---|
| PEH(n=69) | NPEH(n=106) | |||||
| Variable | M | DE | M | DE | F | p |
| Somatizaciones | 0,30 | 0,30 | 0,27 | 0,32 | –0,950 | 0,342 |
| Obsesiones y compulsiones | 0,45 | 0,47 | 0,34 | 0,38 | –1,298 | 0,194 |
| Sensibilidad interpersonal | 0,26 | 0,48 | 0,17 | 0,28 | –1,071 | 0,284 |
| Depresión | 0,34 | 0,37 | 0,31 | 0,37 | –0,863 | 0,388 |
| Ansiedad | 0,20 | 0,27 | 0,18 | 0,21 | –0,014 | 0,989 |
| Hostilidad | 0,26 | 0,39 | 0,14 | 0,27 | –1,792 | 0,073 |
| Ansiedad fóbica | 0,13 | 0,24 | 0,12 | 0,24 | –0,802 | 0,423 |
| Ideación paranoide | 0,23 | 0,37 | 0,22 | 0,34 | –0,358 | 0,721 |
| Psicoticismo | 0,18 | 0,31 | 0,11 | 0,23 | –1,850 | 0,064 |
| Ítems adicionales | 0,26 | 0,30 | 0,23 | 0,28 | –0,391 | 0,696 |
| GSI | 0,27 | 0,30 | 0,22 | 0,25 | –1,116 | 0,264 |
| PST | 15,34 | 16,07 | 14,40 | 14,25 | –0,064 | 0,949 |
| PSDI | 1,32 | 0,32 | 1,24 | 0,39 | –1,966 | 0,049* |
DE: desviación estándar; GSI: Global Severity Index; M: media; NPEH: no portadores de la enfermedad de Huntington; PEH: portador con enfermedad de Huntington; PSDI: Positive Symptom Distress Index; PST: Positive Symptom Total.
Los análisis de correlación muestran relación entre la carga de enfermedad y el malestar psicológico. Las relaciones se presentan en las dimensiones: obsesiones y compulsiones (rho=0,169; p=0,031), sensibilidad interpersonal (rho=0,167; p=0,034), hostilidad (rho=0,192; p=0,015), índice de severidad global (rho=0,158; p=0,046) e índice de malestar por síntomas positivos (rho=0,199; p=0,013). En general, se observan relaciones bajas; sin embargo, son relaciones positivas.
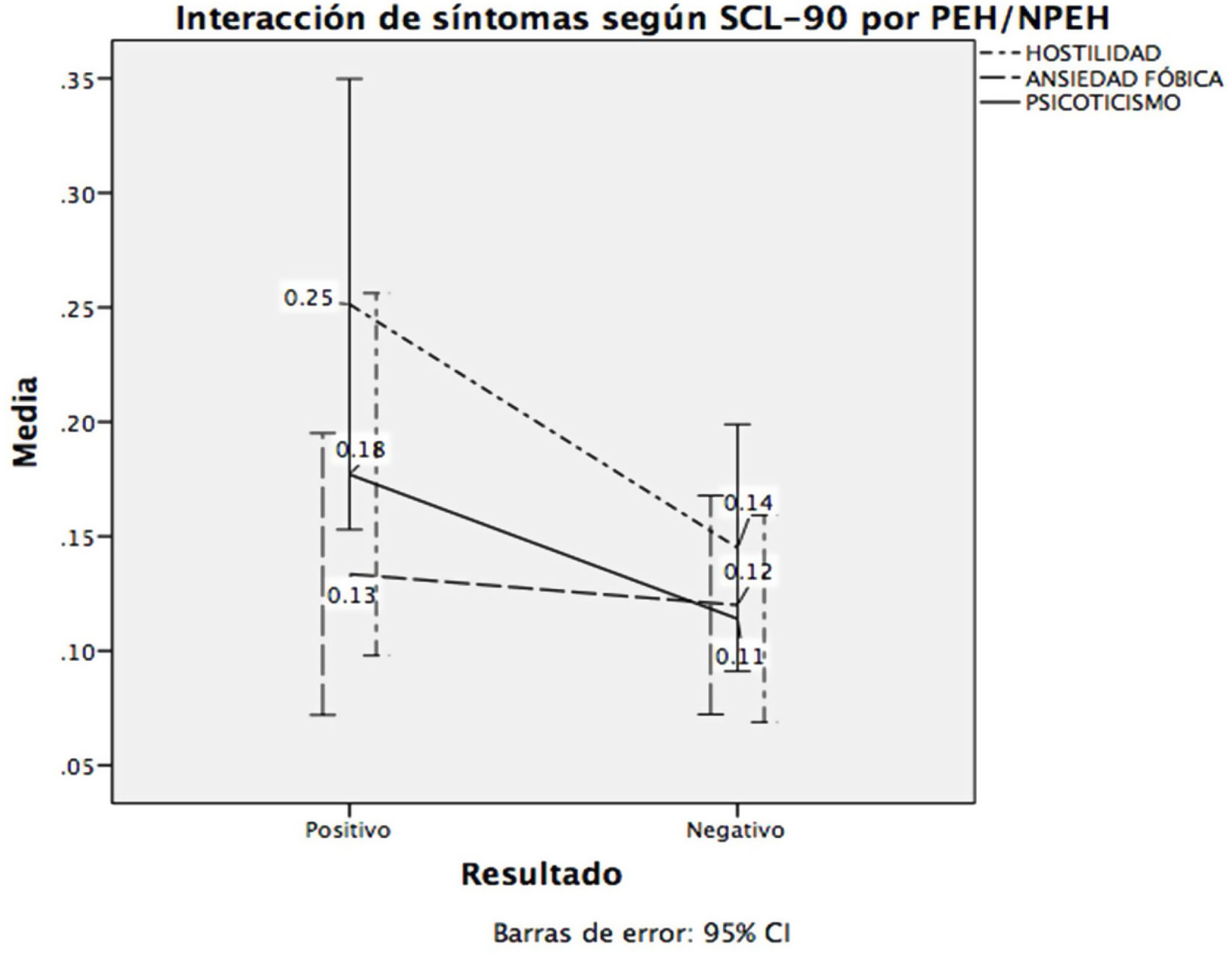
En la tabla 3 se muestra el modelo de regresión múltiple para conocer la relación entre el malestar psicológico obtenido del SCL-90-R y los PEH/NPEH; se ponderó por depresión, observando que la hostilidad, la ansiedad fóbica y el psicoticismo mostraron ser los predictores de la CAP.
Modelo de regresión múltiple entre carga de enfermedad (CAP) y dominios de los síntomas según el SCL-90 en el grupo PEH
| Variable criterio: Carga de la enfermedad (CAP) |
|---|
| Modelo general |
| R2=0,26; R2 ajustada=0,24; F=6,46; p=0,001 |
| Variables predictoras | Coeficiente estandarizado β | Valor p | FIV |
|---|---|---|---|
| Hostilidad | 0,362 | 0,001 | 1,50 |
| Ansiedad fóbica | –0,563 | 0,001 | 1,89 |
| Psicoticismo | 0,347 | 0,013 | 2,29 |
FIV: factor de inflación de la varianza; GSI: Global Severity Index; PEH: portador con enfermedad de Huntington; PSDI: Positive Symptom Distress Index; PST: Positive Symptom Total.
En la figura 2 se muestra la interacción entre estas variables con el ser o no portador de EH. Finalmente calculamos que este modelo explica el 26,9% de la varianza.
Comparación por la cercanía a la etapa manifiesta (edad de inicio de síntomas)Se categorizaron 57 de los 69 participantes del grupo PEH (82,6%) de acuerdo a la cercanía de la etapa manifiesta de la enfermedad, en 12 casos no se contó con los datos completos para poder realizar dicha categorización, quedando (n=8) en el grupo lejano, (n=15) en el grupo medio, y (n=34) en el grupo cerca. Las pruebas de Kruskal-Wallis nos indican los siguientes hallazgos post hoc: para la dimensión obsesiones y compulsiones de SCL-90-R, el grupo «Lejos» es el que obtiene la puntuación más baja a diferencia de los otros grupos; esta misma tendencia se observa en los dominios sensibilidad interpersonal, ansiedad, ansiedad fóbica, ideación paranoide. Esta misma tendencia se observa en el índice de severidad global y total de síntomas positivos (tabla 4).
Comparación por la probabilidad de inicio cercano de la fase manifiesta (tiempo de diagnóstico síntomas motores)
| Cerca | Medio | Lejos | ||||||
|---|---|---|---|---|---|---|---|---|
| n=34 | n=15 | n=8 | Kw | p | ||||
| Variable | M | DE | M | DE | M | DE | ||
| Somatizaciones | 0,26 | 0,28 | 0,43 | 0,35 | 0,23 | 0,25 | 4,967 | 0,083a |
| Obsesiones y compulsiones | 0,32 | 0,35 | 0,69 | 0,53 | 0,20 | 0,20 | 7,968 | 0,019*,a,b |
| Sensibilidad interpersonal | 0,16 | 0,27 | 0,49 | 0,63 | 0,04 | 0,06 | 6,502 | 0,039*,a |
| Depresión | 0,23 | 0,24 | 0,45 | 0,38 | 0,15 | 0,18 | 5,905 | 0,052a,b |
| Ansiedad | 0,13 | 0,21 | 0,27 | 0,21 | 0,08 | 0,08 | 10,195 | 0,006*,a,b |
| Hostilidad | 0,16 | 0,26 | 0,37 | 0,42 | 0,10 | 0,09 | 2,256 | 0,324 |
| Ansiedad fóbica | 0,09 | 0,22 | 0,22 | 0,26 | 0,03 | 0,06 | 6,218 | 0,045*,a |
| Ideación paranoide | 0,13 | 0,19 | 0,43 | 0,48 | 0,00 | 0,00 | 12,282 | 0,002*,a,b |
| Psicoticismo | 0,13 | 0,25 | 0,25 | 0,27 | 0,08 | 0,13 | 3,342 | 0,188 |
| Ítems adicionales | 0,21 | 0,29 | 0,34 | 0,32 | 0,17 | 0,12 | 2,652 | 0,266 |
| Índice de severidad global | 0,19 | 0,21 | 0,40 | 0,31 | 0,12 | 0,10 | 9,464 | 0,009*,a,b |
| Total de síntomas positivos | 13,1 | 12,7 | 25,2 | 17,5 | 9,0 | 8,2 | 8,435 | 0,015*,a,b |
| Índice malestar somático positivo | 1,18 | 0,42 | 1,42 | 0,31 | 1,38 | 0,39 | 5,177 | 0,075a |
Los valores mostrados son medias±desviaciones estándar.
DE: desviación estándar; EH: enfermedad de Huntington; M: media.
Cerca=estimado en <9 años para el diagnóstico de EH; Medio=entre 9 y 15 años para el diagnóstico de EH; Lejos=más de 15 años para el diagnóstico de EH.
Diversos estudios reportan que tanto el grupo de NPEH como el grupo PEH tienen un funcionamiento cognitivo similar, dentro de los rangos normales27,28. Sin embargo, a pesar de que los dos grupos obtuvieron resultados dentro de parámetros normales, nosotros sí encontramos diferencias estadísticas entre los grupos en el puntaje total del MMSE19. Es de amplio conocimiento que las manifestaciones psiquiátricas tienden a afectar el funcionamiento cognitivo en las personas en riesgo de desarrollar EH; por tal razón, el énfasis en el manejo de dichas alteraciones desde etapas presintomáticas de la enfermedad.
Este es el primer estudio en población hispana en analizar el malestar psicológico en portadores y no portadores de la mutación causante de EH. Aunque no se encontraron diferencias estadísticamente significativas entre grupos al valorar sintomatología de ansiedad y depresión, observamos mayor porcentaje de ansiedad (leve 14,3% y moderada 5,1%) que síntomas de depresión en el total de la muestra. Estos resultados confirman los hallazgos de Berrios et al.29 y Julien et al.4, quienes han reportado tasas de ansiedad en personas presintomáticas de EH que se encuentran entre el 11,5 y el 17%, mismas que aumentan al acercarse al diagnóstico motor30.
Aunque los síntomas de depresión se pueden presentar en cualquier momento de la evolución de la enfermedad, se han reportado niveles altos de depresión y ansiedad durante el período en que los individuos se someten a pruebas genéticas31,32, y antes del diagnóstico clínico motor de la EH33. Los síntomas psiquiátricos pueden considerarse parte de la fase prodrómica de la EH, y ser los primeros marcadores de la enfermedad, debido a que el diagnóstico clínico se hace hasta la aparición de sintomatología motora.
En general, encontramos que el grupo PEH, en comparación con el grupo NPEH, obtuvo un puntaje mayor en todas las dimensiones evaluadas con el SCL-90-R, aunque no se observaron diferencias estadísticamente significativas, lo cual se ha reportado en estudios previos12. La única diferencia estadística se observa en el índice de malestar somático positivo, en donde el grupo PEH puntuó más alto; cabe mencionar que el puntaje obtenido (menor de 4) es sospechoso de negación de síntomas o de minimización de patología34. Puntajes mayores en todas las dimensiones del SCL-90-R en portadores de la mutación causante de la EH pueden sugerir un hallazgo temprano de sintomatología psiquiátrica y pueden ser foco de atención en el tratamiento de los pacientes. La sensibilidad interpersonal, hostilidad30 y apatía35 son los síntomas más reportados en grupos de portadores de la mutación.
Se observaron relaciones bajas pero significativas entre la carga de enfermedad y el malestar psicológico evaluado con el SCL-90-R en las dimensiones: obsesiones y compulsiones, sensibilidad interpersonal, hostilidad, índice de severidad global y el índice de malestar somático. Aunque no son relaciones altas, son consistentes con lo reportado en otras investigaciones30,36. También se pudo mostrar que la hostilidad, la ansiedad fóbica y el psicoticismo son predictores de la CAP.
Al hacer comparaciones por cercanía a la etapa manifiesta, se observó que varios de los dominios del SCL-90-R (obsesiones y compulsión, sensibilidad interpersonal, ansiedad, ansiedad fóbica, ideación paranoide) mostraron diferencias significativas (p≤0,05); el grupo «Lejos» es el que obtiene la puntuación más baja a diferencia de los otros dos grupos. Estos datos son similares a lo reportado en otras investigaciones donde se ha observado sintomatología psiquiátrica antes de la aparición clínica de la enfermedad7,30,36 y concuerdan con estudios en donde utilizaron la escala SCL-90-R para evaluar personas en etapas prodrómicas de EH, mostrando mayor gravedad de síntomas psiquiátricos asociada con la proximidad del diagnóstico motor estimado30,36.
Los trastornos obsesivos compulsivos se han asociado a la progresión de la EH y déficits neuropsicológicos. Un importante número de pacientes con EH presentan síntomas obsesivos compulsivos, sin cumplir necesariamente con los criterios de trastorno obsesivo compulsivo según el DSM-V37. Los síntomas pueden expresarse en fases preclínicas o de manera importante en las fases avanzadas de la enfermedad38. Se ha reportado que aproximadamente el 27% de personas en estadios preclínicos de la EH presentan algún síntoma obsesivo-compulsivo y que el pensamiento obsesivo y la conducta compulsiva aumenta con la proximidad al diagnóstico motor, posteriormente se estabiliza39. Otro estudio reportó un 13% de síntomas obsesivos compulsivos leves y un 13% de moderados a graves40.
La ansiedad es común en la EH; su prevalencia va del 13 al 71% y se incrementa con el diagnóstico motor y la progresión de la enfermedad30,41, por eso la importancia de evaluar y tratar a los pacientes en las diferentes etapas del padecimiento.
Marshall et al.36 reportan puntuación significativamente más alta en el grupo de portadores en comparación con el grupo de no portadores de la mutación para EH, para 3 de las dimensiones de síntomas de SCL-90-R (ansiedad, ideación paranoide y psicoticismo). Se conoce que la degeneración del cuerpo estriado y el orbitofrontal-subcortical favorece la aparición de conductas socialmente inapropiadas (sensibilidad interpersonal, ideación paranoide), que al inicio de la enfermedad pueden presentarse de forma sutil e incrementar con el tiempo. Como lo reportamos en este estudio, dichas conductas tienen mayor probabilidad de presentarse en etapas cercanas al diagnóstico de los síntomas motores de la EH.
Los síntomas psiquiátricos tienen gran impacto para los pacientes ya que disminuyen la autonomía, aumentan el deterioro cognitivo y afectan la calidad de vida y funcionalidad del paciente, y para la familia generando mayor sobrecarga en el cuidado42,43.
Una limitación en este estudio pudiera ser el número de muestra diferente entre grupos (portadores y no portadores), aunque la literatura internacional reporta mayor participación de personas con resultados negativos y la diferencia ha ido disminuyendo44. Desde el inicio del PDP-EH, se ha recibido mayor número de solicitudes de ingreso de personas con resultados negativos, y más de mujeres que de hombres45. Es importante mencionar que la mayoría de población solicitante del PDP-EH es mestiza mexicana, proveniente de zonas urbanas en la Ciudad de México o zona conurbada, debido en parte a la ubicación de la institución y lejanía a comunidades rurales, lo que no permite incluir más personas a la investigación.
Aunque los criterios usados para la selección de los participantes en este estudio tienen implicaciones, ya que los resultados no pueden generalizarse a todos las personas en riesgo de EH, los resultados obtenidos concuerdan con estudios que concluyen que el trastorno afectivo es una característica destacada de las etapas prodrómicas de la EH y que existe una fuerte correlación con el inicio clínico de los síntomas motores4. Los estudios longitudinales serán fundamentales para caracterizar la aparición y evolución de los síntomas neuropsiquiátricos en pacientes con EH.
FinanciaciónLa presente investigación no ha recibido ninguna beca específica de agencias de los sectores público, comercial, o sin ánimo de lucro.
Conflicto de interesesNinguno.