La miastenia gravis ocular (MGo) es la forma de presentación de la enfermedad más frecuente. Un porcentaje variable de estos pacientes desarrollan una forma generalizada (MGg), siendo los factores de riesgo de conversión y el efecto protector del tratamiento inmunosupresor objeto de controversia en el momento actual.
Pacientes y métodosDiseñamos un estudio monocéntrico retrospectivo, con el objetivo de describir las características demográficas, clínicas y de laboratorio de una cohorte española de MGo, a partir de una serie de MG registrada en el Hospital Universitario de Albacete desde enero del 2008 hasta febrero de 2020.
ResultadosSeleccionamos 62 pacientes con MGo de una cohorte de 91 sujetos con MG (68,1%). La mediana de edad al diagnóstico fue de 68 (RIQ 52-75,3), con predominio de MGo de inicio muy tardío (n = 34, 54,8%) y de varones (n = 38, 61,3%). La diplopía binocular fue el síntoma inicial más frecuente (51,7%). La tasa de conversión a MGg fue del 50% (n = 31), con una mediana de tiempo de seis meses (RIQ 2-12,8). Encontramos asociación significativa entre ser mujer (OR: 5,46, IC 95% 1,16-25-74, p = 0,03) y tener AcAchR (OR: 8,86, IC 95% 1,15-68,41, p = 0,04), con el riesgo de desarrollar una MGg.
ConclusionesLa tasa de conversión de MGo en nuestra serie es relativamente elevada. La generalización tiene lugar principalmente durante los primeros dos años de evolución y está asociada al sexo femenino y, sobre todo, a la presencia de AcAchR.
Ocular myasthenia gravis (MG) is the most common phenotype of MG at onset. A variable percentage of these patients develop secondary generalisation; the risk factors for conversion and the protective effect of immunosuppressive treatment are currently controversial.
Patients and methodsWe designed a retrospective single-centre study with the aim of describing the demographic, clinical, and laboratory characteristics of a Spanish cohort of patients with ocular MG from Hospital Universitario de Albacete from January 2008 to February 2020.
ResultsWe selected 62 patients with ocular MG from a cohort of 91 patients with MG (68.1%). Median age at diagnosis was 68 (IQR, 52-75.3), and men accounted for 61.3% of the sample (n = 38). Most patients presented very late-onset ocular MG (n = 34, 54.8%). Binocular diplopia was the most frequent initial symptom (51.7%). The rate of progression to generalised MG was 50% (n = 31), with a median time of 6 months (IQR, 2-12.8). Female sex (OR: 5.46; 95% CI, 1.16-25-74; p = .03) and anti–acetylcholine receptor antibodies (OR: 8.86; 95% CI, 1.15-68.41; p = .04) were significantly associated with the risk of developing generalised MG.
ConclusionsThe conversion rate observed in our series is relatively high. Generalisation of MG mainly occurs during the first 2 years of progression, and is strongly associated with female sex and especially with the presence of anti–acetylcholine receptor antibodies.
La miastenia gravis (MG) es una enfermedad clínicamente heterogénea que puede manifestarse con una combinación variable de debilidad y/o fatigabilidad en los músculos esqueléticos. La afectación aislada del elevador de los párpados, orbicular de los ojos y/o musculatura extraocular, que se traduce en la aparición de ptosis y/o diplopía, son la forma de presentación más frecuente de la enfermedad y definen el subtipo de MG ocular (MGo)1,2. Un porcentaje de estos pacientes, que oscila entre un 10 a un 85% según las series, desarrollan una afectación generalizada secundaria (MGg) en el transcurso de la enfermedad, sobre todo en los primeros dos años3–5.
La importante implicación que tiene la conversión de la MGo a una forma generalizada en el pronóstico y tratamiento de estos pacientes ha motivado la realización de numerosos estudios dirigidos a identificar los factores de riesgo (FR) de generalización (tabla 1) y el efecto del tratamiento inmunosupresor y la timectomía en modificar el curso de la enfermedad3,5–19. Las limitaciones inherentes de los estudios observacionales retrospectivos junto a los diferentes criterios de inclusión empleados, pueden justificar en parte la variabilidad y escasa consistencia de los resultados obtenidos. Además, la influencia que ejerce el origen étnico y geográfico en aspectos epidemiológicos y clínicos de la MG20, son también un factor limitante en la extrapolación de los resultados a poblaciones de distinta procedencia.
Resumen de estudios previos dirigidos al análisis de los factores de riesgo (FR) de conversión a MGg
| Referencia | n | Población | Duración mínima MGo (meses) | Edad | Años de seguimiento (mediana, rango) | Tratamiento inmunosupresor | Tasa de conversión a MGg | Meses conversión | FR |
|---|---|---|---|---|---|---|---|---|---|
| Sommer et al., 1997 | 78 | Alemania | 3 | 50,6 * ± 19,5 | 8,4 (0,6-58,2) | Sí | 31% | 24,5* | Ninguno |
| Kupersmith et al., 2003 | 94 | Estados Unidos | ≥ 24 | 50* ± 21 | ≥ 2 | Sí | 18% | - | Título AcAchRPrednisona |
| Hong et al., 2008 | 202 | Corea del Sur | Sin límite | - | 1 en MGo sin generalización | Sí | 23,3% | 8,9* | AcAchR +TimoaPrednisolona |
| Nagia et al., 2015 | 158 | Estados Unidos | 1 | 60,5 (RIQ 21)† | 5 (2-25) | Sí | 20,9% | 20† | - |
| Wang et al., 2015 | 59 | China | - | 46,1* ± 18,5 | - | - | 85% | - | Inicio tardío |
| Wong et al., 2016 | 101 | Reino Unido | 3 | 52* ± 17,3 | 8,4 (2-42) | - | 30,7% | 15† | AcAchR +Otras e. autoinmunesHiperplasia tímica |
| Kamarajah et al., 2018 | 93 | Reino Unido | Sin límite | - | 3 (0,3-12) | No | 52% | 7† | AcAchR +Inicio precoz |
| Huang et al., 2018 | 306 | China | Sin límite | 8† | ≥ 1 | Sí | 19,9% | - | Título de AcAchR |
| Mazzoli et al., 2018 | 168 | Italia | ≥ 24 | 65† (rango 18-84) | 7,8 (3-43) | Sí | 18,4% | 106,3* | MujerAcAchR +Inicio tardío |
| Teo et al., 2018 | 155 | Singapur | 1 | 59* | 3,4 | Sí | 10,6% | 8,4* | AcAchR +ER +Timoma |
| Aguirre et al., 2018 | 61 | Argentina | 1 | 46* | ≥ 2 | Sí | 73,7% | 8* | AcAchR +y título de dicho Ac. |
| Galassi et al., 2018 | 175 | Italia | 24 | 64† | 7,8 | Sí | 21,1% | 83† | AcMuSK +Mujer |
| Sabre et al., 2019 | 83 | Reino Unido | 3 | 54,5 ± 15,2 | 2 | No | 15,6% | 15* | AcAChR +Inicio tardío |
| Li et al., 2018 | 165 | Alemania | Sin límite | - | 73,1* | - | 61,1% | 106* | Timoma |
| Hendricks et al., 2019 | 33 | Estados Unidos | Sin límite | 59* | 7,6 | Sí | 54,5% | 13 | AcAchR+Jitter + |
| Apinyawasisuk S et al., 2020 | 71 MGo-AChR | Tailandia | - | < 54 | - | Sí | 50,7% | 4,97* | MujerTabacoAlteración timoIS |
| Díaz-Maroto et al., 2020 | 62 | España | Sin límite | 68† | 4,5 (0,3-60) | Sí | 50% | 6† | AcAchR +Mujer |
AcAchR: anticuerpos antirreceptor de acetilcolina; AcMuSK: anticuerpos antitirosincinasa; ER: estimulación repetitiva. Los valores han sido expresados en forma de media* y de mediana†, según la información disponible en las referencias bibliográficas.
Dado que la detección de los pacientes con MGo con mayor riesgo de generalización continúa siendo objeto de debate, y debido a la escasez de publicaciones específicas al respecto realizadas sobre población española, nos planteamos como objetivo describir las principales características demográficas, clínicas y serológicas de nuestra serie de pacientes con MGo y analizar los factores asociados a la progresión de la enfermedad a una MGg.
Material y métodosDiseñamos un estudio descriptivo y retrospectivo a partir de una cohorte de pacientes con diagnóstico de MG en seguimiento en la consulta de enfermedades neuromusculares del Complejo Hospitalario Universitario de Albacete desde el año 2008 hasta febrero de 2020. El diagnóstico clínico de MG se confirmó mediante la determinación de anticuerpos dirigidos contra el receptor de acetilcolina (AcAchR) o contra la molécula tirosincinasa muscular específica (AcMuSK) en suero. En aquellos sujetos con un resultado serológico negativo, el diagnóstico se basó en el estudio neurofisiológico con la demostración de una repuesta decremental en la estimulación repetitiva (ER) a bajas frecuencias o de un jitter aumentado en la electromiografía de fibra única. Del total de pacientes con MG, seleccionamos todos aquellos que tuvieran una forma de presentación ocular desde el comienzo de la enfermedad, con un periodo de seguimiento ≥ 3 meses y sin restricción en el tiempo mínimo de síntomas oculares aislados antes de la generalización. Registramos las variables demográficas y clínicas habituales como son el sexo, la edad de inicio estratificada en tres grupos: inicio precoz (< 50 años), tardío (edad entre 51-65 años al diagnóstico) y muy tardío (≥ 65 años); el tipo de síntoma ocular inicial (ptosis uni o bilateral, diplopía o ambas), la presencia y título de AcAchR y AcMuSK, el resultado de la ER y jitter cuando se realizaron, presencia de timoma y timectomía así como el tratamiento sintomático e inmunosupresor que recibieron. Identificamos el subgrupo de pacientes que desarrollaron con la evolución de la enfermedad debilidad y/o fatigabilidad en musculatura facial, orofaríngea, cervical, respiratoria, axial o de extremidades y el momento en el que lo hicieron (meses transcurridos desde la primera manifestación de la MGo hasta la conversión a MGg). Finalmente analizamos las variables asociadas a la conversión en MGg.
La valoración clínica y la revisión de las historias en formato electrónico de los pacientes incluidos en el estudio fue realizada por dos neurólogos con experiencia en el ámbito de las enfermedades neuromusculares. Previamente, recibimos la aprobación por el Comité Ético local y elaboramos una base de datos de MGo anonimizada.
Análisis estadísticoLas variables cualitativas fueron expresadas en forma de porcentajes. Tras la realización de una prueba de Kolmogorov-Smirnov, estas se expresaron como media ± desviación estándar si seguían una distribución normal o como mediana ± rango intercuartílico en el resto. A continuación, se realizó un estudio analítico de contraste de hipótesis para identificar los factores de riesgo de generalización. Se empleó la prueba de χ2, t de Student y U de Mann-Whitney, según conveniencia. Finalmente, mediante la realización de un análisis multivariante (regresión logística binaria), se confirmó qué variables estaban asociadas a la generalización de la MG de forma independiente con el cálculo del riesgo (OR) para un intervalo de confianza del 95% (IC 95%) y un valor p inferior a 0,05.
ResultadosEn la consulta monográfica de enfermedades neuromusculares del Complejo Hospitalario Universitario de Albacete, desde enero de 2008 hasta febrero de 2020, se registraron 91 casos con diagnóstico de MG. Seleccionamos una serie de 62 pacientes (67,4%), caracterizada por presentar síntomas oculares como primera y única manifestación de la enfermedad en el momento diagnóstico; un 51,7% (n = 30) tuvo diplopía, un 32,8% (n = 19) ptosis uni o bilateral, un 15,5% (n = 8) ambas, y este dato no estaba recogido de forma clara y explícita en cuatro pacientes. La mediana de edad al diagnóstico fue de 68 años (RIQ 52-75,3), con un predominio de formas de inicio muy tardío (n = 34, 54,8%) y de varones (n = 38, 61,3%). El 66,1% (n = 41) fueron formas seropositivas para AcAchR con título inicial medio de 11,3 en 12 de los pacientes en los que el dato estaba disponible. Ningún paciente tuvo un resultado positivo a la determinación de AcMuSK. En las formas seronegativas (33,9%, n = 21), la alteración de la transmisión neuromuscular se confirmó mediante ER en un 76,2% de los casos (n = 16) y mediante alteración del jitter en el resto 23,8% (n = 5). La mediana de tiempo en el que se estableció el diagnóstico de MG fue de un mes (RIQ 0-5). En relación con el tratamiento de la MG, en el momento de análisis el 82,3% (n = 51) se encontraban en tratamiento sintomático con bromuro de piridostigmina y el 74,2% (n = 46) con al menos un fármaco inmunosupresor, siendo el más utilizado la prednisona (n = 41) en monoterapia (n = 29) y en combinación otros inmunosupresores como azatioprina, micofenolato mofetilo, ciclosporina, tacrolimus y rituximab (n = 17). La mediana de inicio de tratamiento con corticoides fue de 3,5 meses (RIQ 1-10,3). El 75,6% de los pacientes desarrolló efectos secundarios por el tratamiento esteroideo, entre los más frecuentes, hiperglucemia, fracturas óseas osteoporóticas e hipertensión arterial. Fueron sometidos a timectomía seis pacientes, tres de ellos tras el diagnóstico de timoma y los otros tres con formas seropositivas, tras el desarrollo de una MGg. Se alcanzó el objetivo terapéutico en el 85,5% de los casos; un 37% con síntomas mínimos no limitantes y un 53,2% alcanzó la remisión clínica (completa 17,7%, farmacológica 32,3%). Fallecieron seis pacientes (9,7%), siendo en uno de ellos la causa fundamental del exitus la MG y en otro un timoma invasor.
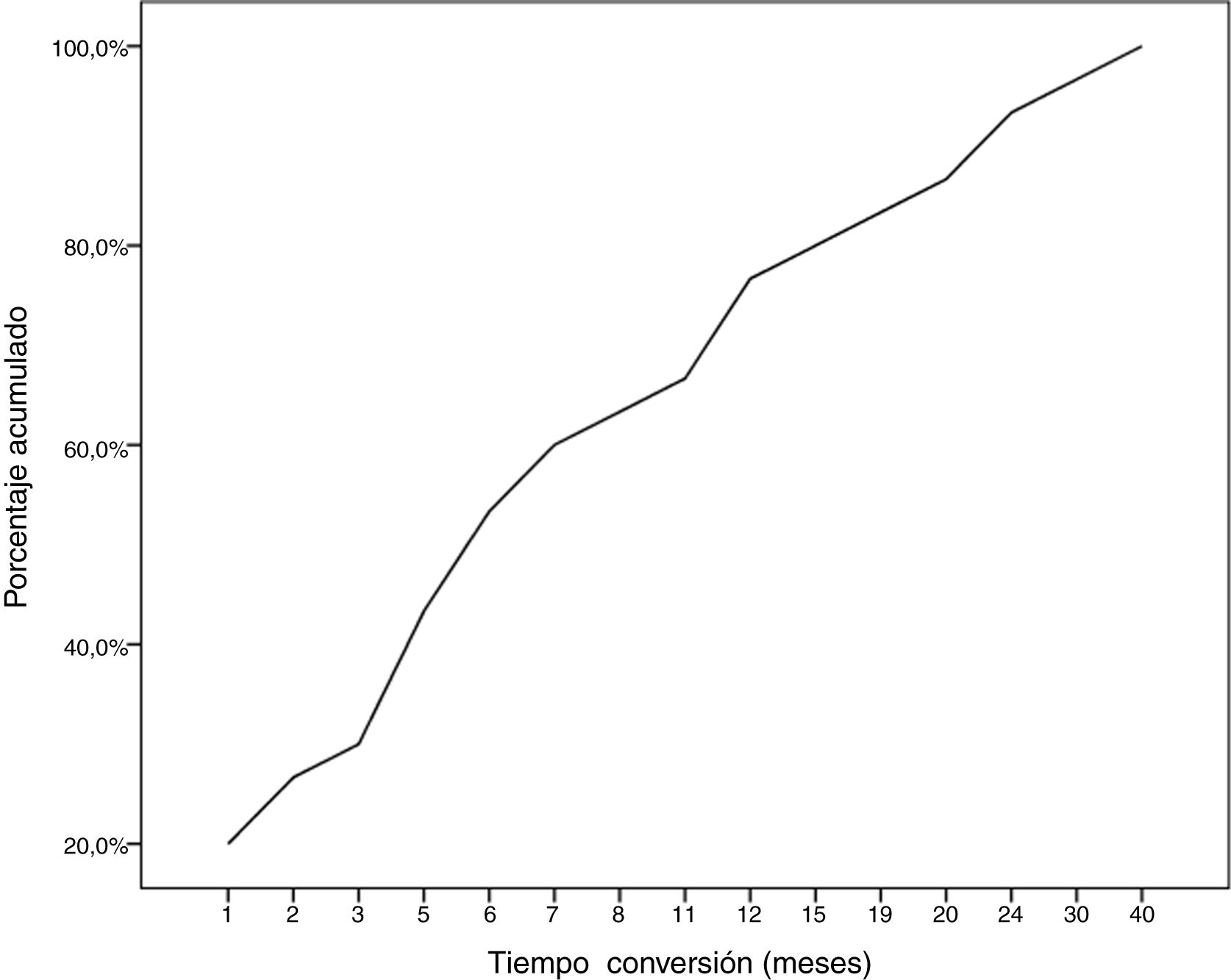
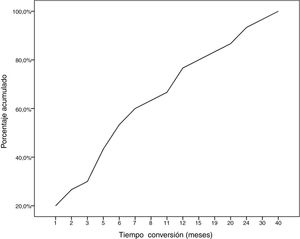
Durante el seguimiento, la mitad de los pacientes (n = 31) presentaron una generalización de los síntomas en una mediana de tiempo de seis meses (RIQ 2-12,8). A excepción de dos casos (6,6%), la progresión a MGg tuvo lugar en los primeros 24 meses de evolución de la enfermedad (Gráfico 1. La mediana de seguimiento de los pacientes en el momento del análisis fue de 54,5 meses (3-720); 13 pacientes (20,9%) con síntomas oculares aislados se encontraban dentro de los primeros dos años de evolución de la MG. La tabla 2 muestra las principales variables demográficas, clínicas, serológicas y pronósticas en los pacientes con MGo y aquellos que desarrollaron una MGg. En el subgrupo de MGg encontramos un predominio de mujeres y de formas seropositivas; la proporción de pacientes que tuvieron diplopía como primera manifestación de la enfermedad y a una edad inferior a 65 años fue superior a las formas oculares. Un 25,8% recibieron tratamiento inmunosupresor (prednisona, n = 8) antes de la generalización, con una mediana de tiempo en el inicio de dicho tratamiento inferior a aquellos con formas oculares (dos [RIQ 1-7] vs. cinco [RIQ 1,5-17,5]), aunque esta diferencia no fue estadísticamente significativa (ES). La proporción de casos que alcanzaron el objetivo terapéutico, y sobre todo la remisión clínica, fue inferior en las formas generalizadas a pesar de recibir tratamiento inmunosupresor un mayor número de pacientes. Finalmente, en un modelo de regresión logística donde incluimos la edad, sexo, presencia de AcAchR, timoma y el momento en el que se inició el tratamiento con corticoides (tabla 3), encontramos una asociación estadísticamente significativa entre ser mujer (OR: 5,46, IC 95% 1,16-25-74, p = 0,03) y tener AcAchR (OR: 8,86, IC 95% 1,15-68,41, p = 0,04).
Análisis comparativo entre las principales características demográficas, clínicas y pronósticas entre MGo, con y sin generalización secundaria
| MGo | MGGs | OR | IC 95% | Valor p | |
|---|---|---|---|---|---|
| Edad al diagnóstico | NA | NA | 0,54 | ||
| < 50 años | 5 (16,1%) | 8 (25,8%) | |||
| 51-65 años | 7 (22,6%) | 8 (25,8%) | |||
| > 65 años | 19 (61,3%) | 15 (48,4%) | |||
| Meses evolución (mediana, RIQ) | 37 (20-70) | 70 (48-131) | NA | NA | < 0,01 |
| Sexo (♀) | 8 (25,8%) | 16 (51,6%) | 3,1 | 1,1-9,1 | 0,04 |
| Síntoma inicial | NA | NA | 0,39 | ||
| Diplopía | 13 (43,3%) | 17 (60,7%) | |||
| Ptosis | 12 (40%) | 7 (25%) | |||
| Ambas | 5 (16,7%) | 4 (14,3%) | |||
| AcAchR | 17 (54,8%) | 24 (77,4%) | 1,4 | 0,9-2,9 | 0,06 |
| Timoma | 1 (3,2%) | 2 (6,5%) | NA | NA | < 0,001 |
| Inicio IS, mesesMediana (RIQ) | 6,3 (1-7) | 16,9 (1,5-17,5) | NA | NA | 0,08 |
| IS actual | 13 (41,9%) | 28 (90,3%) | 12,9 | 3,2-5,3 | < 0,001 |
| Timectomía | 1 (3,2%) | 5 (16,1%) | 5,8 | 0,6-5,2 | 0,08 |
| Remisión completa, farmacológica o mínimos síntomas | 29 (93,5%) | 24 (77,4%) | 4,2 | 0,8-22,3 | 0,07 |
| Exitus | 2 (6,5%) | 4 (12,9%) | 2,1 | 0,4-1,3 | 0,39 |
MGo: miastenia gravis ocular; MGGs: miastenia gravis con generalización secundaria; AcAchR: anticuerpos antirreceptor de acetilcolina; RIQ: rango intercuartílico; IS: inmunosupresor.
Análisis multivariante. Regresión logística binaria para el estudio de variables asociadas a la generalización de la MG en formas de inicio ocular
| HR, IC 95% | valor p | |
|---|---|---|
| Sexo (M) | 5,46 (1,16-25,74) | 0,03 |
| Edad al diagnóstico | 2,49 (0,9-6,91) | 0,08 |
| AcAchR + | 8,86 (1,15-68,41) | 0,04 |
| Timoma | 0,17 (0,01-3,62) | 0,25 |
| Meses inicio IS | 0,94 (0,87-1,01) | 0,08 |
AcAchR: anticuerpos antirreceptor de acetilcolina; IS: inmunosupresor.
Si no estamos equivocados, esta es la primera serie española en la que se analizan las características clínicas y los factores de riesgo de generalización de la MGo. Hemos observado que, en este subtipo de MG, al igual que en la MG en general, existe un predominio de pacientes de sexo masculino, formas de inicio muy tardío y MG-AcAchR positivo21.
En un tercio de las series de MGo publicadas hasta el momento, al igual que en la nuestra, la probabilidad de desarrollar una MGg de forma secundaria asciende a más del 50%10,14,17,18. Uno de los principales factores que explican esta elevada tasa de conversión es la inclusión de todos los pacientes que comienzan con síntomas oculares sin tener en cuenta el momento en el que tiene lugar la generalización. Algunos autores defienden que la aparición de una afectación de musculatura orofaríngea, respiratoria y/o de extremidades durante los primeros tres meses de evolución de la enfermedad, aunque haya comenzado con síntomas oculares, debe ser considerada una MGg y no una forma ocular22. Sin embargo, este criterio temporal no se contempla en la definición de MGo de la Fundación Americana de MG de 2015, según la cual, la presencia de ptosis y/o diplopía al inicio es suficiente para realizar el diagnóstico2.
El hecho de que la generalización de la MGo tenga lugar de forma precoz tras el inicio de los síntomas oculares es interesante desde un punto de vista clínico y terapéutico, ya que si finalmente se demuestra que algún tratamiento (inmunosupresor y/o timectomía) puede prevenirla, este debería implantarse lo antes posible, y por tanto, deberíamos ser capaces de identificar a los pacientes de forma rápida, evitando la demora que a veces se produce en el proceso diagnóstico de la enfermedad. En este sentido, otro aspecto fundamental será poder identificar a los pacientes con mayor riesgo de generalizar, evitando el uso indiscriminado de la inmunosupresión. Wong et al. elaboraron una escala para estratificar el riesgo de los pacientes, según la presencia de AcAchR, otras enfermedades autoinmunes e hiperplasia tímica3. Sin embargo, si nos basamos en la evidencia actual y a ella sumamos nuestros resultados, a pesar de sus limitaciones, el único factor que ha demostrado una asociación consistente y reproducible es la seropositividad para AcAchR3,5,7,10–14,16,18. La probabilidad de generalizar en nuestra serie es casi nueve veces superior en la MGo-AchR+ que en las formas seronegativas. Autores como Huang X. y Aguirre F. encontraron también mayor riesgo a mayor título de este anticuerpo11,14. La MGo-MuSK, aunque no es un fenotipo frecuente de la enfermedad, cuando aparece tiene una elevada tasa de conversión15,22-24. Por otro lado, las mujeres también parecen ser un grupo de mayor riesgo de MGg (OR 4,6). Sin embargo, esta asociación solo se ha encontrado en uno de cada cinco estudios realizados12,15,19. Al igual que sucede con la presencia de alteraciones tímicas3,8,17,19,24, la diplopía como síntoma inicial25 o un resultado patológico en la ER13 o en la EMG de fibra asilada18, tan solo en algunos estudios han mostrado una relación ES con la MGg (fig. 1).
La relación entre la edad al diagnóstico y el riesgo de desarrollar formas generalizadas merece una mención especial, ya que en los últimos años se está produciendo un aumento considerable de la incidencia y prevalencia de la enfermedad en los grupos de edad avanzada25 que, por otro lado, son más susceptibles de sufrir complicaciones derivadas de la inmunosupresión a largo plazo. Según Wang L., Mazzoli M. y Sabre L., la edad avanzada se ha relacionado con un mayor riesgo de conversión3,12,16,24. Sin embargo, en nuestra serie con una edad mediana de inicio de la enfermedad superior a la publicada en otras cohortes, la edad en el subgrupo de pacientes con MGg secundaria fue inferior al resto, aunque de forma no significativa. En este sentido, Kamarajah S.K., quien describe la historia natural de la MGo sin mediación del posible efecto del tratamiento inmunosupresor, a diferencia de otros estudios, defiende que son las formas de inicio precoz las que tienen mayor riesgo de generalización10. Por tanto, la relación entre la edad y la generalización sigue siendo objeto de controversia.
Finalmente, en relación con el tratamiento preventivo de la generalización, no encontramos diferentes tasas de conversión entre los pacientes que recibieron corticoides tras el fracaso del tratamiento sintomático y los que no lo precisaron, aunque curiosamente entre los que generalizaron el tratamiento se inició con anterioridad. Este dato sugiere que una mayor gravedad sintomática al inicio y la ausencia de respuesta al tratamiento con bromuro de piridostigmina también se asocia a un mayor riesgo de generalización12. El primer autor que sugirió que los corticoides podían tener un efecto protector fue Kupersmith et al. en 19964. Estudios previos in vitro habían mostrado que la exposición a dexametasona reducía la pérdida de receptores de acetilcolina en tejido muscular tras la incubación con suero de pacientes con MG26. Desde entonces, se han realizado numerosos estudios retrospectivos sin unas líneas terapéuticas que definan el momento exacto para la introducción del tratamiento, dosis de inicio y de mantenimiento, así como población en riesgo27. El ensayo clínico EPITOME, diseñado para analizar la seguridad, tolerabilidad y efectividad de la prednisona en MGo, fracasó en alcanzar su objetivo debido al cierre del mismo por baja tasa de reclutamiento28. Por tanto, a día de hoy no existe suficiente evidencia científica para recomendar este tratamiento, más allá del control sintomático de la MGo. En cuanto a la timectomía, el resultado de un metaanálisis concluye que tiene efecto protector cuando se realiza de forma precoz29. De hecho, las guías británicas recomiendan realizarla en pacientes con MGo-AChR +, no timomatosa, menores de 40 años30. Sin embargo, esta recomendación no es extensible al resto de guías internacionales.
Debido a las limitaciones de nuestro estudio, y los previos, entre las que destacan su diseño observacional y retrospectivo, la heterogeneidad en cuanto a los criterios de inclusión motivada por la ausencia de una definición pormenorizada de MGo y MGg, el pequeño tamaño muestral y el posible efecto de la inmunosupresión, es importante la realización de estudios prospectivos que permitan seleccionar a los pacientes de mayor riesgo de conversión y ensayos clínicos donde se evalúe el potencial beneficio en ellos del tratamiento inmunosupresor y la timectomía.
En conclusión, la identificación de la MGo asociada a AcAchR tiene un gran interés, ya que la seropositividad es el principal FR de conversión a MGg. Aclarar el papel de otros potenciales FR como la edad, el sexo y las alteraciones tímicas que nos permitan identificar los pacientes candidatos a ensayar el efecto de un de tratamiento preventivo precoz son un reto clínico en el campo de la MG.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.