La esclerosis múltiple (EM) es una enfermedad inflamatoria cuyo sustrato patológico es tanto desmielinizante como axonal. La tomografía de coherencia óptica (TCO) es una técnica cuantitativa que evalúa in vivo el adelgazamiento de la capa de fibras nerviosas de la retina (CFN).
Objetivosvalorar mediante TCO el estado de la CFN de pacientes con EM con y sin antecedentes de neuritis óptica (NO) y pacientes con sólo NO, así como valorar la repercusión de ésta en la agudeza y los campos visuales.
MétodosLos pacientes fueron clasificados en tres grupos :a) G1: pacientes con NO; b) G2: pacientes con EM y NO, y c) G3: pacientes con EM sin brotes de NO documentados. A todos se les realizó una exploración oftalmológica que incluía agudeza visual (AV), campimetría (DM) y determinación del grosor de la CFN mediante TCO y una exploración neurológica.
ResultadosEl grosor de la CFN en el ojo contralateral es significativamente superior en los pacientes con NO (103,99) que en los otros dos grupos (G2, 85,52; G3, 90,85); sin embargo, no hay diferencias significativas entre ojos afectos. No se encuentran diferencias significativas en AV y DM entre los grupos para el ojo afecto (p = 0,878), pero sí para el ojo contralateral (p = 0,007).
ConclusionesEn todos los pacientes con EM se evidencia una pérdida axonal en ambos nervios ópticos, que se acentúa en los casos que han sufrido brotes de NO. El daño axonal se detecta tempranamente, con lo que la TCO se podría usar como marcador de integridad axonal. Además, las alteraciones estructurales detectadas por la TCO están en concordancia con las alteraciones en las pruebas funcionales de AV y DM en los ojos afectos.
Multiple sclerosis (MS) is an inflammatory demyelinating disease with axonal degeneration. Optical coherence tomography (OCT) is a noninvasive technique that quantifies the thickness of the retinal nerve fiber layer (RNFL). The objectives of this study are: to determine the thickness of the RNFL in MS patients with or without previous optic neuritis (ON) and in patients with ON and to determine the relationship between the structural damage and functional alterations in visual acuity (VA) and visual field (VF).
MethodsThree groups were studied: G1 - patients with ON, G2 - patients with MS and ON, and G3 - patients with MS and without previous ON. Ophthalmological (VA, VF, OCT) and neurological examinations were performed.
ResultsOCT thickness in the unaffected eye was significantly thicker in ON patients (103.99) than in the other groups, however there was no differences among the affected eyes. There were significant differences in VA and VF among the non-affected eyes (p = 0.007), but not among the affected eyes (p = 0.878).
ConclusionsAll MS patients showed axonal damage in both optic nerves, more in patients with previous ON. Axonal damage was detected early, so OCT could be used as a structural biomarker. Structural damage was related with the functional alterations.
La esclerosis múltiple (EM) es una enfermedad inflamatoria desmielinizante crónica que afecta al sistema nervioso central y cuya etiología es todavía desconocida. Durante mucho tiempo, se ha considerado que la desmielinización era el sustrato fundamental de esta enfermedad; sin embargo, en la actualidad el daño axonal ha adquirido una importancia crítica en su patogenia y evolución1. La acumulación progresiva del daño axonal parece ser la principal causa de los déficit neurológicos incapacitantes que pueden llevar a una discapacidad permanente. Este daño axonal aparece desde las fases precoces de la enfermedad. En el 85% de los pacientes a quienes posteriormente se diagnostica de esclerosis múltiple clínicamente definida, el cuadro se inicia con un episodio agudo o subagudo de disfunción neurológica, a esta forma de presentación inicial se la denomina síndrome clínico aislado (SCA)2. Las formas más frecuentes de SCA son la neuritis óptica, la mielitis y el síndrome aislado de tronco encefálico.
La neuritis óptica es una neuropatía inflamatoria óptica y es el primer síntoma de esclerosis múltiple en el 20% de los pacientes afectados por esta enfermedad3. Las células ganglionares de la retina son la primera neurona de la vía visual y sus axones constituyen aproximadamente el 82% del espesor de la capa de fibras nerviosas (CFN); mientras que al menos el 18% restante está formado por glía4. Se ha demostrado que un brote de neuritis óptica produce daño de estos axones y se manifiesta por la palidez de la papila y la pérdida de espesor de la CFN. Además, los axones de las células ganglionares no se mielinizan hasta atravesar la lámina cribosa, lo que convierte al nervio óptico en un lugar accesible para estudiar en el sistema nervioso central el daño axonal independientemente del estado de la mielina. Por lo tanto, medir el espesor de la CFN es un método viable para monitorizar el daño axonal en los pacientes con esclerosis múltiple y la neuritis óptica podría convertirse en un modelo de estudio del daño axonal5.
La tomografía de coherencia óptica (TCO) es una técnica exploratoria diseñada para evaluar in vivo, de forma cualitativa y cuantitativa, el adelgazamiento de la capa de fibras nerviosas de la retina, la cabeza del nervio óptico (CNO) y la mácula5. Se trata de una técnica no invasiva, precisa, cuantitativa, fácil de usar y reproducible que permite obtener imágenes del espesor de la retina y cuantificar el grosor de ésta y de su capa más interna, la CFN6,7. Algunos estudios han demostrado que la TCO es capaz de detectar un adelgazamiento brusco de la CFN tras un brote de NO y que los pacientes con EM también pueden presentar pérdida axonal medida por TCO8–14. Por lo tanto, si todos los pacientes con EM, independientemente de si han tenido o no una neuritis óptica, presentaran daño axonal en los nervios ópticos, esta técnica podría usarse como marcador de integridad axonal y, en un futuro, como marcador pronóstico y de evolución. Además, el daño estructural medido por la TCO debería tener una repercusión funcional en la visión.
El objetivo de este estudio es valorar mediante TCO el estado de la CFN de pacientes con EM con y sin antecedentes de NO y de los que han sufrido un episodio aislado de NO, así como valorar la repercusión de las alteraciones estructurales en la agudeza y el campo visual en cada uno de los grupos de pacientes.
Pacientes y métodosSe reclutó para el estudio a los pacientes que cumplían los siguientes criterios: haber sufrido un episodio de neuritis óptica aislado o sufrir una esclerosis múltiple remitenterecurrente con o sin manifestaciones de neuritis óptica documentadas. Los pacientes tenían que haber estado sin tratamiento con corticoides por lo menos 30 días antes de la inclusión en el estudio. Algunos de los pacientes estaban recibiendo tratamientos inmunomoduladores. Se descartaron otras enfermedades neurológicas. Se realizó una exploración neurológica a todos los pacientes y se determinó el estado neurológico con la escala EDSS15.
Se realizó un estudio oftalmológico completo que incluía: agudeza visual (AV), motilidad ocular intrínseca y extrínseca, tonometría de aplanación, biomicroscopia (BMC) del polo anterior, campo visual, fondo de ojo y OCT (Stratus, Carl Zeiss Meditec). En la exploración mediante OCT se emplea el protocolo de adquisición Fast RNFL Thickness (3,46) y el protocolo de análisis RNFL Thickness Average, que proporciona el grosor de la CFN en términos absolutos, expresado en μm, y de forma cualitativa, mediante un código cromático para indicar la posición respecto a la curva normal para la edad16.
Las variables analizadas fueron: a) la AV, medida con optotipos de Snellen y expresada en la escala decimal, aunque transformada a escala logarítmica LogMAR para el análisis estadístico; b) la desviación media (DM) del campo visual expresada en decibelios (dB): se trata de una medida de la sensibilidad luminosa en cada punto del campo explorado en relación con la edad del paciente, y c) el grosor de la CFN en términos absolutos medido en μm y, de forma cualitativa, como normal o atrofia, que se define por un grosor medio por debajo del percentil 5 en comparación con la base de datos normalizada para la edad que proporciona el software del Stratus OCT.
Los pacientes fueron agrupados para el análisis en: grupo 1 (G1), pacientes con un síndrome clínico aislado tipo neuritis óptica de más de 3 meses de evolución; grupo 2 (G2), pacientes con EM y antecedente de NO unilateral, y grupo 3 (G3), pacientes con EM sin brotes de NO documentados.
Se comparó el ojo afecto en los G1 y G2 con el ojo derecho del G3 y los ojos contralaterales de los dos primeros con el ojo izquierdo del G3. Las tres variables AV, DM y espesor de la CFN se compararon mediante la prueba de la t de Student para muestras apareadas y se estableció como nivel de significación estadística p < 0,05. Se midió la correlación entre la discapacidad y la disminución del espesor de la CFN por el coeficiente de Pearson.
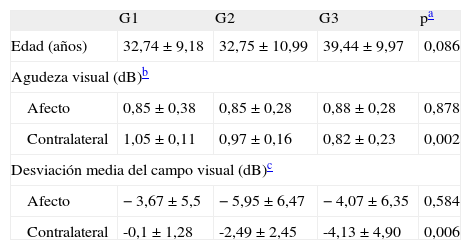
ResultadosSe incluyó en el estudio un total de 49 pacientes: 19 (38,8%) en el G1, 12 (24,5%) en el G2 y 18 (36,7%) en el G3. Del total, 31 eran mujeres (63,3%) y 18, varones (36,7%). La media ± desviación estándar (DE) de edad de los pacientes fue 31,20 ± 10,25 años, no hubo diferencias significativas entre los grupos (ANOVA, p = 0,086). En la tabla 1 se muestra la edad, la AV y la DM para cada grupo. No encontramos diferencias significativas entre los grupos para el ojo afecto (p = 0,878), pero sí para el ojo contralateral (p = 0,007). Tanto la AV como la DM son significativamente mejores en los ojos contralaterales de los grupos que han sufrido NO (G1 y G2) que en el G3 de pacientes con EM.
Variables funcionales: agudeza visual y desviación media del campo visual
| G1 | G2 | G3 | pa | |
| Edad (años) | 32,74 ± 9,18 | 32,75 ± 10,99 | 39,44 ± 9,97 | 0,086 |
| Agudeza visual (dB)b | ||||
| Afecto | 0,85 ± 0,38 | 0,85 ± 0,28 | 0,88 ± 0,28 | 0,878 |
| Contralateral | 1,05 ± 0,11 | 0,97 ± 0,16 | 0,82 ± 0,23 | 0,002 |
| Desviación media del campo visual (dB)c | ||||
| Afecto | −3,67 ± 5,5 | −5,95 ± 6,47 | −4,07 ± 6,35 | 0,584 |
| Contralateral | -0,1 ± 1,28 | -2,49 ± 2,45 | -4,13 ± 4,90 | 0,006 |
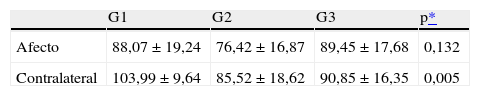
En la tabla 2 se observa que tampoco hay diferencias significativas para el grosor medio de la CFN entre ojos afectos (G1, 88,07; G2, 76,42; G3, 89,45; p = 0,132). Sin embargo, el grosor de la CFN es significativamente mayor en los pacientes con neuritis óptica (G1, 103,99) que en los otros dos grupos (G2, 85,52 y G3, 90,85) en el ojo contalateral (p = 0,005).
Grosor medio de la capa de fibras nerviosas en los tres grupos
| G1 | G2 | G3 | p* | |
| Afecto | 88,07 ± 19,24 | 76,42 ± 16,87 | 89,45 ± 17,68 | 0,132 |
| Contralateral | 103,99 ± 9,64 | 85,52 ± 18,62 | 90,85 ± 16,35 | 0,005 |
Prueba de la t de Student, G1 frente a G2, p = 0,002; G2 frente a G3, p = 0,432; G1 frente a G3, p = 0,007.
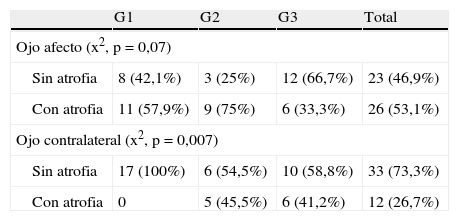
Al estudiar el estado de la CFN tomando como referencia la base normativa etaria, nos encontramos que el grosor medio se clasifica como atrófico en los ojos afectos en el 75% de los casos del G2, el 57,9% de los del G1 y el 33,3% de los del G3. En los ojos contralaterales, sólo se detecta atrofia en los grupos con EM: el 45,5% en G2 y el 41,2% en G3 (tabla 3).
Pacientes con atrofia de la capa de fibras nerviosas
| G1 | G2 | G3 | Total | |
| Ojo afecto (x2, p = 0,07) | ||||
| Sin atrofia | 8 (42,1%) | 3 (25%) | 12 (66,7%) | 23 (46,9%) |
| Con atrofia | 11 (57,9%) | 9 (75%) | 6 (33,3%) | 26 (53,1%) |
| Ojo contralateral (x2, p = 0,007) | ||||
| Sin atrofia | 17 (100%) | 6 (54,5%) | 10 (58,8%) | 33 (73,3%) |
| Con atrofia | 0 | 5 (45,5%) | 6 (41,2%) | 12 (26,7%) |
Se considera atrofia cuando el grosor medio está por debajo del percentil 5 en comparación con la base de datos normalizada.
La puntuación media obtenida en la escala EDSS para el G2 fue 1,12, con un intervalo de 0–3 puntos, y de 2,47 (0-4,5) para el G3 (p = 0,035, t de Student).
La correlación entre el EDSS de los grupos G2 y G3 y el adelgazamiento de la CFN fue muy leve y no fue significativa (r = —0,23 para el ojo afecto y r = —0,11 para el ojo contralateral).
DiscusiónLa NO es una inflamación del nervio óptico que antiguamente se asociaba sólo a un proceso de desmielinización, pero que hoy se está demostrando que también está asociado a una alteración axonal. La NO puede sufrirse de modo aislado (SCA) o como una manifestación de EM. Las neuritis ópticas típicas se presentan como una pérdida visual brusca monocular acompañada de leve dolor periorbitario que aumenta con los movimientos oculares. La pérdida visual puede progresar durante 1 o 2 semanas y comienza a recuperarse durante el primer mes de evolución. El diagnóstico de NO es clínico, aunque se debe confirmar con los potenciales evocados visuales, la TCO y la RM. Es importante determinar y cuantificar el daño axonal en los diferentes estadios de la EM para conocer la severidad y la evolución de la enfermedad y la relación entre el daño axonal y la discapacidad del paciente. Hasta ahora la detección in vivo del daño axonal se había logrado con técnicas no convencionales de resonancia magnética. Actualmente se ha descubierto que la TCO también puede medir el daño axonal17.
En nuestro estudio, medimos el espesor de la CFN en distintos grupos de pacientes con EM y NO. Las cifras medias de grosor final de la CFN varían entre 75 y 89 μm en los grupos de estudio G1 y G2, que han sufrido neuritis óptica, con valores similares a los descritos en la literatura10,16–18. Los pacientes de los grupos G2 y G3 con esclerosis múltiple muestran una reducción del espesor de la CFN en ambos nervios ópticos independientemente si han sufrido neuritis óptica o no, lo que confirman los estudios de histología19 y de RM20–22, donde se detecta daño axonal en los pacientes con EM desde el inicio de la enfermedad. Es muy significativo que en el grupo G3, que no ha sufrido nunca una neuritis óptica, se muestra una adelgazamiento de la CFN bilateral, lo que apoya que la TCO nos puede servir para medir el daño axonal que se produce en la EM independientemente de si se ha sufrido una neuritis óptica, y se podría utilizar esta técnica como marcador de integridad axonal23.
En el grupo de neuritis óptica, se muestra una diferencia significativa entre la diminución del espesor de la CFN entre ambos ojos, lo que confirma un daño axonal en fases iniciales de la enfermedad. En nuestro estudio el ojo contralateral no muestra alteración, como también en algunos estudios previos10,24. Sobre este hecho hay controversia, ya que en algunos estudios el ojo contralateral se afecta de manera subclínica en la fase aguda, como se demostró en el estudio multicéntrico ONTT (Optic Neuritis Treatment Trial), donde sólo uno de cada 3 pacientes obtuvo resultados normales en todas las pruebas, aunque la mayoría de las alteraciones registradas eran leves25,26, y sólo en algunos casos esas diferencias han sido significativas respecto a los controles sanos7,27. En nuestro estudio, a diferencia de otros, las neuritis ópticas eran de corta evolución, y eso podría explicar que el ojo contralateral todavía no estuviese afectado.
En los grupos de esclerosis múltiple (G2, G3), se observa daño axonal en ambos nervios ópticos; sin embargo, hay una diferencia significativa en cuanto a la atrofia, el 75% de los ojos afectados y el 45% de los contralaterales del G2 muestran atrofia. En el grupo 3, el porcentaje de pacientes con atrofia es menor. Esto sucede porque, tras un brote de NO, se ha estimado que se produce una reducción brusca del grosor de la CFN de aproximadamente el 27%7,17 y, por otro lado, se espera que la pérdida axonal propia de los pacientes que sufren EM sea lentamente progresiva, por ello en el G2 se juntan ambos factores.
Mediante la AV y la DM del campo visual, valoramos la repercusión funcional que tiene el estado de la CFN. En general, el pronóstico visual de los pacientes que han sufrido NO es bueno, como se demostró en el ONTT25, en el que hasta el 95% de los casos alcanzaron visiones ≥ 20/40 y en el que a los 6 meses el 51% de los campos visuales se clasificaron como normales con una DM final de —1,94 dB28,29. Al igual que en el grosor de la CFN, en nuestro estudio no se detectan diferencias significativas en los ojos afectos entre los grupos, en que la AV del ojo afecto es similar, aproximadamente 0,85 en la escala de Snellen, y la sensibilidad del CV muestra una disminución media leve de la DM (tabla 1). En concordancia con los resultados de la TCO, se aprecian diferencias significativas en el ojo contralateral del grupo de neuritis óptica respecto a los otros dos grupos, pues las variables funcionales (AV y DM) permanecen dentro de la normalidad en el grupo 1, mientras que se aprecia una afección leve en los otros dos grupos. Sin embargo, llama la atención que en el G3, tanto la AV como la DM sean peores que en el G2 para los ojos contralaterales (tabla 1), a pesar de que la tendencia en el grosor de la CFN sea mejor para el G3 (tabla 2). Esto se podría explicar porque las pruebas funcionales requieren la colaboración activa del paciente y, por lo tanto, dependen de su capacidad cognitiva y, además, los pacientes del G3 están más discapacitados que los del grupo G2.
En concordancia con el trabajo realizado por Pueyo et al14, en nuestro estudio no se encontró una correlación significativa entre el grosor de la CFN y la discapacidad neurológica medida mediante la escala EDSS en los grupos G2 y G3.
En conclusión, este estudio muestra que en los pacientes con esclerosis múltiple, es posible identificar el daño axonal producido en ambos nervios ópticos independientemente de si han sufrido una neuritis óptica o no, con lo que la TCO se podría usar como marcador de integridad axonal, lo cual sería muy importante para poder determinar la evolución y el pronóstico de la enfermedad.
Además, confirmamos que el ojo contralateral en la neuritis óptica de corta evolución presenta una TCO normal; sin embargo, el ojo afecto presenta un daño axonal que confirma que la neurodegeneración se inicia en las fases tempranas de la enfermedad. Las alteraciones anatómicas detectadas por la TCO están en concordancia con las alteraciones en las pruebas funcionales de AV y DM en los ojos afectos.