Actualizar las recomendaciones de la Sociedad Española de Neurología para la prevención del ictus en pacientes con DM-2 o prediabetes, analizando las evidencias disponibles sobre el efecto del control metabólico y el posible beneficio de los antidiabéticos con beneficio vascular añadidos al tratamiento antidiabético estándar en la prevención de ictus.
DesarrolloSe han elaborado preguntas tipo PICO (Patient, Intervention, Comparison, Outcome) para identificar cuestiones prácticas para el manejo de pacientes con ictus y poder realizar recomendaciones específicas en cada una de ellas. Posteriormente se han realizado revisiones sistemáticas en Pubmed y se han seleccionado los ensayos clínicos aleatorizados que han evaluado ictus como variable independiente (principal o secundaria). Finalmente se ha elaborado metaanálisis para cada una de las preguntas PICO y se han redactado unas recomendaciones en respuesta a cada una de ellas.
ConclusionesAunque no hay evidencia de que un mejor control metabólico reduzca el riesgo de ictus, algunas familias de antidiabéticos con beneficio vascular han mostrado reducción en el riesgo de ictus cuando se añaden al tratamiento convencional, tanto en el ámbito de prevención primaria en pacientes con DM-2 de alto riesgo vascular o con enfermedad vascular aterosclerosa establecida (agonistas GLP-1) como en prevención secundaria de ictus en pacientes con DM-2 y prediabetes (pioglitazona).
To update the Spanish Society of Neurology's guidelines for stroke prevention in patients with type 2 diabetes or prediabetes, analysing the available evidence on the effect of metabolic control and the potential benefit of antidiabetic drugs with known vascular benefits in addition to conventional antidiabetic treatments in stroke prevention.
DevelopmentPICO-type questions (Patient, Intervention, Comparison, Outcome) were developed to identify practical issues in the management of stroke patients and to establish specific recommendations for each of them. Subsequently, we conducted systematic reviews of the PubMed database and selected those randomised clinical trials evaluating stroke as an independent variable (primary or secondary). Finally, for each of the PICO questions we developed a meta-analysis to support the final recommendations.
ConclusionsWhile there is no evidence that metabolic control reduces the risk of stroke, some families of antidiabetic drugs with vascular benefits have been shown to reduce these effects when added to conventional treatments, both in the field of primary prevention in patients presenting type 2 diabetes and high vascular risk or established atherosclerosis (GLP-1 agonists) and in secondary stroke prevention in patients with type 2 diabetes or prediabetes (pioglitazone).
La diabetes mellitus tipo 2 (DM-2) y la prediabetes se asocian a un aumento del riesgo vascular en paralelo con el grado de hiperglucemia y de la ausencia de un buen control metabólico1–6. Alrededor del 60-70% de las personas que padecen un ictus presentan como antecedente historia de DM-2 o prediabetes7,8, que a su vez se asocian a un riesgo mayor de recurrencia isquémica9–12. En pacientes con DM-2, las estrategias de prevención de eventos vasculares incluyen modificaciones en el estilo de vida (nutrición y actividad física adecuada y la abstención del hábito tabáquico), el tratamiento de los factores de riesgo vascular asociados (especialmente de la dislipidemia y la hipertensión arterial) y el uso de fármacos antiagregantes13,14.
En las últimas décadas se han llevado a cabo diversos ensayos clínicos que han llegado a la conclusión de que un control glucémico intensivo (definido como una diana de HbA1c<6-6,5% en contraposición a una diana de HbA1c<7-8%) se asocia a una reducción del riesgo de aparición o progresión de daño microvascular y a una reducción discreta del riesgo de eventos coronarios no fatales, especialmente de infarto de miocardio (IM), a pesar de no reducir el riesgo de muerte o de ictus, y a expensas de un mayor riesgo de hipoglucemia sintomática14–18. Estas observaciones han marcado las recomendaciones de las sociedades científicas de diabetes en relación con la intensidad del control glucémico, y para la mayoría de los pacientes con DM-2 se establece que mantener una HbA1c<7% es una diana razonable con el objetivo de reducir el riesgo de eventos microvasculares14,19.
Por otra parte, desde que la Food and Drug Administration (FDA) estableciese el requerimiento de evaluar la seguridad vascular de los antidiabéticos, se ha producido un importante avance en el conocimiento de los beneficios vasculares de algunos de ellos, como los inhibidores selectivos del cotransportador tipo 2 de sodio-glucosa 2 (SGLT2, del inglés sodium-glucose linked transporter 2) o los agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1, del inglés glucagon-like peptide-1), que han mostrado reducción del riesgo de la variable combinada muerte vascular, IM o ictus en pacientes con enfermedad vascular aterosclerótica establecida o alto riesgo vascular20. Estas evidencias han llevado a la American Diabetes Association (ADA) a establecer la recomendación de añadir un agonista del receptor GLP-1 o de un inhibidor selectivo SGLT2 al tratamiento de primera línea (metformina) en pacientes con enfermedad vascular establecida o alto riesgo vascular14. La Sociedad Española de Diabetes incluye, además, entre los fármacos a considerar de segunda línea las tiazolidinedionas19, ya que una de ellas, en concreto pioglitazona, también ha mostrado beneficio vascular global.
Ante estos avances, el Grupo de Estudio de Enfermedades Cerebrovasculares de la Sociedad Española de Neurología ha estimado oportuno actualizar las guías de tratamiento y prevención del ictus21 dedicando un capítulo específico a la prevención de ictus en pacientes con DM-2 o prediabetes. En la primera parte nos centraremos en el efecto del control metabólico (basado en la reducción de los valores de HbA1c) y en la segunda se analizará el posible beneficio de pioglitazona, inhibidores selectivos SGLT2 y agonistas del receptor GLP-1 añadidos al tratamiento antidiabético estándar en pacientes con ictus y DM-2 o prediabetes. No se considerarán aquí otras familias de antidiabéticos que no han mostrado beneficio vascular global ni reducción de ictus en los ensayos clínicos realizados hasta el momento, como es el caso de los inhibidores de la dipeptil-peptidasa 4 (DDP-4)20.
MétodosEn primer lugar, se han elaborado preguntas tipo PICO (del inglés Patient, Intervention, Comparison, Outcomes) con el objetivo de identificar cuestiones prácticas para el manejo de pacientes con ictus y poder realizar recomendaciones específicas en cada una de ellas. Para evaluar el efecto de la intensidad del control glucémico en el riesgo de ictus se han realizado (entre el 18 de agosto y el 1 de octubre de 2019) revisiones sistemáticas en Pubmed utilizando la siguiente estrategia de búsqueda: (((intensive blood glucose control) OR glycated hemoglobin) AND randomized trial) AND stroke AND diabetes; ((((Tiazolidinediones) OR glitazones) OR pioglitazone) AND trial) AND stroke AND diabetes; (((((((Sglt2 Inhibitor) OR Empagliflozin) OR Canagliflozin) OR Dapagliflozin) AND Diabetes) AND Trial) AND Stroke) AND Diabetes; ((((((((GLP-1 Agonist) OR dulaglutide) OR albiglutide) OR semaglutide) OR liraglutide) OR exenatide) OR lixisenatide) AND trial) AND stroke AND diabetes; ((((Prediabetes) OR Insulin Resistance) AND Antidiabetic Drug) AND Stroke) AND Trial.
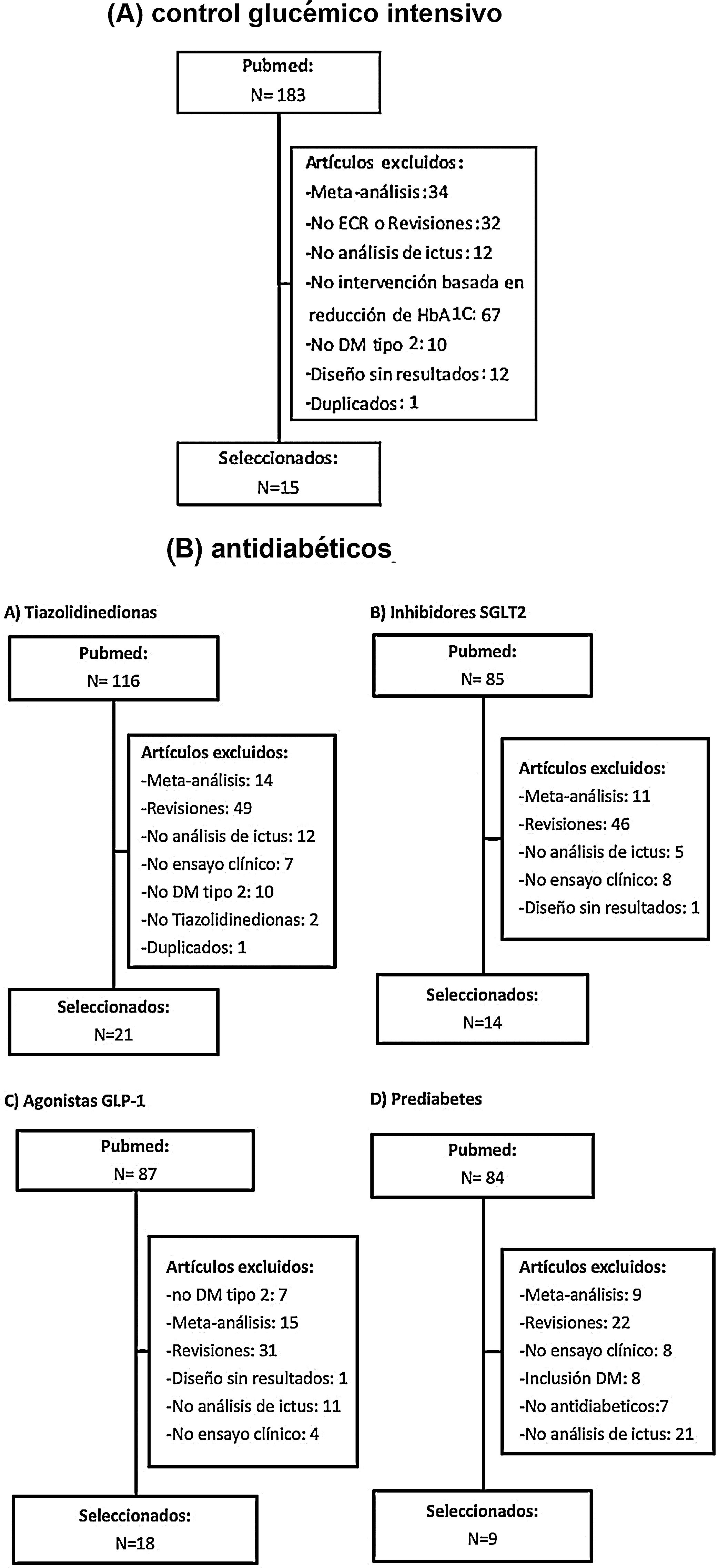
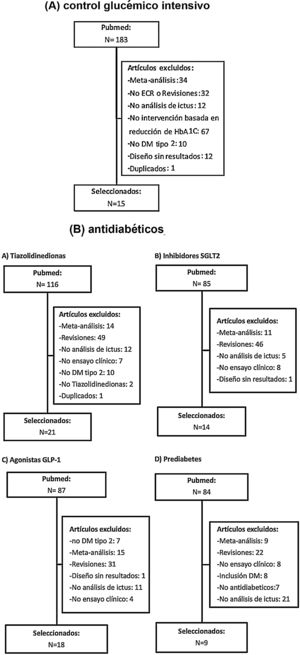
Posteriormente se han revisado los títulos y resúmenes de todos los artículos identificados, seleccionando los que cumplían los siguientes criterios: ensayo clínico aleatorizado, evaluación de ictus como variable independiente (principal o secundaria). Se han excluido los metaanálisis, revisiones no sistemáticas, ensayos realizados en poblaciones diferentes a DM-2 o prediabetes y los ensayos clínicos que no incluían ictus como variable de resultados. En las figuras 1A y B se detalla el proceso de selección de los artículos incluidos en los posteriores metaanálisis, para los que hemos utilizado el programa Review Manager 5 software (Version 5.3.5; Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration, 2014). Preferentemente, los datos que se han introducido en los metaanálisis son los aportados en la publicación principal de los ensayos clínicos, y en algunos casos se ha consultado el material suplementario de dicha publicación principal o publicaciones secundarias. Finalmente, basándonos en los resultados de los metaanálisis, se han redactado unas recomendaciones en respuesta a cada una de las preguntas realizadas, considerando los siguientes grados de recomendación: clase I-fuerte recomendación (beneficio muy superior al riesgo); clase IIa-recomendación moderada (beneficio superior al riesgo); clase IIb-recomendación débil; y clase III-no beneficio cuando el beneficio es equivalente al riesgo22. Para el análisis del perfil de seguridad se han revisado los principales efectos adversos graves de los ensayos clínicos de cada familia de antidiabéticos, y en el caso de que los datos no se pudieran extraer directamente de la publicación original del ensayo clínico o de su material suplementario, se han utilizado datos a partir de metaanálisis publicados. Los niveles de evidencia se han clasificado como nivel de evidencia A (evidencia de alta calidad procedente de más de un ensayo clínico aleatorizado, metaanálisis de alta calidad, o uno o más ensayos clínicos aleatorizados corroborados por estudios de registro de alta calidad); nivel de evidencia B (evidencia de calidad moderada procedente de uno o más ensayos clínicos aleatorizados, o de uno o más estudios no aleatorizados, observacionales o registros de alta calidad, metaanálisis de ensayos clínicos de moderada calidad, o metaanálisis de estudios no aleatorizados); nivel de evidencia C (datos limitados cuando los datos proceden de estudios observacionales o registros con limitaciones metodológicas en su diseño o ejecución)22. Hemos añadido además comentarios adicionales para poner en contexto las recomendaciones. En las tablas 1 y 2 se detallan las características principales de los ensayos clínicos seleccionados.
Características principales de los ensayos clínicos analizados en la evaluación de la intensidad del control glucémico (basado en diana de HbA1c)
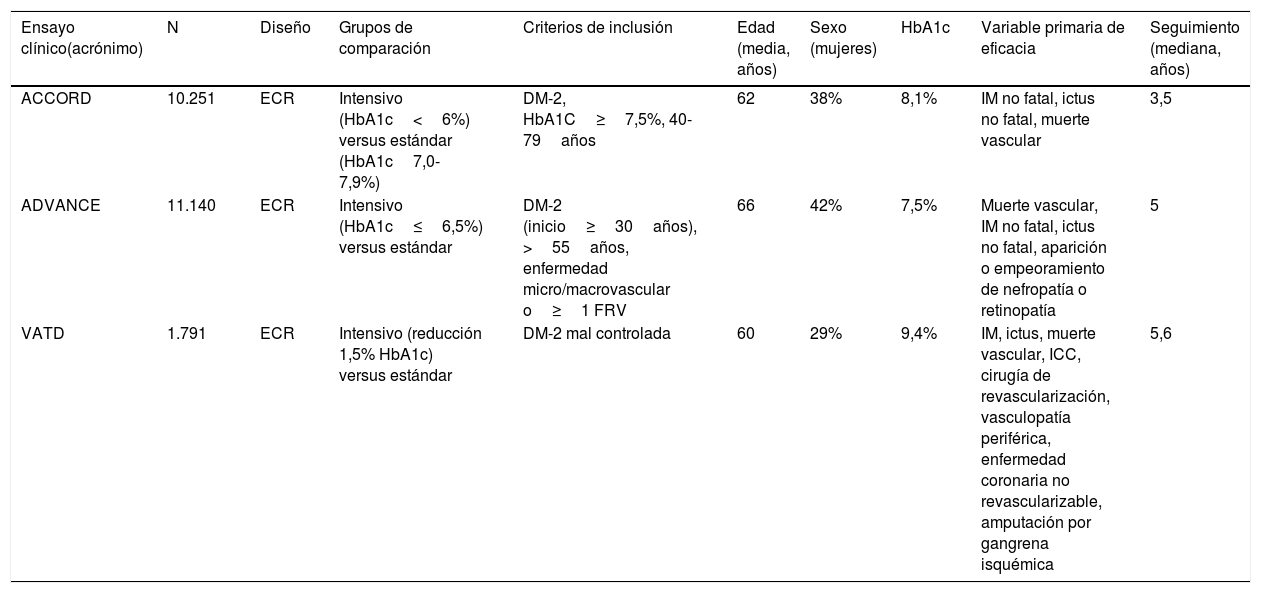
| Ensayo clínico(acrónimo) | N | Diseño | Grupos de comparación | Criterios de inclusión | Edad (media, años) | Sexo (mujeres) | HbA1c | Variable primaria de eficacia | Seguimiento (mediana, años) |
|---|---|---|---|---|---|---|---|---|---|
| ACCORD | 10.251 | ECR | Intensivo (HbA1c<6%) versus estándar (HbA1c7,0-7,9%) | DM-2, HbA1C≥7,5%, 40-79años | 62 | 38% | 8,1% | IM no fatal, ictus no fatal, muerte vascular | 3,5 |
| ADVANCE | 11.140 | ECR | Intensivo (HbA1c≤6,5%) versus estándar | DM-2 (inicio≥30años), >55años, enfermedad micro/macrovascular o≥1 FRV | 66 | 42% | 7,5% | Muerte vascular, IM no fatal, ictus no fatal, aparición o empeoramiento de nefropatía o retinopatía | 5 |
| VATD | 1.791 | ECR | Intensivo (reducción 1,5% HbA1c) versus estándar | DM-2 mal controlada | 60 | 29% | 9,4% | IM, ictus, muerte vascular, ICC, cirugía de revascularización, vasculopatía periférica, enfermedad coronaria no revascularizable, amputación por gangrena isquémica | 5,6 |
Características principales de los ensayos clínicos analizados en la evaluación de fármacos antidiabéticos
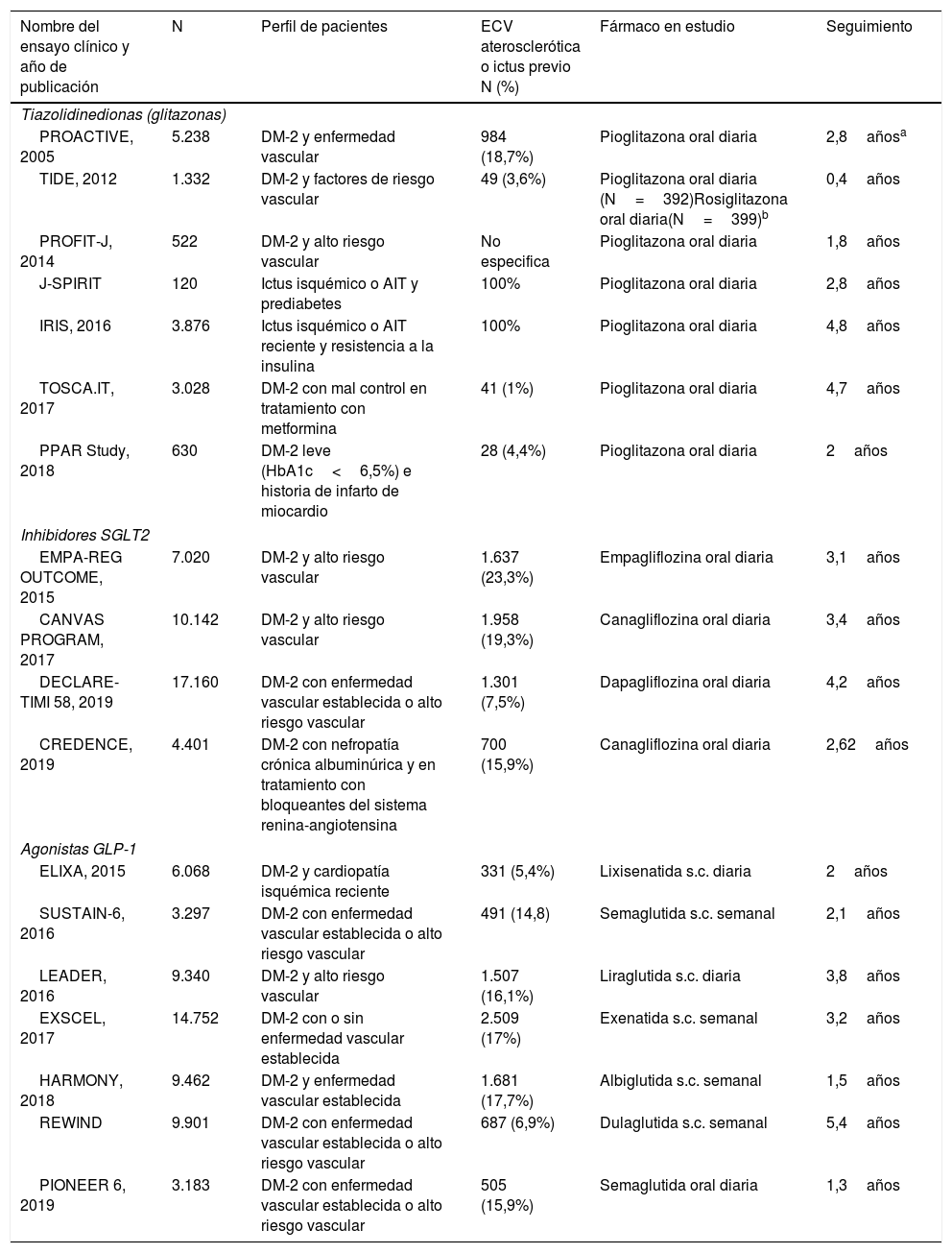
| Nombre del ensayo clínico y año de publicación | N | Perfil de pacientes | ECV aterosclerótica o ictus previo N (%) | Fármaco en estudio | Seguimiento |
|---|---|---|---|---|---|
| Tiazolidinedionas (glitazonas) | |||||
| PROACTIVE, 2005 | 5.238 | DM-2 y enfermedad vascular | 984 (18,7%) | Pioglitazona oral diaria | 2,8añosa |
| TIDE, 2012 | 1.332 | DM-2 y factores de riesgo vascular | 49 (3,6%) | Pioglitazona oral diaria (N=392)Rosiglitazona oral diaria(N=399)b | 0,4años |
| PROFIT-J, 2014 | 522 | DM-2 y alto riesgo vascular | No especifica | Pioglitazona oral diaria | 1,8años |
| J-SPIRIT | 120 | Ictus isquémico o AIT y prediabetes | 100% | Pioglitazona oral diaria | 2,8años |
| IRIS, 2016 | 3.876 | Ictus isquémico o AIT reciente y resistencia a la insulina | 100% | Pioglitazona oral diaria | 4,8años |
| TOSCA.IT, 2017 | 3.028 | DM-2 con mal control en tratamiento con metformina | 41 (1%) | Pioglitazona oral diaria | 4,7años |
| PPAR Study, 2018 | 630 | DM-2 leve (HbA1c<6,5%) e historia de infarto de miocardio | 28 (4,4%) | Pioglitazona oral diaria | 2años |
| Inhibidores SGLT2 | |||||
| EMPA-REG OUTCOME, 2015 | 7.020 | DM-2 y alto riesgo vascular | 1.637 (23,3%) | Empagliflozina oral diaria | 3,1años |
| CANVAS PROGRAM, 2017 | 10.142 | DM-2 y alto riesgo vascular | 1.958 (19,3%) | Canagliflozina oral diaria | 3,4años |
| DECLARE-TIMI 58, 2019 | 17.160 | DM-2 con enfermedad vascular establecida o alto riesgo vascular | 1.301 (7,5%) | Dapagliflozina oral diaria | 4,2años |
| CREDENCE, 2019 | 4.401 | DM-2 con nefropatía crónica albuminúrica y en tratamiento con bloqueantes del sistema renina-angiotensina | 700 (15,9%) | Canagliflozina oral diaria | 2,62años |
| Agonistas GLP-1 | |||||
| ELIXA, 2015 | 6.068 | DM-2 y cardiopatía isquémica reciente | 331 (5,4%) | Lixisenatida s.c. diaria | 2años |
| SUSTAIN-6, 2016 | 3.297 | DM-2 con enfermedad vascular establecida o alto riesgo vascular | 491 (14,8) | Semaglutida s.c. semanal | 2,1años |
| LEADER, 2016 | 9.340 | DM-2 y alto riesgo vascular | 1.507 (16,1%) | Liraglutida s.c. diaria | 3,8años |
| EXSCEL, 2017 | 14.752 | DM-2 con o sin enfermedad vascular establecida | 2.509 (17%) | Exenatida s.c. semanal | 3,2años |
| HARMONY, 2018 | 9.462 | DM-2 y enfermedad vascular establecida | 1.681 (17,7%) | Albiglutida s.c. semanal | 1,5años |
| REWIND | 9.901 | DM-2 con enfermedad vascular establecida o alto riesgo vascular | 687 (6,9%) | Dulaglutida s.c. semanal | 5,4años |
| PIONEER 6, 2019 | 3.183 | DM-2 con enfermedad vascular establecida o alto riesgo vascular | 505 (15,9%) | Semaglutida oral diaria | 1,3años |
Se han identificado 3 ensayos clínicos aleatorizados cuyo objetivo principal fue evaluar el efecto del control metabólico intensivo respecto al tratamiento estándar en el riesgo de eventos vasculares. Tanto la diana del tratamiento intensivo (reducción de la HbA1c por debajo de un umbral absoluto o relativo) como las estrategias farmacológicas y no farmacológicas utilizadas en cada uno de estos ensayos fueron variables.
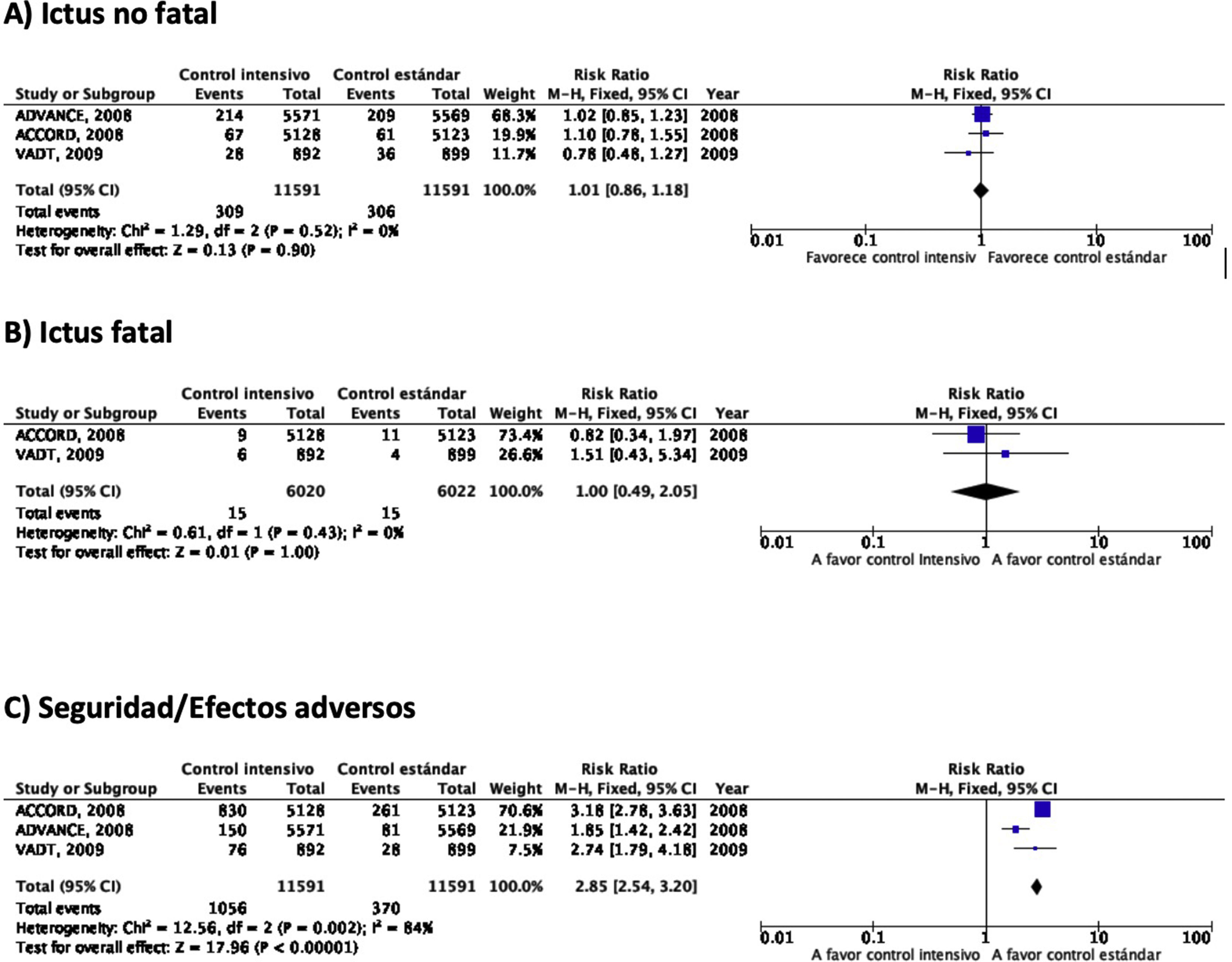
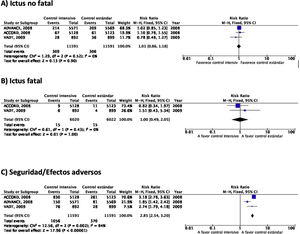
En el estudio ACCORD23–28 el tratamiento intensivo (diana de HbA1c<6%) se asoció a una mayor mortalidad en comparación con el tratamiento no intensivo, observación que motivó la suspensión del estudio tras 3,5años de seguimiento. En el grupo de tratamiento intensivo, 67 de 5.128 (1,3%) pacientes presentaron un ictus no fatal durante el seguimiento en comparación con 61 de 5.123 (1,2%) en el grupo de tratamiento no intensivo, y la incidencia de ictus fatal fue idéntica entre ambos grupos (0,2%) (fig. 2). En este ensayo la variable de eficacia primaria fue definida como la aparición de IM no fatal, ictus no fatal y/o muerte de causa vascular y no se observaron diferencias (HR 0,90; IC 95%: 0,78-1,04; p=0,16). Tanto la mortalidad como la incidencia de hipoglucemia sintomática fueron más frecuentes en el grupo de tratamiento intensivo.
En el estudio ADVANCE17,29–31 un total de 214 de 5.571 (3,8%) pacientes aleatorizados al grupo de tratamiento intensivo (diana de HbA1c<6,5%) presentaron un ictus no fatal durante el seguimiento (5años de mediana), en comparación con 209 de 5.569 (3,8%) de los pacientes del grupo de tratamiento no intensivo (fig. 2). En este ensayo la variable de eficacia primaria fue definida como muerte de causa vascular, IM no fatal, ictus no fatal y/o la aparición o empeoramiento de complicaciones microvasculares tales como nefropatía o retinopatía. El tratamiento intensivo fue capaz de reducir la incidencia de la combinación de enfermedad macrovascular y microvascular (HR 0,90; IC 95%: 0,82-0,98; p=0,01) así como de enfermedad microvascular aislada (HR 0,86; IC 95%: 0,77-0,97; p=0,01), especialmente por su efecto protector del daño renal (HR 0,79; IC 95%: 0,66-0,93; p=0,006). Sin embargo, no se observaron diferencias con relación a la incidencia de enfermedad macrovascular aislada o de muerte. La incidencia de hipoglucemia grave fue más frecuente en el grupo de tratamiento intensivo.
En el estudio VATD tampoco se observaron diferencias en la incidencia de ictus en el grupo de tratamiento intensivo (cuya diana fue obtener una reducción del valor absoluto de la HbA1c del 1,5%) en comparación con el grupo de tratamiento no intensivo18,32–34. La variable de eficacia primaria fue definida como la incidencia de IM, ictus, muerte de causa vascular, insuficiencia cardiaca congestiva, cirugía de revascularización, vasculopatía periférica, enfermedad coronaria no revascularizable y/o amputación por gangrena isquémica, sin observarse diferencias significativas entre los dos grupos (HR 0,88; IC 95%: 0,74-1,05; p=0,14). Tampoco se observaron diferencias significativas en mortalidad o en la incidencia de enfermedad microvascular excepto en la progresión de la microalbuminuria, que fue menor en el grupo de tratamiento intensivo.
RecomendaciónEn pacientes con DM-2 no se recomienda el control intensivo de glucemia para reducir el riesgo de ictus. Recomendación clase III, nivel de evidencia B.
Comentario adicionalUn análisis abierto a 10años de seguimiento de los pacientes incluidos en el estudio UKPDS que fueron inicialmente aleatorizados a recibir tratamiento intensivo (diana de glucemia en ayunas <6mmol/L-108mg/dL) en comparación con tratamiento no intensivo tampoco fue capaz de identificar diferencias en el riesgo de ictus entre los dos grupos (6,3 vs. 6,9 por 1.000 pacientes-año; riesgo relativo [RR] 0,91; IC 95%: 0,73-1,13; p=0,39)35,36. Tampoco se observaron diferencias significativas en el riesgo de ictus en los pacientes aleatorizados al grupo intensivo tratados con metformina (6,0 vs. 6,8 por 1.000 pacientes-año; RR 0,80; IC 95%: 0,50-1,27; p=0,35). No obstante, en los grupos de tratamiento intensivo se observó una reducción significativa en el riesgo de eventos vasculares relacionados con la DM, especialmente en la incidencia de enfermedad microvascular, IM o muerte de cualquier causa. Por lo tanto, para la mayoría de los pacientes con DM-2, mantener una HbA1c<7% es una diana razonable para reducir el riesgo de eventos microvasculares. De forma individualizada un control más estricto (HbA1c<6,5%) o menos estricto (HbA1c>8%) podría ser apropiado en función de determinadas características particulares.
PICO 2: En pacientes con DM-2 e ictus previo, ¿el buen control metabólico (HbA1c<7%) en comparación con el mal control metabólico (HbA1c>7%) reduce el riesgo de recurrencia de ictus?En la revisión sistemática no se han identificado ensayos clínicos que hayan valorado de forma específica el efecto de la intensidad del control metabólico en la población de pacientes con ictus, por lo que no se pueden hacer recomendaciones específicas para la prevención secundaria de ictus.
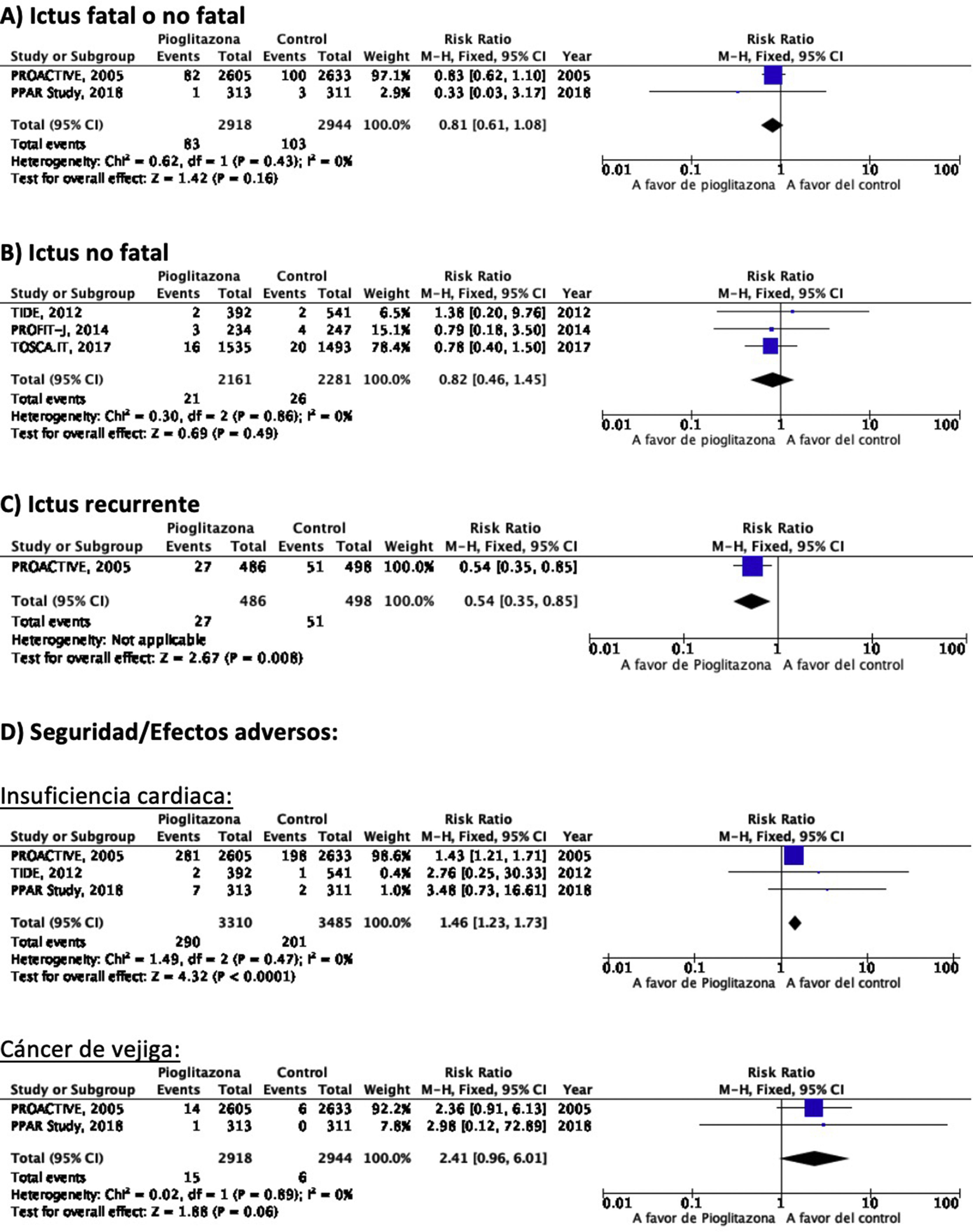
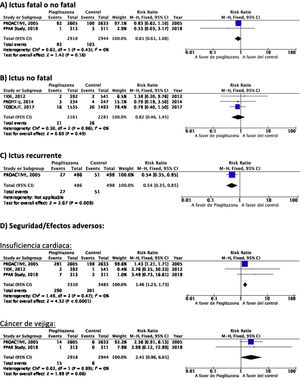
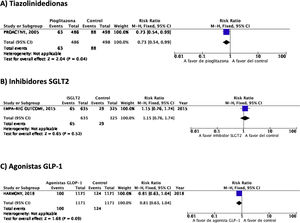
PICO 3: En pacientes con DM-2, ¿los antidiabéticos con beneficio vascular añadidos al tratamiento antidiabético estándar en comparación con el tratamiento antidiabético estándar reducen el riesgo de ictus?TiazolidinedionasDe los 7 ensayos clínicos identificados en los 21 artículos seleccionados en la revisión sistemática, 4 han evaluado los efectos de pioglitazona (PROACTIVE37–47, PROFIT-J48, TOSCA.IT49–51, PPAR-Study52), 2 de rosiglitazona (RECORD53,54, BARI-2D55,56) y el estudio TIDE que incluye, además del grupo control, dos brazos de tratamiento activo, uno con pioglitazona y otro con rosiglitazona, y que tuvo que ser prematuramente interrumpido a los 162 días por cuestiones regulatorias57. Teniendo en cuenta que rosiglitazona ha sido retirada de la comercialización por razones de seguridad, se excluyen los ensayos clínicos RECORD y BARI-2D de los metaanálisis, y del ensayo TIDE solamente se recogen los datos correspondientes al grupo de pioglitazona. Como se puede observar en la figura 3, pioglitazona se asoció a una reducción no significativa del RR de ictus (fatal o no fatal) y de ictus no fatal. El principal efecto adverso de pioglitazona fue la insuficiencia cardiaca.
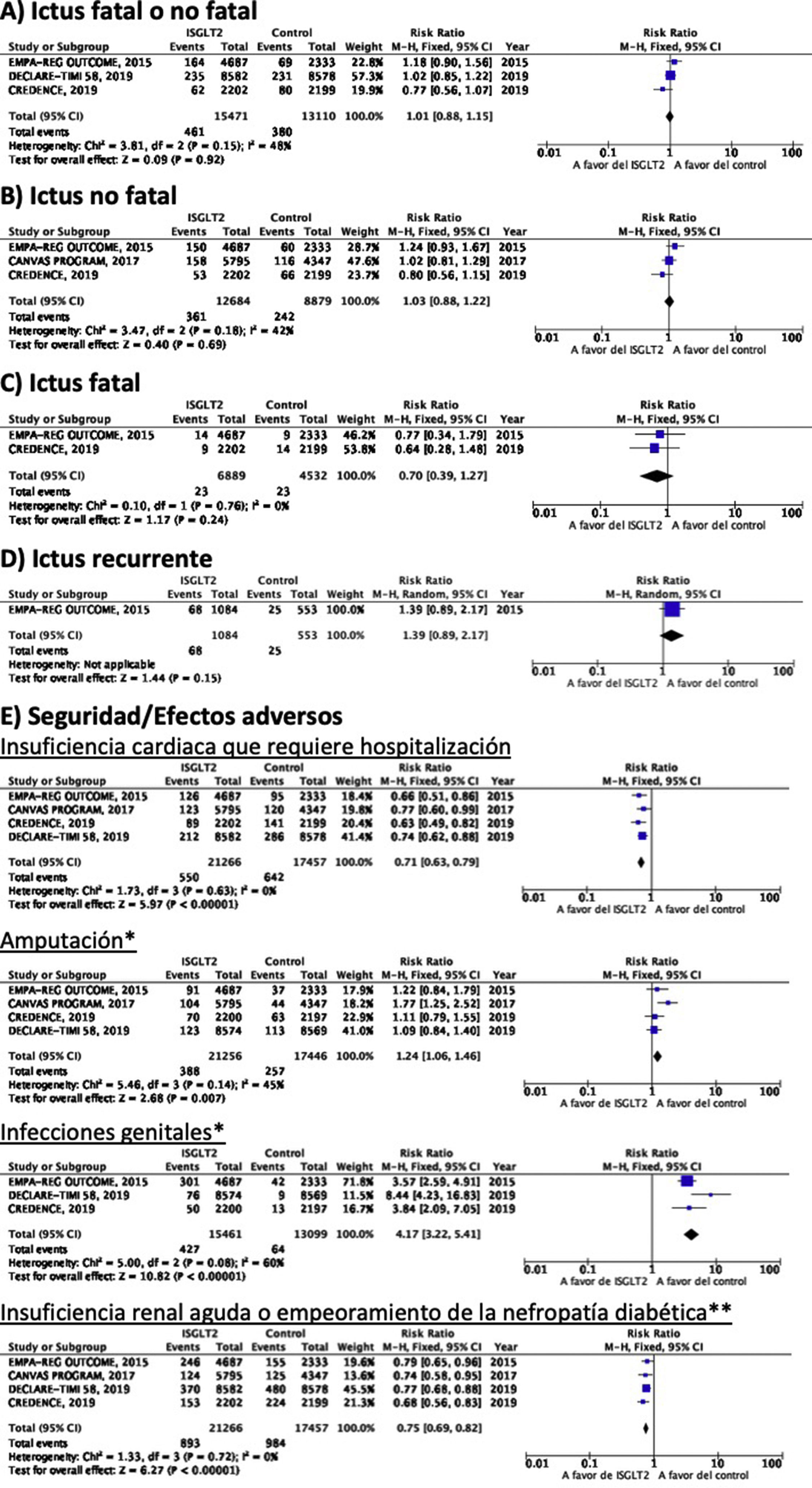
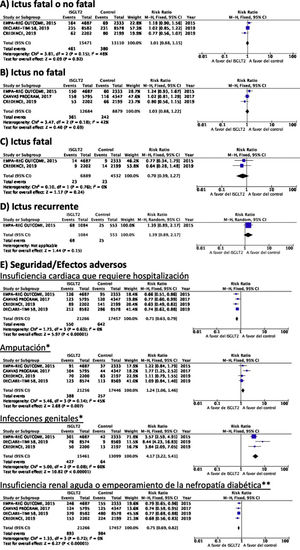
Inhibidores selectivos SGLT2Se identificaron 4 ensayos clínicos aleatorizados, controlados con placebo y doble ciego que han evaluado la eficacia y seguridad de inhibidores SGLT2 en pacientes con DM-2 y en los que se analiza ictus como variable secundaria de resultados: EMPA-REG OUTCOME (empagliflozina oral)58–62, CANVAS (canagliflozina oral)63–66, CREDENCE (canagliflozina oral)67,68, DECLARE-TIMI 58 (dapagliflozina oral)69–71, con un total de 38.723 pacientes incluidos, de los que 5.596 pacientes tenían antecedente de ictus o de enfermedad cerebrovascular (ECV) aterosclerótica (tabla 1). El estudio VERTIS-CV72, que evalúa la seguridad y eficacia de ertugliflozina, solamente ha publicado, hasta el momento de la elaboración de esta revisión sistemática, el diseño y características basales de los pacientes, por lo que se excluye del metaanálisis. El tratamiento con inhibidores de SGLT2 no se asoció a reducción del RR de ictus fatal, ictus no fatal o ictus fatal o no fatal. En el análisis del perfil de seguridad es importante destacar la significativa reducción de hospitalización por insuficiencia cardiaca y de insuficiencia renal aguda o progresión de nefropatía diabética, pero con incremento de amputaciones con canagliflozina en el programa CANVAS73 y de infecciones genitales (fig. 4).
Inhibidores SGLT2 en prevención de ictus en pacientes con DM-2. *Los datos del número de amputaciones del programa CANVAS y del EMPA-REG OUTCOME se han tomado a partir del metaanálisis de Dicembrini et al.73. En el análisis de infecciones genitales no se incluyen datos del programa CANVAS por expresar los datos en n.o/1.000 pacientes años pero que también reporta un incremento significativo de infecciones genitales. ** Criterios diagnósticos variables entre los ensayos clínicos.
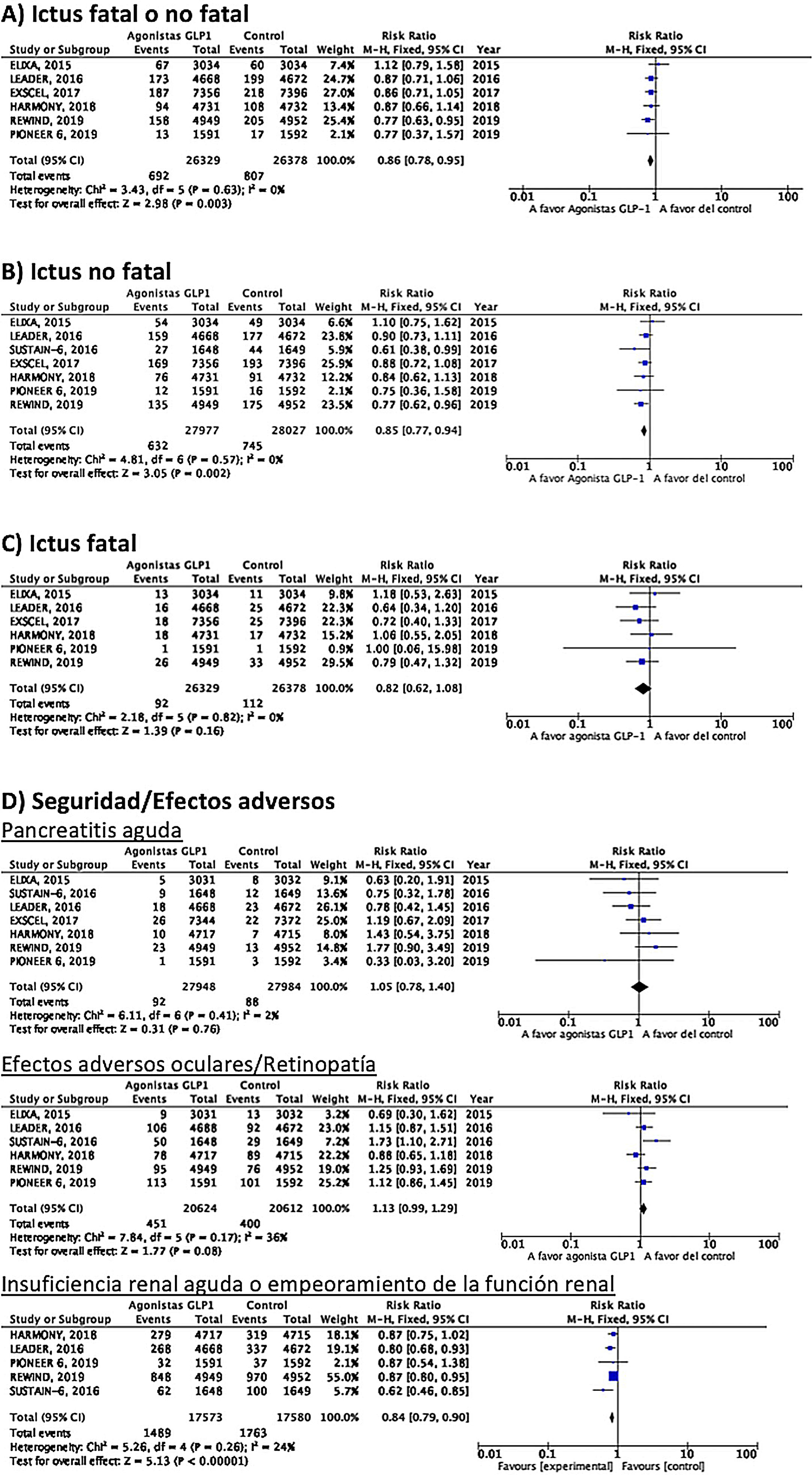
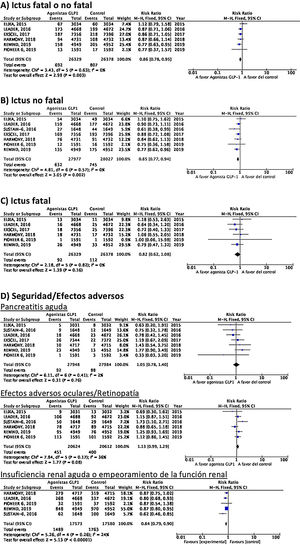
Hasta el momento se han publicado 7 ensayos clínicos aleatorizados que han evaluado la eficacia de agonistas GLP-1 en la prevención de ictus en pacientes con DM-2 y enfermedad vascular establecida o alto riesgo vascular: ELIXA (lixisenatida subcutánea diaria)74–76, SUSTAIN-6 (semaglutida subcutánea semanal)77,78, LEADER (liraglutida subcutánea diaria)79–82, EXSCEL (exenatida subcutánea semanal)83–85, HARMONY (albiglutida subcutánea semanal)86,87, REWIND (dulaglutida subcutánea semanal)88,89 y PIONEER 6 (semaglutida oral diaria)90,91, con un total de 56.004 pacientes incluidos. De ellos, 7.711 (13,7%) presentaban antecedente de ECV o ictus previo (tabla 1). El tratamiento con GLP-1 se asoció a una reducción del RR de ictus fatal o no fatal del 14% (RR 0,86; IC 95%: 0,78-0,95), reducción de ictus no fatal del 15% (RR 0,85; IC 95%: 0,77-0,94), sin diferencia significativa en ictus fatal (RR 0,82; IC 95%: 0,62-1,08). En el análisis del perfil de seguridad no se ha observado incremento significativo del riesgo de pancreatitis o de retinopatía diabética, con el beneficio adicional de la reducción del riesgo de insuficiencia renal aguda o empeoramiento de la función renal (fig. 5).
RecomendaciónEn pacientes con DM-2 con enfermedad vascular establecida o alto riesgo vascular se recomienda el uso de agonistas GLP-1 añadidos al tratamiento antidiabético estándar en prevención de ictus fatal o no fatal. Recomendación grado I, nivel de evidencia B.
En pacientes con DM-2 con enfermedad vascular establecida o alto riesgo vascular no se recomienda pioglitazona o inhibidores de SGLT2 añadidos al tratamiento antidiabético estándar con el objetivo de reducir el riesgo de ictus. Recomendación clase III, nivel de evidencia B.
Comentario adicionalA pesar de que pioglitazona ha mostrado en el metaanálisis de los 5 ensayos clínicos una tendencia no significativa a la reducción de ictus (fatal o no fatal) y de ictus no fatal, el seguimiento a 6 y 10años del estudio PROACTIVE muestra ausencia de diferencia en el riesgo de ictus a largo plazo39,47.
PICO 4: En pacientes con ictus y DM-2, ¿los antidiabéticos con beneficio vascular añadidos al tratamiento antidiabético estándar en comparación con el tratamiento antidiabético estándar reducen el riesgo de recurrencia de ictus?TiazolidinedionasNo existen ensayos clínicos con tiazolidinedionas en prevención secundaria de ictus en pacientes con DM-2. El estudio PROACTIVE es el único ensayo clínico con pioglitazona del que se ha publicado un análisis post-hoc en prevención de recurrencias de ictus en el subgrupo de pacientes con ictus previo, mostrando una reducción del 46% en el riesgo de ictus recurrente (fig. 3)40.
Inhibidores selectivos SGLT2Hasta el momento no se han desarrollado ensayos clínicos en prevención secundaria de ictus. Los estudios EMPA-REG OUTCOME (fig. 4) y el programa CANVAS han publicado datos del análisis de ictus en pacientes con antecedentes de ECV61,64. Ninguno de ellos ha mostrado un efecto significativo de ISGLT2 en la prevención de recurrencias de ictus. El estudio CANVAS expresa los datos en pacientes-años, sin aportar el número de pacientes con ictus recurrente por grupo de estudio, por lo que no se incluye en este metaanálisis, aunque no observan un efecto significativo del fármaco en el riesgo de recurrencia de ictus (HR 0,88; IC 95%: 0,61-1,26)64. Se han publicado análisis post-hoc del estudio CREDENCE analizando el efecto de canagliflozina en los grupos de prevención primaria o secundaria de enfermedad vascular establecida (antecedente de IM o de ictus), sin aportar datos específicos de recurrencias de ictus en pacientes con ictus previo68. El estudio DECLARE-TIMI 58 no ha aportado, hasta el momento, datos del efecto de dapaglifozina en recurrencia de ictus.
Agonistas del receptor GLP-1No se ha realizado ningún ensayo clínico con agonistas del receptor GLP-1 en prevención secundaria de ictus, pero análisis post-hoc de los estudios LEADER y SUSTAIN-6 han evaluado el efecto de liraglutida y semaglutida en el subgrupo de pacientes con ictus o IM previos78,82, sin encontrar un beneficio significativo en reducción de ictus no fatal, a excepción de liraglutida en los pacientes con filtrado glomerular <60mL/min/1,73m281. El estudio LEADER también ha publicado un análisis post-hoc en pacientes con enfermedad polivascular (definida como enfermedad aterosclerótica en dos o más de los siguientes territorios vasculares: arterias coronarias, arterias cerebrales o arterias periféricas), en el que no observan diferencias significativas en el riesgo de ictus no fatal en el grupo de liraglutida frente a placebo92. Al no aportar datos diferenciados del grupo de pacientes con ictus previo no es posible incluirlos en el metaanálisis de prevención de ictus recurrente. Hasta el momento no se dispone de análisis secundarios del efecto de dulaglutida, exenatida, lixisenatida, albiglutida ni de semaglutida oral en prevención de recurrencias de ictus.
RecomendacionesEn pacientes con ictus y DM-2 podría ser razonable el tratamiento con pioglitazona añadida al tratamiento antidiabético convencional con el objetivo de prevenir recurrencias de ictus. Recomendación clase IIb, nivel de evidencia B.
No existen evidencias suficientes para establecer recomendaciones del uso de inhibidores de SGLT2 o agonistas GLP-1 añadidos al tratamiento antidiabético convencional en pacientes con ictus y DM-2 con el objetivo de prevenir recurrencias de ictus.
Comentario adicionalEn pacientes con ictus y DM-2 en los que se considere tratamiento con pioglitazona es conveniente evaluar el riesgo de insuficiencia cardiaca. Por otra parte, teniendo en cuenta que los estudios de beneficio vascular global en pacientes con DM-2 con enfermedad vascular establecida o alto riesgo vascular señalan un significativo beneficio de los agonistas GLP-1 en reducción de ictus en ensayos clínicos aleatorizados en los que se han incluido 7.711 pacientes con antecedente de ECV o ictus previo (lo que representa el 13,7% del total de la población de dichos ensayos clínicos), parece razonable considerar añadir agonistas GLP-1 al tratamiento antidiabético estándar en los pacientes con DM-2 que ya han tenido un ictus.
PICO 5: En pacientes con ictus y DM-2, ¿los antidiabéticos con beneficio vascular añadidos al tratamiento antidiabético estándar en comparación con el tratamiento antidiabético estándar reducen el riesgo de complicaciones vasculares en general?TiazolidinedionasEl ensayo clínico PROACTIVE es el único de los ensayos con pioglitazona que ha publicado el efecto de pioglitazona en el subgrupo de pacientes con ictus40, mostrando una reducción del 27% en el RR de muerte vascular, IM no fatal e ictus no fatal (fig. 6).
Inhibidores selectivos SGLT2En el estudio EMPA-REG OUTCOME no se observa beneficio significativo de empagliflozina en la prevención de muerte vascular, IM no fatal o ictus no fatal en el subgrupo de pacientes con ECV previa59. Una publicación secundaria del programa CANVAS que analiza el beneficio de canagliflozina en pacientes con antecedentes de ECV muestra ausencia de beneficio sobre la variable combinada de muerte vascular, IM no fatal e ictus no fatal en pacientes con antecedentes de ECV (HR 0,96; IC 95%: 0,75-1,23)64. Dado que no aportan los datos numéricos crudos, no se incluye en el metaanálisis. Los estudios CREDENCE y DECLARE TIMI 58 no han comunicado hasta el momento datos específicos de los resultados sobre prevención vascular global en los pacientes con antecedentes de ictus.
Agonistas del receptor GLP-1El ensayo clínico HARMONY87 es el único que ha aportado datos del análisis del beneficio vascular global (reducción del riesgo de muerte vascular, IM no fatal e ictus no fatal) en el subgrupo de pacientes con antecedentes de ictus, mostrando una tendencia a la reducción del riesgo de la variable combinada (fig. 6).
Análisis post-hoc de los estudios LEADER, SUSTAIN-6 y REWIND han evaluado el efecto de los agonistas GLP-1 liraglutida, semaglutida y dulaglutida en el subgrupo de pacientes con ictus o IM previos78,82,89. Tanto liraglutida (HR 0,85; IC 95%: 0,73-0,99)82 como dulaglutida (HR 0,79; IC 95%: 0,66-0,96)89 han mostrado un beneficio significativo en la reducción de muerte vascular, IM no fatal e ictus no fatal en el subgrupo de pacientes con antecedente de ictus o IM.
RecomendacionesEn pacientes con ictus y DM-2, es razonable el uso de pioglitazona añadida al tratamiento antidiabético convencional en prevención de muerte vascular, IM o ictus. Recomendación clase IIa, nivel de evidencia B.
En pacientes con ictus y DM-2, podría ser razonable el uso de agonistas GLP-1 añadidos al tratamiento antidiabético convencional en prevención de muerte vascular, IM o ictus. Recomendación clase IIb, nivel de evidencia B.
En pacientes con ictus, no se recomienda el uso de inhibidores selectivos SGLT2 añadidos al tratamiento convencional en prevención de muerte vascular, IM o ictus. Recomendación clase III, nivel de evidencia B.
Comentario adicionalTeniendo en cuenta que los estudios de beneficio vascular global en pacientes con DM-2 con enfermedad vascular establecida o alto riesgo vascular señalan un significativo beneficio de los agonistas GLP-1 en reducción de muerte vascular, IM no fatal e ictus no fatal en ensayos clínicos aleatorizados en los que se han incluido 7.711 pacientes con antecedente de ECV o ictus previo (lo que representa el 13,7% del total de la población de dichos ensayos clínicos), y que los análisis post-hoc de los ensayos HARMONY, LEADER y REWIND sugieren beneficio vascular global en pacientes con antecedente de ictus o de IM, parece razonable considerar añadir agonistas GLP-1 al tratamiento antidiabético estándar en los pacientes con DM-2 que ya han tenido un ictus.
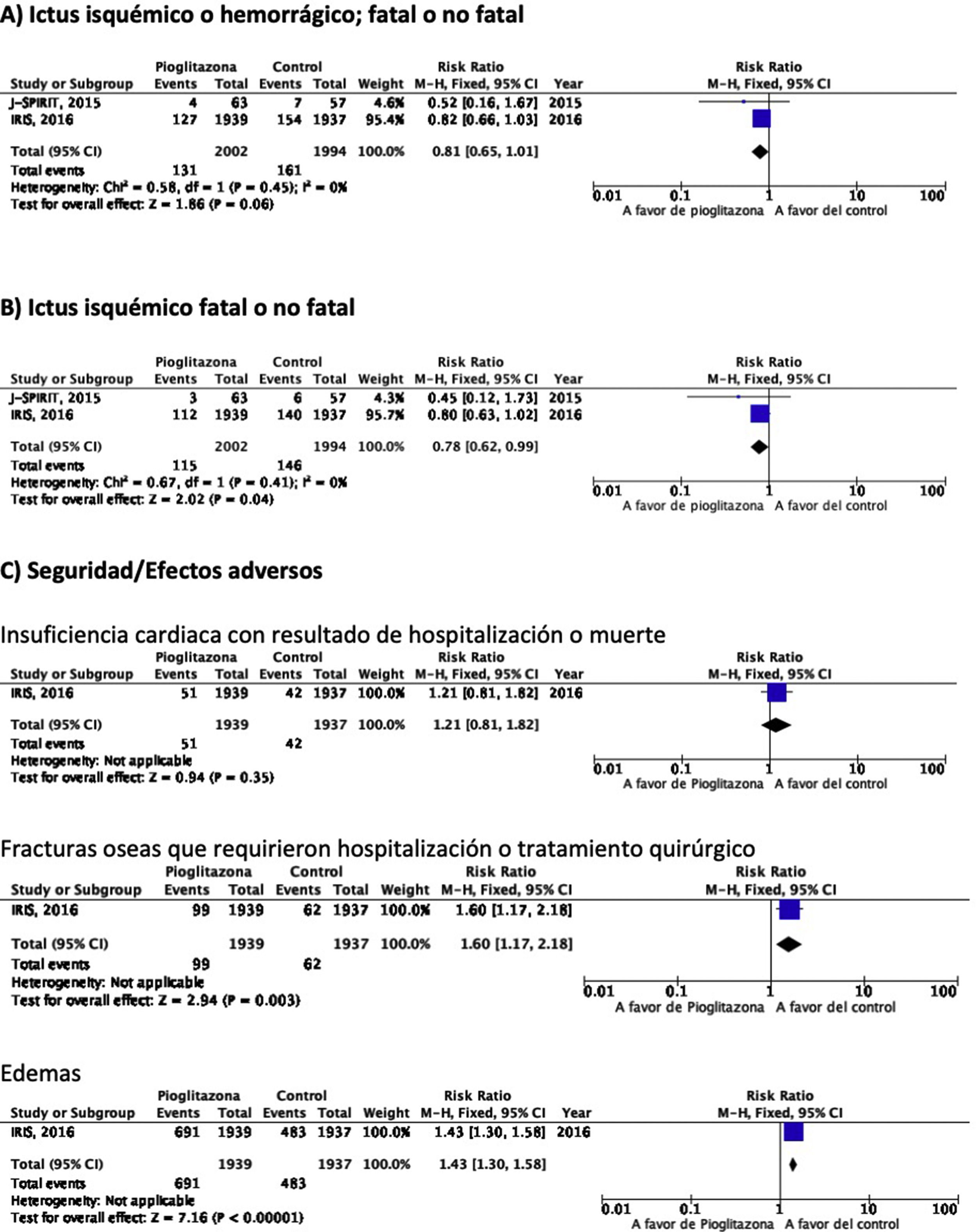
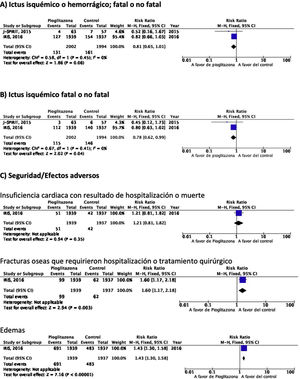
PICO 6: En pacientes con ictus y resistencia a la insulina o prediabetes, ¿los antidiabéticos que han mostrado beneficio vascular global en comparación con placebo reducen el riesgo de ictus recurrente?Se han identificado dos ensayos clínicos en pacientes con antecedentes de ictus y resistencia a la insulina o prediabetes que han analizado si el tratamiento con un fármaco antidiabético modifica el riesgo de ictus recurrente: J-SPIRIT93 e IRIS94–96. En ambos, el fármaco en investigación fue pioglitazona, y hasta el momento no se dispone de ensayos clínicos con otros antidiabéticos en prevención secundaria de ictus en pacientes con prediabetes o resistencia a la insulina. Los criterios para definir este estado metabólico fueron diferentes. Así, en el estudio J-SPIRIT la definición se basó en los resultados de una prueba de tolerancia oral a la glucosa, mientras que en el IRIS se definió la resistencia a la insulina mediante el índice HOMA-IR (del inglés, homeostasis model assessment of insulin resistance). El ensayo J-SPIRIT, que fue un ensayo abierto, no consiguió alcanzar el tamaño de muestra preestimado, con solo 120 pacientes incluidos, por lo que no tuvo la potencia estadística necesaria para obtener conclusiones definitivas93. En el ensayo IRIS, que reclutó 3.876 pacientes, el objetivo principal fue la reducción de la variable combinada ictus fatal o no fatal o IM, siendo la reducción de recurrencias de ictus una variable secundaria95. El metaanálisis de los resultados de los dos estudios muestra una reducción no significativa en el RR de ictus isquémico o hemorrágico en esta población, aunque si el análisis se restringe a la recurrencia como ictus isquémico, pioglitazona sí se asoció a una significativa reducción del 22% en el RR. Sin embargo, se observó un incremento significativo en el riesgo de fracturas óseas que requirieron tratamiento quirúrgico u hospitalización, así como edemas, sin diferencias significativas en el desarrollo de insuficiencia cardiaca con resultado de hospitalización o muerte (fig. 7).
RecomendacionesEn pacientes con ictus y prediabetes o resistencia a la insulina, podría considerarse el uso de pioglitazona añadida al tratamiento convencional en prevención de ictus isquémico recurrente. Clase de recomendación IIb, nivel de evidencia B.
En pacientes con ictus y prediabetes o resistencia a la insulina, no se dispone de evidencias suficientes para recomendar el uso de inhibidores selectivos SLGT2 o de agonistas del receptor GLP-1 por ausencia de ensayos clínicos en esta población.
Comentario adicionalEn el metaanálisis se han incluido solo los datos procedentes de la publicación original del estudio IRIS. No obstante, se ha publicado un análisis secundario en que se modifican los criterios de adjudicación de ictus, incluyendo la consideración de ictus en aquellos casos de síntomas neurológicos de menos de 24h de evolución, pero con lesión en las pruebas de neuroimagen, lo que ha permitido incluir 48 ictus isquémicos adicionales (14 en el grupo de pioglitazona y 34 en el grupo control). El análisis actualizado con estos datos muestra una reducción significativa del RR de ictus de cualquier tipo del 25% y de ictus isquémico del 28%, sin efecto sobre el riesgo de ictus hemorrágico96. Como beneficio adicional de pioglitazona en pacientes con ictus y resistencia a la insulina o prediabetes se ha señalado una reducción del RR de desarrollo de DM-2 a los 5años del 53%97. El estudio IRIS analizó también el efecto de pioglitazona sobre el desarrollo de deterioro cognitivo, sin evidencia de efecto en el seguimiento a 5años98. Por otra parte, otra publicación secundaria del estudio IRIS sugiere que el RR de fracturas óseas atribuibles a pioglitazona es del 47%, siendo el riesgo absoluto de 1,6 a los 5años del inicio del tratamiento, por lo que si se inicia este tratamiento es importante informar de este efecto adverso a los pacientes para prevenir caídas y realizar un cribado y tratamiento de la osteoporosis99.
DiscusiónEn esta revisión sistemática y metaanálisis hemos formulado una serie de preguntas que consideramos relevantes para orientar la estrategia de prevención de ictus en pacientes con DM-2 o prediabetes. En primer lugar, se ha evaluado la evidencia disponible en relación con el efecto de la intensidad del control glucémico en la reducción del riesgo de ictus. En segundo lugar, se han analizado los datos relacionados con el uso de antidiabéticos en la reducción del riesgo de ictus.
Es importante destacar que tanto la diana del tratamiento intensivo (reducción de la HbA1c por debajo de un umbral absoluto o relativo) como las estrategias utilizadas en cada uno de los 3 ensayos que han evaluado el efecto del control glucémico fueron variables17,18,25. Este hecho ha dificultado extraer unas recomendaciones basadas en un umbral único de valores de HbA1c, por lo que en el metaanálisis hemos clasificado los grupos de comparación en función de la asignación a los grupos de control intensivo en comparación con los grupos de control estándar. De acuerdo con los resultados individuales de los ensayos clínicos incluidos y con los datos del metaanálisis realizado, la intensidad del control glucémico no se asoció con una reducción del riesgo de ictus. Sin embargo, basándose en el beneficio del control glucémico en la prevención de eventos microvasculares, las recomendaciones de las sociedades científicas de diabetes establecen como una diana razonable mantener los valores de HbA1c por debajo del 7% en aquellos pacientes con DM-2 sin historia de hipoglucemia grave, sin enfermedad macrovascular avanzada o comorbilidad asociada, con larga esperanza de vida o sin dificultades para asegurar un control estrecho14,19. Finalmente, cabe señalar que en la revisión sistemática no identificamos ningún estudio en el que se analizara específicamente el efecto del control glucémico intensivo en la prevención de ictus recurrente en personas con DM-2 que ya han tenido un ictus, motivo por el que no se han podido ofrecer recomendaciones específicas para la prevención secundaria de ictus.
Con respecto al uso de antidiabéticos, el mandato de la FDA de evaluar el riesgo vascular de los fármacos antidiabéticos ha permitido poner en evidencia sus beneficios en cuanto a reducción de riesgo de ictus y otras complicaciones vasculares en los pacientes con DM-2 y alto riesgo vascular o enfermedad vascular aterosclerosa establecida. En prevención primaria de ictus destaca el grupo de los agonistas GLP-1, mientras que en prevención de ictus recurrente o de otras complicaciones vasculares en pacientes con ictus previo, las evidencias actuales apoyan el uso de pioglitazona. Sin embargo, es importante mencionar como limitaciones de esta revisión sistemática que no se dispone de ensayos clínicos específicamente diseñados para evaluar el efecto de estos fármacos en la reducción de ictus, por lo que las recomendaciones que se recogen en este documento se basan en análisis del riesgo de ictus como variable secundaria en ensayos clínicos o en análisis post-hoc de los mismos, y que de algunas de esas familias de antidiabéticos no se dispone de datos para analizar su posible papel en algunas de las cuestiones planteadas. Por último, en el caso de los pacientes con ictus y prediabetes solamente se dispone de ensayos clínicos con pioglitazona, no pudiéndose concluir si los otros grupos farmacológicos podrían ser eficaces o no en este escenario.
En conclusión, aunque no hay evidencia de que un mejor control metabólico reduzca el riesgo de ictus, algunas familias de antidiabéticos con beneficio vascular han mostrado reducción en el riesgo de ictus cuando se añaden al tratamiento convencional, tanto en el ámbito de prevención primaria en pacientes con DM-2 de alto riesgo vascular o con enfermedad vascular aterosclerosa establecida como en prevención secundaria de ictus en pacientes con DM-2 y prediabetes. Por tanto, es momento de que los neurólogos conozcamos las características y balance beneficio-riesgo de los diferentes fármacos antidiabéticos para incorporarlos en las estrategias de prevención de ictus y otras complicaciones vasculares en los pacientes con DM-2 o prediabetes.
FinanciaciónNinguna.
Conflicto de interesesBlanca Fuentes ha recibido honorarios de Novonordisk por conferencias y asesoría científica. Los demás autores no reportan conflictos de intereses.