Alemtuzumab es un anticuerpo monoclonal contra el receptor CD52 aprobado para el tratamiento de la esclerosis múltiple recurrente-remitente activa (EMRR). Alemtuzumab depleciona los linfocitos T y B circulantes mediante su unión a dicho receptor.
Entre los efectos adversos de alemtuzumab se encuentran las infecciones. Las más frecuentes son nasofaringitis, infecciones del tracto urinario, infecciones de vías respiratorias altas e infecciones herpéticas1,2. También se han descrito infecciones oportunistas después del tratamiento, como reactivación de tuberculosis, meningitis por listeria y nocardiosis cerebral3. Más recientemente, han sido publicados 2casos de reactivación de citomegalovirus (CMV)4 y un caso de coinfección por CMV y Pneumocystis jirovecii (P. jirovecii)5. Un caso adicional de infección por CMV se describió en el brazo de dosis altas de alemtuzumab (24mg/kg) del ensayo pivotal en fase iii6.
Describimos a continuación el caso de una paciente que presentó una neumonía por coinfección de CMV y P. jirovecii tras el primer ciclo de alemtuzumab.
Se trata de una mujer de 39 años diagnosticada de EMRR en 2009. Inicialmente, fue tratada con interferón beta 1b que, tras 9 meses, se cambió a fingolimod por falta de eficacia. En 2014 comenzó con natalizumab por persistencia de actividad de la enfermedad. En 2016 presentó seroconversión del virus John Cunningham y se decidió cambio de tratamiento a alemtuzumab por seguridad.
Ocho semanas antes del tratamiento con alemtuzumab se realizó analítica completa y serología, incluyendo VIH, virus hepatitis y varicela, que fueron normales. Se realizó también análisis de IgG e IgM de CMV que fueron negativas.
Tras un periodo de lavado de 7 semanas, se administró el primer ciclo de alemtuzumab en 5días consecutivos sin incidencias. Se inició profilaxis para infecciones herpéticas con aciclovir 200mg cada 12 h, que se mantuvo un mes tras el tratamiento y se dieron recomendaciones dietéticas para prevenir infecciones por Listeria. La analítica de control al mes mostró leucocitos de 3.370/mm3 con linfocitos de 540/mm3 y 6 TCD4 por mm3. El resto de la analítica, incluyendo plaquetas, bioquímica, hormonas tiroideas y sistemático de orina, era normal.
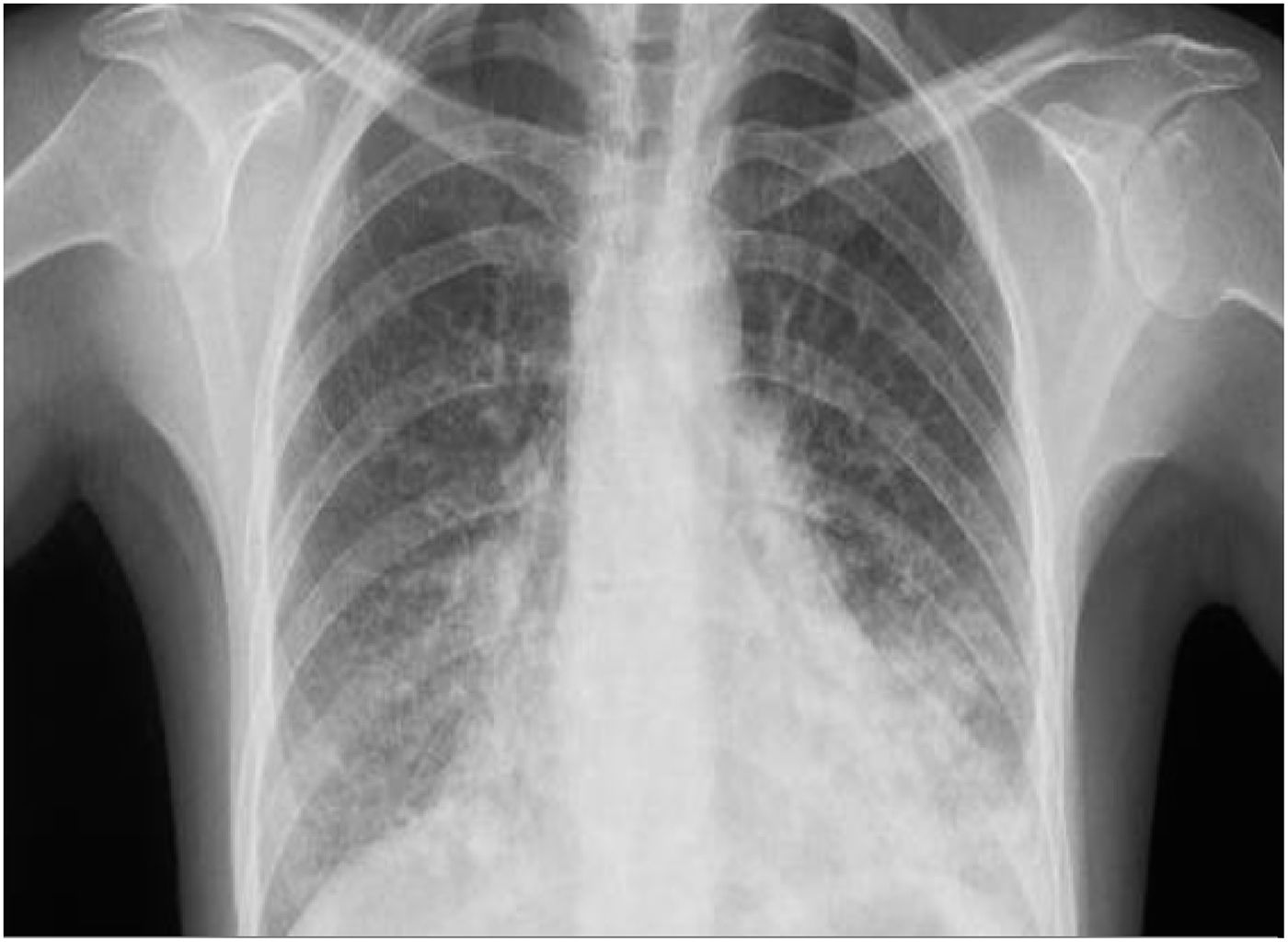
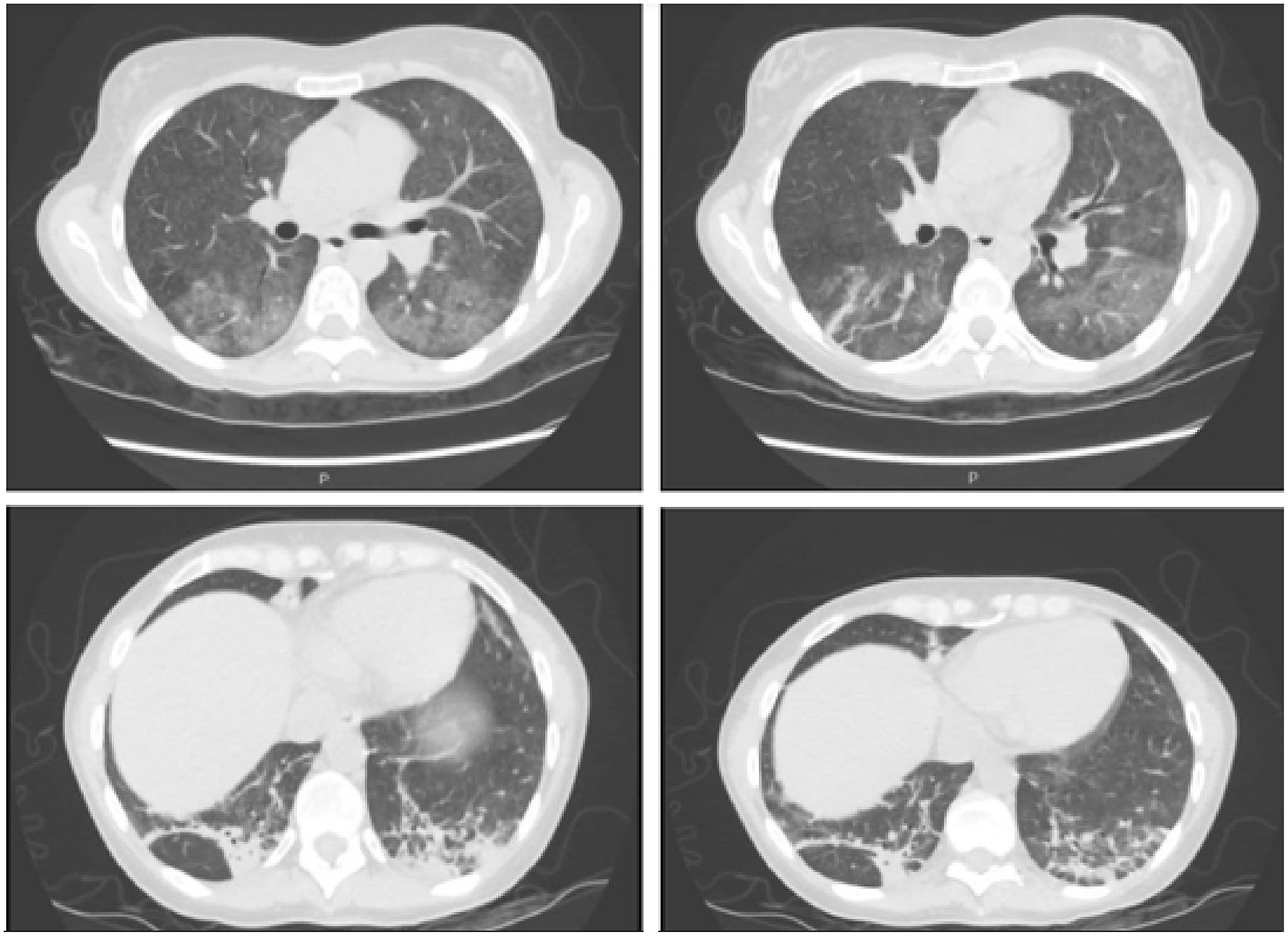
Cinco semanas después de administrar alemtuzumab la paciente acudió a urgencias por fiebre vespertina de hasta 38°C desde la semana anterior y disnea con saturación de oxígeno del 93%. En exploración física destacaba hipoventilación pulmonar. Se realizó analítica sanguínea que mostró elevación de transaminasas y reactantes de fase aguda (aspartato aminotransferasa 169 UI/l, alanino aminotransferasa 163 UI/l, fosfatasa alcalina 281 UI/l, gammaglutamil transpeptidasa 513 UI/l, proteína C reactiva 46mg/dl). El recuento leucocitario era normal, con 1.310 linfocitos/mm3. Se realizó radiografía de tórax que evidenció áreas pulmonares bilaterales “en vidrio deslustrado» (fig. 1), confirmado posteriormente con tomografía computarizada de tórax, donde además se evidenció neumonía basal izquierda (fig. 2). Se realizaron cultivos de sangre, orina y ecografía abdominal, que resultaron normales. En serología se evidenció la positivización de la IgG e IgM de CMV, siendo el resto normal.
Se realizó medición del ADN de CMV mediante reacción en cadena de la polimerasa (PCR) que mostró 3.893 copias/ml y se cursó ingreso con inicio de tratamiento con valganciclovir 900mg/12h y piperacilina/tazobactam 4/0,5g/8h por vía intravenosa.
El cultivo de lavado broncoalveolar fue positivo para P. jirovecii, por lo que se añadió tratamiento con trimetroprim-sulfametoxazol (TMP-SMX) 160/800mg. Los síntomas se resolvieron tras 10días de tratamiento, pero la profilaxis secundaria con valganciclovir y TMP-SMX se mantuvo hasta que la cifra de linfocitos TCD4 aumentó por encima de 200/mm3. La cuantificación del ADN de CMV se realizó semanalmente y fue positiva durante 7 semanas.
Actualmente, la paciente permanece asintomática desde el punto de vista respiratorio y estable desde el punto de vista neurológico. Ha recibido el segundo ciclo de alemtuzumab sin incidencias.
Aparte del caso arriba descrito se han publicado otros 4casos de pacientes con infección por CMV después del tratamiento con alemtuzumab4,5,7 Hasta la fecha, es el primer caso conocido de primoinfección por CMV, con positivización de IgG e IgM de CMV tras un periodo aproximado de un mes después del tratamiento con alemtuzumab. Este hecho es inusual dado que la prevalencia de seropositividad frente a CMV se encuentra en torno al 60% en individuos adultos inmunocompetentes de países desarrollados8,9.
La coinfección con Pneumocystis spp. es frecuente en estos casos, ya que el CMV aumenta la capacidad de adhesión y la replicación de otros microorganismos10.
Ya se conocían casos de reactivación de CMV en pacientes tratados con alemtuzumab por leucemia linfocítica crónica (LLC), llegando a afectar al 4-29% de estos pacientes11. Las guías para el manejo de CMV en pacientes con LLC recomiendan la realización de serología previa y PCR para CMV antes de comenzar alemtuzumab y posteriormente cada semana tras el tratamiento. En estos pacientes, si la PCR de CMV es positiva durante 2semanas consecutivas, o bien en una sola determinación si asocia clínica, se recomienda tratamiento con valganciclovir 14-21 días en pacientes sintomáticos o 7-14 días en pacientes asintomáticos, o bien hasta obtener 2PCR para CMV negativas11.
La infección por CMV es una complicación potencialmente grave tras el tratamiento con alemtuzumab. Para prevenirla, o en su caso diagnosticarla precozmente, proponemos la determinación de IgG e IgM para CMV antes de la administración de tratamiento y posteriormente si se desarrollan síntomas compatibles con infección. En opinión de los autores, la seronegatividad para CMV no debe suponer la negación de alemtuzumab si el balance riesgo/beneficio resulta favorable para el tratamiento; no obstante, se debería incrementar la vigilancia clínica en búsqueda de posibles síntomas de primoinfección, con realización de nueva serología en caso de sospecha. En pacientes que seroconviertan se debería medir el ADN de CMV por PCR. Tal y como recomiendan Clerico et al.4, consideramos que en el caso de que el resultado de la PCR sea positiva debe suspenderse tratamiento con aciclovir e iniciarse tratamiento con ganciclovir o valganciclovir, ya que ambos son tratamientos efectivos frente al CMV. En estos casos, también debería valorarse añadir tratamiento con profiláctico con TMP-SMX para prevenir la coinfección por neumocistis.