El uso de la resonancia magnética (RM) está ampliamente extendido en el diagnóstico y el seguimiento de los pacientes con esclerosis múltiple (EM). La coordinación entre los servicios de Neurología y Neurorradiología es clave para la realización e interpretación de estudios radiológicos de la manera más eficaz posible. Sin embargo, esta coordinación es susceptible de mejoras en una gran parte de los hospitales nacionales.
MétodosUn panel de 17 neurólogos y neurorradiólogos de 8 hospitales españoles, presencialmente y a través de comunicación online, consensuaron una guía de buenas prácticas en la coordinación en EM. La guía se estableció en 4fases: 1) definición del alcance de la guía y metodología del estudio; 2) revisión bibliográfica sobre buenas prácticas o recomendaciones en el uso de la RM en EM; 3) discusión y búsqueda de consenso entre los expertos; y 4) formalización y validación de los contenidos para elaborar el documento de consenso.
ResultadosSe consensuaron un total de 9 recomendaciones dirigidas a la mejora de la coordinación entre los servicios de Neurología y Neurorradiología, que se pueden resumir en: 1) estandarizar las solicitudes de RM, informes y planificación; 2) crear protocolos compartidos para los estudios de RM; 3) establecer comités multidisciplinares y sesiones de coordinación, y 4) generar canales de comunicación formales entre los profesionales de ambos departamentos.
ConclusionesSe espera que las recomendaciones consensuadas sirvan de guía para optimizar la coordinación entre neurólogos y neurorradiólogos y que repercutan en la mejora del diagnóstico y seguimiento de los pacientes con EM.
Magnetic resonance imaging (MRI) is widely used for the diagnosis and follow-up of patients with multiple sclerosis (MS). Coordination between Neurology and Neuroradiology departments is crucial for performing and interpreting radiological studies as efficiently and as accurately as possible. However, improvements can be made in the communication between these departments in many Spanish hospitals.
MethodsA panel of 17 neurologists and neuroradiologists from 8 Spanish hospitals held in-person and online meetings to draft a series of good practice guidelines for the coordinated management of MS. The drafting process included 4 phases: 1) establishing the scope of the guidelines and the methodology of the study; 2) literature review on good practices or recommendations on the use of MRI in MS; 3) discussion and consensus between experts; and 4) validation of the contents.
ResultsThe expert panel agreed a total of 9 recommendations for improving coordination between neurology and neuroradiology departments. The recommendations revolve around 4 main pillars: 1) standardising the process for requesting and scheduling MRI studies and reports; 2) designing common protocols for MRI studies; 3) establishing multidisciplinary committees and coordination meetings; and 4) creating formal communication channels between both departments.
ConclusionsThese consensus recommendations are intended to optimise coordination between neurologists and neuroradiologists, with the ultimate goal of improving the diagnosis and follow-up of patients with MS.
La esclerosis múltiple (EM) es una enfermedad neurodegenerativa inflamatoria desmielinizante que constituye la primera causa de discapacidad no traumática entre las personas jóvenes1. Su prevalencia se ha incrementado sustancialmente en las últimas décadas2, afectando aproximadamente a 2,3 millones de personas en todo el mundo2,3. En España, la prevalencia de EM es media-alta, con 80-180 casos por cada 100.000 habitantes4 y su diagnóstico tiene lugar alrededor de los 32 años de edad media5. Los síntomas asociados a la enfermedad impactan negativamente en las actividades diarias, la capacidad de trabajo y la calidad de vida de los pacientes6. El alto grado de discapacidad que pueden desarrollar los pacientes supone además una alta carga económica, siendo España uno de los países europeos donde el coste por paciente es mayor5.
Desde el punto de vista patológico, la EM se caracteriza por la formación de placas desmielinizantes7,8 en el sistema nervioso central (SNC), incluyendo el encéfalo, la médula espinal y el nervio óptico9-11, y el desarrollo de atrofia cerebral12 y espinal13. La resonancia magnética (RM) se considera la técnica paraclínica más fiable y precisa para diagnosticar y evaluar la actividad de la enfermedad14,15, ya que permite visualizar la presencia de lesiones y su estadio a través de distintas secuencias16. Entre las más utilizadas se encuentran las secuencias ponderadas T2, T2-FLAIR (fluid-attenuated inversion recovery) y T1. La secuencia ponderada T1 se realiza también administrando medios de contraste que contienen gadolinio para identificar lesiones con actividad inflamatoria aguda.
En los criterios diagnósticos de la EM de McDonald 201717 se especifica que la RM es una prueba de apoyo al diagnóstico capaz de complementar los hallazgos clínicos en la determinación de diseminación espacial (lesiones desmielinizantes situadas en al menos 2localizaciones anatómicas diferentes) y diseminación temporal (al menos 2lesiones desmielinizantes detectadas en momentos temporales diferentes) en pacientes que hayan presentado un único brote (síndrome clínico aislado [SCA]). El uso de la RM facilita el diagnóstico temprano18, abriendo la posibilidad de iniciar el tratamiento en fases iniciales. Además, esta prueba tiene un gran valor en el pronóstico de la enfermedad, en el seguimiento de los pacientes y en la evaluación y predicción del efecto de los tratamientos modificadores de la enfermedad (TME)19-21.
A pesar de su gran utilidad, de su extendido uso en la práctica clínica y de los importantes avances tecnológicos acontecidos en los últimos años, el uso de la RM en el diagnóstico y el seguimiento de los pacientes con EM no está exento de limitaciones. Por una parte, la variabilidad en los protocolos de adquisición, la utilización de distintos equipos de RM y la diferencia de criterios entre evaluadores dificulta la comparación de los resultados22,23. Por otra, los resultados de la RM con frecuencia son valorados por neurorradiólogos que no siempre tienen la información clínica adecuada, desconocen los criterios diagnósticos de la EM o no disponen de experiencia suficiente en su interpretación24.
Aunque existen recomendaciones sobre el uso de la RM en pacientes con EM14,25-29, estas no se focalizan en el proceso de colaboración entre neurólogos y neurorradiólogos, aun siendo considerado un aspecto de primordial importancia26. Existe la necesidad de establecer una guía sobre el uso más eficaz de la RM en el diagnóstico y seguimiento del paciente con EM mediante la mejora de la coordinación entre los profesionales sanitarios implicados. Con el objetivo de cubrir esta necesidad, el presente artículo expone las recomendaciones propuestas por un panel de expertos sobre la coordinación entre los servicios de Neurología y Neurorradiología para mejorar el uso de la RM en la práctica clínica española.
MétodosEl desarrollo de las recomendaciones se realizó mediante un proceso dividido en 4fases. En la primera fase, un panel nacional de expertos en Neurología y Neurorradiología se reunió en Barcelona en diciembre del 2018 para definir el alcance de contenidos y metodología a seguir. El panel estaba formado por una Comisión Asesora, encargada del desarrollo y validación de los contenidos, y por un equipo técnico (2 profesionales) que, además de formar parte de esta comisión, era responsable de dirigir y supervisar el proceso. La Comisión Asesora se compuso por 17 profesionales (15 profesionales más equipo técnico) de Neurología y Neurorradiología de 8 hospitales nacionales: 3 en Cataluña (Hospital Clínic de Barcelona, Hospital Universitario Vall d’Hebron y Hospital Moisès Broggi de Sant Joan Despí), 2 en Madrid (Hospital Universitario Ramón y Cajal y Hospital Universitario 12 de Octubre), uno en la Comunidad Valenciana (Hospital Universitario Dr. Peset), uno en Andalucía (Hospital Universitario Reina Sofía) y uno en Murcia (Hospital Clínico Universitario Virgen de la Arrixaca). El equipo técnico estaba formado por un experto en Neurología y un experto en Neurorradiología pertenecientes al Hospital Clínic de Barcelona y al Hospital Universitario Vall d’Hebron, respectivamente.
En una segunda fase se llevó a cabo el desarrollo de los contenidos de manera online y a partir de la revisión de la literatura disponible sobre buenas prácticas o recomendaciones en el uso de RM en EM. En la tercera fase, se realizó un taller de trabajo de un día de duración (marzo del 2019, Madrid) para compartir y definir los contenidos entre todos los expertos. Durante este taller cada participante presentó su propuesta de contenidos, que se discutió en grupo hasta llegar a un consenso. Una vez consensuados, se llevó a cabo la cuarta fase de formalización y validación, en la que se circuló vía online el borrador de recomendaciones para su validación. Primero se realizó una validación por parte del equipo técnico y después se realizó una segunda validación por parte de la Comisión Asesora, obteniendo así la versión final de recomendaciones que se presenta en este artículo.
ResultadosLa Comisión Asesora consensuó un total de 9 recomendaciones que, con base en la literatura disponible y la experiencia profesional, pretenden mejorar la coordinación entre los servicios de Neurología y Neurorradiología en la atención a pacientes con EM en España.
Realización de protocolos compartidosExisten recomendaciones para el desarrollo e implementación de protocolos de obtención (solicitud, realización y técnica de adquisición) y de informes de estudios de RM, tanto para los pacientes con sospecha de EM como para los pacientes ya diagnosticados14-16,27-29. Estos protocolos permiten establecer un lenguaje común que facilita la comunicación entre los profesionales implicados en el diagnóstico y el seguimiento de los pacientes26, facilitando su trabajo, y reduciendo las incoherencias, errores o pérdidas de información. Para que los protocolos sean interpretados e implementados correctamente es necesario que los neurólogos y neurorradiólogos que van a utilizarlos participen activamente en su desarrollo.
Aspectos como el tipo de secuencias o los parámetros técnicos pueden variar según los equipos de RM disponibles y la experiencia de cada centro. Sin embargo, es indispensable que la información contenida en los protocolos de solicitud y la información a incluir en los informes radiológicos sean consensuados y validados de forma multidisciplinar, con base en las evidencias científicas disponibles y las guías establecidas por grupos de expertos14-16,27-30. Para facilitar el diseño, la implementación y la evaluación de estos protocolos compartidos, es necesario definir procesos de comunicación bilaterales y establecer reuniones de trabajo periódicas con el equipo. Además, los protocolos tendrían que estar debidamente formalizados por escrito, ser conocidos y accesibles para todos los profesionales implicados, y garantizar la obtención rápida de la información.
Estandarización de la solicitud de pruebas de RMLa inclusión de la información clínica pertinente en la solicitud de pruebas de RM para el diagnóstico o el seguimiento del paciente tiene gran relevancia, ya que los resultados de estas pruebas van a condicionar la toma de decisiones diagnósticas o actitud terapéutica. En la práctica clínica, la solicitud de pruebas de RM por parte del Servicio de Neurología no siempre contiene la información requerida por el neurorradiólogo, ya sea por la ausencia de justificación de la prueba28, la falta de información clínica o la omisión de las cuestiones que se deben resolver. La falta de información clínica impacta negativamente en la planificación técnica de la prueba y en el posterior informe radiológico29, por lo que es responsabilidad del neurólogo proveer la información necesaria de forma completa, clara y precisa.
Para asegurar que esto se cumpla, se recomienda la estandarización de la información mínima que debe ser incluida en la solicitud de pruebas de RM para los casos de sospecha diagnóstica de EM y para las pruebas de seguimiento una vez diagnosticada esta enfermedad (tabla 1). Esta información permitirá no solo comunicar la información que el neurorradiólogo necesita para priorizar y planificar correctamente la prueba de RM, sino también proporcionar un contexto con las razones de derivación del paciente y un resumen de su situación clínica32 que se utilizará para la realización del informe.
Información mínima a incluir en la solicitud de pruebas de RM
| Diagnóstico | Seguimiento |
|---|---|
| Fecha del SCASíntomas clínicos y su evolución en el tiempoSospecha diagnósticaTratamiento con corticoides (fecha de inicio y fin)Partes del SNC que deben ser examinadas (con justificación clínica)Comorbilidades relevantesExistencia de insuficiencia renal graveAlergia conocida a medios de contrasteNecesidades especiales (nivel de autonomía, claustrofobia, gestación y lactancia, presencia de dispositivos, etc.)Prioridad | Situación clínica: síntomas, estabilidadDiagnóstico: fenotipo de EMMotivo de realización de la prueba: sospecha de brote, cambio de tratamiento, control en paciente estable, riesgo o sospecha de leucoencefalopatía multifocal progresivaSignos clínicos de actividad y/o progresión de la enfermedadGrado de discapacidadTratamiento actual y fecha de inicio (corticoides, TME)Partes del SNC que deben ser examinadas (con justificación clínica)Comorbilidades relevantesExistencia de insuficiencia renal graveAlergia conocida a medios de contrasteNecesidades especiales (nivel de autonomía, claustrofobia, gestación y lactancia, presencia de dispositivos, etc.)Prioridad |
La prioridad clínica podría ser categorizada en 4tipos: inmediata (en el mismo día), urgente (máximo de 72 h), preferente (máximo de 15 días) y ordinaria (antes de la siguiente fecha de consulta con Neurología).
EM: esclerosis múltiple; SCA: síndrome clínico aislado; SNC: sistema nervioso central; TME: tratamientos modificadores de la enfermedad.
Fuente: BOE31.
Los informes radiológicos son susceptibles de presentar una gran variabilidad en cuanto a la estructura y el tipo de información proporcionada por el neurorradiólogo. En ocasiones, los informes son breves resúmenes de hallazgos relacionados con la confirmación del diagnóstico y la detección de un aumento en el número de las lesiones, información que resulta insuficiente para el neurólogo a la hora de tomar decisiones sobre el manejo de la enfermedad. El informe radiológico estructurado facilita la inclusión de información relevante para el neurólogo, supone una guía de sencilla utilización para el neurorradiólogo, facilita la comunicación entre ambos y posibilita el traspaso de información a una base de datos común para su potencial análisis. Existe cada vez más evidencia de que la implementación de informes estructurados conlleva un mayor número de hallazgos relevantes para la EM, favorece la comprensión de los mismos a los neurólogos33,34 y se asocia a una mejor consistencia entre los informes emitidos por los radiólogos35. Dados los beneficios del informe estructurado, la recomendación de su uso ha sido consensuada por grupos de expertos a nivel internacional14,27,36.
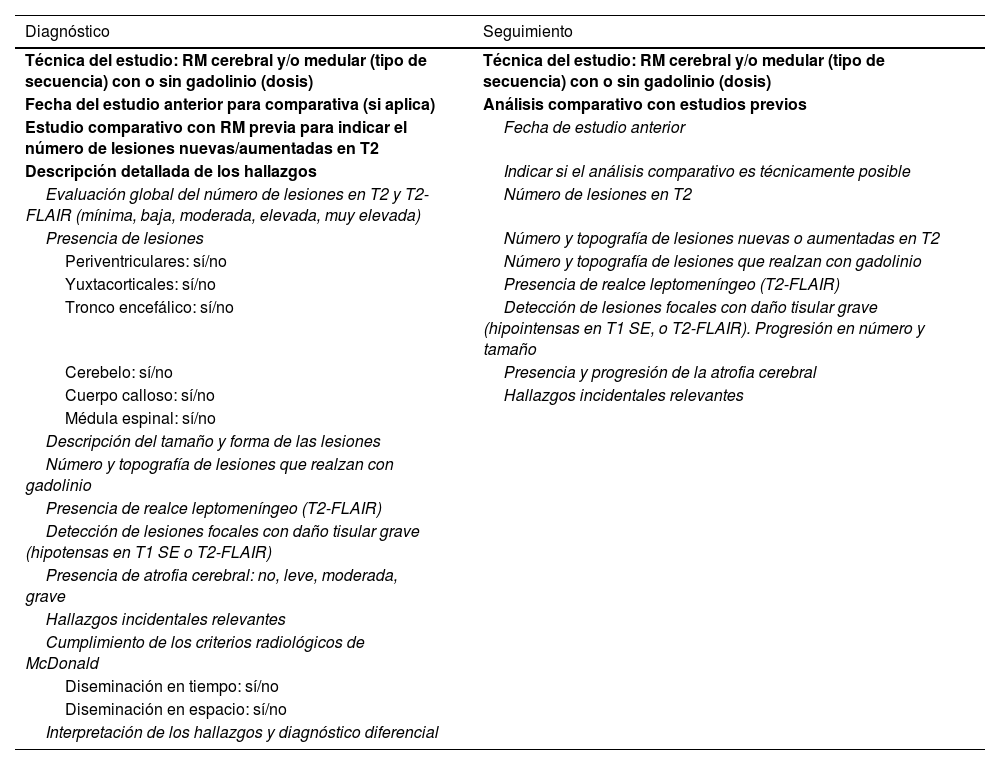
Atendiendo a la evidencia disponible14,25,27,36,38, la Comisión Asesora recomienda que el informe radiológico a cumplimentar por el neurorradiólogo solicitado para el diagnóstico contenga una información radiológica mínima necesaria para establecer el diagnóstico de EM (según la última revisión de los criterios de McDonald17) y para planificar el manejo del paciente14,26,27,32,37. Esta información incluye lo siguiente: 1) una descripción inicial de los hallazgos radiológicos; 2) las partes del SNC que han sido examinadas; 3) el tipo y dosis del medio de contraste administrado; 4) el número, el tamaño y la topografía de las lesiones desmielinizantes (con y sin realce de contraste); 5) la descripción e interpretación de hallazgos incidentales relevantes; 6) el cumplimiento de los criterios radiológicos de McDonald de diseminación en tiempo y espacio, y 7) la interpretación de los hallazgos radiológicos y diagnósticos diferenciales radiológicamente plausibles.
En el caso de que el informe fuera solicitado para el seguimiento del paciente, deberá contener, además de los aspectos incluidos en el informe para el diagnóstico, la valoración de cualquier cambio relevante en comparación con las pruebas anteriores.
La tabla 2 muestra una propuesta consensuada de estructura para cada uno de estos informes.
Propuesta de informe radiológico para el diagnóstico y seguimiento
| Diagnóstico | Seguimiento |
|---|---|
| Técnica del estudio: RM cerebral y/o medular (tipo de secuencia) con o sin gadolinio (dosis) | Técnica del estudio: RM cerebral y/o medular (tipo de secuencia) con o sin gadolinio (dosis) |
| Fecha del estudio anterior para comparativa (si aplica) | Análisis comparativo con estudios previos |
| Estudio comparativo con RM previa para indicar el número de lesiones nuevas/aumentadas en T2 | Fecha de estudio anterior |
| Descripción detallada de los hallazgos | Indicar si el análisis comparativo es técnicamente posible |
| Evaluación global del número de lesiones en T2 y T2-FLAIR (mínima, baja, moderada, elevada, muy elevada) | Número de lesiones en T2 |
| Presencia de lesiones | Número y topografía de lesiones nuevas o aumentadas en T2 |
| Periventriculares: sí/no | Número y topografía de lesiones que realzan con gadolinio |
| Yuxtacorticales: sí/no | Presencia de realce leptomeníngeo (T2-FLAIR) |
| Tronco encefálico: sí/no | Detección de lesiones focales con daño tisular grave (hipointensas en T1 SE, o T2-FLAIR). Progresión en número y tamaño |
| Cerebelo: sí/no | Presencia y progresión de la atrofia cerebral |
| Cuerpo calloso: sí/no | Hallazgos incidentales relevantes |
| Médula espinal: sí/no | |
| Descripción del tamaño y forma de las lesiones | |
| Número y topografía de lesiones que realzan con gadolinio | |
| Presencia de realce leptomeníngeo (T2-FLAIR) | |
| Detección de lesiones focales con daño tisular grave (hipotensas en T1 SE o T2-FLAIR) | |
| Presencia de atrofia cerebral: no, leve, moderada, grave | |
| Hallazgos incidentales relevantes | |
| Cumplimiento de los criterios radiológicos de McDonald | |
| Diseminación en tiempo: sí/no | |
| Diseminación en espacio: sí/no | |
| Interpretación de los hallazgos y diagnóstico diferencial |
La cuantificación de la carga lesional tiene un papel esencial en el estudio del estado del paciente. Por una parte, el número, el tamaño y la localización de las lesiones, en combinación con el número de brotes y la consecuente demostración de diseminación en el tiempo y en el espacio determina el diagnóstico de EM17. Por otra parte, la cuantificación del número de lesiones activas (nuevas o aumentadas en T2, o con realce de gadolinio) en el seguimiento del paciente es cada vez más importante debido a la creciente disponibilidad de TME. Las lesiones activas son indicadores aceptados de empeoramiento de la enfermedad y constituyen uno de los parámetros para determinar la presencia o ausencia de actividad de la enfermedad (NEDA, por sus siglas en inglés, no evidence of disease activity)38 en pacientes tratados con TME. Las secuencias de RM más utilizadas en EM son las ponderadas en T2 y T2-FLAIR para estudio cerebral y secuencias ponderadas en T2 y STIR (del inglés, Short-TI Inversion Recovery) para estudios medulares. En ocasiones, estas secuencias se complementan con secuencias ponderadas en T1 tras la administración de gadolinio39. El número o volumen de las lesiones observadas en T2 y el número de lesiones con realce de gadolinio predicen la progresión de la discapacidad40,41 y el aumento de la tasa de brotes42.
Existe una dificultad intrínseca a la hora de contar el número total de lesiones o el número de lesiones nuevas o aumentadas en T2, especialmente cuando estas últimas son pequeñas o en pacientes con elevado volumen lesional. Aunque en los últimos años se están desarrollando técnicas automatizadas para contar las lesiones43, la técnica más extendida en la práctica clínica es el análisis visual, el cual está sujeto a una elevada variabilidad22. Otra dificultad añadida es la falta de un estándar consensuado para describir el número de lesiones, resultando en una alta variabilidad entre informes de diferentes neurorradiólogos. Algunas guías de ámbito nacional44 y europeo25 proponen clasificar el número de lesiones estableciendo rangos de carga lesional.
En la tabla 3 exponemos nuestra propuesta de descripción del número de lesiones en T2 en los informes radiológicos, tanto en los estudios de RM cerebral como medular. Cuando haya hasta 20 lesiones cerebrales o 10 lesiones medulares, estas serán identificadas una a una visualmente y de forma exhaustiva; por encima de esta cantidad, el recuento será aproximativo y se realizará en forma de rangos. Cuando las lesiones cerebrales sean incontables o confluyentes con otras lesiones, o las lesiones medulares adopten un patrón difuso, ello se deberá especificar en el informe.
Estandarización de la programación de estudios de RMEl número y tipología de pruebas de RM en un servicio de Radiología es muy elevado, siendo necesario homogenizar los criterios para su programación. Los factores que afectan a esta programación abarcan desde el tiempo requerido para realizar las pruebas, el protocolo específico de RM, la disponibilidad de los equipos e incluso el grado de autonomía del paciente. Esto se traduce en una alta variabilidad en el intervalo de tiempo que trascurre desde la solicitud de las pruebas hasta su realización. Se describen a continuación algunas recomendaciones que podrían contribuir a una mejor programación de los estudios de RM.
Programar en función de un tiempo adaptado a cada paciente y tipo de pruebaLa utilización de tiempos estándar para todas las pruebas de RM es una de las prácticas más extendidas en la gestión de su programación, habitualmente en torno a los 20-40 min. En cambio, conviene adaptar la programación de la exploración al tiempo requerido por cada tipo de prueba o paciente. Con base en propuestas de duración consensuadas por expertos de otros países45 y a la experiencia de la Comisión Asesora, se propone una estimación de tiempos mínimos ajustados para diagnóstico y seguimiento que se presentan en la tabla 4.
Propuesta de tiempos mínimos para la realización de pruebas
| Descripción | Tiempo |
|---|---|
| Diagnóstico RM cerebral | 40 min |
| Seguimiento RM cerebral | 30 min |
| Diagnóstico RM cerebral + médula parcial | 40min + 15 min |
| Seguimiento RM cerebral + médula parcial | 30min + 15 min |
| Diagnóstico RM cerebral + médula completa | 40min + 20 min |
| Seguimiento RM cerebral + médula completa | 30min + 20 min |
Estas combinaciones de intervalos pretenden mejorar la programación de los estudios de RM al recoger como un solo concepto las pruebas cerebrales y medulares, y evitar así que se reserve de forma independiente cada prueba. Los tiempos de programación deben considerar, el grado de dependencia del paciente, contando con tiempo adicional computable en uso del equipo y tiempo de rotación entre pacientes. Para facilitar el análisis comparativo con estudios previos, el equipo y la técnica empleados deberían ser los mismos que en los estudios anteriores practicados al paciente.
Para minimizar las demoras causadas por la inclusión en las agendas de exploraciones no programadas (por la necesidad de realizarlas de forma urgente), se puede implantar un sistema de reserva de cupos de citas para estas exploraciones basado en un estudio de la actividad histórica del servicio. Este sistema de planificación facilitaría la realización de este tipo de estudios sin que ello repercutiera en los tiempos previstos para la obtención de los estudios programados.
Priorizar pruebas urgentes o prioritariasUna programación efectiva debe ser flexible para acomodarse a la demanda de pruebas urgentes o prioritarias. Por ejemplo, en pacientes con un SCA típico se recomienda realizar una RM diagnóstica en un tiempo inferior a una semana. Para que se cumpla ese objetivo se necesita implantar un sistema de bloqueo de tiempo disponible de sala de exploración durante un horario concreto.
Recordatorios de citas ambulatoriasPara optimizar el uso de los recursos disponibles y la programación de las citas, se requiere minimizar los cambios y cancelaciones de última hora por parte del paciente. Para ello, es conveniente realizar una llamada telefónica de 24 a 48 h antes de la realización de la prueba o disponer de un sistema automatizado de recordatorios por vía electrónica.
Identificación de neurorradiólogos de referencia para EMIdealmente, se recomienda utilizar el mismo equipo de RM y protocolo de adquisición o el mismo grupo de neurorradiólogos con el objetivo de minimizar la variabilidad en la calidad de los estudios y de los informes radiológicos14. Un alto grado de experiencia y conocimiento de los radiólogos en el campo de la RM es igualmente importante, ya que los informes de RM realizados por radiólogos sin experiencia específica en neurorradiología han mostrado tener menor sensibilidad y una mayor tasa de falsos negativos en la detección de nuevas lesiones de EM que los realizados por neurorradiólogos expertos24. Cabría esperar, por tanto, que contar con un equipo de neurorradiólogos expertos en la realización e interpretación de pruebas de RM en pacientes con EM mejoraría los resultados clínicos.
La Comisión Asesora recomienda que la actividad esté centralizada mediante equipos de trabajo estables y en comunicación estrecha. Se recomienda centrar la actividad de los neurorradiólogos por subespecialidad neurológica, ya que ello favorecería el desarrollo profesional de los neurorradiólogos en áreas específicas y facilitaría su participación en proyectos de investigación. Para mejorar la comunicación entre neurólogos y neurorradiólogos se recomienda la asignación de neurorradiólogos de «consulta» seleccionados con base en su área de experiencia que atiendan a las preguntas de los especialistas. Este puesto podría ser rotatorio y los profesionales asignados deberían estar localizables a través de protocolos de comunicación establecidos.
Implantación de comités multidisciplinares para enfermedades desmielinizantesDado que la EM provoca una alteración multidimensional, el apoyo que requieren los pacientes es interdisciplinar. La coordinación de todos los especialistas implicados es esencial para el manejo adecuado del paciente26,46,47. En este sentido, un comité multidisciplinar ayudaría a que el diagnóstico, el tratamiento y el seguimiento cumplieran unos estándares óptimos. En la tabla 5 se incluyen las recomendaciones propuestas para las funciones, aspectos a establecer y composición del Comité Multidisciplinar. Junto con los especialistas incluidos en el equipo de apoyo (tabla 5), los equipos multidisciplinares podrían incluir otros especialistas, con base en las necesidades detectadas para cada paciente.
Recomendaciones sobre el Comité Multidisciplinar
| Composición |
| Equipo estable: neurólogo, neurorradiólogo, diplomado en enfermería |
| Equipo de apoyo: neurorrehabilitador, logopeda, neurofisiólogo, urólogo, neurooftalmólogo, psicólogo, psiquiatra y farmacólogo |
| Funciones y responsabilidades |
| Identificación previa de casos complejos |
| Presentación de casos |
| Discusión del diagnóstico |
| Discusión del manejo terapéutico |
| Minimización de riesgos |
| Discusión sobre la involucración del paciente y decisiones compartidas |
| Aspectos a establecer tras ser oficializado dentro de cada centro |
| Competencias asumidas, adaptadas a las necesidades de cada centro |
| Composición y roles de sus integrantes |
| Coordinación de las reuniones, sugiriendo que sean gestionadas tanto por neurólogos como por neurorradiólogos de referencia |
| Oficialización de las decisiones a través de la creación de comités clínicos oficiales |
| Reuniones con una periodicidad predeterminada, al menos mensual, aunque sean de corta duración. Sus contenidos variarán en función de la carga clínica, pudiendo ser cancelada con cierta antelación si no se contempla su necesidad |
Para contribuir a la mejora continua de la atención al paciente con EM, se necesita una estructura de gestión que coordine a los servicios de Neurología y de Neurorradiología. Sin embargo, esta práctica no está suficientemente extendida ente los centros asistenciales que tratan este tipo de pacientes. Establecer sesiones de coordinación entre profesionales de los servicios de Neurorradiología y Neurología y los miembros del equipo organizativo y de gestión puede llevar a implantar mejoras en elementos, como la puesta en común de información de interés, el desarrollo de protocolos compartidos, el análisis de resultados mediante indicadores, el control del cumplimiento de estándares de calidad y la programación de citas. La Comisión Asesora estableció las recomendaciones presentadas en la tabla 6 para las sesiones de coordinación.
Recomendaciones para la realización de las sesiones de coordinación entre servicios
| Periodicidad de al menos 2 reuniones al añoPlanteamiento de los temas a tratar en las sesiones con cierta antelación para permitir la reflexión previa de los implicadosOficialización de las sesiones mediante la redacción y firma de actasComunicación y canalización de aquellas decisiones que involucren cambios significativos a los directivos del centroProfesionales implicados en las sesiones: neurorradiólogos, neurólogos y diplomados en enfermería especializados en neurología. Integrar también a técnicos especialistas de radiología y otros especialistas en función de las temáticas tratadas en las sesiones |
Una de las disfunciones organizativas más frecuentes en el ámbito hospitalario es la utilización de mecanismos informales de comunicación como herramienta profesional. El uso de estos mecanismos informales no solo repercute en un gasto adicional del tiempo de los profesionales implicados, sino que también perjudica a las situaciones que requieren una actuación urgente.
El establecimiento de mecanismos de comunicación formal de alertas conllevaría una coordinación más eficiente y rápida entre profesionales. La automatización de la comunicación debería realizarse donde y cuando sea posible, y adaptarse a cada centro. La estandarización de las vías de comunicación se podría realizar, por ejemplo, mediante sistemas de alerta registrados, llamadas de teléfono o aplicaciones de mensajería instantánea por telefonía móvil. La comunicación debería realizarse en ambas direcciones, emitiéndose un acuse de recibo de la información por parte del receptor.
ConclusionesEl uso de las pruebas de RM en el diagnóstico y seguimiento de los pacientes con EM es cada vez mayor debido a su alta sensibilidad para detectar eventos patológicos asociados a la enfermedad. Dado su papel clave y la previsión de un incremento en su utilización en los próximos años, existen cuestiones importantes que requieren ser optimizadas. En particular, los profesionales de los servicios de Neurología y Neurorradiología necesitan unir esfuerzos para mejorar su coordinación. La Comisión Asesora, formada por expertos destacados de ambos servicios, consensuó una serie de recomendaciones enfocadas a la estandarización de la información que cada servicio debe proveer al otro y a la mejora de la comunicación entre ambos. Las recomendaciones están basadas en la evidencia científica disponible, en guías de buenas prácticas de expertos internacionales y en la propia experiencia de los expertos que componen el panel.
La Comisión Asesora es consciente de que la implantación de estas recomendaciones dependerá en gran medida de los recursos, volumen de actividad y tamaño del hospital, pero invita a los neurólogos y neurorradiólogos a que las incorporen en su centro en la medida de lo posible. Cabría esperar que la implementación de estas recomendaciones, incluso de manera parcial, contribuyera significativamente a la mejora de la eficiencia y el funcionamiento de los servicios implicados en el diagnóstico, tratamiento y seguimiento de los pacientes con EM.
FinanciaciónLas reuniones, así como el soporte en la redacción y edición del manuscrito, fueron financiadas por Novartis Farmacéutica S.A.
Conflicto de interesesS.L. ha recibido honorarios por llevar a cabo sesiones formativas y consultorías de Novartis, Merck, Teva, Sanofi, Biogen y Genzyme. E.A. ha participado/participa en juntas de asesoría científica para Novartis, Sanofi-Genzyme, Roche y Biogen, y ha recibido honorarios como conferenciante por parte de Bayer, Sanofi-Genzyme, Merck-Serono, Novartis, Roche y Biogen. L.C-F. ha recibido honorarios por su participación en conferencias, servicios de consultoría, investigaciones clínicas y ayuda a desplazamientos de Merck, Bayer, Biogen, Novartis, Sanofi-Genzyme, Almirall, Roche, Celgene, Biopas, Ipsen y Teva. V.G. declara no tener ningún conflicto de interés. L.L. declara no tener ningún conflicto de interés. D.L. declara no tener ningún conflicto de interés. J.E.M-L. ha recibido honorarios por su participación en conferencias, servicios de consultoría e investigaciones clínicas de Almirall, Biogen, Celgene, Genzyme, Merck, Novartis, Roche y Teva. E.M. ha recibido honorarios por su participación en conferencias y servicios de consultoría de Actelion, Almirall, Bayer Schering Pharma, Biogen-Idec, Merck-Serono, Sanofi-Genzyme, Roche, Teva Pharmaceutical Industries Ltd. F.B-R. declara no tener ningún conflicto de interés. L.K. declara no tener ningún conflicto de interés. A.L. ha recibido honorarios como conferenciante en reuniones Biogen Idec, Novartis, Roche, Genzyme y Merck. A.L. declara no tener ningún conflicto de interés. P.M. declara no tener ningún conflicto de interés. M.D.M. declara no tener ningún conflicto de interés. L.R. declara no tener ningún conflicto de interés. I.Z. ha recibido honorarios por su participación en conferencias de Teva, Biogen, Merck, Novartis y Genzyme, ayuda a desplazamientos de Genzyme, Roche y Merck, y un contrato Río Hortega del Instituto de Salud Carlos III (2016-2018). A.R. ha participado/participa en juntas de asesoría científica para Novartis, Sanofi-Genzyme, SyntheticMR, Bayer, Roche, Biogen, y OLEA Medical, y ha recibido honorarios como conferenciante por parte de Bayer, Sanofi-Genzyme, Bracco, Merck-Serono, Teva, Novartis, Roche y Biogen.
Los autores quisieran mostrar su agradecimiento al departamento médico de Novartis, así como a Laura Prieto del Val, de Dynamic Science S.L., por los servicios prestados en la redacción del artículo.