Los reportes de los resultados quirúrgicos en los pacientes con epilepsia fármaco-resistente del lóbulo temporal sin anormalidades histológicas son escasos.
MétodosFueron revisados retrospectivamente los datos de los pacientes con epilepsia del lóbulo temporal tratados con lobectomía temporal anterior con amígdalo-hipocampectomía que no presentaban alteraciones en los estudios histopatológicos. Fueron analizadas las variables: edad, género, edad al inicio de las crisis epilépticas, edad al momento de la cirugía, tiempo de evolución de la epilepsia desde el diagnóstico hasta la fecha de la cirugía, periodo de seguimiento y clasificación según la escala de Engel.
ResultadosDe una base de datos de 256 lobectomías temporales, fueron identificados 21 pacientes que cumplieron los criterios de inclusión. El promedio de edad a la cual se realizó el diagnóstico de epilepsia fue 8,3 años, al momento de la cirugía fue 28,6 años y de tiempo transcurrido desde el diagnóstico hasta la cirugía fue 20,2 años. Tras un seguimiento promedio de 6,5 años, el 90,5% obtuvo resultados favorables (clases i y ii) y el 42,9% estaba libre de crisis (clase iA). Tras el análisis comparativo de las variables estudiadas, solo existieron diferencias estadísticamente significativas en la edad de inicio de las crisis, siendo inferior en los pacientes que obtuvieron resultados favorables.
ConclusiónAunque en la gran mayoría de los pacientes los resultados quirúrgicos a largo plazo fueron favorables, la proporción de pacientes libres de crisis es inferior a la de los pacientes con epilepsia lesional y comparables con lo reportado previamente en la literatura.
Reports on surgical outcomes in patients with drug-resistant temporal lobe epilepsy without histological abnormalities are scarce.
MethodsRetrospective review of data from patients with drug-resistant temporal lobe epilepsy and no histopathological alterations who underwent anterior mesial temporal lobectomy. We analysed the following variables: age, sex, age at seizure onset, age at surgery, time elapsed between diagnosis and the date of the surgery, follow-up time, and classification according to the Engel rating scale.
ResultsFrom a database of 256 temporal lobectomies, 21 were identified as meeting the inclusion criteria. The average age upon diagnosis of epilepsy was 8.3 years and average age at time of surgery was 28.6 years. The mean time elapsed between diagnosis and surgery was 20.2 years. After a mean follow-up of 6.5 years, 90.5% of the patients showed favourable outcomes (classes i and ii) and 42.9% were seizure-free (class IA). Comparative analysis of the variables revealed that average age at seizure onset was the only statistically significant difference between groups, with age at onset being lower in patients with favourable outcomes.
ConclusionAlthough long-term surgical outcomes were favourable for a large majority of patients, the percentage of seizure-free patients is lower than in patients with lesional epilepsy and comparable to that previously reported in the literature.
La epilepsia del lóbulo temporal (ELT) es el subtipo de epilepsia focal que con mayor frecuencia requiere manejo quirúrgico, logrando el control de las crisis en la gran mayoría de los pacientes tratados1–3.
El resultado de la cirugía para la ELT está estrechamente relacionado con la presencia de anormalidades epileptogénicas detectadas en los estudios preoperatorios de resonancia magnética (RM). En un reciente metaanálisis se encontró que el 75% de los pacientes con lesiones mesiales del lóbulo temporal se encontraron libres de crisis en el seguimiento postoperatorio a largo plazo; mientras que solo un 51% de los pacientes con RM normal obtuvieron beneficios similares con la cirugía4.
Diversos estudios han demostrado que la identificación y delimitación de una lesión epileptogénica en las imágenes preoperatorias resulta imposible en el 20 al 30% de los pacientes con ELT, aun cuando sean utilizados equipos para RM de alta resolución4–6. Este escenario, considerado por algunos autores como epilepsia «no lesional» (ENL)4, puede estar acompañado de alteraciones histopatológicas potencialmente epileptogénicas, por lo que no sería acertado definirla como tal. Por tanto, el estudio microscópico del espécimen quirúrgico continúa siendo la prueba de oro para determinar con certeza la existencia de una lesión implicada en el origen de las crisis.
Algunos estudios han vinculado la ausencia de alteraciones estructurales en el tejido resecado con la persistencia de las crisis tras el tratamiento quirúrgico7–9. El objetivo del presente estudio fue describir los resultados quirúrgicos a largo plazo de una serie de pacientes con ELT, en cuyos estudios histopatológicos no existían anormalidades.
Pacientes y métodosSe realizó un estudio de corte transversal en el cual se revisaron retrospectivamente los datos de los pacientes con epilepsia fármaco-resistente del lóbulo temporal tratados por el grupo multidisciplinario de cirugía de epilepsia de la Fundación Centro Colombiano de Epilepsia y Enfermedades Neurológicas (Cartagena de Indias, Colombia) que no presentaban alteraciones en las neuroimágenes ni en los estudios histopatológicos.
Valoración preoperatoriaToda la evaluación se realizó durante una admisión hospitalaria, en la cual se desarrolló el protocolo institucional de cirugía de epilepsia10.
Los pacientes con características clínicas, semiológicas y alteraciones en el electroencefalograma ictal de superficie que demostraron crisis focales motoras con automatismos típicos, con o sin generalización, fueron evaluados inicialmente mediante videoelectroencefalografía y neuroimágenes (RM/tomografía cerebral sin contraste); así como mediante el examen individualizado por cada uno de los miembros del grupo de cirugía de epilepsia, de acuerdo con el protocolo institucional de cirugía de epilepsia.
En aquellos pacientes que no presentaron anormalidades imagenológicas o electrofisiológicas que permitieran lateralizar el foco epileptogénico, se realizó un videoelectroencefalograma invasivo mediante el implante transitorio de electrodos subdurales subtemporales. Tras el registro de las crisis, se logró determinar la lateralización de la zona epileptogénica temporal.
Antes de cada procedimiento, todos los pacientes fueron evaluados en junta del grupo multidisciplinario de cirugía de epilepsia, integrado por epileptología, neurocirugía de epilepsia, neurología clínica, neuropsicología, fisioterapia y fonoaudiología. Durante las juntas, fue verificado el cumplimiento de los criterios de fármaco-resistencia de la epilepsia, afección de la calidad de vida e indicación quirúrgica para la lobectomía temporal anterior con amígdalo-hipocampectomía. La propuesta quirúrgica se comunicó a cada paciente y a sus respectivos familiares; y posteriormente se obtuvo el consentimiento informado para la cirugía.
Todos los pacientes fueron intervenidos quirúrgicamente mediante la técnica clásica de lobectomía temporal anterior con amígdalo-hipocampectomía. Ninguno de los especímenes obtenidos demostró alteraciones morfológicas microscópicas.
Fueron excluidos los casos con anomalías histológicas inespecíficas, tales como gliosis; así como aquellos cuyo seguimiento postoperatorio fue inferior a 12 meses.
Durante la recolección de los datos fueron registradas las siguientes variables: edad, género, edad al inicio de las crisis epilépticas, edad al momento de la cirugía, tiempo de evolución de la epilepsia desde el diagnóstico hasta la fecha de la cirugía y periodo de seguimiento.
Para la clasificación de los resultados quirúrgicos fue utilizada la escala de Engel y para la evaluación dicotómica los resultados del control de crisis fueron agrupados en favorables (Engel I y II) o desfavorables (Engel III y IV)11. Adicionalmente, se siguieron las recomendaciones de la Comisión de Neurocirugía de la Liga Internacional contra la Epilepsia con respecto a la subdivisión de los pacientes incluidos en la categoría i de escala de Engel. Teniendo en cuenta que en este grupo se clasifica tanto a pacientes completamente libre de crisis, como otros que aún las presentan pero no son incapacitantes, se definió libertad de crisis como la ausencia total de crisis desde la cirugía (clase iA)11.
Análisis estadísticoLos datos fueron ingresados a una base de datos del software SPSS (Statistical Package for the Social Sciences) versión 17,0 (SPSS, Inc., Chicago, IL, EE. UU.). Las variables cuantitativas fueron expresadas mediante medidas de tendencia central (media ± desviación estándar y rango), mientras que las cualitativas fueron presentadas como porcentajes.
Para la comparación entre los grupos se aplicó la prueba de la χ2 de Pearson, en caso de las variables cualitativas; mientras que para evaluar las diferencias entre variables cuantitativas se utilizó la prueba exacta de Fisher, considerando estadísticamente significativo un valor de p < 0,05.
Consideraciones éticasPor su diseño estudio observacional, este estudio carece de limitaciones éticas respecto a las indicaciones del tratamiento12; sin embargo, para la recolección de los datos se obtuvo el consentimiento informado por parte de los familiares de los pacientes. Adicionalmente, se obtuvo la aprobación del comité de ética institucional (Acta de aprobación número 005 del Centro Latinoamericano de Investigación en Epilepsia) y se garantizó la aplicación de las normas científicas y técnicas nacionales para la investigación en seres humanos (Resolución N.° 8430 de 1993 del Ministerio de la Protección Social de la República de Colombia) y los principios de buena práctica clínica (International Conference on Harmonisation/Good Clinical Practice).
ResultadosDe una base de datos constituida por 256 pacientes intervenidos por ELT, fueron identificados 21 pacientes que no presentaron alteraciones en los estudios histopatológicos. Catorce (66,7%) correspondían al género femenino y 7 (33,7%) al masculino. Todos eran diestros. El promedio de edad a la cual se realizó el diagnóstico de epilepsia fue 8,3 ± 8,3 (rango: 0 a 34) años y el promedio de tiempo transcurrido desde el diagnóstico hasta la cirugía fue de 20,2 ± 8,9 (5 a 35) años. La edad de los pacientes a la fecha de la cirugía osciló entre 13 a 49 años, con una media de 28,6 ± 9,8 años. La mayoría de las resecciones fueron realizadas sobre el lóbulo temporal derecho (57,1%). No hubo mortalidad perioperatoria.
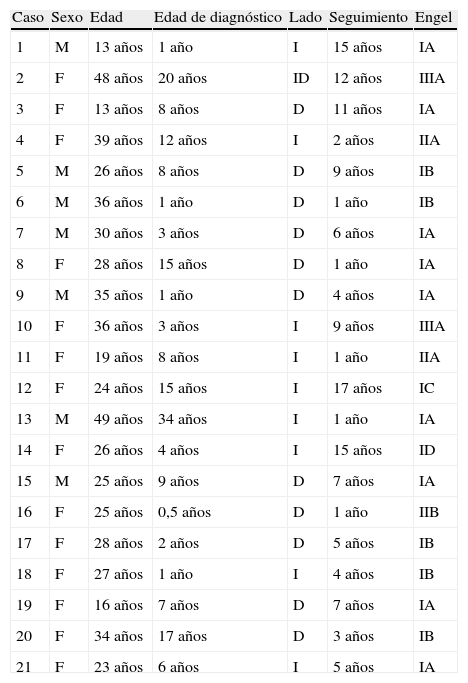
El tiempo promedio de seguimiento postoperatorio fue 6,5 ± 5,1 (rango: 1 a 17) años, tras el cual el 90,5% de los pacientes obtuvieron resultados favorables de acuerdo con el criterio preestablecido (clases iy ii) y el 42,9% estaba libres de crisis (clase iA) (tabla 1).
Características clínicas y clasificación de los resultados postoperatorios según la escala de Engel
| Caso | Sexo | Edad | Edad de diagnóstico | Lado | Seguimiento | Engel |
| 1 | M | 13 años | 1 año | I | 15 años | IA |
| 2 | F | 48 años | 20 años | ID | 12 años | IIIA |
| 3 | F | 13 años | 8 años | D | 11 años | IA |
| 4 | F | 39 años | 12 años | I | 2 años | IIA |
| 5 | M | 26 años | 8 años | D | 9 años | IB |
| 6 | M | 36 años | 1 año | D | 1 año | IB |
| 7 | M | 30 años | 3 años | D | 6 años | IA |
| 8 | F | 28 años | 15 años | D | 1 año | IA |
| 9 | M | 35 años | 1 año | D | 4 años | IA |
| 10 | F | 36 años | 3 años | I | 9 años | IIIA |
| 11 | F | 19 años | 8 años | I | 1 año | IIA |
| 12 | F | 24 años | 15 años | I | 17 años | IC |
| 13 | M | 49 años | 34 años | I | 1 año | IA |
| 14 | F | 26 años | 4 años | I | 15 años | ID |
| 15 | M | 25 años | 9 años | D | 7 años | IA |
| 16 | F | 25 años | 0,5 años | D | 1 año | IIB |
| 17 | F | 28 años | 2 años | D | 5 años | IB |
| 18 | F | 27 años | 1 año | I | 4 años | IB |
| 19 | F | 16 años | 7 años | D | 7 años | IA |
| 20 | F | 34 años | 17 años | D | 3 años | IB |
| 21 | F | 23 años | 6 años | I | 5 años | IA |
D: derecho; F: femenino; I: izquierdo; M: masculino.
Las diferencias de proporciones de resultados favorables tras la cirugía no fueron estadísticamente significativas entre el género femenino (85,7%) y masculino (100%); (χ2: 1,1; p = 0,29). Asimismo, la proporción de pacientes del género masculino libres de crisis fue de 71,4%, mientras que en el femenino fue 28,6%; sin diferencias estadísticamente significativas (χ2: 3,5; p = 0,06).
En cuanto a la lateralidad de la cirugía, no se encontraron diferencias estadísticamente significativas en la proporción de pacientes con resultados favorables (lado derecho: 91,7% vs. izquierdo 88,9%; χ2: 0,046; p = 0,83) ni libres de crisis (lado derecho: 50% vs. izquierdo 33,3%; χ2: 0,6; p = 0,45).
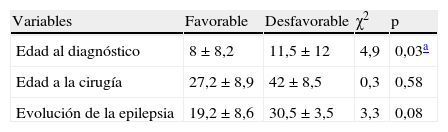
La comparación de la edad al inicio de las crisis y al momento de la cirugía, así como el tiempo de duración de la epilepsia hasta la cirugía, en relación con los resultados postoperatorios, se describen en la tabla 2.
Comparación de variables temporales en relación a los resultados postoperatorios
| Variables | Favorable | Desfavorable | χ2 | p |
| Edad al diagnóstico | 8 ± 8,2 | 11,5 ± 12 | 4,9 | 0,03a |
| Edad a la cirugía | 27,2 ± 8,9 | 42 ± 8,5 | 0,3 | 0,58 |
| Evolución de la epilepsia | 19,2 ± 8,6 | 30,5 ± 3,5 | 3,3 | 0,08 |
| Variables | Libre de crisis | Crisis persistentes | χ2 | p |
| Edad al diagnóstico | 9,3 ± 10,2 | 7,6 ± 6,9 | 0,22 | 0,64 |
| Edad a la cirugía | 25,8 ± 11,6 | 30,7 ± 8,1 | 1,3 | 0,26 |
| Evolución de la epilepsia | 16,4 ± 8,9 | 23,1 ± 8 | 3,2 | 0,09 |
Se ha demostrado ampliamente que la mayoría de pacientes con ELT lesional tienen un pronóstico muy favorable tras la lobectomía temporal anterior con amígdalo-hipocampectomía en el caso de la esclerosis mesial13, o lesionectomías en presencia de otras alteraciones focales, tales como malformaciones vasculares, del desarrollo cortical o tumores14–17. Sin embargo, en algunos casos, a pesar de que existe evidencia semiológica y electrofisiológica de un foco temporal, los estudios de RM no logran identificar ninguna lesión. Esta condición ha sido reiterativamente señalada como uno de los principales factores predictores de pobre resultado postoperatorio, debido a las dificultades técnicas para la localización y la resección de la totalidad del área donde se originan las crisis18,19. Se ha establecido que solo un 34 a un 45% de los pacientes con ELT sin lesiones en la RM permanecerán libres de crisis, lo cual contrasta con el 75% en aquellos en que sí se logran identificar durante la evaluación imagenológica prequirúrgica4.
A pesar de las propuestas para definir la ENL, sobre la base de los hallazgos de la RM o del examen histopatológico, actualmente no existe consenso al respecto. La denominación según los hallazgos de RM ha sido ampliamente criticada, debido a que se han demostrado alteraciones microscópicas relacionadas con epilepsia en el 32 al 57% de los especímenes quirúrgicos provenientes de pacientes sin alteraciones en la RM, siendo las malformaciones del desarrollo cortical las más frecuentes y especialmente las displasias corticales focales tipo IA y IB7,20–24. Es por ello que la definición de ENL sobre la base de los hallazgos de la RM es inadecuada y, por tanto, debería utilizarse exclusivamente el criterio histopatológico.
Las experiencias en el seguimiento postoperatorio de los pacientes con histopatología negativa son escasas. En la serie publicada por Bien et al., tan solo el 2,6% de los pacientes intervenidos por ELT no presentaron alteraciones histológicas y en la presente este grupo correspondió al 8,2% (21/256)7. Se ha observado que la proporción de pacientes libres de crisis con histología normal es notablemente inferior a la descrita en aquellos con lesiones; aun cuando estas no hayan sido detectadas en la RM preoperatoria4,7,9,25. En un estudio de 4 pacientes publicado por Kasasbeh et al. tan solo 2 de ellos estaban libres de crisis en el seguimiento a 2 años9. Asimismo, Bien et al. trataron a 20 pacientes, de los cuales tan solo 4 (20%) permanecieron libres de crisis, mientras que esta proporción ascendía al 77,8% en los que presentaban una RM negativa y una lesión demostrada histopatológicamente (p = 0,003)7.
En el presente estudio, la proporción de pacientes con un resultado favorable (Engel I y II) fue del 90,5%, mientras que solo el 42,9% permaneció libre de crisis durante el seguimiento. Esta observación es similar a los hallazgos que reportaron Téllez-Zenteno et al. en pacientes con histología normal, quienes encontraron una tasa de libertad de crisis del 36%, con un intervalo de confianza del 95% entre 29 y 43%4. Cabe resaltar que, aunque la mayoría de los pacientes incluidos en este estudio se beneficiaron ostensiblemente de la cirugía, la baja tasa de libertad completa de crisis refleja la posible existencia de remanentes de tejido epileptogénico, que estarían por fuera de los márgenes de resección descritos en la técnica quirúrgica clásica para lobectomía temporal anteromesial7. Otras potenciales causas de recurrencia de las crisis podrían ser la incompleta identificación de múltiples focos distantes del área resecada7. Sobre la base de estos postulados, sería razonable una nueva evaluación con registros intracraneales en busca de los focos epileptogénicos remanentes, considerando una eventual reintervención; sin embargo, aún no han sido descritas experiencias con estos casos.
Existe evidencia preliminar de que estas dificultades podrían resolverse mediante los estudios de tomografía por emisión de positrones, los cuales permitirían optimizar la lateralización y delimitación del área específica donde tienen origen las descargas ictales20,26–28. En 3 estudios realizados en diferentes centros de cirugía de epilepsia encontraron que los resultados quirúrgicos de los pacientes con RM normal, que muestran disminución del metabolismo del agente emisor en la tomografía por emisión de positrones, no diferían de aquellos con lesiones evidentes en la RM, resaltando la importancia de este método para conocer la real extensión de foco epileptogénico y, por tanto, planear resecciones más efectivas20,26,28. Incluso, algunos autores han propuesto que el registro electroencefalográfico invasivo podría obviarse en los pacientes con ELT que no presenten hallazgos discordantes entre la tomografía por emisión de positrones y la semiología de las crisis28. Dado que este método no se encontraba disponible en nuestra región, todos los pacientes de la presente serie fueron evaluados con electrodos subdurales temporales.
Actualmente, el sustrato patogénico subyacente a un foco epileptogénico histológicamente normal sigue siendo enigmático y las teorías que han intentado explicar el origen y las vías de propagación de las descargas anómalas son escasas29. La única hipótesis que ha podido comprobarse con certeza involucra la presencia de alteraciones funcionales en el gen TSC2, similares a las descritas en los pacientes portadores de otras afecciones que se pueden manifestar clínicamente con epilepsia fármaco-resistente, tales como el complejo esclerosis tuberosa, los gangliogliomas y las displasias corticales. Se ha postulado que estas alteraciones podrían comportarse como formas frustras de estas enfermedades que no alcanzaron a expresar las alteraciones morfológicas típicas, pero sí podrían modificar los patrones normales de descarga y diseminación de la actividad neuronal29.
Tras el análisis comparativo de las variables estudiadas, tan solo se encontraron diferencias estadísticamente significativas en la edad de inicio de las crisis, siendo inferior en los pacientes que obtuvieron resultados favorables, lo cual es consistente con los estudios previos30–32. También fue llamativa la tendencia en los varones a presentar mejores resultados postoperatorios, acercándose al criterio preestablecido de significancia estadística (p = 0,06). En estudios realizados por Burneo et al.33, Varoglu et al.34 y Aull-Watschinger et al.35 en pacientes con ELT también han encontrado que el resultado postoperatorio en los varones es más favorable, aunque otros no han confirmado esta asociación1,36. Hasta el momento, no han sido expuestas explicaciones certeras a estas observaciones; sin embargo, se especula que las alteraciones de los niveles de los fármacos antiepilépticos relacionadas con una mayor actividad de la citocromo P450-3A4, el embarazo, la menopausia o la menstruación podrían explicar la mayor tasa de recurrencia de crisis, en comparación con los hombres, quienes tienen niveles más estables y mejor adherencia al tratamiento durante el postoperatorio34,37.
Adicionalmente, se observó que en los pacientes con buenos resultados postoperatorios, el promedio de tiempo transcurrido desde el diagnóstico de epilepsia hasta la cirugía fue más breve, con diferencias tendientes a la significación estadística; sin embargo, debido al tamaño de la población, esto no fue posible determinarlo con certeza. Esta observación sugiere que los pacientes con ENL también podrían beneficiarse del tratamiento quirúrgico temprano, apoyando la iniciativa de remitirlos para evaluación oportuna por un grupo multidisciplinario de cirugía de epilepsia, tan pronto se demuestre fallo en el tratamiento con 2 fármacos antiepiléticos38–43; lo cual ha sido asociado a un mejor control de las crisis, índices superiores de calidad de vida y menor alteración de las funciones cognitivas38,40–44.
Control de sesgosEn el presente estudio, los pacientes fueron estudiados mediante RM de 1 y 1,5 unidades Tesla, debido a que en Colombia tan solo se dispone de un equipo con capacidad de producir imágenes de alta resolución (3 Tesla) y se encuentra muy distante del sitio donde fueron evaluados los casos (distancia en ruta aproximada de 1.060km). Esto podría suponer una alta tasa de estudios negativos en comparación con otras series7. Para eliminar este potencial sesgo, en este estudio solamente fueron incluidos aquellos casos cuyos especímenes carecían de alteraciones histológicas, de acuerdo con el examen realizado por al menos un médico patólogo con entrenamiento formal (fellowship) en neuropatología y experiencia en el estudio de muestras tisulares obtenidas durante cirugías de epilepsia.
FinanciaciónEste estudio fue financiado por la Fundación Centro Colombiano de Epilepsia y Enfermedades Neurológicas (entidad privada sin ánimo de lucro) y el Centro Latinoamericano de Investigación en Epilepsia. Cartagena de Indias, Colombia.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
A todo el grupo multidisciplinario de cirugía de Epilepsia de la Fundación Centro Colombiano de Epilepsia y Enfermedades Neurológicas por el esfuerzo y dedicación a los pacientes para su tratamiento y rehabilitación. A la Dra. Lucía Niño-Hernández por su apoyo en la redacción del manuscrito. A Cristina Lozano por su apoyo en la traducción del resumen en inglés.