Se describen las características epidemiológicas y clínicas de los casos de síndrome de trombosis con trombocitopenia (STT) notificados en España.
MétodosSe incluyeron los casos de trombosis venosa o arterial con trombocitopenia tras recibir vacuna con vectores de adenovirus no replicantes frente a la COVID-19 (AstraZeneca y Janssen) del 1 de febrero al 26 de septiembre de 2021. Se describe la tasa de notificación (número de casos notificados/número de dosis administradas), y el análisis de casos observados vs. esperados (O/E). Se evaluaron los predictores de mortalidad.
ResultadosSe notificaron 61 casos, cumpliendo 45 los criterios de elegibilidad, 82% mujeres. La tasa de notificación global fue 4/1.000.000 dosis y 14-15/1.000.000 dosis entre los 30-49 años. El número de casos de trombosis de senos cerebrales observados fue 6-18 veces superior al esperado en menores de 49 años. Los síntomas comenzaron 10 (rango intercuartílico: 7-14) días tras la vacunación. El 80% (intervalo de confianza [IC] al 95%: 65-90%) tenía trombocitopenia en el momento de su visita a urgencias y el 65% (IC 95%: 49-78%) elevación del dímero D (> 2.000 ng/mL). La trombosis fue de múltiples localizaciones en 36% y fatal en 24% de los pacientes. Un valor nadir de trombocitopenia < 50.000 /μL (odds ratio [OR]: 7,4; IC 95%: 1,2-47,5) y la presencia de hemorragia cerebral (OR: 7,9; IC 95%: 1,3-47,0) se asociaron a un desenlace fatal.
ConclusionesDebe sospecharse el STT en pacientes que presenten síntomas unos 10 días tras la vacunación y presenten trombocitopenia y/o elevación de dímero D.
We describe the epidemiological and clinical characteristics of thrombosis with thrombocytopenia syndrome (TTS) cases reported in Spain.
MethodsWe included all venous or arterial thrombosis with thrombocytopenia following adenovirus vector-based vaccines (AstraZeneca or Janssen) to prevent COVID-19 disease between February 1st and September 26th, 2021. We describe the crude rate and the standardized morbidity ratio. We assessed the predictors of mortality.
ResultsSixty-one cases were reported and 45 fulfilled eligibility criteria, 82% women. The crude TTS rate was 4/1,000,000 doses and 14-15/1,000,000 doses between 30-49 years. The number of observed cases of cerebral venous thrombosis was 6-18 higher than the expected in patients younger than 49 years. Symptoms started 10 (interquartile range [IQR]: 7-14) days after vaccination. Eighty percent (95% confidence interval [CI]: 65-90%) had thrombocytopenia at the time of the emergency department visit, and 65% (95% CI: 49-78%) had D-dimer >2,000 ng/mL. Patients had multiple location thrombosis in 36% and fatal outcome in 24% cases. A platelet nadir < 50,000/μL (odds ratio [OR]: 7.4; CI 95%: 1.2-47.5) and intracranial hemorrhage (OR: 7.9; IC 95%: 1.3-47.0) were associated with fatal outcome.
ConclusionTTS must be suspected in patients with symptoms 10 days after vaccination and thrombocytopenia and/or D-dimer increase.
La primera vacuna frente al virus causante de la enfermedad por coronavirus 2019 (COVID-19), BNT162b2 (Comirnaty®, Pfizer BioNTech), se autorizó el 21 de diciembre de 2020 y, de forma inmediata, comenzó en nuestro país la campaña de vacunación de acuerdo con la estrategia de vacunación aprobada por el Consejo Interterritorial del Sistema Nacional de Salud1. El 29 de enero 2021 y el 11 de marzo de 2021 se autorizaron la vacuna ChAdOx1-S nCov-19 (Vaxzevria®, AstraZeneca) y la vacuna Ad26.COV2-S (Janssen), respectivamente. En paralelo a su autorización, se puso en marcha un plan de vigilancia de la seguridad de estas vacunas2 que, entre otras acciones, contemplaba la revisión clínica exhaustiva de acontecimientos adversos notificados al Sistema Español de Farmacovigilancia de Medicamentos de uso Humano (SEFV-H) que fueran clínicamente complejos.
El 7 de marzo 2021 se informaron los dos primeros casos de STT en pacientes que habían recibido la vacuna de AstraZeneca en Europa, en concreto en Austria, y el 14 de marzo 2021 el primer caso en España3–5. De forma urgente, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) creó un grupo multidisciplinar de expertos para la evaluación de estos casos, el seguimiento de las notificaciones registradas en nuestro país y la ulterior elaboración de guías específicas con recomendaciones diagnósticas y terapéuticas sobre este acontecimiento adverso grave6.
El síndrome de trombosis con trombocitopenia (STT) asociado a la vacunación se caracteriza por la presencia de trombosis únicas o múltiples, principalmente venosas, pero también arteriales, con cierta predilección por afectar a localizaciones inusuales, como el territorio esplácnico o los senos venosos cerebrales4,5,7–9. La presencia de anticuerpos antifactor plaquetario 4 (anti-PF4) provoca agregación plaquetaria y micro y macrotrombosis, causando una trombocitopenia marcada y las manifestaciones trombóticas características del síndrome8. El STT se ha relacionado con vacunas de vectores de adenovirus no replicantes, como la vacuna de AstraZeneca o la vacuna de Janssen4–8,10. El reconocimiento de esta entidad clínica como posible reacción adversa de las vacunas de adenovirus11 se comunicó por parte de la AEMPS el 7 de abril de 202112 y motivó modificaciones en la estrategia de vacunación con la finalidad de minimizar este riesgo, como limitar su uso en edades más jóvenes –en las que el riesgo parecía superior– y evitar una segunda dosis de AstraZeneca en dicha franja etaria13. Poco después, el 26 de mayo de 2021, un grupo de trabajo de expertos de la Federación de Asociaciones Científico Médicas Españolas (FACME) publicó unas recomendaciones diagnóstico-terapéuticas sobre el manejo de la trombosis venosa cerebral relacionada con la vacunación frente a COVID-196.
El objetivo del presente artículo es describir las características epidemiológicas y clínicas de todos los casos de STT notificados en España desde el 1 de febrero hasta el 26 de septiembre de 2021 asociados a vacunas de vectores de adenovirus no replicantes frente al SARS-CoV-2. Se estudiarán de manera específica dichas vacunas, por ser aquellas en las que se observó asociación y sobre las que se estableció una situación de alerta por los diferentes organismos nacionales e internacionales. Se describe el patrón demográfico de los casos incidentes durante la campaña de vacunación (hasta el 26 de septiembre de 2021), la tasa de notificación y el análisis de casos observados vs. los casos esperados. Desde el punto de vista clínico, se detalla la frecuencia de comorbilidades, la presentación clínica, los hallazgos de laboratorio, el tratamiento empleado y el pronóstico. Como objetivos exploratorios, se analiza la sensibilidad de los parámetros de laboratorio en el momento de la presentación de los pacientes en urgencias y las variables que podrían asociarse con una mayor probabilidad de muerte.
2MétodosEstudio observacional, descriptivo, con diseño de serie de casos, realizado de acuerdo con las recomendaciones STROBE14. La población de estudio la integran los pacientes que han sufrido un evento trombótico venoso o arterial en los 100 días posteriores a la administración de una vacuna de vectores de adenovirus no replicantes frente al SARS-CoV-2, virus causante de la COVID-19. La población estudiada la integran todos los casos con sospecha diagnóstica de STT tras la administración de estas vacunas notificados al SEFV-H, coordinado por la AEMPS. El protocolo de estudio fue aprobado por el Comité Ético de Investigación Médica del Hospital Clínico Universitario de Valladolid (PI 21-2450).
Criterios de elegibilidadLos criterios de inclusión, basados en los criterios de la Organización Mundial de la Salud (OMS) y la Brighton Collaboration15 fueron: 1) presencia de al menos una trombosis arterial y/o venosa; 2) presencia de trombocitopenia (definida como un valor inferior a 150.000 plaquetas/μL o una disminución respecto del valor basal superior al 50%) en algún momento de su evolución; 3) exposición a una vacuna con vectores de adenovirus no replicantes frente a la COVID-19 en los 100 días previos. Se excluyeron aquellos casos que, a juicio del grupo de expertos, podían explicarse por otra causa, y los casos cuyo diagnóstico notificado fuera erróneo, equívoco, o no dispusieran de la información necesaria.
IntervenciónPara el análisis epidemiológico se ha estimado la tasa de notificación, definida como el número de casos con este acontecimiento adverso en relación con el número de dosis administradas en el periodo de tiempo a estudio, calculándose por franjas de edad, sexo y número de dosis administrada (primera o segunda). El número de dosis administradas por vacuna, edad y sexo se obtuvo del Registro de Vacunación (REGVACU) del Ministerio de Sanidad16. El análisis de los casos observados (notificados) en la población y el tiempo, frente al número de casos esperados en la población general, se realizó siguiendo la metodología descrita17 de manera global y por franjas de edad. Para ello, se consideró que todos los casos se notificaron –supuesto más conservador– y se estimó una ventana de riesgo de 30 días, periodo en que debutó la mayoría de los casos registrados. Una ratio superior a la unidad indica una desproporción numérica entre los casos observados y los esperados en la población no vacunada, que es estadísticamente significativa si el límite inferior del intervalo de confianza (IC) supera el 1. El cálculo de casos observados/esperados se realizó únicamente en las trombosis de senos venosos cerebrales (TSVC) al ser la única entidad clínica que integra el STT de la que hay información epidemiológica sobre su incidencia basal en la población general no vacunada, procedente de los datos hospitalarios de la base de datos FISABIO18 de la Comunidad Valenciana, no existiendo datos de incidencia de otras trombosis en localizaciones atípicas en nuestro medio.
Para el estudio de las características demográficas, clínicas y pronósticas se revisó la información disponible en los casos notificados, anonimizada en origen, y se analizaron datos demográficos: sexo, edad, factores de riesgo de trombosis (Material adicional 1) y antecedentes de infección por COVID-19; el tipo de vacuna administrada y el número de dosis; datos clínicos: presencia de infección por COVID-19 concomitante al STT, días desde la vacunación hasta el inicio de los síntomas, días desde el inicio de los síntomas hasta el diagnóstico, síntomas de presentación, localización de la trombosis y, en los casos con TSVC, presencia de cefalea en algún momento de la evolución, presencia de hemorragia intracraneal y presencia de datos de alarma (Material adicional 2); datos analíticos: plaquetas en el momento de la visita a urgencias y nadir, dímero D en el momento de la visita a urgencias y valor más elevado, fibrinógeno al ingreso y resultado de la determinación de anticuerpos anti-PF4; tratamiento administrado: inmunoglobulinas, anticoagulante heparínico, anticoagulante no heparínico, transfusión de plaquetas, tratamiento con esteroides15; y pronóstico: desenlace del caso clasificado como recuperado, mortal o desconocido.
Periodo de estudioEl periodo de estudio abarca desde la fecha de administración de la primera dosis de vacuna con vectores de adenovirus no replicantes frente a la COVID-19 administrada en España, desde el 1 de febrero de 2021 hasta el 26 de septiembre de 2021, cuando la administración de estas vacunas pasó a ser testimonial al estar vacunada la mayor parte de la población candidata a recibirlas.
Análisis estadísticoSe realizó un análisis descriptivo donde las variables cualitativas y cuantitativas ordinales se presentan como frecuencia y porcentaje. Las variables cuantitativas continuas se presentan como media y desviación estándar (DE) o mediana y rango intercuartílico (RIQ) en función de su distribución. En la estimación del número de casos se calculó el intervalo de confianza del 95% (IC 95%). En la comparación entre variables cualitativas u ordinales se empleó la prueba exacta de Fisher y en el contraste de hipótesis entre variables cuantitativas y cualitativas la prueba de la t de Student o la prueba de la U de Mann-Whitney en función de la distribución. Se aceptó un error alfa del 5%.
Se realizó una comparación de subgrupos entre pacientes vacunados con vacuna de AstraZeneca vs. vacunados con la vacuna de Janssen, y otra entre pacientes con anticuerpos anti-PF4 positivos vs. pacientes con anti-PF4 negativos, excluyéndose a aquellos pacientes sin este dato disponible. Solo se consideraron positivos los pacientes en los que el resultado positivo había sido realizado mediante técnica ELISA o estudio funcional plaquetario. La sensibilidad de los parámetros de laboratorio se estimó con los siguientes puntos de corte, recomendados en las guías de práctica clínica6,9,15: 50.000, 100.000 y 150.000 plaquetas/μL; 2.000 y 4.000 ng/mL de dímero D.
Para la evaluación de variables asociadas a un mayor riesgo de mortalidad se realizó un análisis de regresión logística: en primer lugar, univariante; y, en segundo lugar, multivariante, incluyendo en el modelo aquellas variables con un valor de p < 0,1 en el análisis univariante, presentándose la OR con su IC 95%. El manejo de los datos perdidos se realizó por análisis de casos completos.
La estimación de la sensibilidad se calculó por análisis de intención de tratar y mediante análisis por protocolo, calculando el IC 95% de cada valor. El análisis estadístico se llevó a cabo con el programa SPSS, versión 26.0 para Mac (IBM Corp, Armonk, NY, EE. UU.).
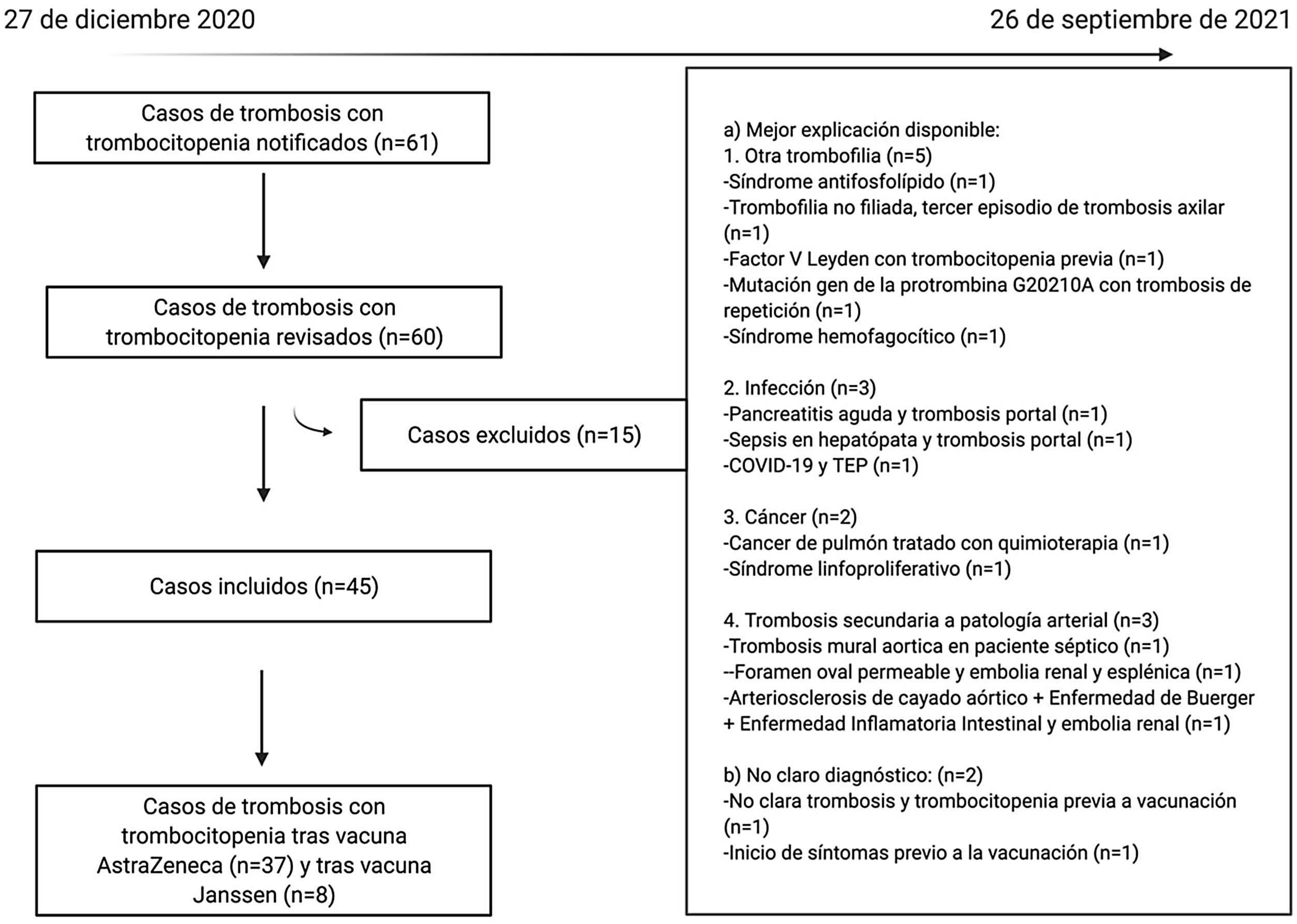
3ResultadosDurante el periodo de estudio se notificaron al SEFV-H 61 casos originalmente diagnosticados de STT y atribuidos por sus informantes a vacunas de vectores de adenovirus no replicantes. La figura 1 representa el número de casos notificados, revisados, excluidos e incluidos. Finalmente, se incluyó y analizó a 45 pacientes, 37 tras vacunación con AstraZeneca y ocho tras vacunación con Janssen.
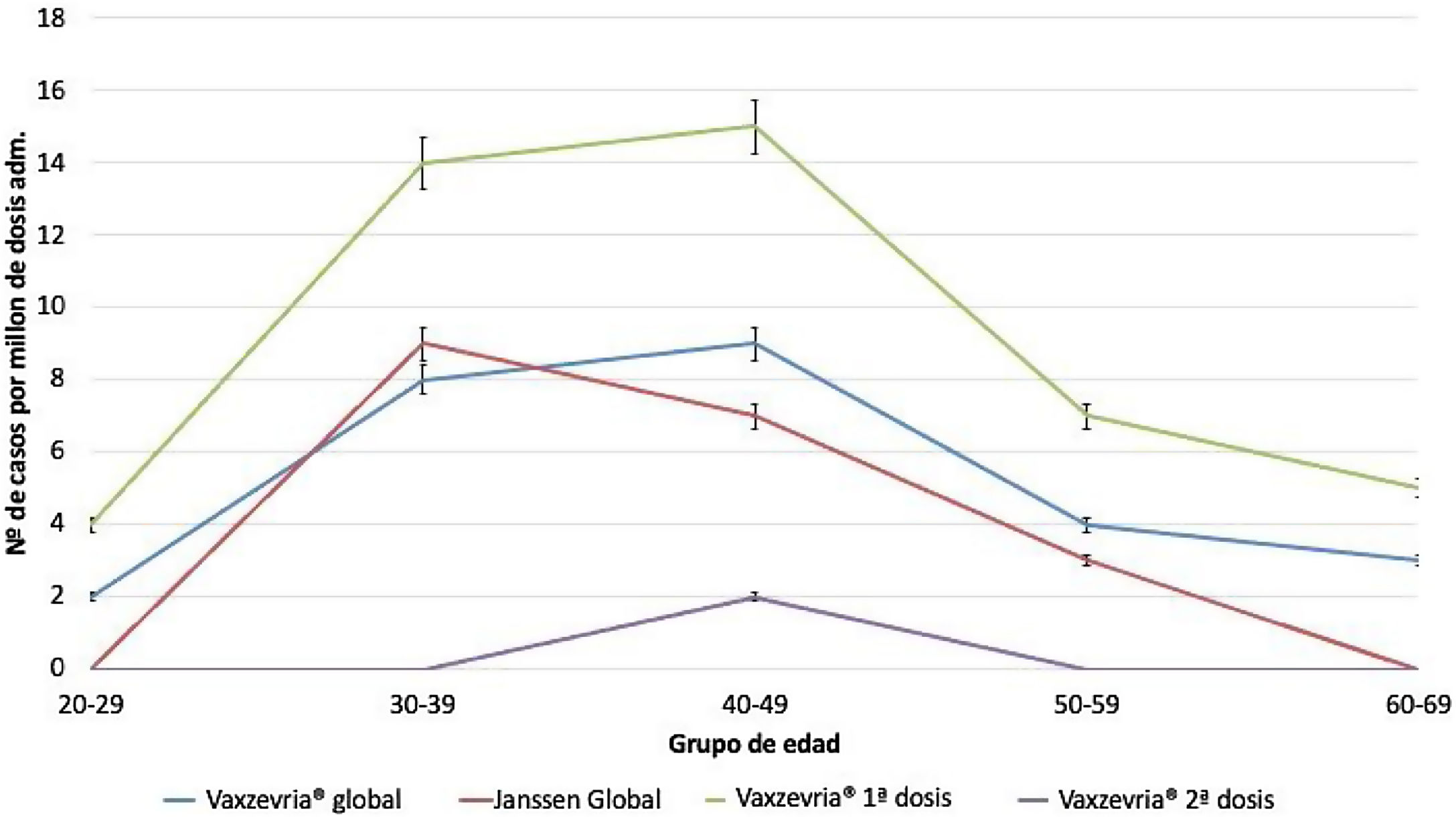
Hasta el 26 de septiembre de 2021 se habían administrado 9.771.767 dosis de la vacuna de AstraZeneca (5.103.885 primeras dosis y 4.667.882 segundas dosis) y 1.959.146 de la vacuna de Janssen. La tasa de notificación global estimada fue de cuatro casos/1.000.000 de vacunas administradas tanto con AstraZeneca como con Janssen, siendo superior en el grupo de edad de 30 a 49 años, donde la tasa se sitúa entre ocho y nueve casos/1.000.000 de dosis administradas de AstraZeneca. En cuanto a la primera dosis de AstraZeneca, la tasa de notificación de STT en los grupos etarios de 30-39 y 40-49 años fue de 14 y 15 casos/1.000.000 de habitantes, respectivamente, mientras que con la segunda dosis fue de cero y dos casos/1.000.000 de habitantes, respectivamente (fig. 2).
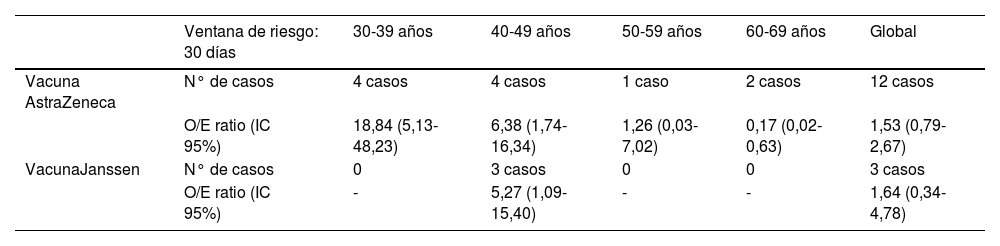
El análisis de casos observados frente a esperados de TSVC mostró una desproporción estadísticamente significativa para los grupos etarios de 30 a 49 años inmunizados con AstraZeneca y de 40 a 49 años con la vacuna de Janssen (tabla 1).
Análisis de casos observados frente a esperados de trombosis de senos venosos cerebrales con vacunas de adenovirus. Datos globales y por grupo de edad
| Ventana de riesgo: 30 días | 30-39 años | 40-49 años | 50-59 años | 60-69 años | Global | |
|---|---|---|---|---|---|---|
| Vacuna AstraZeneca | N° de casos | 4 casos | 4 casos | 1 caso | 2 casos | 12 casos |
| O/E ratio (IC 95%) | 18,84 (5,13-48,23) | 6,38 (1,74-16,34) | 1,26 (0,03-7,02) | 0,17 (0,02-0,63) | 1,53 (0,79-2,67) | |
| VacunaJanssen | N° de casos | 0 | 3 casos | 0 | 0 | 3 casos |
| O/E ratio (IC 95%) | - | 5,27 (1,09-15,40) | - | - | 1,64 (0,34-4,78) |
O/E: observado frente a esperado; IC: intervalo de confianza. Los valores en negrita representan valores estadísticamente significativos (Ratio superior a la unidad si el límite inferior del intervalo de confianza (IC) supera el 117.
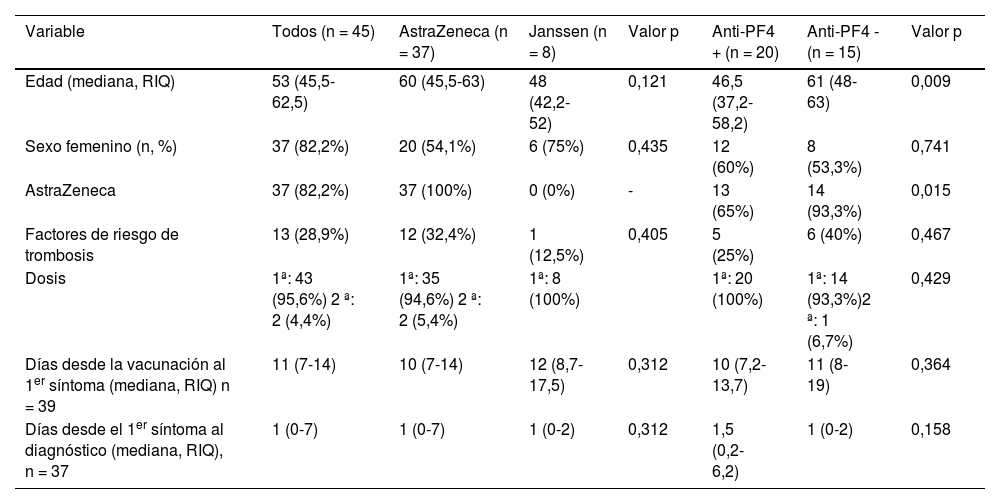
La tabla 2 resume las principales características de la muestra. Solo en un 2,2% de los pacientes se describió historia previa de infección por COVID-19. En 15 pacientes se informó de la realización de PCR frente a SARS-CoV-2 al ingreso y en tres pacientes de test de antígenos, siendo negativos en todos los casos. En la comparación entre subgrupos, según el tipo de vacuna y la presencia o no de anticuerpos anti-PF4, solo se observaron diferencias estadísticamente significativas relativas a una menor mediana de edad en los pacientes con anticuerpos anti-PF4. La mediana de tiempo entre la vacunación y la presentación clínica del acontecimiento fue de 11 días (RIQ: 7-14, rango 1-60 días).
Variables demográficas y de presentación clínica
| Variable | Todos (n = 45) | AstraZeneca (n = 37) | Janssen (n = 8) | Valor p | Anti-PF4 + (n = 20) | Anti-PF4 - (n = 15) | Valor p |
|---|---|---|---|---|---|---|---|
| Edad (mediana, RIQ) | 53 (45,5-62,5) | 60 (45,5-63) | 48 (42,2-52) | 0,121 | 46,5 (37,2-58,2) | 61 (48-63) | 0,009 |
| Sexo femenino (n, %) | 37 (82,2%) | 20 (54,1%) | 6 (75%) | 0,435 | 12 (60%) | 8 (53,3%) | 0,741 |
| AstraZeneca | 37 (82,2%) | 37 (100%) | 0 (0%) | - | 13 (65%) | 14 (93,3%) | 0,015 |
| Factores de riesgo de trombosis | 13 (28,9%) | 12 (32,4%) | 1 (12,5%) | 0,405 | 5 (25%) | 6 (40%) | 0,467 |
| Dosis | 1ª: 43 (95,6%) 2 ª: 2 (4,4%) | 1ª: 35 (94,6%) 2 ª: 2 (5,4%) | 1ª: 8 (100%) | 1ª: 20 (100%) | 1ª: 14 (93,3%)2 ª: 1 (6,7%) | 0,429 | |
| Días desde la vacunación al 1er síntoma (mediana, RIQ) n = 39 | 11 (7-14) | 10 (7-14) | 12 (8,7-17,5) | 0,312 | 10 (7,2-13,7) | 11 (8-19) | 0,364 |
| Días desde el 1er síntoma al diagnóstico (mediana, RIQ), n = 37 | 1 (0-7) | 1 (0-7) | 1 (0-2) | 0,312 | 1,5 (0,2-6,2) | 1 (0-2) | 0,158 |
RIQ: rango intercuartílico; PF4: factor plaquetario 4. La variable AstraZeneca se incluyó para la comparación de anticuerpos antiPF4 en función del tipo de vacuna. Evaluado mediante prueba exacta de Fisher, o en el contraste entre variables cuantitativas y cualitativas, t de Student (variables con distribución normal, presentadas como media y desviación estándar) o U de Mann-Whitney (variables con distribución no normal, presentadas como mediana y rango intercuartílico).
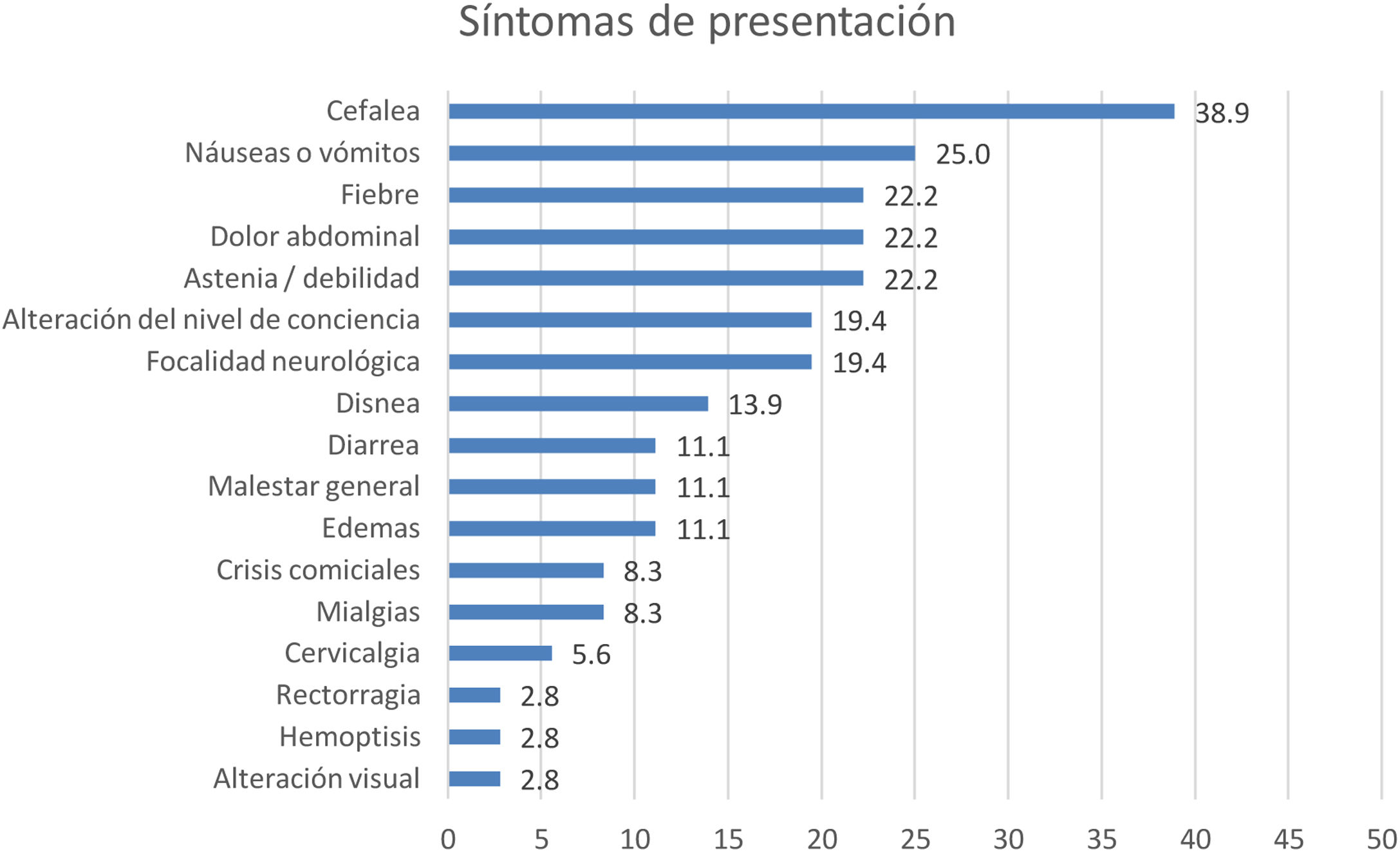
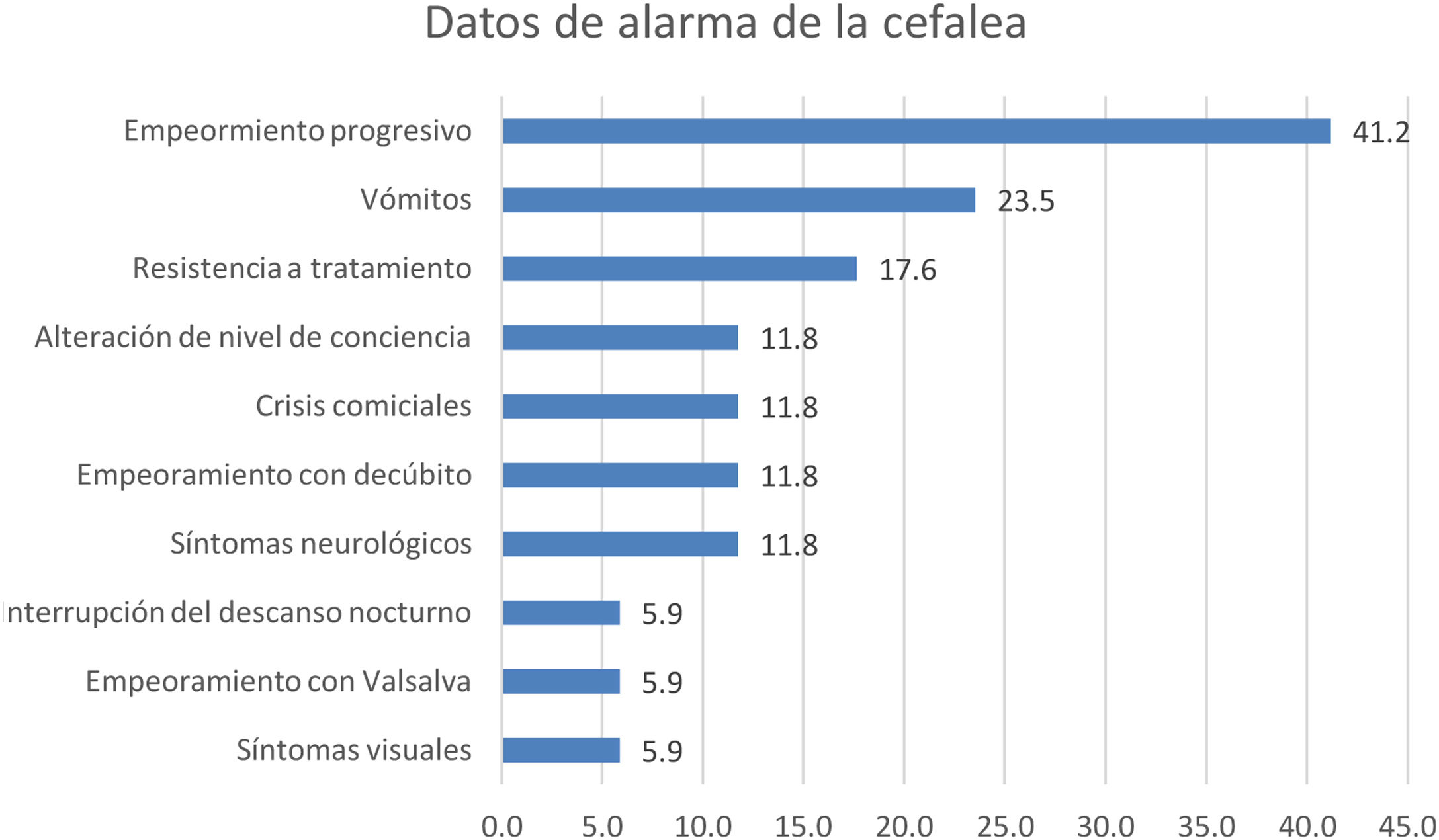
Se dispuso de información clínica en 36 (80%) de los 45 casos. La figura 3 muestra los síntomas de presentación más frecuentes. Diecisiete (37,8%) de los 45 pacientes presentaron cefalea en algún momento de su evolución, con datos de alarma en todos los casos. La figura 4 presenta la frecuencia observada de datos de alarma.
Síntomas de presentación (n = 36). En la figura se describen los síntomas iniciales y se representan todos los pacientes, tanto aquellos con trombosis de localización neurológica como no neurológica. Hubo pacientes con trombosis no neurológicas que presentaron síntomas neurológicos, tales como cefalea.
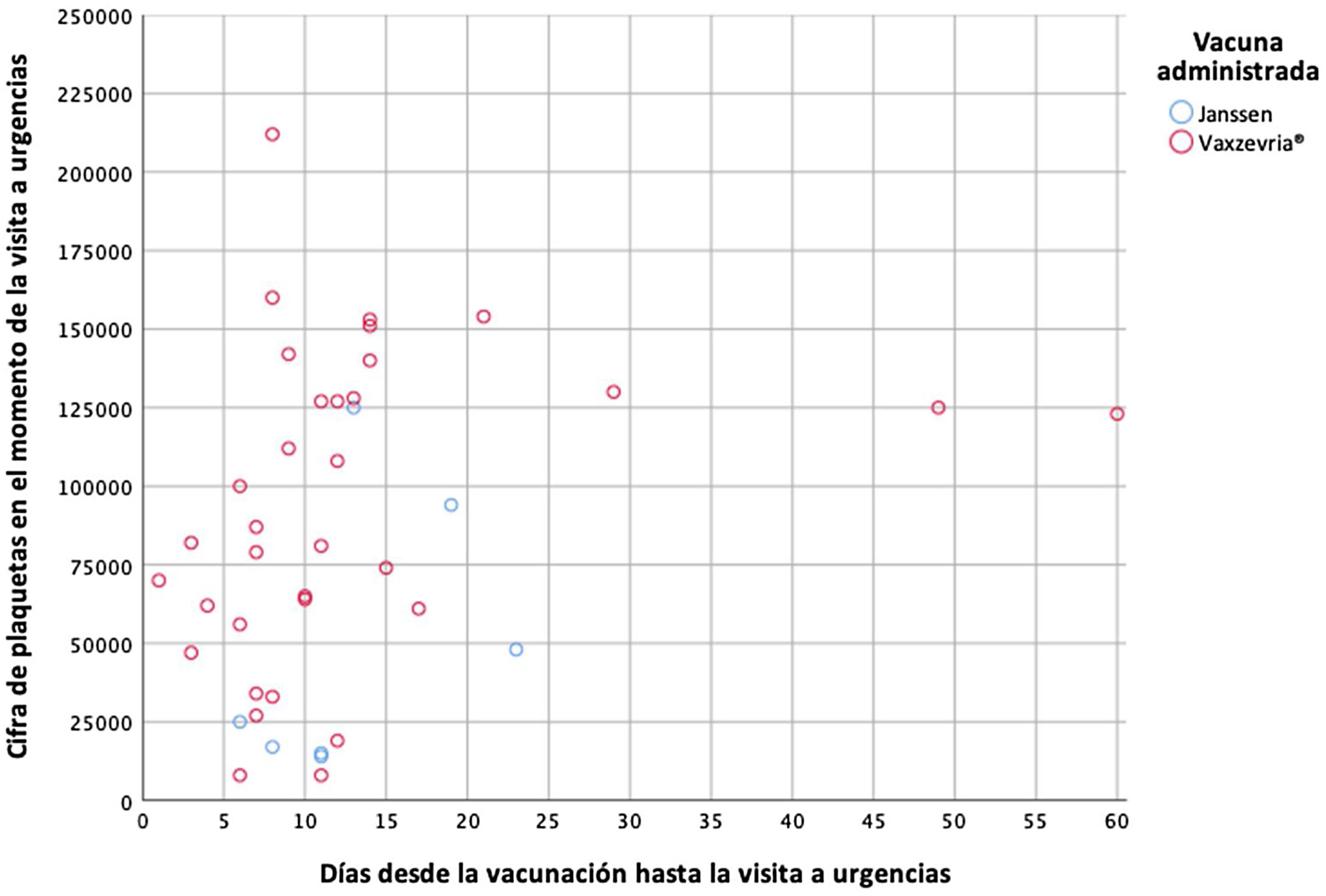
En el momento de la visita al Servicio de Urgencias, la mediana de plaquetas fue de 81.000/μL (RIQ: 40.500-127.000; rango: 8.000-212.000) y la mediana de dímero D de 21.000 ng/mL (RIQ: 5.360-35.612; rango: 130-60.000). La figura 5 muestra el valor de plaquetas en función del tiempo transcurrido entre la vacunación y la visita al Servicio de Urgencias. En la comparación entre las diferentes vacunas, se observaron diferencias estadísticamente significativas en el valor de plaquetas en el momento de la visita a urgencias y en la presencia de anticuerpos anti-PF4 (material adicional tabla 1, figura 1). En la comparación entre pacientes con anticuerpos anti-PF4 y el resto de los pacientes no se encontraron diferencias estadísticamente significativas (material adicional tabla 2, figuras 2 y 3).
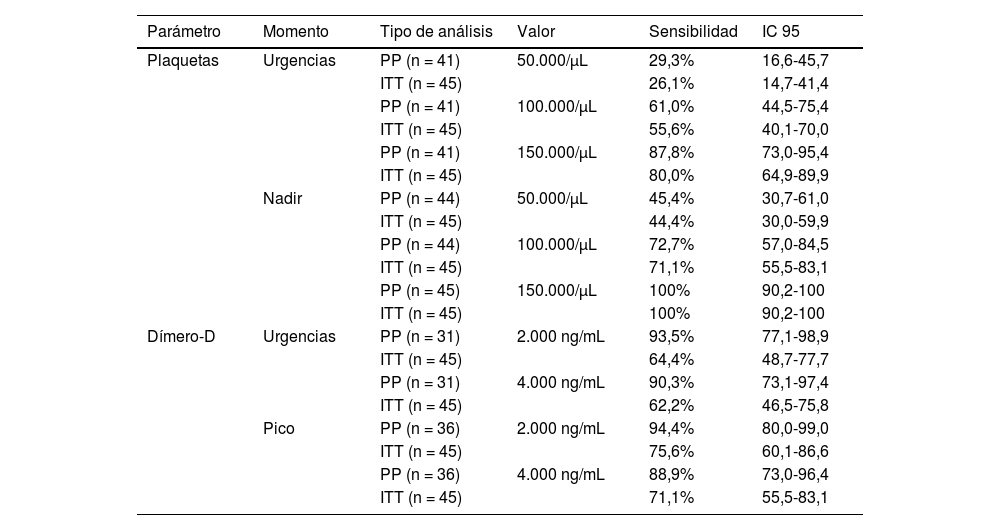
La tabla 3 muestra el análisis de la sensibilidad de los puntos de corte sugeridos en las guías internacionales en función del valor de trombocitopenia y dímero D, tanto por protocolo (análisis de la información disponible) como por intención de tratar (incluyendo aquellos casos sin valor disponible).
Sensibilidad del valor de plaquetas y dímero-D en urgencias y cuando se alcanza el valor más extremo (nadir y pico para plaquetas y dímero-D, respectivamente)
| Parámetro | Momento | Tipo de análisis | Valor | Sensibilidad | IC 95 |
|---|---|---|---|---|---|
| Plaquetas | Urgencias | PP (n = 41) | 50.000/μL | 29,3% | 16,6-45,7 |
| ITT (n = 45) | 26,1% | 14,7-41,4 | |||
| PP (n = 41) | 100.000/μL | 61,0% | 44,5-75,4 | ||
| ITT (n = 45) | 55,6% | 40,1-70,0 | |||
| PP (n = 41) | 150.000/μL | 87,8% | 73,0-95,4 | ||
| ITT (n = 45) | 80,0% | 64,9-89,9 | |||
| Nadir | PP (n = 44) | 50.000/μL | 45,4% | 30,7-61,0 | |
| ITT (n = 45) | 44,4% | 30,0-59,9 | |||
| PP (n = 44) | 100.000/μL | 72,7% | 57,0-84,5 | ||
| ITT (n = 45) | 71,1% | 55,5-83,1 | |||
| PP (n = 45) | 150.000/μL | 100% | 90,2-100 | ||
| ITT (n = 45) | 100% | 90,2-100 | |||
| Dímero-D | Urgencias | PP (n = 31) | 2.000 ng/mL | 93,5% | 77,1-98,9 |
| ITT (n = 45) | 64,4% | 48,7-77,7 | |||
| PP (n = 31) | 4.000 ng/mL | 90,3% | 73,1-97,4 | ||
| ITT (n = 45) | 62,2% | 46,5-75,8 | |||
| Pico | PP (n = 36) | 2.000 ng/mL | 94,4% | 80,0-99,0 | |
| ITT (n = 45) | 75,6% | 60,1-86,6 | |||
| PP (n = 36) | 4.000 ng/mL | 88,9% | 73,0-96,4 | ||
| ITT (n = 45) | 71,1% | 55,5-83,1 |
PP: análisis por protocolo (solo pacientes con datos disponibles); ITT: análisis por intención de tratar (incluyendo a todos los pacientes y asumiendo que, si no se disponía del dato, era negativo, lo que indicaría el porcentaje mínimo de pacientes que tendría este parámetro).
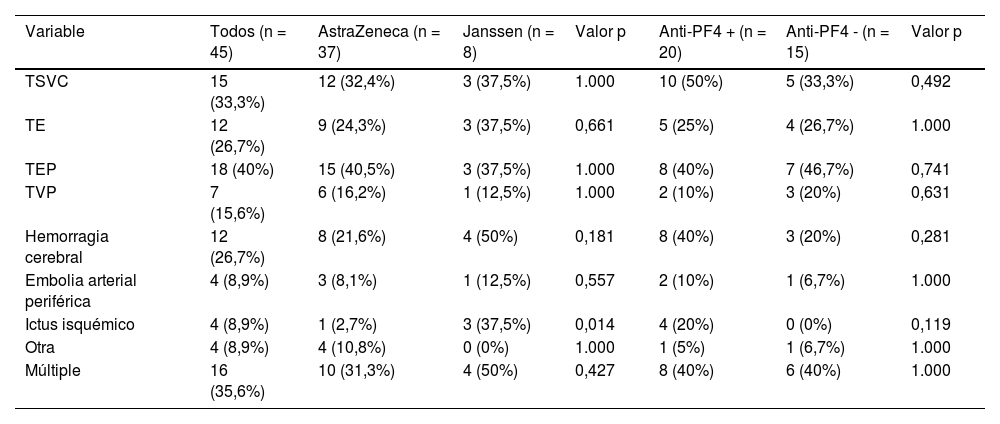
En 16 (35,6%) pacientes hubo trombosis en múltiples localizaciones. No se observaron diferencias estadísticamente significativas en cuanto a la localización y tipo de trombosis en función del tipo de vacuna (tabla 4).
Localización de la trombosis en función del tipo de vacuna administrada y la positividad de anticuerpos antifactor plaquetario 4
| Variable | Todos (n = 45) | AstraZeneca (n = 37) | Janssen (n = 8) | Valor p | Anti-PF4 + (n = 20) | Anti-PF4 - (n = 15) | Valor p |
|---|---|---|---|---|---|---|---|
| TSVC | 15 (33,3%) | 12 (32,4%) | 3 (37,5%) | 1.000 | 10 (50%) | 5 (33,3%) | 0,492 |
| TE | 12 (26,7%) | 9 (24,3%) | 3 (37,5%) | 0,661 | 5 (25%) | 4 (26,7%) | 1.000 |
| TEP | 18 (40%) | 15 (40,5%) | 3 (37,5%) | 1.000 | 8 (40%) | 7 (46,7%) | 0,741 |
| TVP | 7 (15,6%) | 6 (16,2%) | 1 (12,5%) | 1.000 | 2 (10%) | 3 (20%) | 0,631 |
| Hemorragia cerebral | 12 (26,7%) | 8 (21,6%) | 4 (50%) | 0,181 | 8 (40%) | 3 (20%) | 0,281 |
| Embolia arterial periférica | 4 (8,9%) | 3 (8,1%) | 1 (12,5%) | 0,557 | 2 (10%) | 1 (6,7%) | 1.000 |
| Ictus isquémico | 4 (8,9%) | 1 (2,7%) | 3 (37,5%) | 0,014 | 4 (20%) | 0 (0%) | 0,119 |
| Otra | 4 (8,9%) | 4 (10,8%) | 0 (0%) | 1.000 | 1 (5%) | 1 (6,7%) | 1.000 |
| Múltiple | 16 (35,6%) | 10 (31,3%) | 4 (50%) | 0,427 | 8 (40%) | 6 (40%) | 1.000 |
TSVC: trombosis de senos venosos cerebrales; TE: trombosis esplácnica; TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda; Anti-PF4: anticuerpos antifactor plaquetario tipo 4. Evaluado mediante prueba exacta de Fisher, o en el contraste entre variables cuantitativas y cualitativas, t de Student (variables con distribución normal, presentadas como media y desviación estándar) o U de Mann-Whitney (variables con distribución no normal, presentadas como mediana y rango intercuartílico).
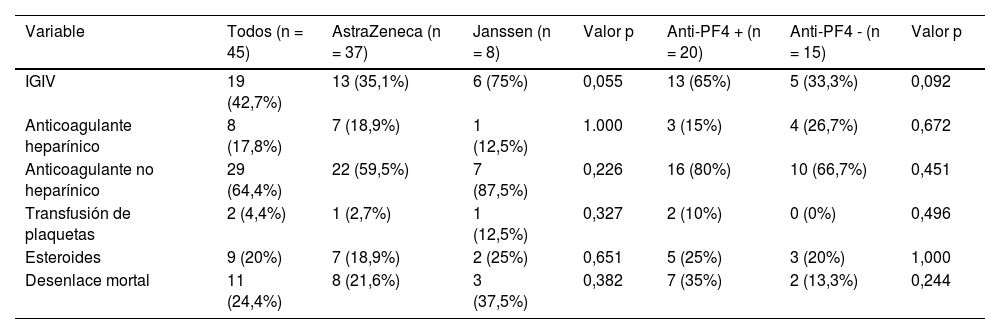
Treinta (66,7%) pacientes recibieron tratamiento anticoagulante: no heparínico en 29 (64,4%) casos y heparínico en ocho (17,8%). Siete (15,6%) pacientes recibieron ambos tipos de anticoagulantes. Se trató con inmunoglobulinas a 19 (42,7%) pacientes y con esteroides a nueve (20%), empleándose al menos uno de los dos tratamientos en 22 (48,9%) pacientes. No se observaron diferencias estadísticamente significativas en función de la vacuna administrada o la presencia de anticuerpos antifactor plaquetario 4 (tabla 5).
Tratamientos administrados en función de la vacuna y la presencia o ausencia de anticuerpos antifactor plaquetario 4 y desenlace
| Variable | Todos (n = 45) | AstraZeneca (n = 37) | Janssen (n = 8) | Valor p | Anti-PF4 + (n = 20) | Anti-PF4 - (n = 15) | Valor p |
|---|---|---|---|---|---|---|---|
| IGIV | 19 (42,7%) | 13 (35,1%) | 6 (75%) | 0,055 | 13 (65%) | 5 (33,3%) | 0,092 |
| Anticoagulante heparínico | 8 (17,8%) | 7 (18,9%) | 1 (12,5%) | 1.000 | 3 (15%) | 4 (26,7%) | 0,672 |
| Anticoagulante no heparínico | 29 (64,4%) | 22 (59,5%) | 7 (87,5%) | 0,226 | 16 (80%) | 10 (66,7%) | 0,451 |
| Transfusión de plaquetas | 2 (4,4%) | 1 (2,7%) | 1 (12,5%) | 0,327 | 2 (10%) | 0 (0%) | 0,496 |
| Esteroides | 9 (20%) | 7 (18,9%) | 2 (25%) | 0,651 | 5 (25%) | 3 (20%) | 1,000 |
| Desenlace mortal | 11 (24,4%) | 8 (21,6%) | 3 (37,5%) | 0,382 | 7 (35%) | 2 (13,3%) | 0,244 |
IGIV: inmunoglobulinas intravenosas; PF4: factor plaquetario 4. Evaluado mediante prueba exacta de Fisher, o en el contraste entre variables cuantitativas y cualitativas, t de Student (variables con distribución normal, presentadas como media y desviación estándar) o U de Mann-Whitney (variables con distribución no normal, presentadas como mediana y rango intercuartílico).
Once (24,4%) pacientes se manejaron de forma aparentemente no óptima por los siguientes motivos: realización de tomografía computarizada craneal sin contraste, pese a la presencia de cefalea con datos de alarma y trombocitopenia en siete (15,5%) casos, administración de heparina pese a la presencia de anticuerpos anti-PF4 en dos casos (4,4%), transfusión de plaquetas en ausencia de indicación en un (2,2%) caso, y diagnóstico empírico de posible infección por COVID-19 sin prueba diagnóstica en un (2,2%) caso.
Desenlace y predictores de mortalidadOnce (24,4%) pacientes fallecieron y en dos (4,4%) pacientes no se dispuso de información. Un valor de plaquetas < 50.000/μL en el momento de la visita a urgencias o en el nadir y la presencia de hemorragia intracraneal fueron las variables que se asociaron a una mayor probabilidad de muerte en el análisis univariante. En el análisis multivariante, la presencia de hemorragia intracraneal (OR: 7,9; IC 95%: 1,32-47,0) y una cifra nadir de plaquetas < 50.000/μL (OR: 7,4; IC 95%: 1,16-47,6) se asociaron a una mayor mortalidad (material adicional tablas 3-5).
4DiscusiónEste trabajo presenta los datos epidemiológicos y clínicos de la serie de casos de STT en relación con vacunas de vectores de adenovirus no replicantes notificados al SEFV-H.
La frecuencia de casos de STT notificados en España se sitúa entre 1 caso /1.000.000 y 1 caso/100.000 dosis administradas, cifra similar a otros países de nuestro entorno, tanto para la vacuna de AstraZeneca como para la de Janssen19–22, salvo en menores de 30 años, probablemente debido a la baja tasa de inmunización con estas vacunas en dicha franja etaria11,13. La tasa de notificación de STT en otros países oscila entre 0,3 y 1,02 casos/100,000 dosis de la vacuna de Janssen en los EE. UU. y 1,28 y 1,53 casos/100,000 dosis tras la vacuna de AstraZeneca en países europeos o el Reino Unido19–22. La notificación de acontecimientos adversos con vacunas es el procedimiento más ágil y universal para identificar posibles nuevos riesgos. La principal limitación de la farmacovigilancia es la infranotificación, ya que solo se recibe y procesa aquello que los profesionales sanitarios o ciudadanos notifican. No obstante, aunque las notificaciones están sometidas a una serie de limitaciones, no parece probable que se hubieran dejado de notificar casos tan graves y característicos debido a su gran eco mediático y a la labor de difusión de la AEMPS, el Ministerio de Sanidad del Gobierno de España, las Comunidades Autónomas y FACME. Por ello, las tasas notificadas y descritas en este trabajo pueden asimilarse con alto grado de confianza a la tasa de incidencia real por número de dosis de vacuna administrada.
El riesgo de STT asociado a vacunas de vectores de adenovirus no replicantes es mayor en personas jóvenes. Desde los primeros análisis realizados por la Agencia Europea del Medicamento (EMA)3,11 y la Food and Drug Administration (FDA)10, se informó de que el número de casos de TSVC observados excedía el que sería esperable en la población general, hecho que se ha reproducido en el presente estudio y en otras series23–25. Este riesgo ha sido especialmente acusado en personas jóvenes, por lo que la disponibilidad de otras vacunas con tecnología ARN, sin evidencia de riesgo de STT, hizo que se modificara la estrategia de vacunación, dejándose de recomendar la utilización de vacunas de vectores de adenovirus no replicantes en edades jóvenes13.
Tras los primeros casos de STT en relación con la primera dosis de AstraZeneca notificados a los sistemas de farmacovigilancia, el efecto de una segunda dosis era una incógnita. Sin embargo, según nuestros datos y de otros países25,26, el riesgo de STT asociado a esta segunda dosis parece haber sido notablemente menor, en torno a 0,3 casos/100.000 dosis de AstraZeneca en el Reino Unido25. Se ha reportado que la mediana del tiempo de negativización de los anticuerpos anti-PF4 en pacientes que los desarrollaron tras la primera dosis de AstraZeneca es de 12 semanas27. Esto podría tener implicaciones en aquellos países donde no exista disponibilidad de otras vacunas. Las primeras series de supervivientes de STT que han recibido una segunda dosis de la misma vacuna no han descrito nuevos eventos trombóticos ni trombocitopenia tras la re-exposición28.
Una característica singular del STT es el inicio diferido de los síntomas29,30. Se han descrito acontecimientos adversos en los primeros días tras la vacunación en un porcentaje muy elevado de personas, en su mayoría leves, transitorios y similares a los observados con otras vacunas31-33. Sin embargo, la demora en la aparición del STT parece un dato clínico distintivo, ya que se requiere un tiempo mínimo para la génesis de los anticuerpos causantes. El 93% de los pacientes se presentó en el intervalo entre los tres y 30 días, propuesto inicialmente como el periodo de alto riesgo15. En la presente serie, un caso comenzó con síntomas antes de este intervalo y en otros dos el cuadro apareció más allá de los 30 días, con negatividad en la determinación de anticuerpos anti-PF4 en todos ellos.
El presente estudio es el primero que evalúa la precisión de los parámetros de laboratorio principales: cifra de plaquetas y dímero D. Hasta una quinta parte de los pacientes puede no tener trombocitopenia en el momento de su visita a urgencias y los parámetros plaquetarios establecidos como punto de corte por las guías de la OMS15 parecen tener una baja sensibilidad, inferior al 50%, tanto en el momento de la visita a urgencias como en el nadir. Sin embargo, el dímero D parece tener una sensibilidad superior, por lo que un alto índice de sospecha y la evaluación conjunta de ambos parámetros podría mejorar la precisión diagnóstica9,30. Esto es especialmente importante debido a la demora que el médico responsable puede tener en disponer de los resultados de los anticuerpos anti-PF4, que puede variar entre uno y varios días, lo que hace que no siempre puedan ser empleados a la hora de decidir el tratamiento y manejo óptimo para cada paciente9,15,34,35.
El tratamiento de este síndrome requiere la eliminación de los anticuerpos anti-PF4 y la administración de tratamiento anticoagulante8,17,18. La detección precoz ha favorecido un descenso en la mortalidad36, pasando del 40-50% en los primeros casos a un 10% en los casos detectados tras la creación de recomendaciones de manejo y campañas dirigidas a la población37. Se ha descrito que algunos pacientes comienzan con una cefalea con datos de alarma en combinación con el resto de las características típicas del síndrome, incluyendo positividad para anticuerpos anti-PF4, en ausencia de trombosis cerebral evidenciable38–41. Es importante conocer que, en nuestra muestra, la cefalea fue el síntoma de presentación más frecuente, y fue descrita por pacientes con trombosis de localizaciones no cerebrales. En nuestro estudio, la presencia de hemorragia intracraneal y la cifra de plaquetas se asociaron con un diferente riesgo de mortalidad, de manera similar a otros estudios30,37,42 que también han descrito los niveles de fibrinógeno y la edad42.
Por la analogía del STT con el síndrome de trombocitopenia inducida por heparina, se ha recomendado el uso de anticoagulantes no heparínicos6,9,15. Sin embargo, en la serie presentada no se observó que el uso de anticoagulantes heparínicos se asociase a una mayor mortalidad. Datos recientes indican que, en el 95% de los pacientes, la heparina compite con los anticuerpos anti-PF4 por un mismo epítopo plaquetario de unión, dato que aboga por su seguridad43. Dado que la realización de estudios funcionales plaquetarios necesarios para su confirmación requiere de un tiempo considerable, se recomienda el uso de anticoagulantes no heparínicos como primera opción en caso de disponibilidad15,35.
El presente trabajo tiene algunas limitaciones, ya que los datos proceden de notificaciones espontáneas, por lo que la información podía ser incompleta. Para minimizar este problema, se realizaron estimaciones conservadoras y se llevó a cabo un análisis por intención de tratar. La tasa de notificación podría estar infraestimada en caso de que no se notificaran o diagnosticaran algunos casos, en efecto, pero esto parece menos probable dada la gran atención mediática que atrajo este problema. El periodo de seguimiento fue variable y en algunos casos los pacientes estaban todavía en proceso de recuperación, por lo que los datos reportados en relación con el pronóstico pueden no reflejar de forma completa la realidad de la población analizada.
5ConclusionesEl STT ha tenido una frecuencia entre 1 caso/1.000.000 y 1 caso/100.000 personas inmunizadas con vacunas de vectores de adenovirus no replicantes en España. Su aparición es más frecuente en adultos jóvenes (< 49 años) y se caracteriza por la aparición de síntomas relacionados con la localización de la trombosis que debutan en aproximadamente 10 días tras la vacunación. Todos los pacientes presentan trombocitopenia en algún momento, si bien esta puede no observarse en el momento de su visita a urgencias. En estos casos, la cifra de dímero D puede ser de ayuda y orientar el diagnóstico. En su tratamiento debe favorecerse la eliminación de los anticuerpos anti-PF4 y la resolución de la trombosis, preferiblemente con anticoagulantes no heparínicos. Uno de cada cuatro pacientes falleció, observándose asociación entre la trombocitopenia grave y la presencia de hemorragia intracraneal con un mayor riesgo de muerte.
6FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
7Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la labor de colaboración de los profesionales sanitarios y la ciudadanía notificando los casos de acontecimientos adversos y el inestimable trabajo y dedicación de los Centros Autonómicos del Sistema Español de Farmacovigilancia.
Grupo de trabajo español para el estudio de casos de síndrome de trombosis con trombocitopenia asociado a vacunas COVID-19.