Valorar la memoria episódica, adaptándola a la definición del concepto, haciéndola asequible a las familias, y aplicándola con una alta sensibilidad y especificidad, es el concepto del test episódico y el test episódico del cuidador.
Métodos y resultadosSe aplicó un test formado por 10 preguntas relacionadas con hechos episódicos a 332 sujetos, de los cuales 65 tenían enfermedad de Alzheimer (EA), 115 deterioro cognitivo leve amnésico (DCLa) y 152 no mostraron alteración cognitiva, según la escala de deterioro global (GDS) de Reisberg. Se calculó la sensibilidad y especificidad del test episódico para detectar EA frente a DCLa y normalidad. El área bajo la curva ROC para el diagnóstico de DCLa fue de 0,94 y el mejor punto de corte fue 20, valor con el que se obtuvo una sensibilidad del 89% y una especificidad del 82%. Con respecto al diagnóstico de EA, el área bajo la curva ROC fue de 0,99 y el mejor punto de corte fue 17, con el que se obtuvo una sensibilidad del 98% y una especificidad del 91%. Un estudio posterior con similar metodología demostró resultados similares cuando el test era pasado directamente por el cuidador.
ConclusionesEl test episódico y el test episódico del cuidador son herramientas útiles como test breves de cribado para la captación de enfermos con EA en estadios iniciales, adecuadas para la utilización en atención primaria y en él domicilio, al poder ser pasado directamente por el cuidador. Las limitaciones del test vienen dadas por la necesidad de un cuidador fiable y por la medición exclusiva de la memoria episódica.
The purpose of the episodic memory test and the caregiver's episodic memory test is to evaluate episodic memory according to its definition in a way that is feasible for families and achieves high degrees of sensitivity and specificity.
Methods and resultsWe administered a test consisting of 10 questions about episodic events to 332 subjects, of whom 65 had Alzheimer's disease (AD), 115 had amnestic MCI (aMCI) and 152 showed no cognitive impairment according to Reisberg's global deterioration scale (GDS). We calculated the test's sensitivity and specificity to distinguish AD from episodic aMCI and from normal ageing. The area under the ROC curve for the diagnosis of aMCI was 0.94 and the best cut-off value was 20; for that value, sensitivity was 89% and specificity was 82%. For a diagnosis of AD, the area under the ROC curve was 0.99 and the best cut-off point was 17, with a sensitivity of 98% and a specificity of 91%. A subsequent study using similar methodology yielded similar results when the test was administered directly by the caregiver.
ConclusionsThe episodic memory test and the caregiver's episodic memory test are useful as brief screening tools for identifying patients with early-stage AD. It is suitable for use by primary care medical staff and in the home, since it can be administered by a caregiver. The test's limitations are that it must be administered by a reliable caregiver and the fact that it measures episodic memory only.
La mayoría de los pacientes con demencia muestran problemas de memoria en el inicio de su enfermedad1. La memoria es un proceso mental para recuperar la información almacenada después de un tiempo2; esta no es un constructo unitario, sino que hay una interrelación en los subsistemas3. La memoria episódica se refiere al sistema que envuelve el recuerdo particular de episodios o experiencias de nuestra vida; estas son dependientes del contexto y están asociados a un determinado tiempo y lugar4. La memoria episódica depende de redes neuronales que incluyen los lóbulos temporales, el hipocampo y los lóbulos frontales esencialmente3. El hipocampo es la estructura crucial para la consolidación de la información en los circuitos de almacenes de memoria de largo tiempo. Las lesiones del hipocampo producen los fallos de nuevos aprendizajes con conservación de la memoria inmediata y lejana2. Algunos han argumentado que la memoria de reconocimiento puede ser apoyada por 2 procesos separables, el recuerdo y la familiaridad. Recuerdo implica la recuperación del contexto de un evento previo, incluyendo sus características espacio-temporales, más en consonancia con el concepto de viaje en el tiempo mental, propagada por Endel Tulving4, y requiere que permanezca intacto el hipocampo, mientras que la familiaridad es un sentimiento no contextual del encuentro anterior que es dependiente de la corteza perirrinal5–7. Por ejemplo, es muy común ver a un actor en una película y pensar que la persona es muy familiar, pero no ser capaz de recuperar todos los detalles sobre la persona (familiaridad). Por otra parte, todos sabemos lo que se siente al recordar de pronto dónde había visto al actor antes u otras piezas de la información, como el nombre del mismo (el recuerdo). Nuestros recuerdos anteriores nos permiten simular y predecir eventos futuros, lo cual tiene importantes implicaciones para la planificación y la toma de decisiones8–13.
En términos generales, pueden identificarse 2 tipos de alteración de memoria episódica: los trastornos amnésicos y los síndromes de déficit de recuperación de lo memorizado. Los trastornos amnésicos ocurren en pacientes con disfunción temporal medial, límbica e hipocampal, como los que presentan EA; los síndromes de déficit de recuperación de lo memorizado son típicos de los que sufren disfunción de circuitos subcorticales o frontales (demencia frontotemporal, enfermedad de Parkinson, parálisis supranuclear progresiva, degeneración corticobasal y la mayoría de los pacientes con demencia vascular, demencia con cuerpos de Lewy y ancianos normales). Clásicamente, la memoria verbal se mide pidiendo al paciente que repita de 3 a 10 palabras hasta 5 veces o hasta que el paciente pueda repetir inmediatamente la lista completa sin pausas. En la siguiente fase de la exploración, sin distraer al enfermo, se le permite que se concentre en las palabras y las repase interiormente durante un minuto, antes de pedirle que las repita. Tras un tiempo de 5 a 10 min en el que se le entretiene con otras tareas, se le pide al paciente que vuelva a repetirlas y que posteriormente identifique las palabras omitidas en una lista de palabras objetivo (presentadas previamente) mezcladas con otras no mostradas al principio. Los pacientes amnésicos no aprenderán o almacenarán la nueva información y exhibirán déficit tanto en la repetición como la identificación posterior de palabras. Los pacientes con síndrome de recuperación de lo memorizado tendrán dificultades para repetir las palabras, pero se desenvolverán mejor en la identificación de los vocablos omitidos. Otro método para la valoración de la recuperación es dar claves semánticas14–17.
La memoria activa, inmediata o de trabajo es una función de la atención basada en mantener temporalmente activa la información, está estrechamente relacionado con la integridad de la red prefrontal y sus conexiones subcorticales y el sistema reticular activador ascendente. El término memoria de trabajo o memoria a corto plazo se refiere a la memoria que utilizamos para retener dígitos, palabras, nombres u otros ítems durante un periodo breve. El modelo de memoria de trabajo propuesto por Baddeley y Hitch (1974)18 está formado por un controlador atencional o ejecutivo central que hace referencia a un sistema de control cuya finalidad es la de mantener los estímulos en la memoria y proporcionar la atención selectiva necesaria para centrarse en alguna operación. El ejecutivo central está vinculado al lóbulo frontal y el daño en este lóbulo produce el denominado «síndrome disejecutivo», en el que el paciente presenta dificultades para mantener y manipular la información, para planificar y coordinar actividades, y se compone de 3 sistemas subsidiarios: a) el bucle fonológico que está relacionado con la retención inmediata de la información fonológica y escrita; b) la agenda visuoespacial que está relacionada con la retención inmediata de la información visuoespacial, y c) el bucle episódico, añadido por Baddeley en el año 200019. Este bucle proporcionaría un almacenamiento temporal y de capacidad limitada de tipo multimodal, integrando la información procedente de los bucles fonológico y visual con la memoria a largo plazo.
La extrapolación del recuerdo en minutos a la memoria episódica roza casi el concepto de memoria de trabajo. Cuando valoramos la memoria episódica en la práctica clínica deberíamos usar información que exceda la memoria inmediata. Sabemos que muchos pacientes normales puntúan 0 o 1 en el recuerdo diferido de las 3 palabras del MMSE, por lo que hay que tener precaución en interpretar el recuerdo simple como un índice de memoria20. Un aprendizaje de lista de tareas con posterior recuperación y pruebas de reconocimiento (California Verbal Learning Test-II, Rey Auditory Verbal Learning test) es más adecuado para la evaluación de la memoria21–23. En nuestro medio, 2 test muy breves, tanto el MIS24 como el test de las fotos25, han demostrado un excelente rendimiento con un tiempo de administración menor de 5 min, por lo que parecen adecuados, como test breves, para la detección en atención primaria de la EA. En consultas especializadas (tiempo medio 10-25 min) son más recomendables las baterías neuropsicológicas breves que exploren varias áreas cognitivas, como el test de los 7 minutos26 o el test de alteración de la memoria M@T27,28.
El deterioro cognitivo leve se define como el estado transicional entre los cambios cognitivos del envejecimiento normal y la demencia muy temprana (Petersen et al., 2008)29.
En los últimos años, ha aumentado el interés con respecto al constructo de deterioro cognitivo leve. Este interés radica en la necesidad de identificar de forma temprana las características de enfermedades como el Alzheimer y otras demencias. El deterioro cognitivo leve (DCL) representa el estadio más temprano de estas enfermedades y, como tal, es necesario su estudio e investigación desde el punto de vista clínico, epidemiológico, estudios con neuroimagen, biomarcadores y neuropatología (Petersen et al., 2009)30.
Algunos de estos biomarcadores se han incorporado a los nuevos criterios31,32 como medio para incrementar la probabilidad de que el síndrome de deterioro cognitivo se deba a la fisiopatología de la enfermedad de Alzheimer dando lugar al concepto de EA prodrómica o demencia debida a EA probable con evidencia de proceso fisiopatológico de EA.
Son varios los biomarcadores que se incluyen como factores pronósticos del DCL, la atrofia del hipocampo en los estudios de RMN33,34, los biomarcadores amiloide B 1-42 y Tau en líquido cefalorraquídeo35, los cambios en la tomografía por emisión de positrones (PET) con 2-desoxi 2 (f-18) fluoruro-D-glucosa (FDG-PET)36 y los estudios anormales con PET y el compuesto B de Pittsburgh (B-PET)37.
La pérdida de la memoria episódica es una característica definitoria de la clínica de la EA; también hay pérdida de la misma en ancianos y en el DCL amnésico (DCLa). La pérdida de memoria de la edad adulta difiere cuantitativamente y cualitativamente de la pérdida de la memoria en la EA; cualitativamente, está marcado por un mayor deterioro de las tareas que requieren la recuperación de información asociativa, tal y como ocurre en los déficits frontosubcorticales38; cuantitativamente, es menos intensa. Cualitativamente, sin embargo, la distinción entre los déficits de memoria en el anciano y el DCLa es menos clara y esta aseveración no está demostrada. El papel exacto de esta afección en los déficits de memoria episódica de la EA aún no ha sido resuelto. La causa de la pérdida de la memoria episódica en la EA es probablemente multifactorial. Además de la presencia de la enfermedad neurofibrilar en el lóbulo temporal medial en los primeros estadios, especialmente en la capa ll de las neuronas39, otros factores han de tenerse en cuenta, como los cambios patológicos en el cerebro basal, disminuyendo en gran medida la entrada colinérgica para el neocórtex40. La presencia de amiloide y enfermedad neurofibrilar en los lóbulos frontales en estadios muy iniciales41 y, por último, el amiloide soluble en sí se ha propuesto tener un efecto específico sobre la potenciación a largo plazo en el hipocampo, con efectos concomitantes sobre el aprendizaje42.
ObjetivoDar a conocer un nuevo test, que a través de la medición exclusiva de la memoria episódica, nos permita distinguir con una alta sensibilidad y especificidad los estadios iniciales de la EA. Las características distintivas son la brevedad, la no interferencia con la memoria de trabajo ni con el nivel cultural, la fácil aplicabilidad que nos permite ser realizado por un cuidador y ser un test ecológico adaptado al concepto de memoria episódica.
Sujetos y métodosDescripción del cuestionarioEl diseño del cuestionario fue concebido para adaptarse al concepto de memoria episódica de Tulving, en donde el tiempo, el lugar y el contexto son las piezas clave del recuerdo4. Al mismo tiempo, se utiliza un cuestionario que debe ser contrastado por el cuidador, como ocurre en la Clinical Dementia Rating de Hughes, pero a diferencia de esta, nuestro test está estructurado en preguntas y puntuaciones concretas sobre hechos episódicos y se valora en exclusiva la memoria episódica.
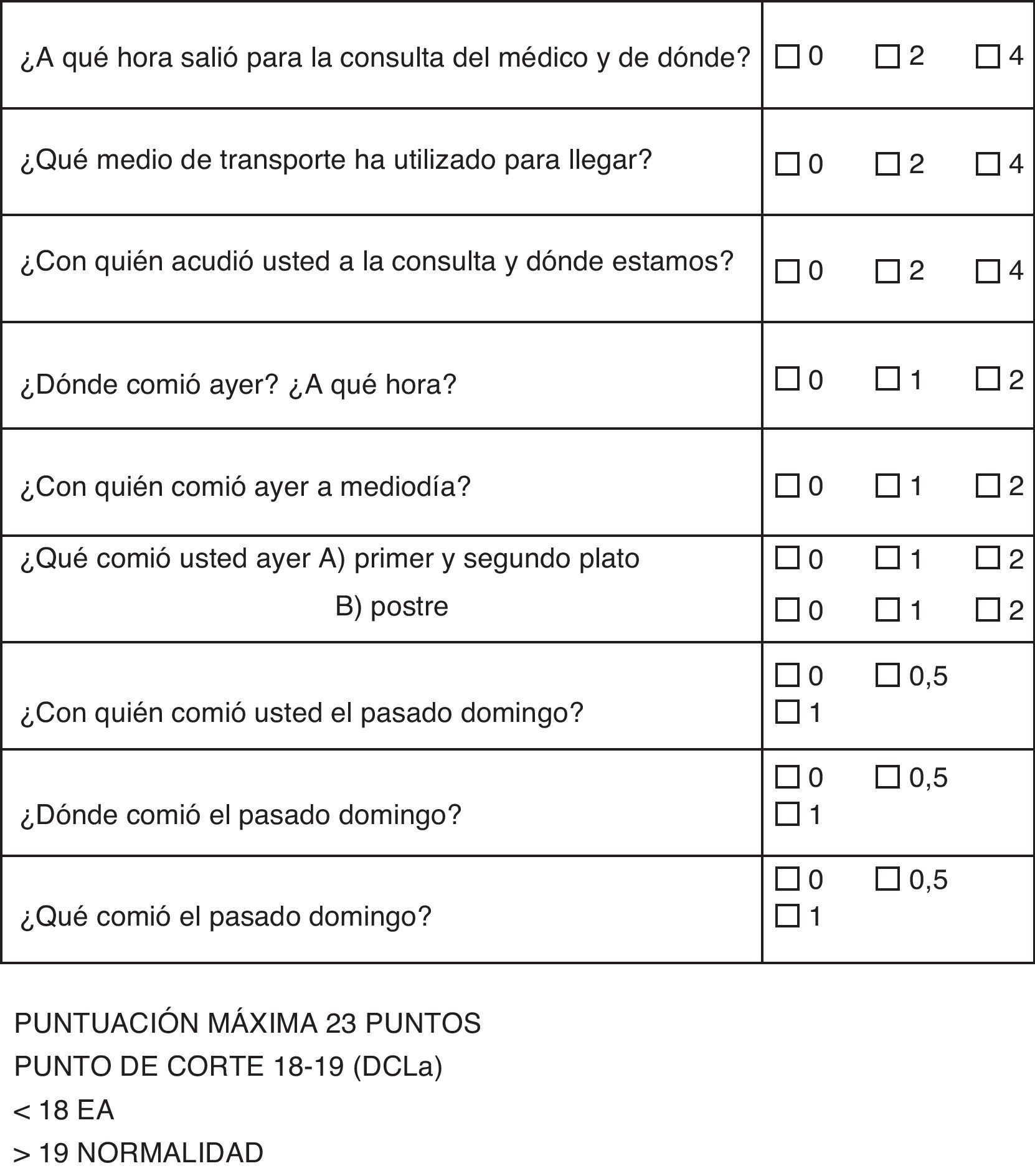
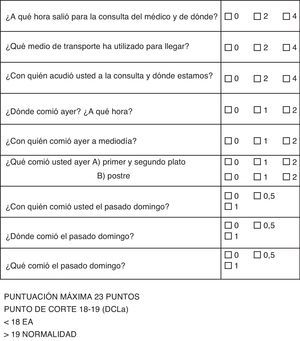
Se elige, en primer lugar, una tarea universal y común, como es el acto de la comida; esta representa una tarea social que implica un lugar (dónde), una compañía (con quién), y el mismo contenido de lo que se come (qué).
Todas estas tareas las relacionamos con el tiempo, de tal manera que cuantificamos hechos acaecidos el mismo día, el día anterior y pasado un día (fin de semana). Utilizamos el sábado o el domingo indistintamente, con tal de dejar pasar más de 24 h, que es lo esencial en el concepto, de tal manera, que si es el lunes cuando realizamos la pregunta, debemos de referirnos siempre al pasado sábado.
Las puntuaciones se adjudican según el valor de la pérdida de memoria, que debe ser más significativa si se pierden los recuerdos del mismo día, que si se pierden los el día anterior, o días atrás (fig. 1).
Las preguntas deben seguir el mismo orden, de tal manera que cuando preguntamos por el lugar donde comió o con quién estamos, damos claves para la recuperación de lo comido en ese momento.
La puntuación se divide en 3 posibles respuestas, una correcta, otra errónea y otra aproximada. En general, consideramos aproximada la hora de salida si no pasa una hora del límite; en cuanto a la compañía, si esta es numerosa, la falta de uno de los acompañantes, y en cuanto a las comidas, si ha errado parcialmente algún contenido. En el caso del test del cuidador, se considera puntuación parcial lo que este considere oportuno, sin normas exactas.
Es condición imprescindible que el paciente acuda acompañado de un cuidador fiable para poder contrastar el resultado de las preguntas; sin él, el test sería imposible de realizar.
El test episódico fue conceptualizado para valorar al paciente en la consulta. El test episódico del cuidador es una variedad en el que el cuidador pasará el test antes de entrar en la consulta y fue validado en un estudio posterior.
La adaptación de los 3 primeros ítems fue realizada para que el cuidador pueda pasarla en casa y para pacientes internados en residencias en el que preguntas como «con quién acudió usted a la consulta y con qué medio» no tiene lugar (fig. 2).
ParticipantesLos pacientes se seleccionaron en una consulta terciaria de memoria de manera consecutiva que acudían por primer vez procedentes de atención primaria y consultas generales de neurología, psiquiatría y otras especialidades. A todos los pacientes y sus cuidadores se les pidió el consentimiento informado. El criterio de selección fue el GDS; en la clasificación, se tuvieron en cuenta datos como las puntuaciones del MMSE, el MIS y la escala de Blessed para categorizar el estadio GDS.
Los grupos con DCLa y EA fueron seleccionados de pacientes que acudieron por quejas de memoria y acompañados por sus cuidadores. Era imprescindible que los cuidadores tuvieran un contacto diario con los pacientes. El grupo de normalidad fue seleccionado de familiares sanos que acompañaban a otros enfermos a la consulta de memoria. Los grupos se seleccionaron según la escala de deterioro global de Reisberg (GDS) en normales, de acuerdo con estadios 1 y 2 de la GDS, DCLa según criterios de Petersen y de acuerdo con el estadio 3 de la escala GDS, y pacientes con EA en estadio leve-moderado se clasificaron según criterios NINCDS ADRDA para la EA y de acuerdo con los estadios 4 y 5 de la escala GDS.
De los 180 pacientes seleccionados, 115 presentaron deterioro cognitivo leve, 65 pacientes con EA en estadio leve-moderado y 152 no presentaban deterioro cognitivo.
Un segundo estudio fue realizado con la misma metodología, con la diferencia de que el test era pasado directamente por el cuidador, cuyos datos también adjuntamos.
Treinta y cinco pacientes se excluyeron del primer estudio; de estos, 6 pacientes no tenían un cuidador fiable con un contacto muy ocasional con el paciente, 10 pacientes tenían un componente vascular importante, 4 pacientes tenían antecedentes psiquiátricos graves de muy larga evolución, 8 pacientes cumplían criterios de enfermedad con cuerpos de Lewy y 6 de demencia frontotemporal. Un paciente tenía secuelas de alcoholismo crónico activo.
En el segundo estudio se excluyó a 19 pacientes, 4 por falta de cuidador fiable, uno por encontrarse en situación avanzada y el resto por cumplir criterios de otras demencias (demencia vascular, demencia con cuerpos de Lewy y demencia frontotemporal).
ProcedimientoEn la consulta, el médico pasó los siguientes test a todos los pacientes: la adaptación en castellano del Memory Impairment Screen MIS-Buschke24, el MMSE de Folstein43, la escala de demencia de Blessed44, la escala GDS45 y el test episódico, siguiendo las instrucciones de cada uno de los test (tabla 1).
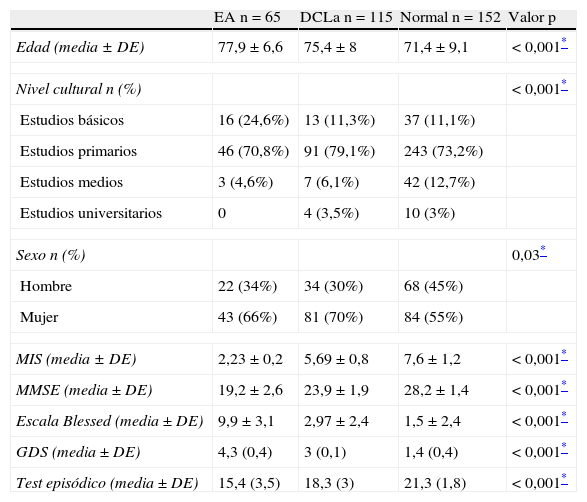
Características sociodemográficas y escalas neuropsicológicas del estudio de validación del test episódico que nos permitieron clasificar a los 3 grupos
| EA n=65 | DCLa n=115 | Normal n=152 | Valor p | |
| Edad (media ± DE) | 77,9 ± 6,6 | 75,4 ± 8 | 71,4 ± 9,1 | < 0,001* |
| Nivel cultural n (%) | < 0,001* | |||
| Estudios básicos | 16 (24,6%) | 13 (11,3%) | 37 (11,1%) | |
| Estudios primarios | 46 (70,8%) | 91 (79,1%) | 243 (73,2%) | |
| Estudios medios | 3 (4,6%) | 7 (6,1%) | 42 (12,7%) | |
| Estudios universitarios | 0 | 4 (3,5%) | 10 (3%) | |
| Sexo n (%) | 0,03* | |||
| Hombre | 22 (34%) | 34 (30%) | 68 (45%) | |
| Mujer | 43 (66%) | 81 (70%) | 84 (55%) | |
| MIS (media ± DE) | 2,23 ± 0,2 | 5,69 ± 0,8 | 7,6 ± 1,2 | < 0,001* |
| MMSE (media ± DE) | 19,2 ± 2,6 | 23,9 ± 1,9 | 28,2 ± 1,4 | < 0,001* |
| Escala Blessed (media ± DE) | 9,9 ± 3,1 | 2,97 ± 2,4 | 1,5 ± 2,4 | < 0,001* |
| GDS (media ± DE) | 4,3 (0,4) | 3 (0,1) | 1,4 (0,4) | < 0,001* |
| Test episódico (media ± DE) | 15,4 (3,5) | 18,3 (3) | 21,3 (1,8) | < 0,001* |
En un segundo estudio se realizaron los mismos test, excepto el test episódico, que fue pasado por el cuidador directamente al paciente, sin intervención de ningún profesional, y mientras esperaban en la sala de espera del médico (tabla 2). No se pasaron los test en pacientes institucionalizados o en el domicilio.
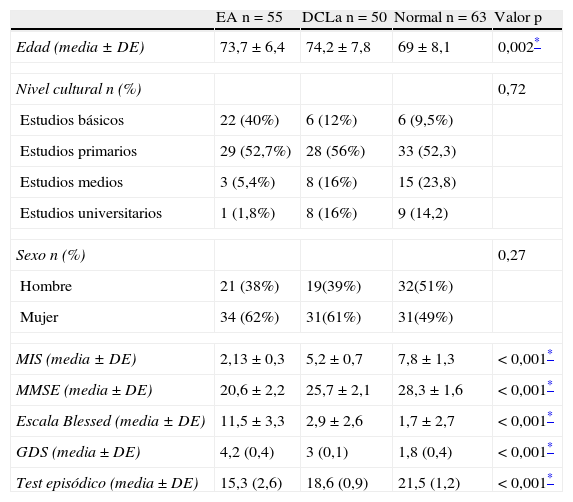
Características sociodemográficas y escalas neuropsicológicas del estudio de validación del test episódico del cuidador que nos permitieron clasificar a los 3 grupos
| EA n=55 | DCLa n=50 | Normal n=63 | Valor p | |
| Edad (media ± DE) | 73,7 ± 6,4 | 74,2 ± 7,8 | 69 ± 8,1 | 0,002* |
| Nivel cultural n (%) | 0,72 | |||
| Estudios básicos | 22 (40%) | 6 (12%) | 6 (9,5%) | |
| Estudios primarios | 29 (52,7%) | 28 (56%) | 33 (52,3) | |
| Estudios medios | 3 (5,4%) | 8 (16%) | 15 (23,8) | |
| Estudios universitarios | 1 (1,8%) | 8 (16%) | 9 (14,2) | |
| Sexo n (%) | 0,27 | |||
| Hombre | 21 (38%) | 19(39%) | 32(51%) | |
| Mujer | 34 (62%) | 31(61%) | 31(49%) | |
| MIS (media ± DE) | 2,13 ± 0,3 | 5,2 ± 0,7 | 7,8 ± 1,3 | < 0,001* |
| MMSE (media ± DE) | 20,6 ± 2,2 | 25,7 ± 2,1 | 28,3 ± 1,6 | < 0,001* |
| Escala Blessed (media ± DE) | 11,5 ± 3,3 | 2,9 ± 2,6 | 1,7 ± 2,7 | < 0,001* |
| GDS (media ± DE) | 4,2 (0,4) | 3 (0,1) | 1,8 (0,4) | < 0,001* |
| Test episódico (media ± DE) | 15,3 (2,6) | 18,6 (0,9) | 21,5 (1,2) | < 0,001* |
Todos los pacientes aportaban RM 1,5 teslas y analítica general, niveles de TSH, niveles de vitamina B12, acido fólico y serología de lúes. No se analizó el grado de atrofia temporal, ni se realizó de manera rutinaria una neuroimagen funcional ni otros biomarcadores.
Análisis estadísticoSe realizó un análisis descriptivo de las variables, donde las variables continuas se expresaron mediante la media ± desviación estándar (DE) y las variables cualitativas, mediante frecuencias absolutas y porcentajes. Se aplicó el test de Kruskall-Wallis para comparar las características de los pacientes y los valores de la puntuación total del test en los 3 grupos, para el caso de variables continuas, y la prueba de la chi al cuadrado para variables categóricas. Para calcular la sensibilidad y la especificidad de la prueba para la detección de EA se contrastaron pacientes con EA frente a pacientes con DCL y sanos. Para la detección de DCL, se contrastaron pacientes sanos frente a pacientes con EA y DCL.
Para determinar la seguridad con la que la prueba predecirá la presencia o ausencia de enfermedad, se calcularán los valores predictivos positivos y negativos. Como indicador para evaluar el desempeño de cada uno de los test diagnósticos utilizados, se calculará la eficacia. Se calcularán los intervalos de confianza del 95% de todos los indicadores de validez.
Esta misma metodología se utilizó en un segundo estudio, en el que el test es pasado por el cuidador en la sala de espera.
El análisis estadístico se realizará mediante R-program.
ResultadosCaracterísticas sociodemográficas: las edades medias, el porcentaje de varones, junto con el nivel de estudios, y las distintas escalas que nos permitieron clasificarlos en sus correspondientes estadios del GDS, se muestran en las tablas 1 y 2.
Aplicabilidad: todos los pacientes sometidos al test pudieron efectuarlo sin problemas. No se detectaron limitaciones por aspectos educacionales ni por alteraciones sensoriales. El tiempo que se invirtió en la aplicación del test osciló entre 1 y 5 min.
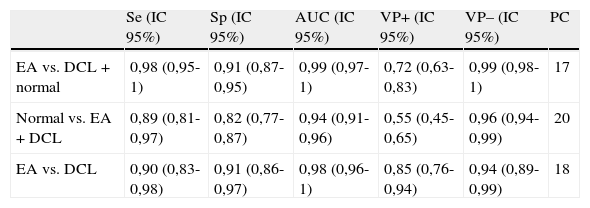
El área bajo la curva ROC para el diagnóstico de DCL fue de 0,94 y el mejor punto de corte fue 20, valor con el que se obtuvo una sensibilidad del 89% y una especificidad del 82%. Con respecto al diagnóstico de EA, el área bajo la curva ROC fue de 0,99 y el mejor punto de corte fue 17, con el que se obtuvo una sensibilidad del 98% y una especificidad del 91% (tabla 3).
Sensibilidad (Se), especificidad (Sp), valores predictivos (VP+/–), área bajo la curva ROC (AUC) y puntos de corte (PC) del test episódico
| Se (IC 95%) | Sp (IC 95%) | AUC (IC 95%) | VP+ (IC 95%) | VP– (IC 95%) | PC | |
| EA vs. DCL+normal | 0,98 (0,95-1) | 0,91 (0,87-0,95) | 0,99 (0,97-1) | 0,72 (0,63-0,83) | 0,99 (0,98-1) | 17 |
| Normal vs. EA+DCL | 0,89 (0,81-0,97) | 0,82 (0,77-0,87) | 0,94 (0,91-0,96) | 0,55 (0,45-0,65) | 0,96 (0,94-0,99) | 20 |
| EA vs. DCL | 0,90 (0,83-0,98) | 0,91 (0,86-0,97) | 0,98 (0,96-1) | 0,85 (0,76-0,94) | 0,94 (0,89-0,99) | 18 |
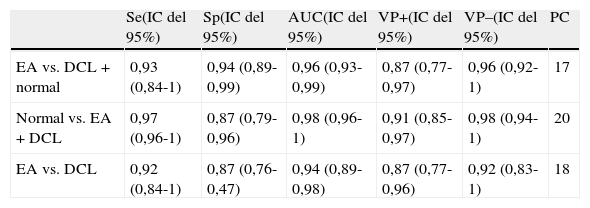
Los resultados fueron muy similares cuando el test era pasado por el cuidador (tabla 4).
Sensibilidad (Se), especificidad (Sp), valores predictivos (VP+/–), área bajo la curva ROC (AUC) y puntos de corte (PC) del test episódico del cuidador
| Se(IC del 95%) | Sp(IC del 95%) | AUC(IC del 95%) | VP+(IC del 95%) | VP–(IC del 95%) | PC | |
| EA vs. DCL+normal | 0,93 (0,84-1) | 0,94 (0,89-0,99) | 0,96 (0,93-0,99) | 0,87 (0,77-0,97) | 0,96 (0,92-1) | 17 |
| Normal vs. EA+DCL | 0,97 (0,96-1) | 0,87 (0,79-0,96) | 0,98 (0,96-1) | 0,91 (0,85-0,97) | 0,98 (0,94-1) | 20 |
| EA vs. DCL | 0,92 (0,84-1) | 0,87 (0,76-0,47) | 0,94 (0,89-0,98) | 0,87 (0,77-0,96) | 0,92 (0,83-1) | 18 |
A medida que conocemos mejor el perfil neuropsicológico y patológico del envejecimiento normal46–49, el deterioro cognitivo leve50–56 y la EA57–63, nos aproximamos más al diagnóstico precoz de la EA. Sin embargo, nos encontramos con grandes dificultades a la hora de utilizar un instrumento único para distinguir estos 3 estadios de una manera práctica y universal.
La distinción entre el envejecimiento normal y la demencia tipo Alzheimer puede realizarse en la práctica clínica con una gran sensibilidad y especificidad, basándonos en estudios neuropsicológicos, y corroborada con estudios patológicos. Esta afirmación deja de ser menos cierta en personas mayores de 80 años comparativamente con los menores de 70 años62 y es más apropiada si consideramos la asimetría de los déficits (p. ej., memoria verbal con respecto a visual y viceversa)63.
Más dificultad entraña la distinción entre el envejecimiento normal y el DCL. Esta dificultad añadida ha llevado en los últimos años a utilizar los marcadores biológicos, como apoyo al diagnóstico neuropsicológico, para definir con más precisión los estadios precoces de la enfermedad.
Hoy en día la tasa anuales de conversión de DCL a demencia varía entre el 1 y el 72% por año56 y entre un 10 y un 40% volverá a la normalidad una vez revaluados54,55. Esta variabilidad en las cifras se debe a 3 circunstancias. En primer lugar, al hecho de no contar con un instrumento adecuado y universal para identificar adecuadamente la memoria u otras capacidades cognitivas48.
En segundo lugar, a la falta de consenso en cuanto a qué dominios cognitivos deben ser evaluados para determinar la presencia o ausencia de DCL; la mayoría aboga por la memoria verbal50, pero una minoría importante se perdería si no valoramos la memoria visual51, o la valoración de dominios cognitivos distintos de la memoria52. En tercer lugar, no conocemos qué valor del deterioro puede ser definido como un déficit, por ejemplo 1,5 DE por debajo de las normas apropiadas para la edad53,54.
Todas estas ambigüedades hacen que los médicos suelan tomar decisiones de acuerdo con la consistencia de los resultados y los patrones de deterioro, y no basándose en aislados valores deficitarios.
Por lo tanto, variando el numero de medidas neuropsicológicas utilizadas para determinar el deterioro objetivo o los puntos de corte utilizados para definir leve afección en la cognición de las personas mayores, se pueden alterar considerablemente las tasas de DCL64,65, como discuten Jak et al., 200766.
Los déficits sutiles de la memoria episódica resultan difíciles de evaluar y con los métodos clásicos de evaluación se requiere un tiempo por encima de los 15 min para que no interfiera con la memoria activa o de trabajo. Este inconveniente se hace más tangible cuanto más breve es el test utilizado, ya que la retención de la nueva información puede estar interferido con la misma.
Una característica de nuestro test es obviar los inconvenientes descritos previamente; es un test que no precisa conocer qué valor del deterioro puede ser definido como un déficit según las DE sobre la población estudiada, no precisa distinguir entre amnesia y recuperación de la memoria y, a pesar de la brevedad del test, al utilizar información ya grabada en el tiempo, evita la interferencia con la memoria de trabajo.
En la fase de DCLa, en el que la codificación está parcialmente afectada, la anatomía patológica demuestra una precoz afección de los circuitos frontales67, también corroborado por el PIB, lo que hace difícil distinguir estos pacientes de los ancianos normales, especialmente porque se pueden comportar ambos como un déficit de recuperación de lo memorizado.
ConclusionesCreemos que hemos conseguido un test adaptado al concepto ecológico de la memoria episódica, donde la relevancia del lugar, el contexto y el tiempo desempeñan un papel primordial en la valoración de la misma. Este test consigue, con una alta sensibilidad y especificidad, la distinción entre la normalidad y los estadios iniciales de la EA con unos puntos de corte bien definidos. Otras características positivas del mismo, como su nula interferencia con el nivel cultural, su simplicidad y su brevedad, lo acercan al concepto que Parker y Philp describen como test idóneo para la captación del enfermo con Alzheimer68.
El hecho de ser un test apto para ser pasado por el cuidador hace de este un instrumento potencial para ser utilizado como cribado poblacional o en consultas de atención primaria.
El test tiene limitaciones obvias, como la necesidad de contar con un cuidador fiable y la medición exclusiva de la memoria episódica. Merecen también puntualizarse las limitaciones del estudio con una mera correlación entre el GDS y el test episódico en un grupo sesgado por su remisión a una consulta terciaria de memoria por el criterio clínico experto de los autores y sin la aplicación de marcadores biológicos. Sin embargo, los buenos resultados nos han animado a dar a conocer el test y continuar con los estudios, en el que los nuevos marcadores biológicos deberían estar presentes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Autor del test.