La enfermedad periodontal y la demencia son enfermedades muy prevalentes, especialmente en poblaciones envejecidas. Numerosos estudios han demostrado una relación entre ambas afecciones, pero la alta heterogeneidad en el diagnóstico, así como la metodología empleada, pueden dificultar la interpretación y la comparación de los resultados obtenidos. El objetivo de este artículo es realizar una revisión crítica de las publicaciones que asocian ambos procesos.
DesarrolloSe incluyen 22 artículos, mayoritariamente estudios retrospectivos, y se analizan diversas variables metodológicas, como población de estudio, diagnóstico de periodontitis, definición de demencia, variables ajustadas y resultados. Además, se analizan los diferentes mecanismos etiopatogénicos que pueden influir en la progresión de ambas enfermedades y en la interacción entre ellas.
ConclusionesAunque la evidencia disponible indica una tendencia positiva a la asociación entre periodontitis y demencia, se desconoce el grado de esta asociación y la existencia de una relación causal entre ambas enfermedades.
Periodontal disease and dementia are very prevalent, especially in elderly populations. Multiple studies have shown a link between these diseases; however, the conditions are highly heterogeneous and so is the diagnostic methodology, which may hinder interpretation and comparison of the results. The aim of this article is to provide a critical review of the literature linking these 2 processes.
DevelopmentWe retrieved 22 studies, most of which were retrospective, and analysed various methodological variables including study population, diagnosis of periodontitis, definition of dementia, adjusted variables, and results. The different aetiopathogenic mechanisms that may affect the progression and interaction of these 2 conditions were also analysed.
ConclusionsAlthough available evidence indicates a positive association between periodontitis and dementia, both the strength of that association and the presence of a causal relationship have yet to be determined.
La periodontitis es una enfermedad inflamatoria crónica de origen infeccioso que se manifiesta como una destrucción del tejido de soporte de los dientes. Esta pérdida de soporte irreversible, causada por la presencia de bolsas periodontales profundas y por una pérdida de inserción avanzada, pueden llegar a provocar la pérdida dental1. Los diferentes tipos de periodontitis (crónica, agresiva, como manifestación sistémica, necrosante) se encuentran dentro de las enfermedades periodontales según el último consenso internacional de 19992.
La demencia se define como un síndrome clínico que se caracteriza por un deterioro persistente y progresivo de funciones cerebrales superiores como la memoria, el lenguaje, la orientación, el cálculo o la percepción espacial. Los casos de demencia aumentan de forma exponencial con la edad, constituyendo una de las principales causas de dependencia y discapacidad de la población de edad avanzada3. Esta afección engloba trastornos como la enfermedad de Alzheimer (EA), la demencia vascular (DV) y otros tipos de demencia menos frecuentes, como la demencia con cuerpos de Lewy, la degeneración lobular frontotemporal o la demencia asociada a Parkinson. Aunque algunos criterios diagnósticos de demencia incluyen la presencia de deterioro amnésico, ciertas formas de demencia, como la degeneración lobular frontotemporal, la demencia con cuerpos de Lewy, demencia asociada a Parkinson o la DV pueden no tener una alteración grave de la memoria hasta fases avanzadas4.
La periodontitis y la demencia son enfermedades muy prevalentes en personas de avanzada edad. Según la encuesta poblacional de salud bucodental en España en 20105, el 10,8% de la población adulta de entre 65-74 años presenta bolsas periodontales profundas, y el 17,7% de esta cohorte de población muestra una pérdida de inserción clínica de 6mm o mayor. Las tasas de prevalencia de demencia en España se sitúan entre el 5,2-16,3% de la población mayor de 65 años, llegando a alcanzar entre el 22-30% en los pacientes con edad de 85 años o mayor3,4.
Numerosos estudios publicados recientemente han relacionado ambas enfermedades basándose en la población de estudio implicada y en una posible ruta fisiopatológica común.
Los objetivos del presente artículo son revisar los estudios publicados hasta noviembre de 2015 sobre la asociación entre la enfermedad periodontal y la demencia, así como los mecanismos fisiopatológicos comunes que podrían explicar la posible relación entre ambos procesos.
DesarrolloLa búsqueda bibliográfica se llevó a cabo de manera independiente por 2 revisores (PP y YL) en noviembre de 2015 utilizando las bases de datos electrónicas PubMed, EMBASE y Web of Science. Además, también se realizó una búsqueda manual en las revistas más relevantes de periodoncia y demencia. La estrategia de búsqueda que se utilizó fue la siguiente: ((periodontitis OR periodontal disease) AND (cognition OR memory OR poor cognitive function OR dementia OR cognitive impairment OR cognitive decline OR cognitive function OR Alzheimer's disease OR cognitive disability OR memory impairment OR cognitive loss)), tanto en términos MeSH como de texto libre.
Estudios sobre la asociación entre la periodontitis y la demenciaEn las tablas 1–3 se muestran los estudios de cohortes6,7, casos-controles8–10 y transversales11–27 de mayor relevancia publicados sobre la asociación entre la periodontitis y la demencia. La interpretación de los resultados se encuentra limitada por la falta de consenso para definir la enfermedad periodontal y clasificar los trastornos neurológicos, así como por la selección de pacientes.
Estudios de cohortes
| Autor | Población estudio | Diagnóstico periodontal | Diagnóstico demencia | Variables ajustadas | Principales resultados |
|---|---|---|---|---|---|
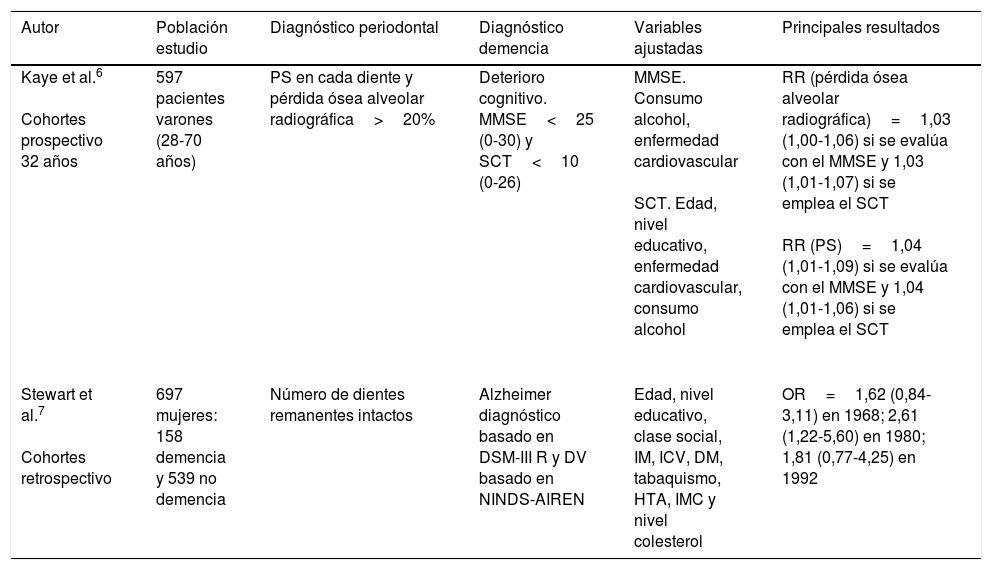
| Kaye et al.6 Cohortes prospectivo 32 años | 597 pacientes varones (28-70 años) | PS en cada diente y pérdida ósea alveolar radiográfica>20% | Deterioro cognitivo. MMSE<25 (0-30) y SCT<10 (0-26) | MMSE. Consumo alcohol, enfermedad cardiovascular SCT. Edad, nivel educativo, enfermedad cardiovascular, consumo alcohol | RR (pérdida ósea alveolar radiográfica)=1,03 (1,00-1,06) si se evalúa con el MMSE y 1,03 (1,01-1,07) si se emplea el SCT RR (PS)=1,04 (1,01-1,09) si se evalúa con el MMSE y 1,04 (1,01-1,06) si se emplea el SCT |
| Stewart et al.7 Cohortes retrospectivo | 697 mujeres: 158 demencia y 539 no demencia | Número de dientes remanentes intactos | Alzheimer diagnóstico basado en DSM-III R y DV basado en NINDS-AIREN | Edad, nivel educativo, clase social, IM, ICV, DM, tabaquismo, HTA, IMC y nivel colesterol | OR=1,62 (0,84-3,11) en 1968; 2,61 (1,22-5,60) en 1980; 1,81 (0,77-4,25) en 1992 |
DM: diabetes mellitus; DSM-III R: Diagnostic and Statistical Manual of Mental Disorders III; DV: demencia vascular; HTA: hipertensión arterial; ICV: infarto cerebrovascular; IM: infarto de miocardio; IMC: índice de masa corporal; MMSE: Mini-Mental State Examination; NINDS-AIREN: National Institute of Neurological Disorders and Stroke and the Association Internationale pour la Recherche et l’Enseignement en Neurosciences; OR: odds ratio; PS: profundidad de sondaje; RR: riesgo relativo; SCT: Spatial Copying Task.
Estudios de casos y controles
| Autor | Población estudio | Diagnóstico periodontal | Diagnóstico demencia | Variables ajustadas | Principales resultados |
|---|---|---|---|---|---|
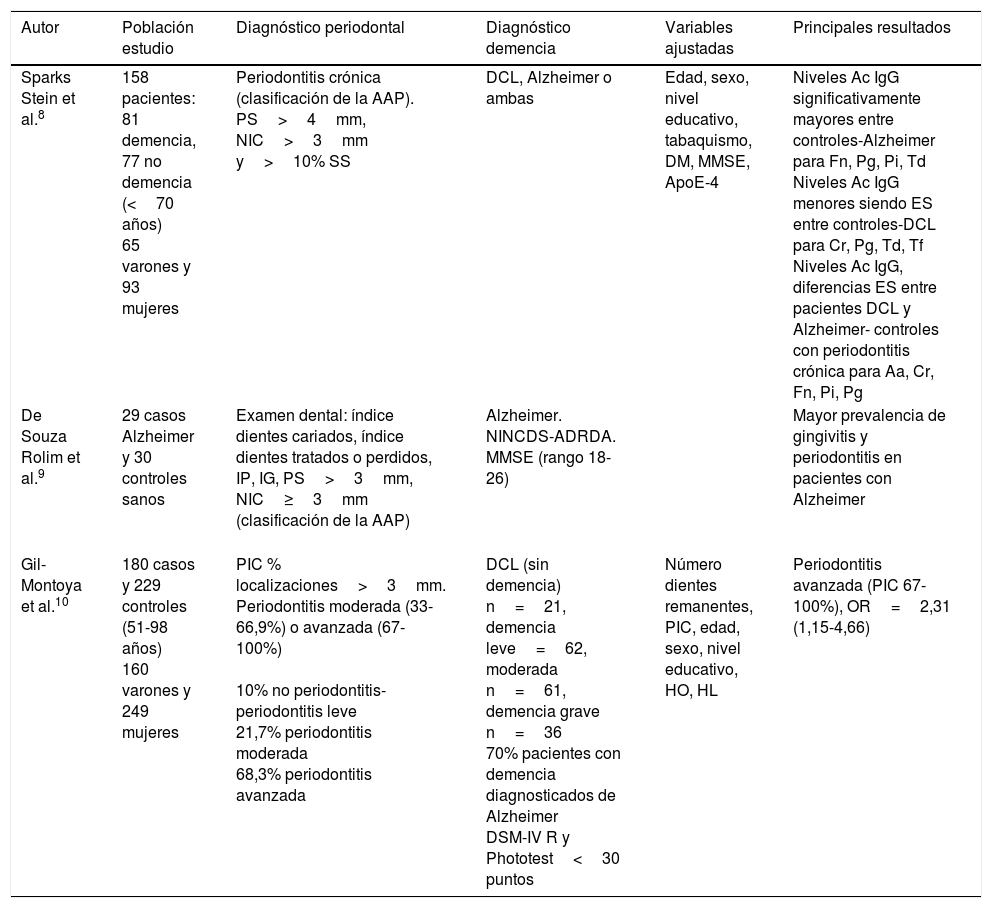
| Sparks Stein et al.8 | 158 pacientes: 81 demencia, 77 no demencia (<70 años) 65 varones y 93 mujeres | Periodontitis crónica (clasificación de la AAP). PS>4mm, NIC>3mm y>10% SS | DCL, Alzheimer o ambas | Edad, sexo, nivel educativo, tabaquismo, DM, MMSE, ApoE-4 | Niveles Ac IgG significativamente mayores entre controles-Alzheimer para Fn, Pg, Pi, Td Niveles Ac IgG menores siendo ES entre controles-DCL para Cr, Pg, Td, Tf Niveles Ac IgG, diferencias ES entre pacientes DCL y Alzheimer- controles con periodontitis crónica para Aa, Cr, Fn, Pi, Pg |
| De Souza Rolim et al.9 | 29 casos Alzheimer y 30 controles sanos | Examen dental: índice dientes cariados, índice dientes tratados o perdidos, IP, IG, PS>3mm, NIC≥3mm (clasificación de la AAP) | Alzheimer. NINCDS-ADRDA. MMSE (rango 18-26) | Mayor prevalencia de gingivitis y periodontitis en pacientes con Alzheimer | |
| Gil-Montoya et al.10 | 180 casos y 229 controles (51-98 años) 160 varones y 249 mujeres | PIC % localizaciones>3mm. Periodontitis moderada (33-66,9%) o avanzada (67-100%) 10% no periodontitis-periodontitis leve 21,7% periodontitis moderada 68,3% periodontitis avanzada | DCL (sin demencia) n=21, demencia leve=62, moderada n=61, demencia grave n=36 70% pacientes con demencia diagnosticados de Alzheimer DSM-IV R y Phototest<30 puntos | Número dientes remanentes, PIC, edad, sexo, nivel educativo, HO, HL | Periodontitis avanzada (PIC 67-100%), OR=2,31 (1,15-4,66) |
Aa: Aggregatibacter actinomycetemcomitans; AAP: Asociación Americana de Periodoncia; Ac IgG: anticuerpo inmunoglobulina G; ApoE-4: genotipo ApoE-4; Cr: Campylobacter rectus; DCL: deterioro cognitivo leve; DM: diabetes mellitus; DSM-IV R: Diagnostic and Statistical Manual of Mental Disorders IV; ES: estadísticamente significativo; Fn: Fusobacterium nucleatum; HL: hiperlipidemia; HO: higiene oral; IG: índice gingival; IP: índice de placa; MMSE: Mini-Mental State Examination; NIC: nivel de inserción clínico; NINCDS-ADRDA: National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer's Disease and Related Disorders Association; OR: odds ratio; Pg: Porphyromonas gingivalis; Pi: Prevotella intermedia; PIC: pérdida de inserción clínica; PS: profundidad de sondaje; SS: sangrado al sondaje; Td: Treponema denticola; Tf: Tannerella forsythia.
Estudios transversales
| Autor | Población estudio | Diagnóstico periodontal | Diagnóstico demencia | Variables ajustadas | Principales resultados |
|---|---|---|---|---|---|
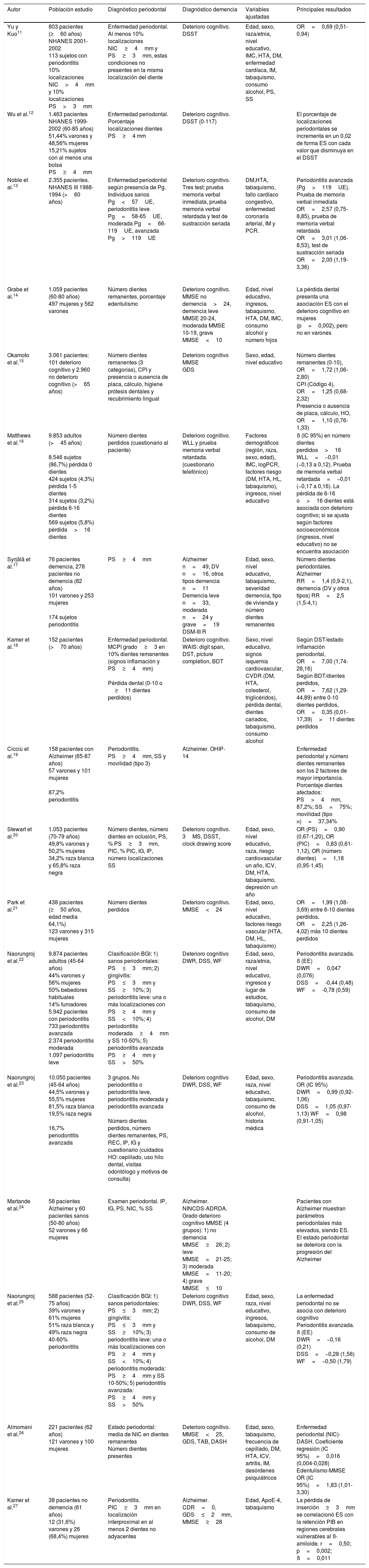
| Yu y Kuo11 | 803 pacientes (≥60 años) NHANES 2001-2002 113 sujetos con periodontitis 10% localizaciones NIC>4mm y 10% localizaciones PS>3mm | Enfermedad periodontal. Al menos 10% localizaciones NIC≥4mm y PS≥3mm, estas condiciones no presentes en la misma localización del diente | Deterioro cognitivo. DSST | Edad, sexo, raza/etnia, nivel educativo, IMC, HTA, DM, enfermedad cardíaca, IM, tabaquismo, consumo alcohol, PS, SS | OR=0,69 (0,51-0,94) |
| Wu et al.12 | 1.463 pacientes NHANES 1999-2002 (60-85 años) 51,44% varones y 48,56% mujeres 15,21% sujetos con al menos una bolsa PS≥4mm | Enfermedad periodontal. Porcentaje localizaciones dientes PS≥4 mm | Deterioro cognitivo. DSST (0-117) | El porcentaje de localizaciones periodontales se incrementa en un 0,02 de forma ES con cada valor que disminuya en el DSST | |
| Noble et al.13 | 2.355 pacientes. NHANES III 1988-1994 (>60 años) | Enfermedad periodontal según presencia de Pg. Individuos sanos Pg<57UE, periodontitis leve Pg=58-65UE, moderada Pg=66-119UE, avanzada Pg>119UE | Deterioro cognitivo. Tres test: prueba memoria verbal inmediata, prueba memoria verbal retardada y test de sustracción seriada | DM,HTA, tabaquismo, fallo cardíaco congestivo, enfermedad coronaria arterial, IM y PCR. | Periodontitis avanzada (Pg>119UE). Prueba de memoria verbal inmediata OR=2,57 (0,75-8,85), prueba de memoria verbal retardada OR=3,01 (1,06-8,53), test de sustracción seriada OR=2,00 (1,19-3,36) |
| Grabe et al.14 | 1.059 pacientes (60-80 años) 497 mujeres y 562 varones | Número dientes remanentes, porcentaje edentulismo | Deterioro cognitivo. MMSE no demencia>24, demencia leve MMSE 20-24, moderada MMSE 10-19, grave MMSE<10 | Edad, nivel educativo, ingresos, tabaquismo, HTA, DM, IMC, consumo alcohol y número hijos | La pérdida dental presenta una asociación ES con el deterioro cognitivo en mujeres (p=0,002), pero no en varones |
| Okamoto et al.15 | 3.061 pacientes: 101 deterioro cognitivo y 2.960 no deterioro cognitivo (>65 años) | Número dientes remanentes (3 categorías), CPI y presencia o ausencia de placa, cálculo, higiene prótesis dentales y recubrimiento lingual | Deterioro cognitivo MMSE GDS | Sexo, edad, nivel educativo | Número dientes remanentes (0-10), OR=1,72 (1,06-2,80) CPI (Código 4), OR=1,25 (0,68-2,32) Presencia o ausencia de placa, cálculo, HO, OR=1,10 (0,76-1,33) |
| Matthews et al.16 | 9.853 adultos (>45 años) 8.546 sujetos (86,7%) pérdida 0 dientes 424 sujetos (4,3%) pérdida 1-5 dientes 314 sujetos (3,2%) pérdida 6-16 dientes 569 sujetos (5,8%) pérdida>16 dientes | Número dientes perdidos (cuestionario al paciente) | Deterioro cognitivo. WLL y prueba memoria verbal retardada. (cuestionario telefónico) | Factores demográficos (región, raza, sexo, edad), IMC, logPCR, factores riesgo (DM, HTA, HL, tabaquismo), ingresos, nivel educativo | ß (IC 95%) en número dientes perdidos>16 WLL=−0,01 (−0,13 a 0,12). Prueba de memoria verbal retardada=−0,01 (−0,17 a 0,16). La pérdida de 6-16 o>16 dientes está asociada con deterioro cognitivo; si se ajusta según factores socioeconómicos (ingresos, nivel educativo) no se encuentra asociación |
| Syrjälä et al.17 | 76 pacientes demencia, 278 pacientes no demencia (82 años) 101 varones y 253 mujeres 174 sujetos periodontitis | PS≥4mm | Alzheimer n=49, DV n=16, otros tipos demencia n=11 Demencia leve n=33, moderada n=24 y grave=19 DSM-III R | Edad, sexo, nivel educativo, tabaquismo, severidad demencia, tipo de vivienda y número dientes remanentes | Número dientes periodontales. Alzheimer RR=1,4 (0,9-2,1), demencia (DV y otros tipos) RR=2,5 (1,5-4,1) |
| Kamer et al.18 | 152 pacientes (>70 años) | Enfermedad periodontal. MCPI grado≥3 en 10% dientes remanentes (signos inflamación y PS≥4mm) Pérdida dental (0-10 o ≥11 dientes perdidos) | Deterioro cognitivo. WAIS: digit span, DST, picture completion, BDT | Sexo, nivel educativo, signos isquemia cardiovascular, CVDR (DM, HTA, colesterol, triglicéridos), pérdida dental, dientes cariados, tabaquismo, consumo alcohol | Según DST/estado inflamación periodontal, OR=7,00 (1,74-28,16) Según BDT/dientes perdidos, OR=7,62 (1,29-44,89) entre 0-10 dientes perdidos, OR=0,35 (0,01-17,39)>11 dientes perdidos |
| Cicciù et al.19 | 158 pacientes con Alzheimer (65-87 años) 57 varones y 101 mujeres 87,2% periodontitis | Periodontitis. PS≥4mm, SS y movilidad (tipo 3) | Alzheimer. OHIP-14 | Enfermedad periodontal y número dientes remanentes son los 2 factores de mayor importancia. Porcentaje dientes afectados: PS>4mm, 87,2%; SS=75%; movilidad (tipo iii)=37,34% | |
| Stewart et al.20 | 1.053 pacientes (70-79 años) 49,8% varones y 50,2% mujeres 34,2% raza blanca y 65,8% raza negra | Número dientes, número dientes en oclusión, PS, % PS≥3mm, PIC, % PIC, IG, IP, número localizaciones SS | Deterioro cognitivo. 3MS, DSST, clock drawing score | Edad, sexo, nivel educativo, raza, riesgo cardiovascular un año, ICV, DM, HTA, tabaquismo, depresión un año | OR (PS)=0,90 (0,67-1,20), OR (PIC)=0,83 (0,61-1,12), OR (número dientes)=1,18 (0,95-1,45) |
| Park et al.21 | 438 pacientes (≥50 años, edad media 64,1%) 123 varones y 315 mujeres | Número dientes perdidos | Deterioro cognitivo. MMSE<24 | Edad, sexo, nivel educativo, factores riesgo vascular (HTA, DM, HL, tabaquismo) | OR=1,99 (1,08-3,69) entre 6-10 dientes perdidos. OR=2,25 (1,26-4,02) más 10 dientes perdidos |
| Naorungroj et al.22 | 9.874 pacientes adultos (45-64 años) 44% varones y 56% mujeres 50% bebedores habituales 14% fumadores 5.942 pacientes con periodontitis 733 periodontitis avanzada 2.374 periodontitis moderada 1.097 periodontitis leve | Clasificación BGI: 1) sanos periodontales: PS≤3mm; 2) gingivitis: PS≤3mm y SS≥10%; 3) periodontitis leve: una o más localizaciones con PS≥4mm y SS<10%; 4) periodontitis moderada≥4mm y SS 10-50%; 5) periodontitis avanzada PS≥4mm y SS>50% | Deterioro cognitivo DWR, DSS, WF | Edad, sexo, raza/etnia, nivel educativo, ingresos y lugar de estudios, tabaquismo, consumo de alcohol, DM | Periodontitis avanzada. ß (EE) DWR=0,047 (0,076) DSS=-0,44 (0,48) WF=-0,78 (0,59) |
| Naorungroj et al.23 | 10.050 pacientes (45-64 años) 44,5% varones y 55,5% mujeres 81,5% raza blanca 19,5% raza negra 16,7% periodontitis avanzada | 3 grupos. No periodontitis o periodontitis leve, periodontitis moderada y periodontitis avanzada Número dientes perdidos, número dientes remanentes, PS, REC, IP, IG y cuestionario (cuidados HO: cepillado, uso hilo dental, visitas odontólogo y motivos de consulta) | Deterioro cognitivo DWR, DSS, WF | Edad, sexo, raza, nivel educativo, tabaquismo, consumo de alcohol, historia médica | Periodontitis avanzada. OR (IC 95%) DWR=0,99 (0,92-1,06) DSS=1,05 (0,97-1,13) WF=0,98 (0,91-1,05) |
| Martande et al.24 | 58 pacientes Alzheimer y 60 pacientes sanos (50-80 años) 52 varones y 66 mujeres | Examen periodontal. IP, IG, PS, NIC, % SS | Alzheimer. NINCDS-ADRDA. Grado deterioro cognitivo MMSE (4 grupos): 1) no demencia MMSE≥26; 2) leve MMSE=21-25; 3) moderada MMSE=11-20; 4) grave MMSE≤10 | Pacientes con Alzheimer muestran parámetros periodontales más elevados, siendo ES. El estado periodontal se deteriora con la progresión del Alzheimer | |
| Naorungroj et al.25 | 588 pacientes (52-75 años) 39% varones y 61% mujeres 51% raza blanca y 49% raza negra 40-60% periodontitis | Clasificación BGI: 1) sanos periodontales: PS≤3mm; 2) gingivitis: PS≤3mm y SS≥10%; 3) periodontitis leve: una o más localizaciones con PS≥4mm y SS<10%; 4) periodontitis moderada: PS≥4mm y SS 10-50%; 5) periodontitis avanzada: PS≥4mm y SS>50% | Deterioro cognitivo DWR, DSS, WF | Edad, sexo, raza, nivel educativo, ingresos, tabaquismo, consumo de alcohol, DM | La enfermedad periodontal no se asocia con deterioro cognitivo Periodontitis avanzada. ß (EE) DWR=−0,16 (0,21) DSS=−0,28 (1,56) WF=−0,50 (1,79) |
| Almomani et al.26 | 221 pacientes (62 años) 121 varones y 100 mujeres | Estado periodontal: media de NIC en dientes remanentes Número dientes presentes | Deterioro cognitivo. MMSE<25, GDS, TAB, DASH | Edad, sexo, tabaquismo, frecuencia de cepillado, DM, HTA, ICV, artritis, IM, desórdenes psiquiátricos | Enfermedad periodontal (NIC)-DASH. Coeficiente regresión (IC 95%)=0,016 (0,004-0,028) Edentulismo-MMSE OR (IC 95%)=1,83 (1,01-3,30) |
| Kamer et al.27 | 38 pacientes no demencia (61 años) 12 (31,6%) varones y 26 (68,4%) mujeres | Periodontitis. PIC≥3mm en localización interproximal en al menos 2 dientes no adyacentes | Alzheimer. CDR=0, GDS≤2mm, MMSE≥28 | Edad, ApoE-4, tabaquismo | La pérdida de inserción≥3mm se correlacionó ES con la retención PIB en regiones cerebrales vulnerables al ß-amiloide. r=0,50; p=0,002; ß=0,011 |
ApoE-4: genotipo ApoE-4; ß: coeficiente beta; BDT: Block Design Test; BGI: biofilm-gingival interface; CDR: Clinical Demencia Rating; CPI: índice periodontal comunitario; CVDR: riesgo de enfermedad cardiovascular; DASH: Disability of Arm, Shoulder and Hand test; DM: diabetes mellitus; DSM-III R: Diagnostic and Statistical Manual of Mental Disorders III; DSS: Digit Symbol Substitution; DSST: Digit Symbol Substitution Test; DST: Digital Symbol Test; DV: demencia vascular; DWR: Delayed Word Recall; EE: error estándar; ES: estadísticamente significativo; GDS: Geriatric Depression Scale; HL: hiperlipidemia; HO: higiene oral; HTA: hipertensión arterial; IC: intervalo de confianza; ICV: infarto cerebrovascular; IG: índice gingival; IM: infarto de miocardio; IMC: índice de masa corporal; IP: índice de placa; LogPCR: logaritmo de la proteína C reactiva; MCPI: índice periodontal comunitario modificado; MMSE: Mini-Mental State Examination; NHANES: National Health and Nutrition Examination Survey; NIC: nivel de inserción clínico; NINCDS-ADRDA: National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer's Disease and Related Disorders Association; OHIP-14: Oral Health Impact Profile-14 (cuestionario de 14 preguntas del impacto de la salud oral); OR: odds ratio; PCR: proteína C reactiva; Pg: Porphyromonas gingivalis; PIB: Pittsburgh compound B; PIC: pérdida de inserción clínica; PS: profundidad de sondaje; r: coeficiente de correlación; REC: recesión; RR: riesgo relativo; SS: sangrado al sondaje; TAB: Tinetti Assessment Battery for gait and balance; UE: unidades ELISA; WAIS: Wechsler Adult Intelligence Scale; WF: word fluency; WLL: word list learning; 3MS: Mini-Mental State Examination modificado.
En los estudios evaluados existen multitud de definiciones de enfermedad periodontal. Esta falta de homogeneidad en el diagnóstico de la periodontitis dificulta la comparación de los resultados. Para realizar un diagnóstico periodontal correcto es necesaria una exploración clínica donde se deben registrar parámetros como la profundidad de sondaje de la bolsa periodontal (PS)6,9,11,12,15,18–20,22–25,27, el nivel clínico de inserción8–11,13,15,23–25,27, la presencia de sangrado al sondaje8,19,22,24, el índice de placa presente durante la exploración24, la movilidad dentaria19 o valores radiográficos, como la pérdida ósea alveolar6, que se utilizan como métodos diagnósticos complementarios. Sin embargo, hay publicaciones que definen la periodontitis de una forma menos fiable e imprecisa, con un registro de la pérdida dental o las ausencias dentarias en el momento de la exploración oral sin tener en cuenta sus causas7,14,15,18,20,21,26. La presencia de caries, la fractura dental por un traumatismo o motivos ortodóncicos son algunas de las razones por las que podría ser necesaria la extracción dentaria. Otro método utilizado es el uso de un cuestionario que se aplica directamente al paciente y donde debe indicar el número de dientes perdidos. Esta autoevaluación permite incluir en el estudio a un gran número de sujetos, pero la validez del diagnóstico periodontal no es fiable16. En 2009 se publicó un estudio donde se definían los diferentes grados de afectación periodontal siguiendo un criterio microbiológico, en el cual categorizaban la periodontitis como leve, moderada o avanzada con base en la presencia de Porphyromonas gingivalis, una bacteria de alta prevalencia en pacientes periodontalmente comprometidos13.
De la misma forma que ocurre con la periodontitis, la definición de demencia no es homogénea en los estudios analizados, y son pocos los que diferencian entre EA, DV y otros tipos de demencia7,17. En otros casos, la demencia se clasifica según el nivel de gravedad de la enfermedad, que puede ser leve, moderada o grave10,14,17,24. Además, se utilizan diferentes test diagnósticos que dificultan equiparar el deterioro de la enfermedad en cada una de las poblaciones de estudio. El más utilizado es el Mini-Mental State Examination6,9,14,15,20,24,26,27, introducido por Folstein en 197528. No existe tampoco homogeneidad respecto a los criterios diagnósticos empleados. En unos casos se utilizan los de la Asociación Americana de Psiquiatría en sus diferentes versiones y revisiones, como los del Diagnostic and Statistical Manual of Mental Disorders (DSM-II R, DSM-III R, DSM-IV R)29. Otros estudios emplean los criterios del National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer's Disease and Related Disorders Association30 para el diagnóstico de EA7,9,10,17,24 o los del National Institute of Neurological and Communicative Disorders and Stroke and the Association Internationale pour la Recherche et l’Enseignement en Neurosciences31 para la DV7. En ocasiones se utilizan test aislados y en otras, combinaciones de varios, como el Digit Symbol Substitution Test11,12,18,22,23,25,32, que forma parte de la batería integrada de la Wechsler Adult Intelligence Scale18. Unos emplean pruebas diagnósticas basadas en series de preguntas, como el Oral Health Impact Profile-1419, otros, pruebas de memoria inmediata o retardada y series de repetición13, y en algún caso, cuestionarios realizados telefónicamente16.
Otro de los factores a tener en cuenta es la edad de los sujetos incluidos en los estudios. En unos, se establecen rangos de edad entre 45 y 87 años14,19,20,22–25; en otros, una media de edad de 4516 o se incluyen pacientes con 65 años o más10,15,17,18,26,27, mientras que un estudio prospectivo incluye pacientes de menor edad estableciendo un rango entre 28 y 70 años6. Como se aprecia en las publicaciones incluidas, los casos de demencia se incrementan de forma exponencial con la edad. De la misma forma ocurre con la periodontitis, por lo que ambas enfermedades se asocian con poblaciones envejecidas.
El tamaño muestral es otra variable que presenta una amplia heterogeneidad. En los estudios transversales oscila entre 15218 y 9.853 sujetos16, y en los estudios de cohortes, entre 5976 y 697 individuos7. Los estudios de casos y controles emplean muestras de menor tamaño, cuyo número de sujetos varía de entre 299 y 180 casos10 a entre 309 y 229 controles10. Esta gran variabilidad dificulta la comparación de resultados entre las diferentes publicaciones.
En la mayoría de los estudios incluidos, algunas variables corresponden a factores de riesgo comunes a la periodontitis y a la demencia y pueden conducir a una interpretación errónea de la relación entre ambos procesos y por este motivo se han tenido en cuenta al realizar el análisis estadístico. Algunos de estos factores de confusión ajustados fueron la edad6,7,10,11,14–17,20–23,25,26, el sexo10,11,15–18,20–23,25,26, el hábito tabáquico11,13,14,16–18,20–23,25,26, el consumo de alcohol6,11,14,18,22,23,25, algunas condiciones sistémicas como la diabetes mellitus y la hipertensión arterial, el infarto cerebrovascular, el riesgo de enfermedad cardiovascular, la hiperlipidemia, el colesterol sérico, el índice de masa corporal, desórdenes psiquiátricos6,7,10,11,13,14,16,18,20–23,25,26, el nivel educativo6,7,10,11,14–18,20–23,25, el estatus socioeconómico14,16,22,25, el número de dientes remanentes o dientes cariados10,17,18 y los hábitos de higiene oral10,26.
Los estudios analizados demostraron un amplio rango de asociación entre la periodontitis y la demencia. Esta se expresó como odds ratio en estudios retrospectivos y como riesgo relativo en los de carácter prospectivo. Los estudios retrospectivos mostraron una odds ratio que oscilaba entre 0,6911 y 7,6218, mientras que en el estudio prospectivo el riesgo relativo fue de 1,03 al analizarse la pérdida ósea radiográfica, y de 1,04 si se valoran parámetros clínicos como la PS6. Los datos obtenidos deben analizarse en detalle, ya que las odds ratios se obtienen de la combinación de variables periodontales radiográficas6, microbiológicas13 y clínicas como la pérdida dental7,15,18,21,26, la higiene oral15 o la PS y el nivel clínico de inserción6,10,11,15,18,23. Estas 2 últimas constituyen los parámetros más fiables a nivel metodológico. Hay que destacar que en muchas ocasiones se emplean varias evaluaciones diagnósticas para establecer una clasificación de periodontitis6,7,10,13,15,23. Por otra parte, los test neurológicos más utilizados son el Mini-Mental State Examination6,15,21,26, el Digit Symbol Substitution Test11,23, la Wechsler Adult Intelligence Scale18 y pruebas de memoria inmediata o retardada y series de repetición13. Se han empleado los criterios diagnósticos de deterioro cognitivo y demencia del DSM-III R7,17, DSM-IV R10 y National Institute of Neurological and Communicative Disorders and Stroke and the Association Internationale pour la Recherche et l’Enseignement en Neurosciences7.
Mientras los estudios de Yu y Kuo11 y Naorungroj et al.23, publicados en 2008 y 2013, respectivamente, no encuentran asociación entre ambas enfermedades, Okamoto et al.15 y Kamer et al.18 descubren una asociación positiva cuando establecen como variable principal el número de dientes presentes. Sin embargo, cuando la variable a analizar es la presencia de placa, la PS o el nivel clínico de inserción, dicha relación no es significativa. Lo mismo ocurre con otros autores, que obtienen una relación positiva dependiendo del tipo de test neurológico utilizado13,21. Cuando se ponen en relación el número de dientes remanentes y el Mini-Mental State Examination21,26 o la existencia de una periodontitis avanzada y los criterios DMS-IV R10, se encuentra una asociación positiva entre periodontitis y deterioro cognitivo.
Algunos de los estudios analizados carecen de medidas de frecuencia. Autores como Grabe et al.14 muestran sus resultados en términos clínicos y concluyen que la pérdida dental se asocia de forma estadísticamente significativa con el deterioro cognitivo, aunque esta asociación solo se observó en mujeres. En 2013, Cicciú et al.19 confirman que los factores orales que más influyen en la calidad de vida son la enfermedad periodontal, una PS>4mm, el sangrado al sondaje y el número de dientes remanentes. Concluyen que con la ausencia de más de 2 dientes molares se incrementa la inestabilidad oclusal, empeorando la calidad de vida. Además, los pacientes con EA y un deterioro cognitivo grave presentan una PS y una pérdida de inserción periodontal casi 3mm mayor que los pacientes sin trastornos neurológicos, siendo estas diferencias estadísticamente significativas24.
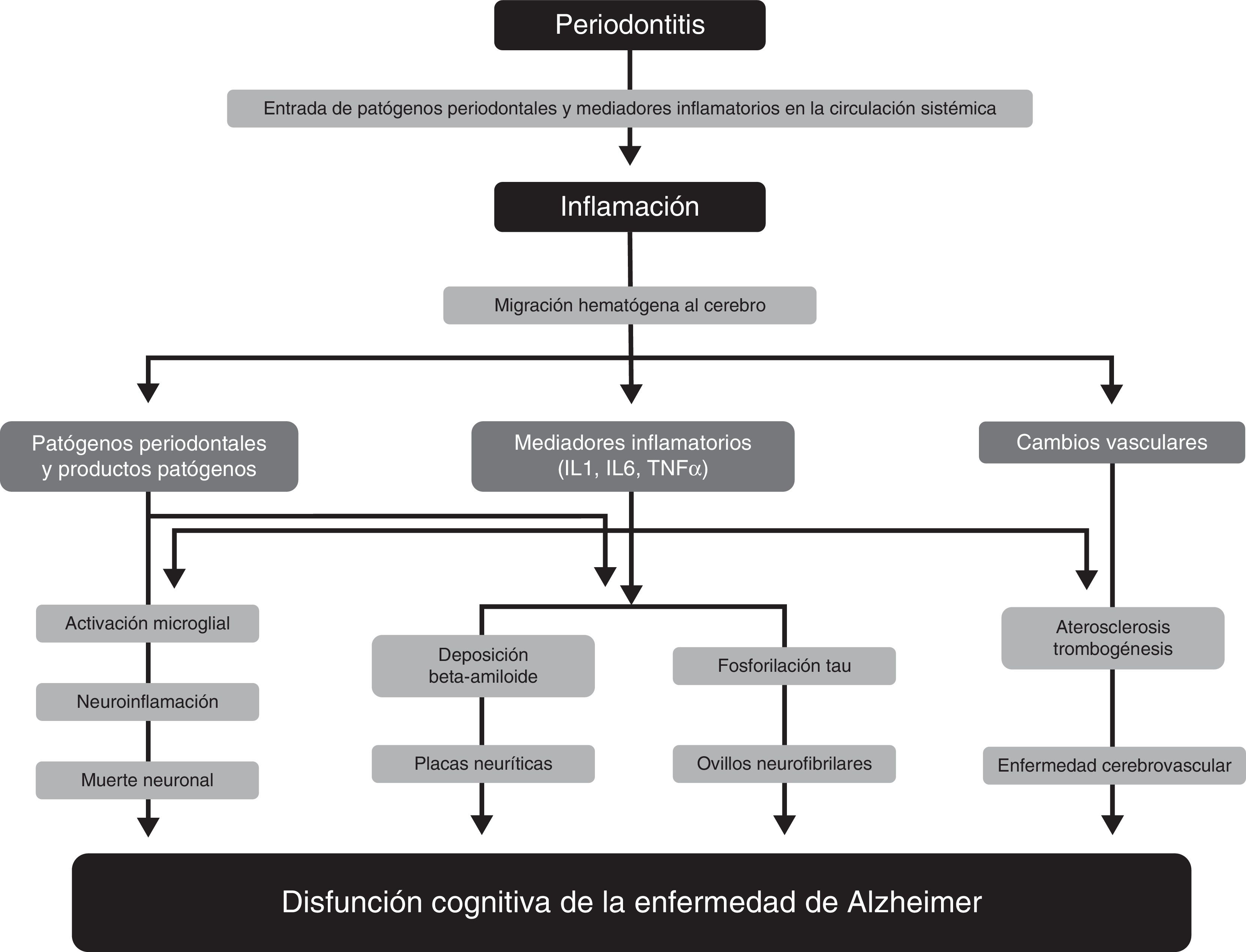
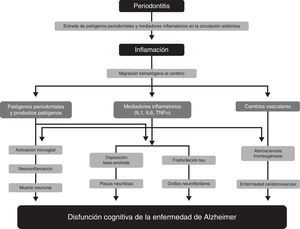
Mecanismos fisiopatológicos implicados en la relación entre la periodontitis y la demenciaNumerosos estudios han propuesto varios mecanismos fisiopatológicos por los que la periodontitis puede contribuir a la patogenia de la EA33–36 (Figura). Uno de estos mecanismos es el paso de agentes patógenos y mediadores de inflamación de la cavidad oral a la circulación sistémica. Cuando las barreras de defensa físicas, químicas o inmunológicas de la cavidad oral están afectadas puede producirse una bacteriemia. Existen evidencias de que en actividades cotidianas como la masticación o procedimientos de higiene oral como el cepillado o el uso de hilo dental37,38, los patógenos periodontales y sus productos pueden inducir la producción de citocinas proinflamatorias, como la interleucina (IL) 1, la IL-6 y el factor de necrosis tumoral α. Sometidos a una exposición bacteriana repetida, los receptores de estas citocinas pueden saturarse y estas pueden llegar a la circulación sistémica. En etapas avanzadas de la enfermedad, la periodontitis puede producir un estado de inflamación sistémica, como demuestran algunos estudios en los que los pacientes periodontales tienen niveles más altos de la proteína C reactiva si se comparan con sujetos sanos15,17.
Mecanismos fisiopatológicos que podrían explicar la asociación entre periodontitis y demencia.
Modificada de Uppoor et al.33.
Estudios como el de Rai et al.39 muestran que los recuentos totales de leucocitos, neutrófilos, plaquetas y los niveles de marcadores proinflamatorios como la proteína C reactiva, las metaloproteinasas de la matriz 8, las metaloproteinasas de la matriz 9 y el factor de necrosis tumoral α se encontraban significativamente elevados en pacientes con demencia y periodontitis en comparación con los controles. El aspecto negativo de este estudio es que no define los criterios empleados para el diagnóstico de demencia. Algunos autores aportan evidencias sobre el papel de la inflamación como nexo de unión entre periodontitis y deterioro cognitivo, y sobre el efecto beneficioso de los antiinflamatorios no esteroideos en el desarrollo de las primeras fases de la demencia40,41.
Otra ruta fisiopatológica que podría relacionar ambas entidades implica el acceso al tejido cerebral de microorganismos que residen en el biofilm de la placa dental, bien mediante la invasión tisular directa, bien a través de la circulación sanguínea o los nervios periféricos. Se han hallado periodontopatógenos como Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Tannerella forsythia, Fusobacterium nucleatum y Prevotella intermedia implicados en abscesos cerebrales, lo que demuestra su capacidad para invadir los tejidos cerebrales. Un estudio indica que ciertas especies de Treponema oral, como el Treponema denticola, se detecta en mayor medida en cerebros afectados por EA que en los sujetos libres de esta enfermedad42.
Estos patógenos, o los mediadores inflamatorios que producen, pueden atravesar la barrera hematoencefálica y acceder al tejido cerebral, donde son capaces de desencadenar una cascada de reacciones que inducen la destrucción tisular. Las lesiones cerebrales características de la EA son las placas neuríticas extracelulares originadas por deposición de ß-amiloide, derivado del metabolismo anómalo de la proteína precursora de amiloide, y los ovillos neurofibrilares constituidos por acúmulo intracelular de proteína tau hiperfosforilada. Se ha propuesto que la IL-1 juega un papel fundamental en el procesamiento de la proteína precursora de amiloide y favorece la deposición anormal de ß-amiloide en el cerebro. El ß-amiloide desencadena la activación de células microgliales que producen reactantes de fase aguda, prostaglandinas y citocinas, algunas de ellas neurotóxicas, que estimulan una mayor producción de ß-amiloide y la formación de ovillos neurofibrilares. La IL-1, además, aumenta la producción de óxido nítrico sintasa y de acetilcolinesterasa; y otros mediadores inflamatorios, como la IL-6 y el factor de necrosis tumoral α, modulan la cascada de respuesta neuroinflamatoria43,44. Todos estos cambios provocan inicialmente una disfunción sináptica y conducen, finalmente, a la muerte neuronal.
Por otro lado, cada vez existe una mayor evidencia de que los factores vasculares desempeñan un papel importante en la EA. Así, se ha descrito una mayor carga de placas neuríticas y ovillos neurofibrilares en pacientes con lesiones ateroescleróticas graves. La evidencia disponible demuestra que la periodontitis puede tener un papel relevante en la ateroesclerosis y sus complicaciones. Ciertos periodontopatógenos,como Porphyromonas gingivalis y Streptococcus sanguis, aumentan la expresión de proteínas de agregación plaquetaria y pueden propiciar la formación de placas de ateroma, originando trombos que precipiten un evento cerebrovascular. De igual manera, la inflamación sistémica causada por patógenos periodontales juega un papel relevante en la disfunción endotelial. La enfermedad periodontal, al contribuir a la formación de placas ateroescleróticas y al desarrollo de disfunción endotelial, podría constituir un factor de riesgo para el desarrollo y la progresión del deterioro cognitivo en la EA45. El hecho observado de que pacientes con CADASIL presenten un mayor riesgo y prevalencia de enfermedad periodontal podría encuadrarse también en esta hipótesis46.
Finalmente, también se ha propuesto una relación bidireccional entre enfermedad periodontal y EA47. En este sentido, puede existir una plausibilidad coherente para que la EA pueda predisponer al desarrollo de periodontitis crónica. Esto podría ser explicado debido a que los pacientes con EA tienen una peor higiene oral, ya sea bien porque su destreza manual para llevar a cabo un control de placa mecánico casero está disminuida o ausente, o bien por la incapacidad del propio sujeto para acudir al odontólogo en busca de cuidados dentales profesionales (por ejemplo, instrucciones en higiene oral, tartrectomía supragingival y/o raspado y alisado radicular). Todo esto dará lugar al desarrollo de la infección periodontal, en la que en último término produce la pérdida de los dientes48,49. Respecto a esto, un estudio mostró que significativamente más pacientes con demencia requirieron ayuda para cepillarse los dientes en comparación con los sujetos sin demencia (58,2 vs. 0,9%; p<0,01). Además, los cuidadores del centro donde se desarrolló el estudio observaron más dificultades en los pacientes con demencia a la hora de realizar una correcta higiene oral (por ejemplo, rechazo al cepillado dental, no apertura de la boca u olvido para cepillarse los dientes). Debido a esto, al año de seguimiento, los pacientes diagnosticados de demencia presentaban niveles de placa significativamente más elevados que los sujetos sin demencia (p<0,01)50. Sin embargo, hay que ser cautos al interpretar los resultados de este estudio, ya que no se valoraban parámetros periodontales clave para definir la enfermedad periodontal, tales como la PS, la pérdida de inserción periodontal clínica o el sangrado al sondaje.
ConclusionesEn conclusión, aunque la evidencia disponible indica una tendencia positiva a la asociación entre periodontitis y demencia, se desconoce el grado de esta asociación y la existencia de una relación causal entre ellas debido a la gran heterogeneidad de las definiciones de ambas enfermedades, a la metodología empleada en los estudios analizados y a la variedad de mecanismos fisiopatológicos implicados. Es necesario realizar estudios prospectivos observacionales bien diseñados en los que se clasifique de manera exhaustiva la enfermedad periodontal (tipo, extensión y gravedad) y se defina inequívocamente el tipo de demencia que se estudia, en los que además se seleccionen poblaciones de estudio homogéneas y representativas, cuyo estudio permita aclarar qué factores de riesgo están implicados en la interacción entre ambos procesos.
FinanciaciónY. Leira es beneficiario de una ayuda predoctoral otorgada por el Instituto de Investigación Sanitaria de Santiago de Compostela.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de interés.