No existen prácticamente series de cefalea en racimos (CR) en nuestro país. Nuestro objetivo es describir longitudinalmente las características de los pacientes con CR atendidos desde 1980 en un hospital de tercer nivel.
MétodosRevisión retrospectiva de historias de pacientes con CR en nuestro centro.
ResultadosSe incluyeron 153 pacientes diagnosticados de CR. Ciento treinta y siete (89,5%) varones, media de edad (ME) al diagnóstico 39,5 años (desviación media: 11,4) y ME al inicio de los síntomas 32,8 (desviación media: 11,3). Ciento veintiocho sufrían CR episódica (CRe: 92,2% varones) y 25 CR crónica (CRc: 76% varones). La ME al inicio fue más tardía en CRc que en CRe (37,6 vs. 31,8; p=0,023). Cuatro pacientes (2,6%) tenían antecedentes familiares. Solo 3 (2%) referían aura (visual). Al diagnóstico, 66% eran fumadores y 15% bebedores. La mediana de duración del brote fue de 60 días, con una mediana de frecuencia de 2 años. Dieciséis (10,5%) fueron casos benignos (racimo único).
ConclusionesLa prevalencia mínima de CR en nuestra área fue del 0,05%, siendo el fenotipo más frecuente la CRe. Hasta uno de cada 10 pacientes presentó una forma benigna con un único racimo. El retraso diagnóstico de casi 7 años indica un insuficiente reconocimiento de esta entidad. Una elevada tasa de pacientes tenía hábitos de vida poco saludables ya al diagnóstico. Los racimos duraron una media de 2 meses y ocurrieron aproximadamente cada 2 años. Un inicio tardío y ser mujer, se asoció con CRc.
There are practically no series of cluster headache (CH) in our country. Our aim was to longitudinally describe the characteristics of patients with CH seen in our Hospital since 1980.
MethodsRetrospective analysis of the clinical charts of patients diagnosed as CH.
ResultsWe included 153 patients diagnosed as CH. 137 (89,5%) males, with a mean age (MA) at diagnosis of 39.5 years (mean deviation 11.4) and a MA at the beginning of the symptoms of 32.8 years (mean deviation 11.3). 128 suffered from episodic CH (eCH; 92.2% males) and 25 chronic CH (cCH; 76% males). The MA at the beginning was delayed in cCH as compared with eCH (37.6 versus 31.8; P=.023). Four patients (2.6%) had familial antecedents. Only 3 (2%) referred to visual aura. At diagnosis, 66% were smokers and 15% heavy alcohol drinkers. The median duration of cluster period was 60 days, with a median frequency of every 2 years. 16 cases (10.5%) presented a benign course with only one cluster period.
ConclusionsThe minimal prevalence of CH in our area was 0.05%, with eCH being the most frequent phenotype. Up to one out of 10 patients showed a benign form with just one cluster period. The diagnostic delay close to 7 years indicates an insufficient recognition of this entity. A high proportion of CH patients showed, already at diagnosis, unhealthy life habits. Cluster periods lasted an average of 2 months and occurred approximately every 2 years. A late beginning and being a woman were associated with the variant of cCH.
La cefalea en racimos (CR) es la más frecuente de las cefaleas trigémino-autonómicas (CTA), con una prevalencia variable dependiendo de los diferentes estudios, pudiendo alcanzar hasta 1/1.000 personas de la población general1,2. Es la cefalea primaria más invalidante y, aunque tiene unas características clínicas singulares3, es infradiagnosticada4–6. Los criterios diagnósticos CIC-37 exigen al menos 5 ataques de dolor orbitario, supraorbitario y/o temporal unilateral y grave, de 15-180min de duración, con al menos un síntoma autonómico craneal y/o una sensación de inquietud o agitación, con una frecuencia de entre uno y 8 por día. Hay 2 subtipos: la CR episódica (CRe) con racimos de entre 7 días y un año, separados por remisiones de al menos 3 meses, y la CR crónica (CRc), en la que los periodos libres de dolor duran menos de 3 meses al año7.
Se han descrito algunas peculiaridades de esta cefalea, como su ritmicidad circadiana y circanual que refleja la implicación de un marcapasos biológico, el predominio masculino y los hábitos de vida poco saludables3,8. En los últimos años se han identificado también otros síntomas asociados como la presencia de aura (síntoma clásicamente asociado a la migraña) más frecuentemente visual y con una prevalencia variable, habiendo sido descrita hasta en el 23% de los casos9–11. Sin embargo, las series grandes publicadas son muy escasas, y en el caso de nuestro país, únicamente hay una serie descrita, previa a los criterios vigentes12.
Nuestro objetivo principal fue describir las características clínicas y epidemiológicas de los pacientes con CR diagnosticados y atendidos durante cuatro décadas en un hospital de tercer nivel en España. Como objetivo secundario analizamos las diferencias entre los pacientes con CRe y CRc.
MétodosDesde el año 1980 todos los pacientes con CR atendidos en las consultas externas de nuestro servicio, tanto por neurólogos generales como especializados en el ámbito de las cefaleas, han sido recogidos en un archivo ad hoc. Revisamos las historias de los pacientes con diagnóstico de CR hasta mayo de 2021. Los diagnósticos se reclasificaron de acuerdo con los criterios actuales7. Se recogieron las variables clínicas y demográficas en una base de datos preparada ad hoc. El uso de estos datos para el análisis científico y la publicación fue aprobado por el Comité de Ética de Cantabria (Código 2021.137). Dada la naturaleza del estudio, el comité no requirió consentimiento informado.
Se recogieron para cada paciente el número de historia clínica, género, edad actual, edad de inicio de los síntomas, edad al diagnóstico, diagnóstico específico (CRc o CRe), lado del dolor, frecuencia de los racimos en años y duración del brote en días. Otras variables específicamente analizadas fueron los antecedentes familiares de CTA, la presencia de síntomas compatibles con aura y la coexistencia de migraña. Además, la presencia o no de hipertensión arterial (HTA), diabetes mellitus (DM), dislipemia, obesidad, tabaquismo, consumo excesivo de alcohol, cáncer y otras comorbilidades al diagnóstico que se agruparon en: enfermedad cardiovascular (ECV), enfermedades digestivas, respiratorias, psiquiátricas y otras enfermedades neurológicas.
Se realizó un análisis descriptivo en el que las variables cualitativas se presentan con su frecuencia absoluta (n) y relativa (porcentaje, %), y las cuantitativas se describen mediante una medida de tendencia central (media o mediana) y una medida de dispersión (desviación media o rango intercuartílico), según su distribución. Se analizó la distribución de las variables cuantitativas mediante la prueba de Kolmogorov-Smirnov. Todas seguían una distribución normal, excepto las variables «edad al diagnóstico» en el total de individuos con CR y en el subgrupo de CRe y las variables «frecuencia de racimos» y «duración del brote» en el subgrupo de CRe. Las características basales se calcularon para la muestra total y para CRe y CRc por separado. Se compararon las características clínicas y demográficas entre los pacientes con CRe y CRc, partiendo de la hipótesis de la existencia de diferencias entre ambos grupos. Para ello se utilizó la prueba t de Student para comparar las variables continuas con distribución tanto normal como no normal (dado que n>30), y la prueba Chi-cuadrado (o el test exacto de Fisher cuando fue necesario) para las variables categóricas. Los análisis se realizaron con el software SPSS®. Se estableció la significación en p<0,05.
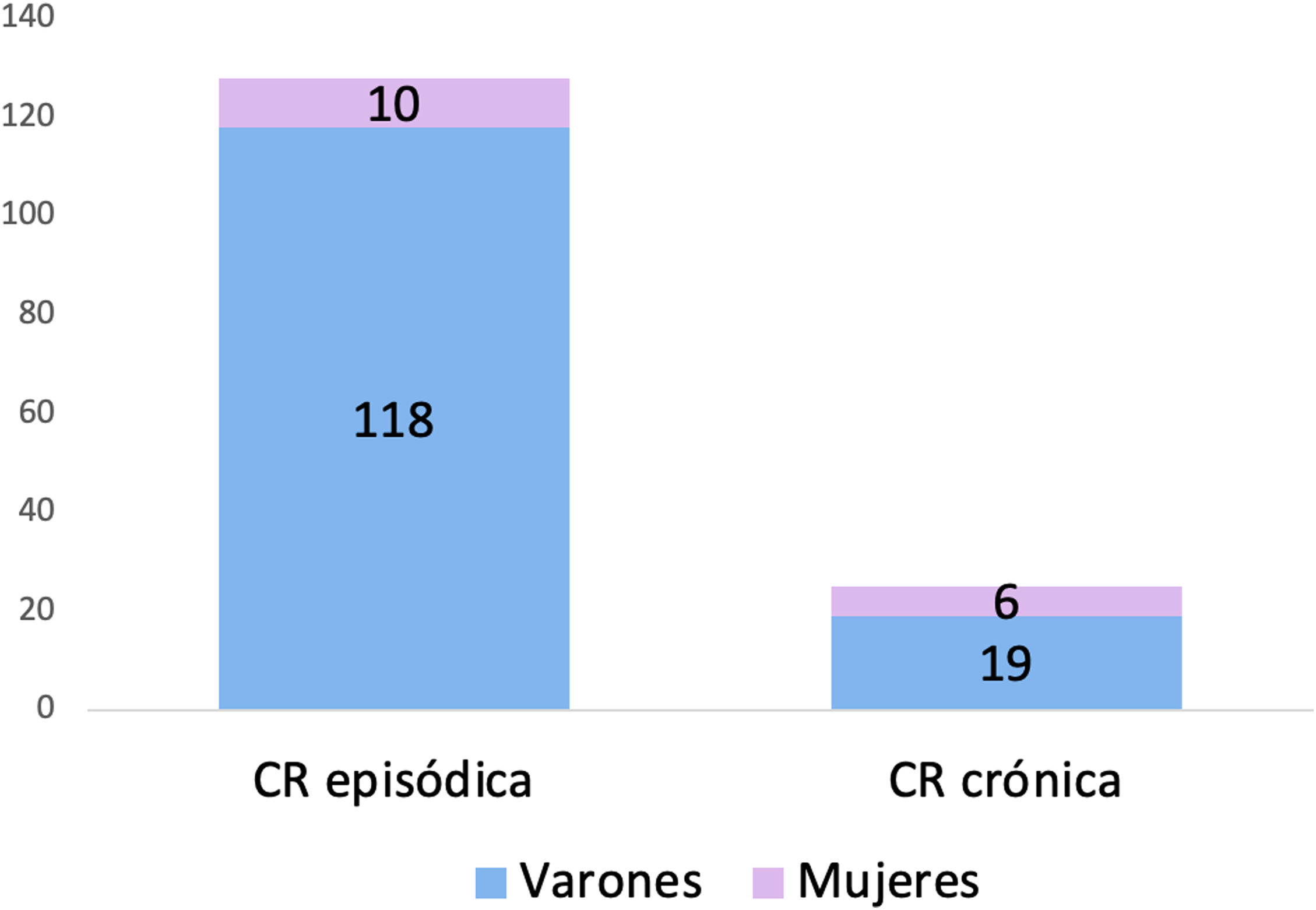
ResultadosCaracterísticas demográficas y clínicasDiagnóstico según CIC-3, género y edadUn total de 156 pacientes cumplían inicialmente criterios de CR. Un paciente fue excluido por insuficiente información clínica y otros 2 por presentar menos de un año de seguimiento y, por tanto, no poder clasificarse adecuadamente en CRe o CRc, incluyéndose finalmente 153 pacientes. De ellos, tras reclasificar los diagnósticos, 128 (83,7%) cumplían criterios de CRe y 25 (16,3%) de CRc. Eran varones 137 (89,5%). Analizando la distribución por géneros según el diagnóstico, se registraron 118 (92,2%) varones con diagnóstico de CRe y 19 (76%) con CRc (fig. 1). Esta diferencia fue significativa (p=0,027) (tabla 1). La media de edad actual de los pacientes con CR incluidos fue de 60,6 años (desviación media: 13,8). La media de la edad al inicio fue de 32,8 años (desviación media: 11,3) y la mediana de la edad al diagnóstico fue de 38 (rango intercuartílico: 17,25). Estos datos muestran un retraso diagnóstico medio de 6,7 años (39,5 vs. 32,8; t de Student para muestras relacionadas 6,06; IC 95%: 4,85-7,26; p=0,000). En la tabla 1 se presenta una comparación de la media de edad al diagnóstico y al inicio de los síntomas entre los pacientes con CRe y CRc, encontrando diferencias significativas en la edad de inicio de los síntomas que fue más tardía en los pacientes con CRc (p=0,023).
Principales características demográficas de nuestra serie de CR
| Total(N=153) | CRe(N=128) | CRc(N=25) | Valor de p* | |
|---|---|---|---|---|
| Varones, n (%) | 137 (89,5%) | 118 (92,2%) | 19 (76,0%) | 0,027** |
| Edad al diagnósticoa | 38 (17,25) | 37 (17,25) | 43 (21,25) | 0,096*** |
| Edad al inicio de los síntomasb | 32,8 (11,3) | 31,8 (10,8) | 37,1 (13,0) | 0,023*** |
CRc: cefalea en racimos crónica; CRe: cefalea en racimos episódica.
Cuatro pacientes (2,6%) tenían antecedentes familiares, en primer grado, de alguna CTA. Una mujer con CRc izquierda, tenía un pariente de primer grado con diagnóstico de cefalea hemicránea paroxística izquierda. Un varón con CRe tenía un hermano con CR. Otros 2 pacientes con parentesco en primer grado, ambos registrados en esta serie, compartían diagnóstico de CRe.
Características clínicas de la cefaleaLateralidad del dolorEn el 51,1% de los pacientes la cefalea era estrictamente hemicraneal derecha, en el 46,1% izquierda y en un 2,8% alternante (estrictamente unilateral, aunque cambiante de lateralidad en los distintos ataques), no existiendo diferencias significativas según el subtipo CRe o CRc.
Duración y frecuencia de los brotesEn los pacientes con CRe, la mediana de duración de los brotes fue de 60 días (rango intercuartílico: 45). En cuanto a la frecuencia de estos, la mediana de frecuencia de brotes fue de uno cada 2 años (rango intercuartílico: 1,33 años). Dieciseis pacientes (10,5%) tenían recogido en su historia un único brote, de los cuales 7 (4,6%) mantuvieron seguimiento longitudinal ambulatorio en el servicio de neurología y posteriormente en atención primaria (confirmándose, por tanto, el curso benigno) y 9 (5,9%) lo perdieron tras el primer brote.
Aura y migrañaSe encontraron síntomas típicos de aura, siempre visual, en 3 (2%) pacientes. Todos cumplían criterios de CRe y en ninguno se describía la coexistencia de migraña. Solo un paciente (0,7%) de toda la serie sufría migraña además de Cre.
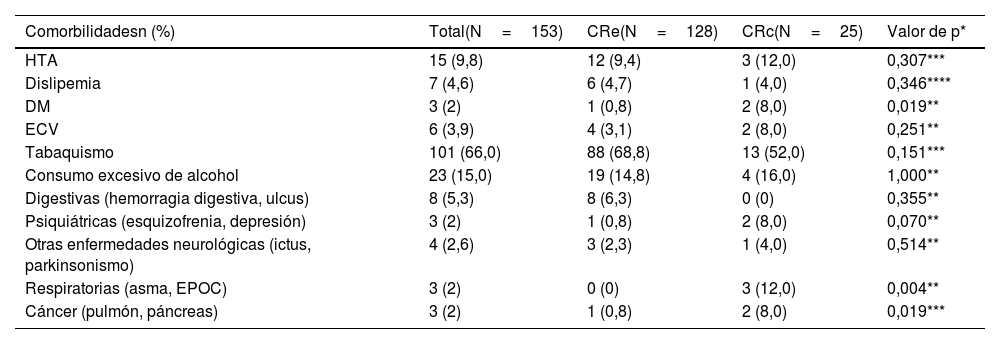
Comorbilidades al diagnósticoLa frecuencia de las distintas comorbilidades al diagnóstico se muestra en la tabla 2. Salvo para la DM (p=0,019), las enfermedades respiratorias (p=0,004) y el cáncer (p=0,019), que fueron más frecuentes en la CRc, no hubo diferencias significativas en la frecuencia de ninguna otra de estas comorbilidades entre los pacientes con CRc y Cre, si bien la frecuencia de todas ellas, excepto del consumo de tabaco y alcohol, fue muy discreta.
Comorbilidades al diagnóstico de CR
| Comorbilidadesn (%) | Total(N=153) | CRe(N=128) | CRc(N=25) | Valor de p* |
|---|---|---|---|---|
| HTA | 15 (9,8) | 12 (9,4) | 3 (12,0) | 0,307*** |
| Dislipemia | 7 (4,6) | 6 (4,7) | 1 (4,0) | 0,346**** |
| DM | 3 (2) | 1 (0,8) | 2 (8,0) | 0,019** |
| ECV | 6 (3,9) | 4 (3,1) | 2 (8,0) | 0,251** |
| Tabaquismo | 101 (66,0) | 88 (68,8) | 13 (52,0) | 0,151*** |
| Consumo excesivo de alcohol | 23 (15,0) | 19 (14,8) | 4 (16,0) | 1,000** |
| Digestivas (hemorragia digestiva, ulcus) | 8 (5,3) | 8 (6,3) | 0 (0) | 0,355** |
| Psiquiátricas (esquizofrenia, depresión) | 3 (2) | 1 (0,8) | 2 (8,0) | 0,070** |
| Otras enfermedades neurológicas (ictus, parkinsonismo) | 4 (2,6) | 3 (2,3) | 1 (4,0) | 0,514** |
| Respiratorias (asma, EPOC) | 3 (2) | 0 (0) | 3 (12,0) | 0,004** |
| Cáncer (pulmón, páncreas) | 3 (2) | 1 (0,8) | 2 (8,0) | 0,019*** |
CR: cefalea en racimos; CRc: cefalea en racimos crónica; CRe: cefalea en racimos episódica; DM: diabetes mellitus; ECV: enfermedad cardiovascular (incluye fibrilación auricular, cardiopatía isquémica o miocardiopatía hipertrófica); HTA: hipertensión arterial.
Esta es la primera gran serie española de CR con los criterios diagnósticos actuales y una de las pocas publicadas con seguimiento longitudinal, en muchos casos, durante cuatro décadas. Los resultados confirman algunas de las características típicas descritas para esta cefalea y arrojan datos novedosos.
En primer lugar, uno de los hallazgos comunes a todas las series, es el retraso de 5-10 años4–6 entre el inicio de los síntomas y el diagnóstico. En nuestra serie, se ha encontrado un retraso de más de 6 años, lo que indica un insuficiente reconocimiento de esta entidad. El diagnóstico tardío e incorrecto implica un retraso en el tratamiento adecuado, y teniendo en cuenta que la CR es uno de los dolores más invalidantes3,13, conlleva una importante pérdida de calidad de vida.
Por otra parte, y aunque su prevalencia es menor que la de otras cefaleas primarias14, la CR es la más común de las CTAs13 y su frecuencia no es desdeñable. La prevalencia teórica mínima de CR en nuestra población de referencia de 320.000 habitantes es del 0,05%, es decir, 45,9 casos/100.000, o lo que es lo mismo un caso por cada 2.178 habitantes. Estas cifras se encuentran dentro de los amplios límites de los estudios epidemiológicos de la CR, en los que la prevalencia oscila entre 31 y 588 casos/100.0001,2. Estas cifras indican que los médicos de atención primaria deben de conocer esta entidad, ya que en cada cupo habrá prácticamente un paciente con CR y que los servicios de neurología hemos de adaptarnos para planificar su atención adecuada.
Nuestros resultados confirman el predominio masculino que describe la literatura clásica, encontrando solo un 10% de mujeres con este diagnóstico15. En los últimos años esta relación se ha atenuado en algunos trabajos16,17. No está claro si esta tendencia es el resultado de un aumento real de la incidencia, de un mejor diagnóstico en el sexo femenino al ser una entidad más r reconocida en la actualidad (en el pasado podrían haberse cometido errores diagnósticos, siendo diagnosticadas de migraña, por su alta prevalencia en este sexo), o si podría estar en relación con el reciente incremento de consumo de tabaco y alcohol en mujeres18.
En cuanto a la distribución por diagnósticos y la edad de debut, la CRe es el fenotipo más frecuente y únicamente alrededor de un 15% cumplen criterios de CRc3,6,13,15,19. La edad media de debut se sitúa en torno a los 30 años16,20, y es más tardía en los pacientes con CRc2,16,21. Un dato interesante de nuestra serie es la diferencia en la distribución por géneros según el fenotipo, de manera que la relación hombre/mujer de la CRe es prácticamente el doble que la proporción entre ambos géneros para la CRc. Estos datos sugieren que, además del inicio tardío, ser mujer se asocia también con el diagnóstico de CRc. Esta hipótesis concuerda con el estudio de Manzoni et al. en el que la edad de inicio de la CRc fue 5 años superior en mujeres16, y con el estudio de Ekbom et al. donde la aparición tardía de la CR ocurre con mayor frecuencia en mujeres con formas crónicas22. Por tanto, el debut a partir de la cuarta década de la vida en el sexo femenino, debe advertirnos que con mayor probabilidad nos encontremos ante una forma crónica de esta enfermedad.
Respecto a la duración y la frecuencia de los racimos, encontramos una mediana de duración de 60 días (8,5 semanas) y una mediana de frecuencia de los racimos cada 2 años. Estos resultados concuerdan con los escasos datos publicados. Clásicamente se ha descrito que la duración del brote oscila entre 6 y 12 semanas y que lo habitual sería sufrir racimos anuales3,17,23. Otros estudios han encontrado que más del 20% de los pacientes tienen racimos con una frecuencia superior a 2 años24. Este análisis tiene especial relevancia en la práctica clínica, puesto que en nuestro medio podríamos estimar que los pacientes tendrán un racimo de aproximadamente 2 meses de duración cada aproximadamente 2 años.
Un dato interesante de esta serie es que 7 pacientes han sufrido un único brote tras un largo periodo de seguimiento (en otros 9 existe un único brote registrado, pero perdimos seguimiento). Al igual que existen pacientes crónicos y refractarios, este dato sugiere, coincidiendo con lo encontrado por otros autores25, que alrededor uno de cada 20 pacientes no tendrá necesariamente brotes recurrentes.
El aura no ha sido reconocida como un síntoma asociado a la CR hasta fechas recientes: Silberstein et al. describieron en el año 2000 el aura mayoritariamente visual, en un 6% de los pacientes con CR11, y otros estudios retrospectivos posteriores han encontrado aura incluso con una frecuencia superior5,15,26. En nuestra cohorte hemos encontrado síntomas de aura visual recogidos en la historia clínica en el 2% de los pacientes. Esta cifra es similar a la de un estudio prospectivo reciente (3,5%), que encontró que la mayoría de los pacientes con aura tienen también migraña con aura27. La prevalencia de migraña entre los pacientes con CR se ha estimado similar a la de la población general28, mientras que solo hemos encontrado recogida la coexistencia de migraña en un solo paciente, por lo que es probable que esta información no se haya recogido en las historias con rigurosidad, tal vez ocultada por la severidad de la CR.
Sólo un 2,6% de los pacientes presentaban antecedentes familiares de CTAs, concordando con estudios previos que cifraban concurrencia familiar entre un 2,3 y un 4,1%29,30. Estos resultados no apoyarían un fuerte componente hereditario en esta entidad, si bien dado el carácter retrospectivo del estudio no podemos descartar un componente genético significativo como indican hallazgos recientes31–33.
Un hallazgo recurrente en la literatura acerca de la CR es la alta prevalencia de hábitos de vida poco saludables, especialmente de tabaquismo, descrito en más de dos tercios de los pacientes5,34. Algunos estudios han identificado una duración más prolongada del racimo, una mayor frecuencia de ataques, así como una mayor intensidad del dolor en los pacientes fumadores33. En nuestro estudio encontramos que 2 de cada 3 pacientes eran fumadores al diagnóstico, duplicando la tasa de fumadores diarios de nuestra región35. Lo mismo sucede con el consumo de alcohol: un 15% eran consumidores excesivos al diagnóstico, superando al porcentaje estimado para la población general de nuestra región (11,8%), en el periodo de 2014-201836. Debe puntualizarse que no se pudo cuantificar el consumo de alcohol dado que no figuraba en la mayor parte de las historias. Aunque su relación con la CR no está clara, el alcohol es uno de los principales desencadenantes del ataque durante los racimos34,37. Algunos estudios sugieren que este tipo de hábitos podría estar en relación con un componente ansioso y compulsivo de la personalidad en los pacientes con CR38,39, mientras que otros no han encontrado diferencias con los grupos de comparación40,41. Esto respalda la necesidad de realizar más estudios que definan las comorbilidades psicológicas de la CR y cómo estas pueden afectar al afrontamiento del dolor, la calidad de vida y las recomendaciones de tratamiento óptimas.
Para finalizar, debemos destacar que nuestros resultados podrían haberse visto sujetos a sesgos intrínsecos de la naturaleza retrospectiva del estudio. Por ejemplo, la periodicidad de los racimos podría no estar recogida con exactitud ya que es posible que los pacientes no consultaran en cada uno de ellos o se perdiera su seguimiento por traslado. Por esta misma razón no se ha podido establecer la tasa de conversión de CRe a CRc, ni identificar posibles desencadenantes u otras características clínicas de esta cefalea, como, por ejemplo, la intensidad o duración de los ataques, la asociación de signos trigémino-autonómicos o su ritmicidad circadiana. Es por ello que se necesitan más estudios de carácter prospectivo que permitan conocer más esta enfermedad. A pesar de estas limitaciones, los resultados obtenidos son consistentes con los publicados previamente, lo cual indica la buena calidad de la mayoría de las historias clínicas analizadas y la validez de las conclusiones.
Conclusiones- –
La teórica prevalencia mínima de CR encontrada fue del 0,05%. Observamos un retraso diagnóstico de más de 6 años, lo que indica una falta de reconocimiento adecuado de esta entidad.
- –
Esta cefalea tiene un claro predominio masculino, encontrando 9 varones por cada mujer afectada, aunque esta relación se atenúa en el subtipo CRc.
- –
Un inicio más tardío de la sintomatología, y ser mujer, se asoció a una mayor probabilidad de CRc.
- –
Los pacientes tuvieron de media un racimo de 2 meses de duración cada aproximadamente 2 años. La coexistencia de aura en estos pacientes fue infrecuente.
- –
Al menos un 5% de los pacientes de nuestra serie presentaron un curso «benigno», con un único brote documentado.
- –
Una elevada tasa de pacientes tenía hábitos de vida poco saludables.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.